Полиморфы фексофенадина и способы их получения
Иллюстрации
Показать всеИзобретение относится к новому безводному кристаллическому гидрохлориду 4-[4-[4-(гидроксидифенилметил)-1-пиперидинил]-1-гидроксибутил]-а,а-диметилбензолуксусной кислоты (фексофенадин) формы С, отличающийся тем, что имеет рентгенограмму дифракционных полос с характерными пиками (2θ): 8,9712°, 14,8293°, 16,0514°, 17,0775°, 18,3418°, 19,3099°, 19,7703°, 21,1340°, 21,5207°, 23,0743° и 23,8286°. Изобретение также относится к фармацевтически приемлемой композиции для антигистаминного лечения, а также к способам получения безводного кристаллического гидрохлорида 4-[4-[4-(гидроксидифенилметил)-1-пиперидинил]-1-гидроксибутил]-α,α-диметилбензолуксусной кислоты (фексофенадин) формы С. Технический результат - получение новых полиморфов фексофенадина, которые являются антагонистами рецепторов H1 и полезным антигистаминным лекарственным средством. 9 н. и 16 з.п. ф-лы, 3 табл., 9 ил.
Реферат
Данное изобретение относится к полиморфам феноксадина, способам их получения и их применению в фармацевтических композициях и способах антигистаминного лечения.
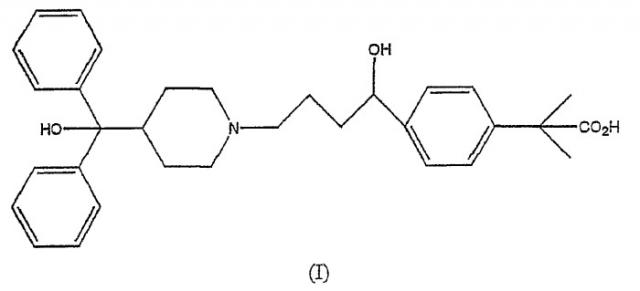
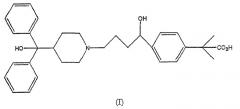
4-[4-[4-(гидроксидифенилметил)-1-пиперидинил]-1-гидроксибутил]-α,α-диметилбензолуксусная кислота формулы (I), фексофенадин, является антагонистом рецептора Н1 и полезным антигистаминным лекарственным средством
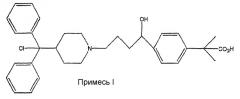
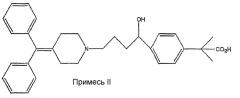
Были описаны различные фармацевтически приемлемые соли фексофенадина, например ЕР 1178041А, страница 5, параграф 0010. В ЕР 1178041А также описано получение безводного гидрохлорида фексофенадина (формы I и III) и гидрированные формы (формы II и форма IV). Способ, описанный в ЕР 1178041А, включает получение безводных форм I и III из гидрированных форм II и IV, например, азеотропной перегонкой с нагреванием в кислых условиях в течение длительных периодов. Продолжительное нагревание таким способом может привести к превышению приемлемых уровней содержания следующих примесей I и II
В ЕР 1178041А также описана ограничивающая воду кристаллизация, которая включает кристаллизацию гидрата, но она требует применения больших объемов растворителя для ограничения содержания воды до приемлемых уровней.
В WO 01/94313 описана Форма А гидрохлорида фексофенадина. Способ ее получения включает применение воды, что означает получение Формы А в гидрированной форме, что не подходит для фармацевтической композиции.
US 4254129 является основным патентом, касающимся фексофенадина, в нем описан HCl фексофенадин, выделенный из водной хлористоводородной кислоты, что дает образование гидрированной формы, которая, как сказано выше, не подходит для фармацевтической композиции.
WO 93/21156 также относится к гидрохлориду фексофенадина, и в примере 1 описано растворение основания фексофенадина в метилендихлориде и подкисление газообразной HCl до рН 3. Реакционную массу затем концентрируют до остатка, добавляют простой эфир и смесь перемешивают с получением твердого вещества, которое фильтруют с получением гидрохлорида фексофенадина. Этот процесс приводит к образованию аморфного гидрохлорида фексофенадина, который имеет тенденцию поглощать влагу и образовывать крупные куски при хранении, что создает трудности при обработке во время получения таблеток и капсул. Далее, применение простого эфира при его получении не подходит для промышленного масштаба и, следовательно, описанный способ не подходит для промышленного применения.
Кроме гидрохлорида, в безводной и гидрированной формах, описанных выше, однако другие соли фексофенадина в известном уровне техники не представлены. Превращение гидрированных солей в их безводные формы кристаллизацией, минимизирующей воду, также описано в ЕР 766668В, но данное описание ограничено взаимопревращением соответствующих солей. Превращение одной соли, гидрированной или, наоборот, в другую безводную соль не описано и не предложено.
В данном изобретении представлены новые полиморфы фексофенадина, где первая соль фексофенадина в гидрированной форме может быть превращена непосредственно в другую соль фексофенадина в безводной форме. Более конкретно, авторы данного изобретения обнаружили, что ацетат фексофенадина и его гидрированные формы могут быть превращены в новые полиморфы безводного гидрохлорида фексофенадина, которые отличаются от полиморфов гидрохлорида фексофенадина, описанных в известном уровне техники, интервалом температуры плавления, рентгенограммой дифракционных полос и спектром абсорбции инфракрасного излучения. Далее показаны преимущества безводного гидрохлорида фексофенадина в соответствии с данным изобретением по сравнению с известным уровнем техники, например отсутствие характерных примесей (таких как примеси I и II, описанные выше), а также его свободнотекучая природа, что делает безводный гидрохлорид фексофенадина в соответствии с данным изобретением особенно подходящим для применения в композициях.
В данном изобретении также представлен моногидрат свободного основания фексофенадина, который также может быть превращен в новый полиморф безводного гидрохлорида фексофенадина.
Более конкретно, в данном изобретении представлен безводный кристаллический гидрохлорид фексофенадина формы С.
В данном изобретении также представлен безводный кристаллический гидрохлорид фексофенадина формы С, имеющий рентгенограмму дифракционных полос или практически такую же рентгенограмму дифракционных полос, как показана на фиг.1. Более конкретно, безводный кристаллический гидрохлорид фексофенадина формы С в соответствии с данным изобретением может быть охарактеризован рентгенограммой дифракционных полос с характерными пиками (2θ): 8,9712°, 14,8293°, 16,0514°, 17,0775°, 18,3418°, 19,3099°, 19,7703°, 21,1340°, 21,5207°, 23,0743° и 23,8286°.
Другие характерные данные безводного кристаллического гидрохлорида фексофенадина формы С в соответствии с данным изобретением, полученные при рентгенографии дифракционных лучей, показаны в таблице 1.
| Таблица 1 | |||
| Пик № | 2θ (град.) | d(А) | I/II |
| 1 | 6,0640 | 14,56317 | 5 |
| 2 | 8,5400 | 10,34563 | 4 |
| 3 | 8,9712 | 9,84931 | 30 |
| 4 | 9,4917 | 9,31033 | 6 |
| 5 | 12,2731 | 7,20591 | 8 |
| 6 | 14,2000 | 6,23213 | 7 |
| 7 | 14,8293 | 5,96904 | 100 |
| 8 | 15,3400 | 5,77145 | 9 |
| 9 | 16,0514 | 5,51723 | 30 |
| 10 | 16,3600 | 5,41384 | 8 |
| 11 | 17,0775 | 5,18796 | 31 |
| 12 | 17,4651 | 5,07369 | 10 |
| 13 | 18,3418 | 4,83311 | 25 |
| 14 | 19,3099 | 4,59293 | 22 |
| 15 | 19,7703 | 4,48700 | 38 |
| 16 | 21,1340 | 4,20045 | 22 |
| 17 | 21,5207 | 4,12584 | 15 |
| 18 | 22,1600 | 4,00823 | 3 |
| 19 | 22,5560 | 3,93875 | 6 |
| 20 | 23,0743 | 3,85144 | 22 |
| 21 | 23,8286 | 3,73120 | 17 |
| 22 | 25,3114 | 3,51588 | 17 |
| 23 | 25,8400 | 3,44514 | 8 |
| 24 | 26,0800 | 3,41398 | 12 |
| 25 | 26,6000 | 3,34841 | 3 |
| 26 | 26,9400 | 3,30691 | 4 |
| 27 | 27,2305 | 3,27229 | 8 |
| 28 | 27,9737 | 3,18702 | 4 |
| 29 | 28,8733 | 3,08974 | 14 |
| 30 | 29,6000 | 3,01551 | 5 |
| 31 | 29,9400 | 2,98204 | 9 |
| 32 | 31,3543 | 2,85068 | 9 |
| 33 | 31,6800 | 2,82211 | 3 |
| 34 | 34,7180 | 2,58180 | 3 |
| 35 | 35,6950 | 2,51334 | 3 |
| 36 | 37,5325 | 2,39441 | 3 |
Безводный кристаллический гидрохлорид фексофенадина формы С в соответствии с данным изобретением предпочтительно отличается тем, что имеет температуру плавления в интервале от около 191 до 196°С (ДСК; открытая капсула). Более конкретно, безводный кристаллический гидрохлорид фексофенадина формы С в соответствии с данным изобретением предпочтительно отличается тем, что имеет температуру плавления в интервале от около 192 до 194°С (ДСК; открытая капсула) как показано на фиг.2, что отличается от полиморфов известного уровня техники, описанных выше.
Безводный кристаллический гидрохлорид фексофенадина формы С в соответствии с данным изобретением, предпочтительно, имеет чистоту более чем около 99,5% мас./мас. (область пика).
Безводный кристаллический гидрохлорид фексофенадина формы С в соответствии с данным изобретением также может быть охарактеризован тем, что он имеет такой же спектр абсорбции инфракрасного излучения или практически такой же спектр абсорбции инфракрасного излучения, как показан на фиг.3.
Термин «безводный» в данном описании, по отношению к кристаллическому гидрохлориду фексофенадина формы С, означает содержание в нем воды менее чем около 0,5 мас.%.
В данном изобретении также представлены гидрированные кристаллические ацетаты фексофенадина форм D и Е. Форма D представляет собой кристаллический моногидрат ацетата фексофенадина. Форма Е представляет собой кристаллический дигидрат ацетата фексофенадина, который может быть легко получен в промышленном масштабе из свободного основания фексофенадина так, как более подробно описано ниже. Дигидрат ацетата фексофенадина, представленный в соответствии с данным изобретением, является кристаллическим, легко подвергается фильтрации и сушке, и получение ацетата предпочтительно позволяет удалить большинство примесей, которые трудно удалить в других случаях.
Кристаллический дигидрат ацетата фексофенадина формы Е в соответствии с данным изобретением может быть охарактеризован тем, что имеет спектр поглощения инфракрасного излучения или практически такой же спектр поглощения инфракрасного излучения, как показан на фиг.4.
В данном изобретении также представлен кристаллический дигидрат ацетата фексофенадина формы Е, имеющий рентгенограмму дифракционных полос или практически такую же рентгенограмму дифракционных полос, как показана на фиг.5. Более конкретно, кристаллический дигидрат ацетата фексофенадина формы Е в соответствии с данным изобретением может быть охарактеризован рентгенограммой дифракционных полос с характерными пиками (2θ): 8,2266°, 9,3654°, 10,6929°, 11,1600°, 13,0400°, 13,4200°, 15,7473°, 16,4400°, 16,9785°, 17,5334°, 19,9728°, 20,7000°, 21,1236°, 23,0150° и 26,2977°.
Другие характерные данные кристаллического дигидрата ацетата фексофенадина формы Е в соответствии с данным изобретением, полученные при рентгенографии дифракционных лучей, показаны в таблице 2.
| Таблица 2 | |||
| Пик № | 2θ (град.) | d(А) | I/II |
| 1 | 6,5665 | 13,44981 | 8 |
| 2 | 7,9000 | 11,18226 | 6 |
| 3 | 8,2266 | 10,73904 | 29 |
| 4 | 8,9200 | 9,90573 | 7 |
| 5 | 9,3654 | 9,43561 | 21 |
| 6 | 9,8798 | 8,94546 | 8 |
| 7 | 10,6929 | 8,26699 | 43 |
| 8 | 11,1600 | 7,92200 | 13 |
| 9 | 13,0400 | 6,78379 | 31 |
| 10 | 13,4200 | 6,59255 | 26 |
| 11 | 14,5800 | 6,07054 | 7 |
| 12 | 14,9000 | 5,94088 | 10 |
| 13 | 15,3800 | 5,75653 | 10 |
| 14 | 15,7473 | 5,62308 | 22 |
| 15 | 16,4400 | 5,38768 | 33 |
| 16 | 16,9785 | 5,21799 | 100 |
| 17 | 17,5334 | 5,05408 | 30 |
| 18 | 18,5000 | 4,79213 | 6 |
| 19 | 18,7200 | 4,73631 | 10 |
| 20 | 19,3200 | 4,59055 | 24 |
| 21 | 19,9728 | 4,44196 | 63 |
| 22 | 20,7000 | 4,20753 | 32 |
| 23 | 21,1236 | 4,20249 | 66 |
| 24 | 21,8975 | 4,05569 | 16 |
| 25 | 22,4623 | 3,95497 | 21 |
| 26 | 23,0150 | 3,86123 | 25 |
| 27 | 23,5600 | 3,77313 | 5 |
| 28 | 23,8600 | 3,72636 | 6 |
| 29 | 24,7800 | 3,59006 | 10 |
| 30 | 25,1800 | 3,53393 | 16 |
| 31 | 25,7600 | 3,45566 | 7 |
| 32 | 26,2977 | 3,38621 | 29 |
| 33 | 27,1413 | 3,28284 | 11 |
| 34 | 27,7071 | 3,21708 | 5 |
| 35 | 28,7490 | 3,10281 | 6 |
| 36 | 30,1035 | 2,96621 | 8 |
| 37 | 30,9400 | 2,88790 | 6 |
| 38 | 31,3454 | 2,85147 | 14 |
Кристаллический моногидрат ацетата фексофенадина формы Е также отличается типовой термограммой ДСК, показывающей три эндотерма, как показано на фиг.6. Два эндотерма, первый из которых находится между 74 и 87°С и второй из которых находится между 130 и 143°С, означают потерю молекул воды, и острый эндотерм, имеющий начало при около 216°С, означает эндотерм плавления. Кристаллический дигидрат ацетата фексофенадина формы Е в соответствии с данным изобретением предпочтительно характеризуется температурой плавления в интервале от около 216 до 229°С (ДСК; открытая капсула) и характеристиками ДСК, показанными на фиг.6.
Кристаллический дигидрат ацетата фексофенадина формы Е в соответствии с данным изобретением предпочтительно имеет чистоту более чем около 99,5% мас./мас. (область пика).
Термин «моногидрат» в данном описании, применительно к кристаллическому ацетату фексофенадина формы D, означает содержание в нем влаги в интервале от около 3 до 5 мас.%. Термин «дигидрат» в данном описании, применительно к кристаллическому ацетату фексофенадина формы Е, означает содержание в нем влаги в интервале от около 6 до 8 мас.%.
В данном изобретении также представлен кристаллический моногидрат свободного основания фексофенадина формы F.
Кристаллический моногидрат свободного основания фексофенадина формы F в соответствии с данным изобретением может быть охарактеризован тем, что имеет спектр поглощения инфракрасного излучения или практически такой же спектр поглощения инфракрасного излучения, как показан на фиг.7.
В данном изобретении также представлен кристаллический моногидрат свободного основания фексофенадина формы F, имеющий рентгенограмму дифракционных полос или практически такую же рентгенограмму дифракционных полос, как показана на фиг.8. Более конкретно, кристаллический моногидрат свободного основания фексофенадина формы F в соответствии с данным изобретением может быть охарактеризован рентгенограммой дифракционных полос с характерными пиками (2θ): 3,6184°, 7,2914°, 9,5669°, 11,4946°, 11,9468°, 17,8400°, 18,2536°, 19,4768°, 21,6636°, 23,7517° и 25,6771°.
Другие характерные данные кристаллического моногидрата свободного основания фексофенадина формы F в соответствии с данным изобретением, полученные при рентгенографии дифракционных лучей, показаны в таблице 3.
| Таблица 3 | |||
| Пик № | 2θ (град.) | D(А) | I/II |
| 1 | 3,6184 | 24,39878 | 53 |
| 2 | 7,2914 | 12,11420 | 12 |
| 3 | 9,5669 | 9,23732 | 22 |
| 4 | 11,4946 | 7,69214 | 26 |
| 5 | 11,9468 | 7,40198 | 13 |
| 6 | 13,2800 | 6,66173 | 7 |
| 7 | 13,6800 | 6,46783 | 16 |
| 8 | 14,0800 | 6,28497 | 9 |
| 9 | 16,0591 | 5,51460 | 11 |
| 10 | 17,8400 | 4,96791 | 76 |
| 11 | 18,2536 | 4,85626 | 100 |
| 12 | 19,4768 | 4,55395 | 53 |
| 13 | 20,5000 | 4,32890 | 21 |
| 14 | 20,8600 | 4,25500 | 20 |
| 15 | 21,3800 | 4,15267 | 16 |
| 16 | 21,6636 | 4,09894 | 34 |
| 17 | 22,5525 | 3,93935 | 18 |
| 18 | 23,7517 | 3,74310 | 23 |
| 19 | 25,6771 | 3,46663 | 22 |
| 20 | 26,5400 | 3,35584 | 16 |
| 21 | 26,8600 | 3,31658 | 15 |
| 22 | 27,7305 | 3,21441 | 10 |
| 23 | 28,5977 | 3,11888 | 12 |
| 24 | 30,2654 | 2,95071 | 10 |
| 25 | 31,1246 | 2,87119 | 14 |
| 26 | 32,3453 | 2,76556 | 10 |
| 27 | 35,8600 | 2,50215 | 7 |
Кристаллический моногидрат свободного основания фексофенадина формы F также отличается типовой термограммой ДСК, показывающей два эндотерма, как показано на фиг.9. Широкий эндотерм, который находится между 70 и 102°С означает потерю молекул воды, и острый эндотерм, имеющий начало при около 222°С, означает эндотерм плавления. Существует также два меньших эндотерма (между двумя эндотермами), которые, вероятно, обозначают фазовые переходы при высоких температурах. Кристаллический моногидрат свободного основания фексофенадина формы F в соответствии с данным изобретением предпочтительно характеризуется температурой плавления в интервале от около 222 до 231°С (ДСК; открытая капсула) и характеристиками ДСК, показанными на фиг.9.
Кристаллический моногидрат свободного основания фексофенадина формы F в соответствии с данным изобретением предпочтительно имеет чистоту более чем около 99,5% мас./мас. (область пика).
Фексофенадин находит терапевтическое применение в качестве антагониста рецептора Н1 и применяется для введения пациенту для изменения симптомов, вызываемых гистаминами. В качестве антигистаминного средства фексофенадин является эффективным при облегчении симптомов, вызываемых возбудителями выброса гистамина, передаваемыми по воздуху и при непосредственном контакте. Такие вещества включают пыльцу, споры, перхоть животных, промышленные химикаты, пыль и пылевые клещи. Симптомы, которые могут быть облегчены фексофенадином, включают бронхиальные спазмы, чихание, ринорею, закупорку носового канала, слезотечение, покраснение, сыпь, крапивницу и зуд. Словосочетание «антигистаминное лечение» в данном описании означает лечение любого из представленных выше симптомов.
Полиморфы фексофенадина C, D, E или F, особенно безводный кристаллический гидрохлорид фексофенадина формы С, в соответствии с данным изобретением, применяются для доставки фексофенадина в желудочно-кишечный тракт, мембраны слизистой, кровь и воспаленные ткани пациента, страдающего воспалением, вызванным гистамином. Фексофенадин форм C, D, E или F, особенно безводный кристаллический гидрохлорид фексофенадина формы С, подходят для включения в фармацевтические композиции для применения при антигистаминном лечении, а также подходят для применения в способах лечения пациентов, страдающих от или подверженных воспалению, вызываемому гистамином.
В данном изобретении также представлены фармацевтически приемлемая композиция для антигистаминного лечения, где композиция содержит терапевтически эффективное количество любого фексофенадина форм C, D, E или F, описанных выше, особенно безводного кристаллического гидрохлорида фексофенадина формы С, вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем.
В данном описании термин «терапевтически эффективное количество» означает количество любого фексофенадина форм C, D, E или F, которое способно оказывать профилактическое, облегчающее или исключающее действие на воспаление, вызванное гистамином.
Под «фармацевтически приемлемой композицией» понимается то, что носитель, разбавитель или наполнитель совместим с любым фексофенадином форм C, D, E или F и не наносит вреда пациенту. Было обнаружено, что фексофенадин форм C, D, E или F в соответствии с данным изобретением подходят для включения в подходящие твердые композиции, обладающие хорошими свойствами выделения.
Фармацевтические композиции в соответствии с данным изобретением могут вводиться любым подходящим путем в любой подходящей форме, например, перорально (предпочтительно) в форме таблеток, капсул, порошков или жидких композиций (например, сиропов) или, например, парентерально в форме обычных стерильных растворов для инъекций, или ингалятов, или офтальмологических композиций.
Фармацевтические композиции в соответствии с данным изобретением могут быть получены обычными методами, известными в данной области техники. Например, таблетки могут быть получены смешиванием любого фексофенадина форм C, D, E или F в соответствии с данным изобретением с известными адъювантами и/или разбавителями с последующим прессованием смеси в обычной машине для получения таблеток. Примеры адъювантов или разбавителей могут включать кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и подобные. Другие адъюванты или добавки, такие как красители, улучшители запаха, консерванты и подобные, могут применяться при условии, что они совместимы с фексофенадином форм C, D, E или F, описанным выше.
В жидких фармацевтических композициях, представленных в данном изобретении, любой фексофенадин форм C, D, E или F и любые другие твердые наполнители могут быть растворены или суспендированы в жидком носителе, таком как вода, растительное масло, спирт, полиэтиленгликоль, пропиленгликоль или глицерин. Жидкие фармацевтические композиции в соответствии с данным изобретением могут, при необходимости, также содержать эмульгирующие агенты, агенты, улучшающие вязкость, подсластители, консерванты и буферы.
Точная дозировка фексофенадина форм C, D, E или F, особенно безводного кристаллического гидрохлорида фексофенадина формы С, требуемая для антигистаминного лечения, представленного в данном изобретении, зависит от конкретного воспаления, вызванного гистамином, симптомов и их тяжести. Дозировка, способы введения и частота введения наилучшим образом определяется лечащим терапевтом.
В данном изобретении также представлен фексофенадин форм C, D, E или F для применения при получении лекарственного средства для антигистаминного лечения.
В данном изобретении также представлен способ антигистаминного лечения, где способ включает введение пациенту терапевтически эффективного количества любого фексофенадина форм C, D, E или F, особенно безводного кристаллического гидрохлорида фексофенадина формы С.
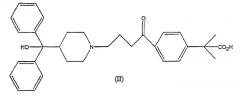
В другом аспекте данного изобретения представлен новый способ получения свободного основания фексофенадина в виде моногидрата гидролизом кетоэфира формулы III до соответствующей кетокислоты формулы II с последующим восстановлением кислоты с подходящим боргидридом натрия в водных или спиртовых условиях с получением натриевой соли фексофенадина, которую превращают в свободное основание корректировкой рН.
В данном изобретении представлен способ получения фексофенадина, где способ включает восстановление соединения формулы (II)
и выделение моногидрата свободного основания фексофенадина в кристаллической форме. Подходящие восстанавливающие агенты могут включать боргидрид натрия, цианоборгидрид натрия, алюмогидрид лития или подобные. Предпочтительно применяется боргидрид натрия, и соединение формулы (II) может быть восстановлено с первоначальным получением натриевой соли фексофенадина, как указано выше, которую превращают в свободное основание корректировкой рН.
Способ в соответствии с данным изобретением также включает получение соединения формулы (II) гидролизом соединения формулы (III)
где R1 является подходящей карбоксизащитной группой, такой как С1-С4алкил, в частности метил.
Данное изобретение также включает способ получения фексофенадина, где способ включает гидролиз соединения формулы (III)
с получением соединения формулы (II)
с последующим восстановлением соединения формулы (II), выделением моногидрата свободного основания фексофенадина в кристаллической форме и, необязательно, превращением указанного свободного основания фексофенадина в фармацевтически приемлемую соль.
В способе в соответствии с данным изобретением предпочтительно, чтобы соединение формулы (III) получали взаимодействием защищенного производного формулы (IV)
где Hal является хлором, бромом или иодом, в частности хлором, и R1 является подходящей карбоксизащитной группой, такой как С1-С4алкил, в частности метил, как указано выше, с азациклоналом формулы (V)
Обычно соединение формулы (IV) получают из защищенного производного формулы (VI)
где Hal такой, как определен выше, и R2 является подходящей гидроксизащитной группой, такой как ацетил или бензил, предпочтительно ацетил, в несколько стадий, включающих снятие защиты, окисление и последующую повторную защиту перед взаимодействием с соединение формулы (V). Обычно последовательность реакций следующая:
Соединение формулы (VI) обычно получают взаимодействием защищенного производного формулы (IX)
где R2 является подходящей гидроксизащитной группой, такой как ацетил или бензил, предпочтительно ацетил, как описано выше, с соединением галогена формулы (Х)
где Hal такой, как определен выше, и В является галогеном или гидрокси, обычно галогеном, в частности хлором, в общих условиях ацилирования по Фриделю-Крафтсу в присутствии подходящей кислоты Льюиса. Подходящие кислоты Льюиса хорошо известны в данной области техники и включают трихлорид бора, хлорид алюминия, тетрахлорид титана, трифторид бора, тетрахлорид олова, хлорид железа, хлорид кобальта (II) и хлорид цинка, где предпочтительным является хлорид алюминия.
Соединение формулы (IX) подходящим образом получают защитой соответствующего соединения гидрокси формулы (XI)
введением защитной группы R2, предпочтительно этерификацией.
Соединение формулы (XI) подходящим образом получают этерификацией соединения формулы (XII) и последующим восстановлением соединения формулы (XIII) согласно следующей последовательности реакций
где R3 является C1-C4алкилом, в частности метилом.
Подходящим образом соединение формулы (XII) получают метилированием соединения формулы (XIV) и последующим гидролизом соединения формулы (XV) согласно следующей последовательности реакций
Указанные выше стадии реакции обычно дают моногидрат свободного основания фексофенадина, который, предпочтительно, может быть далее превращен в фармацевтически приемлемую соль. Подходящие соли в основном могут включать ацетат и гидрохлорид, как описано выше, и могут быть представлены любой из форм C, D или Е в соответствии с данным изобретением. Предпочтительно, как описано выше, способ также включает обработку свободного основания фексофенадина, обычно моногидрата свободного основания фексофенадина формы F, фармацевтически приемлемой кислотой с получением фармацевтически приемлемой соли, в частности обработку хлористоводородной кислотой и/или уксусной кислотой с получением любого безводного кристаллического гидрохлорида фексофенадина формы С, кристаллического моногидрата ацетата фексофенадина формы D или кристаллического дигидрата ацетата фексофенадина формы Е в соответствии с данным изобретением.
В предпочтительном варианте способ, такой как описан ранее, также включает взаимодействие моногидрата свободного основания фексофенадина формы F, полученного ранее, с хлористоводородной кислотой с получением безводного кристаллического гидрохлорида фексофенадина формы С.
В альтернативном варианте способ, такой как описан ранее, также включает взаимодействие моногидрата свободного основания фексофенадина формы F, полученного ранее, с уксусной кислотой с получением кристаллического моногидрата ацетата фексофенадина формы D, и дальнейшее его превращение (обычно обработкой моногидрата ацетата фексофенадина формы D в достаточно влажной атмосфере в течение достаточного количества времени) в кристаллический дигидрат ацетата фексофенадина формы Е. Кристаллический дигидрат ацетата фексофенадина формы Е затем может быть подвергнут обработке хлористоводородной кислотой с получением безводного кристаллического гидрохлорида фексофенадина формы С.
В еще одном альтернативном варианте способ, такой как описан ранее, также включает взаимодействие моногидрата свободного основания фексофенадина, полученного ранее, с уксусной кислотой с получением кристаллического дигидрата ацетата фексофенадина формы Е. Кристаллический дигидрат ацетата фексофенадина формы Е затем может быть обработан хлористоводородной кислотой с получением безводного кристаллического гидрохлорида фексофенадина формы С.
Согласно данному изобретению здесь также представлен способ получения кристаллического моногидрата ацетата фексофенадина формы D из кристаллического моногидрата свободного основания фексофенадина формы F. Обычно этот способ включает растворение кристаллического моногидрата свободного основания фексофенадина формы F в первом водном растворе (таком как водный гидроксид натрия), превращение свободной карбоксильной группы фексофенадина в функциональную соль щелочного металла (такую как натриевая соль), гашение полученного водного раствора в другом водном растворе, содержащем избыток уксусной кислоты, что вызывает осаждение кристаллического моногидрата ацетата фексофенадина формы D.
В соответствии с данным изобретением, также представлен способ получения кристаллического дигидрата ацетата фексофенадина формы Е из кристаллического моногидрата ацетата фексофенадина формы D, который включает обработку моногидрата ацетата фексофенадина формы D в достаточной влажной атмосфере в течение достаточного периода времени с получением кристаллического дигидрата ацетата фексофенадина формы Е.
В соответствии с данным изобретением, также представлен способ получения кристаллического дигидрата ацетата фексофенадина формы Е из кристаллического моногидрата свободного основания фексофенадина формы F. Обычно этот способ включает растворение кристаллического моногидрата свободного основания фексофенадина формы F в первом водном растворе (таком как водный гидроксид натрия), превращение свободной карбоксильной группы фексофенадина в функциональную соль щелочного металла (такую как натриевая соль), гашение полученного водного раствора в другом водном растворе, содержащем избыток уксусной кислоты, что вызывает осаждение кристаллического дигидрата ацетата фексофенадина формы Е.
В соответствии с данным изобретением, также представлен способ получения безводного кристаллического гидрохлорида фексофенадина формы С из кристаллического моногидрата свободного основания фексофенадина формы F. Обычно этот способ включает взаимодействие кристаллического моногидрата свободного основания фексофенадина формы F с хлористоводородной кислотой. Предпочтительно, кристаллический моногидрат свободного основания фексофенадина формы F сначала суспендируют в первом органическом растворителе и к нему добавляют хлористоводородную кислоту (обычно в виде сухого газа хлористоводородной кислоты); концентрацию до остатка; добавление остатка во второй органический растворитель и осаждение безводного кристаллического гидрохлорида фексофенадина формы С. Обычно первый органический растворитель может в качестве растворителя содержать кетон, такой как ацетон; альтернативно, первый органический растворитель может содержать ТГФ. Обычно второй органический растворитель может содержать смесь сложного эфира и спирта, такую как изопропанол и этилацетат.
В соответствии с данным изобретением, также представлен способ получения безводного кристаллического гидрохлорида фексофенадина формы С из кристаллического дигидрата ацетата фексофенадина формы Е, где кристаллический дигидрат ацетата фексофенадина формы Е получают из кристаллического моногидрата свободного основания фексофенадина формы F. Кристаллический дигидрат ацетата фексофенадина формы Е может быть получен непосредственно из кристаллического моногидрата свободного основания фексофенадина формы F или через кристаллический моногидрат ацетата фексофенадина формы D, как описано выше. Обычно этот способ включает взаимодействие кристаллического дигидрата ацетата фексофенадина формы Е с хлористоводородной кислотой. Предпочтительно, кристаллический дигидрат ацетата фексофенадина формы Е суспендируют в первом органическом растворителе и к нему добавляют хлористоводородную кислоту (обычно в виде сухого газа хлористоводородной кислоты); концентрацию до остатка; добавление остатка во второй органический растворитель и осаждение безводного кристаллического гидрохлорида фексофенадина формы С. Обычно первый органический растворитель может в качестве растворителя содержать кетон, такой как ацетон; альтернативно, первый органический растворитель может содержать ТГФ. Обычно второй органический растворитель может содержать смесь сложного эфира и спирта, такую как изопропанол и этилацетат.
В каждом из представленных выше способов получения безводного кристаллического гидрохлорида фексофенадина формы С, его получают либо из кристаллического моногидрата свободного основания фексофенадина формы F, либо из кристаллического дигидрата ацетата фексофенадина формы Е, без получения гидрированного гидрохлорида фексофенадина.
В данном изобретении также представлено применение кристаллического моногидрата свободного основания фексофенадина формы F, такого как описан выше, для получения безводного гидрохлорида фексофенадина (любая форма). В данном изобретении также представлено применение кристаллического дигидрата ацетата фексофенадина формы Е, такого как описан выше, для получения безводного гидрохлорида фексофенадина (любая форма).
В данном изобретении также представлены любые из безводного кристаллического гидрохлорида фексофенадина формы С, кристаллического моногидрата ацетата фексофенадина формы D, кристаллического дигидрата ацетата фексофенадина формы Е и кристаллического моногидрата свободного основания фексофенадина формы F, полученные способом, описанным выше.
Данное изобретение далее проиллюстрировано рисунками, промежуточными соединениями и примерами, которые не ограничивают объем данного изобретения. В подразделе экспериментальной части, озаглавленном «Промежуточные соединения», если реагенты указаны как «описанные выше», это означает, что они применяются в количествах, указанных в представленных выше списках реагентов.
На фиг.1 представлена PXRD диаграмма безводного гидрохлорида фексофенадина.
На фиг.2 представлена ДСК диаграмма безводного гидрохлорида фексофенадина.
На фиг.3 представлен ИК спектр безводного гидрохлорида фексофенадина.
На фиг.4 представлен ИК спектр дигидрата ацетата фексофенадина.
На фиг.5 представлена PXRD диаграмма дигидрата ацетата фексофенадина.
На фиг.6 представлена ДСК диаграмма дигидрата ацетата фексофенадина.
На фиг.7 представлен ИК спектр моногидрата основания фексофенадина.
На фиг.8 представлена PXRD диаграмма моногидрата основания фексофенадина.
На фиг.9 представлена ДСК диаграмма моногидрата основания фексофенадина.
ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ
Промежуточное соединение 1
Получение 2,2-диметил-2-фенилуксусной кислоты
Цианид бензила (0,5 кг), гидроксид калия (1,4 кг) и ДМСО (2,5 л) сначала загружают в реактор и к полученной смеси медленно добавляют диметилсульфат (1,20 кг) в течение одного часа. Смесь перемешивают в течение 3-4 часов при комнатной температуре. Массу медленно гасят в воде при перемешивании. рН доводят до 1-2 добавлением концентрированной HCl. Раствор фильтруют, твердые вещества промывают водой и полученный материал сушат в вакууме в печи. Полученный продукт суспендируют в воде (3,0 л), добавляют гидроксид натрия (0,5 кг) и смесь кипятят с обратным холодильником в течение 6 часов. После завершения реакции реакционную массу охлаждают до комнатной температуры и подкисляют HCl до рН 2-3. Полученный осажденный продукт фильтруют, промывают водой и сушат с получением указанного в заголовке соединения.
Промежуточное соединение 2
Получение метил-2,2-диметил-2-фенилацетата
Метанол (2,5 л), 2,2-диметил-2-фенилуксусную кислоту (промежуточное соединение 1) (0,5 кг) и концентрированную серную кислоту (50 мл) загружают в реактор при комнатной температуре. Температуру повышают до температуры кипения с обратным холодильником и выдерживают в течение 12 часов. рН доводят до 7-8 добавлением водного аммиака и полностью концентрируют метанол. Реакционную массу гасят в воде (1 л) и экстрагируют MDC (750 мл). Слой MDC сушат над сульфатом натрия и концентрируют с получением 500 г указанного в заголовке соединения в виде масла, имеющего чистоту 98%.
Промежуточное соединение 3
Получение 2-метил-2-фенилпропанола
Метил-2,2-диметил-2-фенилацетат (промежуточное соединение 2) (0,5 кг) и ТГФ (2,5 л) загружают в реактор и порциями добавляют боргидрид натрия (100 г). Смесь перемешивают при комнатной температуре в течение 5 часов. После завершения реакции рН дово