Белковый комплекс, полученный с использованием фрагмента иммуноглобулина, и способ получения такого комплекса
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии и иммунологии. Описан физиологически активный белковый конъюгат. Белковый конъюгат включает физиологически активный полипептид, ковалентно связанный с Fc-фрагментом иммуноглобулина посредством полиэтиленгликоля. Раскрыт способ получения белкового конъюгата. Использование изобретения обеспечивает повышенную физиологическую активность in vivo конструкции по сравнению с нативным физиологически активным полипептидом и увеличение времени полужизни в сыворотке физиологически активного полипептида с минимальным риском индуцирования нежелательных иммунных ответов. Это может быть найти применение при изготовлении различных полипептидных лекарственных препаратов пролонгированного действия. 2 н. и 15 з.п. ф-лы, 19 ил.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к белковому конъюгату, содержащему физиологически активный полипептид, не-пептидный полимер и Fc-фрагмент иммуноглобулина, которые являются ковалентно связанными и обладают более продолжительным физиологическим действием по сравнению с нативной формой.
Предшествующий уровень техники
Поскольку полипептиды легко денатурируют, что обусловлено их низкой стабильностью, расщепляются протеолитическими ферментами крови и свободно проходят через почки или печень, то лекарственные препараты на основе белка, содержащие такие полипептиды в качестве фармацевтически эффективных компонентов, должны часто вводиться пациентам для поддержания желаемого уровня концентраций и титров в крови. Однако такое частое введение белковых лекарственных препаратов, особенно путем инъекции, вызывает боли у пациентов. Для решения этих трудностей было предпринято множество попыток повысить стабильность белковых лекарственных средств в сыворотке и добиться поддержания высоких уровней лекарственных средств в крови в течение длительного периода времени и таким образом максимально повысить фармацевтическую эффективность этих лекарственных средств. Поэтому возникла необходимость в получении фармацевтических композиций с пролонгированной активностью, которые обеспечивали бы высокую стабильность белковых лекарственных средств и поддержание их титров на достаточно высоких уровнях, не вызывая, при этом, нежелательных иммунных ответов у пациентов.
Для стабилизации белков и предотвращения их ферментативного разложения и выведения почками обычно, в целях химической модификации поверхности белкового лекарственного средства, используют полимер, обладающий высокой растворимостью, такой как полиэтиленгликоль (далее называемый просто “PEG”). PEG, благодаря своему связыванию со специфическими или различными областями белка-мишени, стабилизирует белок и предотвращает его гидролиз, не вызывая, при этом серьезных побочных эффектов (Sada et al., J. Fermentation Bioengineering 71:137-139, 1991). Однако это присоединение PEG, несмотря на его способность повышать стабильность белка, связано с такими проблемами, как значительное снижение титров физиологически активных белков. Кроме того, с увеличением молекулярной массы PEG уменьшается выход белка, что обусловлено снижением реакционной способности белков.
Недавно в качестве лекарственного препарата были предложены полимербелковые конъюгаты. Так, например, в патенте США № 5738846 описано, что для повышения активности белкового лекарственного средства, конъюгат может быть получен путем присоединения идентичных белковых лекарственных средств к обоим концам PEG. Кроме того, как описано в публикации Международной патентной заявки WO 92/16221, к обоим концам PEG могут быть присоединены два различных белковых лекарственных средства с получением конъюгата, обладающего двумя различными активностями. Однако вышеуказанные методы оказались не очень эффективными для сохранения уровня активности белковых лекарственных средств.
С другой стороны, в работе Kinstler et al. сообщалось, что гибридный белок, полученный путем связывания гранулоцитарного колониестимулирующего фактора (G-CSF) с человеческим альбумином, обладает более высокой стабильностью (Kinstler et al., Pharmaceutical Research 12(12):1883-1888, 1995). Однако в этой публикации указывалось, что поскольку модифицированное лекарственное средство, имеющее структуру “G-CSF-PEG-альбумин”, обнаруживает примерно только четырехкратное увеличение времени его пребывания в организме и лишь небольшое увеличение времени полужизни в сыворотке, по сравнению с нативным G-CSF, то промышленное производство такого лекарственного средства в качестве эффективного белкового препарата пролонгированного действия не является целесообразным.
Альтернативный метод повышения in vivo стабильности физиологически активных белков предусматривает присоединение гена физиологически активного белка к гену, кодирующему белок, обладающий высокой стабильностью в сыворотке, посредством методов генетической рекомбинации, и культивирование клеток, трансфецированных таким рекомбинантным геном, с получением гибридного белка. Так, например, гибридный белок может быть получен путем конъюгирования альбумина, белка, который, как известно, является наиболее эффективным для повышения стабильности белка, или его фрагмента, с интересующим физиологически активным белком посредством генетической рекомбинации (публикация Международной патентной заявки № WO 93/15199 и WO 93/15200, публикация Европейской патентной заявки № 413622). Время полужизни гибридного белка интерферона-альфа и альбумина, полученного компанией Human Genome Science Company и поставляемого под торговым знаком AlbuferonTM, было увеличено с 5 часов до 93 часов у обезьян, однако проблема заключается в том, что такое увеличение времени полужизни приводило к снижению активности in vivo до менее чем 5% по сравнению с немодифицированным интерфероном-альфа (Osborn et al., J. Phar. Exp. Ther. 303(2):540-548, 2002).
С другой стороны, иммуноглобулин (Ig) состоит, в основном, из двух областей: Fab-фрагмента с антигенсвязывающим сайтом, и Fc-фрагмента с комплементсвязывающим сайтом. Были предприняты и другие попытки присоединения белкового лекарственного средства к Fc-фрагменту иммуноглобулина посредством генетической рекомбинации. Так, например, интерферон (публикация выложенной корейской патентной заявки № 2003-9464) и рецептор интерлейкина-4, рецептор интерлейкина-7 или рецептор эритропоэтина (ЕРО) (Корейский патент, регистрационный номер № 249572) были предварительно экспрессированы у млекопитающих в форме гибрида с Fc-фрагментом иммуноглобулина. В публикации Международной патентной заявки № WO 01/03737 описан гибридный белок, содержащий цитокин или фактор роста, связанные с Fc-фрагментом иммуноглобулина посредством олигопептидного линкера.
Кроме того, в патенте США № 5116964 описан LHR (лимфоцитарный гликопротеин клеточной поверхности) или белок CD4, присоединенный к амино-концу или к карбокси-концу Fc-фрагмента иммуноглобулина посредством генетической рекомбинации, а в патенте США № 5349053 описан гибридный белок IL-2 и Fc-фрагмента иммуноглобулина. Другими примерами Fc-гибридных белков, полученных посредством генетической рекомбинации, являются гибридный белок интерферона-бета или его производного и Fc-фрагмента иммуноглобулина (публикация Международной патентной заявки № WO 00/23472), гибридный белок рецептора IL-5 и Fc-фрагмента иммуноглобулина (патент США № 5712121), гибридный белок интерферона-альфа и Fc-фрагмента иммуноглобулина G4 (патент США № 5723125), и гибрид белка CD4 и Fc-фрагмента иммуноглобулина G2 (патент США № 6451313). Кроме того, как описано в патенте США № 5605690, Fc-вариант, имеющий аминокислотные альтерации, а в частности, в комплементсвязывающем сайте или в сайте связывания с рецептором, может быть присоединен к рецептору TNF с помощью техники рекомбинантных ДНК с получением гибридного белка “TNFR-Fc-фрагмент IgG1”. Так, например, способы получения Fc-гибридного белка с использованием Fc-фрагмента иммуноглобулина, модифицированного посредством генетической рекомбинации, описаны в патентах США № 6277375, 6410008 и 6444792.
В патенте США № 6660843 описан способ получения конъюгата, содержащего нужный белок, присоединенный к Fc-фрагмента иммуноглобулина посредством линкера, в E.coli путем генетической рекомбинации. Этот метод позволяет получить конъюгат с меньшими экономическими затратами, чем это может быть осуществлено с использованием экспрессионных систем млекопитающих, и дает возможность получить конъюгат в агликозилированной форме. Однако, если нужный белок и Fc-фрагмент иммуноглобулина продуцируются вместе в E.coli, и если этот белок является, по своей природе, гликозилированным, то использование такого целевого белка в указанном методе является проблематичным. Применение этого метода связано и с другой проблемой, которая заключается в том, что экспрессия конъюгата в виде телец включения приводит к образованию в высокой степени неправильной укладки.
Однако такие Fc-гибридные белки, продуцированные посредством генетической рекомбинации, имеют следующие недостатки: такой гибридный белок присутствует только в специфической области Fc-фрагмента иммуноглобулина, которая расположена у амино- или у карбокси-конца; продуцируются лишь гомодимерные, а не мономерные формы этого белка; и такой гибрид может находиться только между гликозилированными белками или между агликозилированными белками, и невозможно получить такой гибридный белок, который состоял бы из гликозилированного белка и агликозилированного белка. Кроме того, новая аминокислотная последовательность, созданная путем слияния, может индуцировать иммунные ответы, а линкерная область может оказаться восприимчивой к протеолитическому расщеплению.
С другой стороны, что касается получения гибридных белков с использованием Fc-фрагмента иммуноглобулина, то каких-либо сообщений о получении конъюгата, содержащего целевой белок, связанный с человеческим нативным Fc-фрагментом посредством сшивающего агента, пока еще не было. Получение конъюгата с использованием линкера имеет то преимущество, что оно облегчает выбор и регуляцию линкерных сайтов, а также позволяет обеспечивать соответствующую ориентацию двух связанных друг с другом белков и осуществлять экспрессию с образованием мономера, димера или мультимера, а также получать гомологичные или гетерогенные конструкции. Fc-фрагмент иммуноглобулина может быть продуцирован методом рекомбинантных ДНК с использованием клеток млекопитающих или E.coli. Однако до настоящего времени не появлялось каких-либо сообщений о нативном Fc-фрагменте иммуноглобулина, который был бы отдельно продуцирован в массовом масштабе и с высокими выходами в E.coli и который можно было бы использовать для получения препаратов пролонгированного действия. Кроме того, до настоящего времени также не предпринималось каких-либо попыток получения конъюгата, содержащего нужный белок, присоединенный к такому происходящему от E.coli Fc-фрагменту иммуноглобулина, продуцированному методами рекомбинантных ДНК, с использованием сшивающего агента.
С другой стороны, иммуноглобулины обладают функциями антитела, такими как антителозависимая клеточно-опосредованная цитотоксичность (ADCC) или комплементзависимая цитотоксичность (CDC), а сахарные группы, присутствующие в Fc-фрагменте иммуноглобулинов, играют важную роль в ADCC- и CDC-эффектах (Burton D., Molec. Immun. 22, 161-206, 1985). Иммуноглобулины, у которых отсутствуют сахарные группы, имеют время полужизни в сыворотке, аналогичное времени полужизни гликозилированных иммуноглобулинов, но обладают в 10-1000 раз меньшей аффинностью связывания с комплементом и рецептором (Waldmann H., Eur. J. Immunol. 23, 403-411, 1993; Morrison S., J. Immunol. 143, 2595-2601, 1989).
Как описано выше, для связывания полимера с физиологически активным белком могут быть использованы различные методы. Стандартные методы позволяют повысить стабильность полипептидов, но приводят к значительному снижению их активности, либо они позволяют повысить активность полипептидов в ущерб его стабильности. Поэтому необходимо разработать такой способ, который, при минимальном снижении активности белкового лекарственного средства, обеспечивал бы повышение его стабильности.
Поэтому, что привело к настоящему изобретению, были предприняты интенсивные и глубокие исследования, направленные на получение такого белкового лекарственного препарата с пролонгированным действием, которое было бы способно, при минимальном снижении активности, обеспечить повышение стабильности, трудно достижимой стандартными методами, и в результате этих исследований было обнаружено, что белковый конъюгат, полученный путем ковалентного связывания Fc-фрагмента иммуноглобулина, не-пептидного полимера и физиологически активного полипептида, обеспечивает значительное увеличение времени полужизни физиологически активного белка в сыворотке и поддержание более высоких титров, чем известные белковые лекарственные средства.
Описание настоящего изобретения
Таким образом, настоящее изобретение относится к белковому конъюгату, который, при минимальном снижении физиологической активности полипептида, обеспечивает увеличение времени полужизни полипептида в сыворотке, что уменьшает риск индуцирования иммунных ответов; и к способу получения такого конъюгата.
Еще одним объектом настоящего изобретения является лекарственный препарат пролонгированного действия, содержащий в качестве эффективного компонента белковый конъюгат с более длительным временем полужизни.
Другим объектом настоящего изобретения является способ увеличения стабильности и продолжительности действия активного полипептида, при минимальном снижении его физиологической активности, путем увеличения времени полужизни данного полипептида в сыворотке.
Краткое описание чертежей
Вышеуказанные и другие объекты, а также отличительные признаки и другие преимущества настоящего изобретения будут более понятны из нижеследующего подробного описания, сопровождаемого чертежами, где:
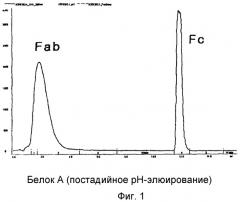
На фиг.1 представлены результаты хроматографии Fc-фрагмента иммуноглобулина, полученного путем расщепления иммуноглобулина папаином;
На фиг.2 представлены результаты электрофореза в SDS-PAGE очищенного Fc-фрагмента иммуноглобулина (М: маркер молекулярной массы, дорожка 1: IgG; дорожка 2: Fc);
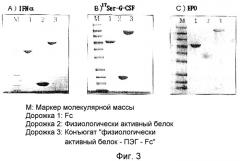
На фиг.3 представлены результаты электрофореза в SDS-PAGE для конъюгатов: (А) IFNα-PEG-Fc, (В) 17Ser-G-CSF-PEG-Fc и (С) ЕРО-PEG-Fc, которые были продуцированы путем реакции связывания (М: маркер молекулярной массы, дорожка 1: Fc, дорожка 2: физиологически активный белок, дорожка 3: конъюгат “физиологически активный белок-PEG-Fc);
На фиг.4 представлены результаты вытеснительной хроматографии конъюгата IFNα-PEG-Fc, очищенного после реакции связывания;
На фиг.5 представлены результаты масс-спектрометрии MALDI-TOF конъюгата ЕРО-PEG-Fc;
На фиг.6а и 6b представлены результаты масс-спектрометрии MALDI-TOF и SDS-PAGE-анализа, соответственно, нативного Fc-фрагмента иммуноглобулина и дегликозилизованного Fc-фрагмента иммуноглобулина (DG Fc);
На фиг.7 представлены результаты масс-спектрометрии MALDI-TOF конъюгата IFNα-PEG-Fc и конъюгата IFNα-PEG-DG-Fc;
На фиг.8а-8с представлены результаты обращенно-фазовой ВЭЖХ конъюгатов IFNα-PEG-Fc, IFNα-PEG-DG-Fc и IFNα-PEG-производное Fc-фрагмента рекомбинантного AG;
На фиг.9 представлен график, иллюстрирующий результаты фармакокинетического анализа нативного IFNα, комплекса IFNα-40К PEG, конъюгата IFNα-PEG-альбумина и конъюгата IFNα-PEG-Fc;
На фиг.10 представлен график, иллюстрирующий результаты фармакокинетического анализа нативного ЕРО, в высокой степени гликозилированного ЕРО, конъюгата ЕРО-PEG-Fc и конъюгата ЕРО-PEG-AG-Fc;
На фиг.11 представлен график, иллюстрирующий результаты фармакокинетического анализа конъюгатов IFNα-PEG-Fc, IFNα-PEG-DG-Fc и IFN-α-PEG-производное рекомбинантного AG-Fc;
На фиг.12 представлен график, иллюстрирующий результаты фармакокинетического анализа Fab', комплекса Fab'-S-40K-PEG, конъюгата Fab'-N-PEG-N-Fc и конъюгата Fab'-S-PEG-N-Fc;
На фиг.13 представлен график, иллюстрирующий in vivo-активности Fab', комплекса Fab'-S-40K-PEG, конъюгата Fab'-N-PEG-N-Fc и конъюгата Fab'-S-PEG-N-Fc;
На фиг.14 представлен график, иллюстрирующий результаты сравнения аффинности связывания человеческих иммуноглобулинов подкласса IgG с комплементом C1q;
На фиг.15 представлен график, иллюстрирующий результаты сравнения аффинности связывания гликозилированного Fc, ферментативно дегликозилированного (DG) Fc и конъюгата интерферон-PEG-носитель, где носителем является неглигозилированный (AG) Fc, продуцируемый E.coli, с комплементом C1q.
Наилучшие варианты осуществления изобретения
В одном из аспектов достижения вышеуказанных целей, настоящее изобретение относится к белковому конъюгату, содержащему физиологически активный полипептид, не-пептидный полимер, имеющий реакционно-способные группы по обоим концам, и Fc-фрагмент иммуноглобулина, ковалентно связанные друг с другом.
Используемый здесь термин “белковый конъюгат” или “конъюгат” означает один или несколько физиологически активных полипептидов, один или несколько не-пептидных полимеров, имеющих реакционно-способные группы по обоим концам, и один или несколько Fc-фрагментов иммуноглобулина, где указанные три компонента ковалентно связаны друг с другом. Кроме того, в отличие от “конъюгата”, конструкция, содержащая только две различные молекулы, выбранные из физиологически активного полипептида, не-пептидного полимера и Fc-фрагмента иммуноглобулина, где указанные две молекулы ковалентно связаны друг с другом, называется “комплексом”.
Белковый конъюгат по настоящему изобретению представляет собой вариант белкового лекарственного средства, который получают так, чтобы он, при минимальном снижении физиологической активности, увеличивал продолжительность действия белкового лекарственного средства in vivo, и который получают путем присоединения Fc-фрагмента иммуноглобулина к указанному белковому лекарственному средству.
Fc-фрагмент иммуноглобулина является безопасным для использования в качестве носителя лекарственного средства, поскольку он представляет собой биологически разлагаемый полипептид, который подвергается метаболизму в организме. Кроме того, Fc-фрагмент иммуноглобулина имеет относительно низкую молекулярную массу по сравнению с целыми молекулами иммуноглобулина, что делает его предпочтительным с точки зрения получения, очистки и выхода конъюгата. Поскольку Fc-фрагмент иммуноглобулина не содержит Fab-фрагмента, аминокислотная последовательность которого отличается от аминокислотных последовательностей антител других подклассов, и который поэтому является в высокой степени негомогенным, то этот Fc-фрагмент может значительно повышать степень гомогенности веществ и является менее антигенным.
Используемый здесь термин “Fc-фрагмент иммуноглобулина” означает белок, который содержит константную область 2 тяжелой цепи (СН2) и константную область 3 тяжелой цепи (СН3) иммуноглобулина, и не содержит вариабельных областей тяжелой и легкой цепей, константной области 1 тяжелой цепи (СН1) и константной области 1 легкой цепи (СL1) иммуноглобулина. Кроме того, он может содержать шарнирную область в константной области тяжелой цепи. Fc-фрагмент иммуноглобулина настоящего изобретения может также содержать часть константной области 1 тяжелой цепи (СН1) или всю эту область, и/или часть константной области 1 легкой цепи (СL1) или всю эту область, за исключением вариабельных областей тяжелой и легкой цепей. Кроме того, в том случае, если Fc-фрагмент иммуноглобулина обладает физиологической функцией, в основном, аналогичной физиологической функции нативного белка, или лучшей физиологической функцией, чем нативный белок, то таким Fc-фрагментом IgG может быть фрагмент, имеющий делецию в относительно длинной части аминокислотной последовательности СН2 и/или СН3. То есть, Fc-фрагмент иммуноглобулина настоящего изобретения может содержать (1) домен СН1, домен СН2, домен СН3 и домен СН4, (2) домен СН1 и домен СН2, (3) домен СН1 и домен СН3, (4) домен СН2 и домен СН3, (5) комбинацию одного или нескольких доменов и шарнирной области иммуноглобулина (или части такой шарнирной области), и (6) димер каждого из этих доменов константных областей тяжелой цепи и константной области легкой цепи.
Fc-фрагмент иммуноглобулина настоящего изобретения включает нативную аминокислотную последовательность и производные этой последовательности (мутанты). Производной аминокислотной последовательностью является последовательность, отличающаяся от нативной аминокислотной последовательности тем, что она включает делецию, инсерцию, не-консервативную или консервативную замену одного или нескольких аминокислотных остатков или их комбинации. Так, например, в Fc IgG, аминокислотные остатки в положениях 214-238, 297-299, 318-322 или 327-331, которые, как известно, играют важную роль в связывании, могут быть использованы в качестве подходящей мишени для модификации. Кроме того, могут быть использованы и другие различные производные, включая производные, в которых либо делетирована область, способная образовывать дисульфидную связь, либо элиминированы некоторые аминокислотные остатки, которые обычно присутствуют у N-конца нативной Fc-формы, либо добавлен метиониновый остаток. Кроме того, для ингибирования эффекторных функций может быть осуществлена делеция в комплементсвязывающем сайте, таком как C1q-связывающий сайт и ADCC-сайт. Методы получения таких производных последовательностей Fc-фрагмента иммуноглобулина описаны в публикациях Международных патентных заявок №№ WO 97/34631 и WO 96/32478.
Аминокислотные замены в белках и пептидах, которые, в основном, не влияют на активность таких белков или пептидов, известны специалистам (H. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly, и наоборот.
Кроме того, Fc-фрагмент, если это необходимо, может быть модифицирован путем фосфорилирования, сульфирования, акрилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования, амидирования и тому подобное.
Вышеупомянутыми производными Fc являются производные, которые обладают биологической активностью, идентичной активности Fc-фрагмента настоящего изобретения, или обладают повышенной структурной устойчивостью, например, к нагреванию, к изменению рН, или т.п.
Кроме того, эти Fc-фрагменты могут быть получены из нативных форм, выделенных у человека и других животных, включая коров, коз, свиней, мышей, кроликов, хомячков, крыс и морских свинок, либо они могут быть их рекомбинантами или производными, полученными из трансформированных клеток животных или микроорганизмов. В соответствии с настоящим изобретением, они могут быть получены из нативного иммуноглобулина путем выделения целых иммуноглобулинов из организма человека или животного, и их обработки протеолитическим ферментом. Папаин гидролизует нативный иммуноглобулин на Fab- и Fc-фрагменты, а обработка пепсином приводит к продуцированию pF'c- и F(ab')2-фрагментов. Эти фрагменты могут быть подвергнуты, например, вытеснительной хроматографии для выделения Fc или pF'c.
Человеческим Fc-фрагментом, предпочтительно, является рекомбинантный Fc-фрагмент иммуноглобулина, полученный из микроорганизма.
Кроме того, Fc-фрагмент иммуноглобулина настоящего изобретения может присутствовать в форме, имеющей обычно присущее ей число сахарных цепей, или в форме, имеющей повышенное число сахарных цепей по сравнению с нативной формой или пониженное число сахарных цепей по сравнению с нативной формой, либо он может присутствовать в дегликозилированной форме. Увеличение, уменьшение или удаление сахарных цепей Fc-фрагмента иммуноглобулина может быть достигнуто методами, известными специалистам, такими как химический метод, ферментативный метод и метод генной инженерии с использованием микроорганизма. Удаление сахарных цепей из Fc-фрагмента приводит к резкому снижению аффинности связывания с C1q-частью первого компонента комплемента С1, а также к снижению или к потере антителозависимой клеточно-опосредованной цитотоксичности (ADCC) или комплементзависимой цитотоксичности (CDC), не индуцируя, при этом, нежелательных иммунных ответов in vivo. В этой связи следует отметить, что Fc-фрагмент иммуноглобулина в дегликозилированной или агликозилированной форме может оказаться более подходящим для использования в настоящем изобретении в качестве носителя лекарственного средства.
Используемый здесь термин “дегликозилирование” означает ферментативное удаление сахарных групп из Fc-фрагмента, а термин “агликозилирование” означает, что Fc-фрагмент был продуцирован в негликозилированной форме прокариотом, предпочтительно, E.coli.
С другой стороны, Fc-фрагмент иммуноглобулина может быть выделен у человека или других животных, включая коров, коз, свиней, мышей, кроликов, хомячков, крыс и морских свинок, и предпочтительно, от человека. Кроме того, Fc-фрагментом иммуноглобулина может быть Fc-фрагмент IgG, IgA, IgD, IgE и IgM их комбинаций или гибридов. Предпочтительно, если этот Fc-фрагмент является Fc-фрагментом иммуноглобулинов IgG или IgM, которые, среди прочих белков, присутствуют в наибольшем количестве в крови человека, и, наиболее предпочтительно, если он является Fc-фрагментом IgG, который, как известно, увеличивает время полужизни связывающихся с лигандом белков.
С другой стороны, используемый здесь термин “комбинация” означает, что полипептиды, кодирующие одноцепочечные Fc-области иммуноглобулина того же самого происхождения, присоединены к одноцепочечному полипептиду другого происхождения и образуют димер или мультимер. То есть, димер или мультимер могут быть образованы из двух или более фрагментов, выбранных из группы, состоящей из Fc-фрагментов IgG1, IgG2, IgG3 и IgG4.
Используемый здесь термин “гибрид” означает, что последовательности, кодирующие два или более Fc-фрагментов иммуноглобулина различного происхождения, присутствуют в одноцепочечном Fc-фрагменте иммуноглобулина. В настоящем изобретении могут быть использованы различные типы гибридов. То есть, гибриды доменов могут состоять из одного-четырех доменов, выбранных из группы, включающей СН1, СН2, СН3 и СН4 Fc-фрагментов IgG1, IgG2, IgG3 и IgG4, и могут включать шарнирную область.
С другой стороны, IgG подразделяется на подклассы IgG1, IgG2, IgG3 и IgG4, и настоящее изобретение включает их комбинации и гибриды. Предпочтительными являются подклассы IgG2 и IgG4, а наиболее предпочтительным является Fc-фрагмент IgG4, который редко обладает эффекторными функциями, такими как CDC (комплементзависимая цитотоксичность)(см, фиг. 14 и 15).
Таким образом, в качестве носителя лекарственного средства настоящего изобретения, наиболее предпочтительным Fc-фрагментом иммуноглобулина является негликозилированный Fc-фрагмент человеческого IgG4. Человеческий Fc-фрагмент является более предпочтительным, чем Fc-фрагмент другого источника, который может действовать в организме человека как антиген и вызывать нежелательные иммунные ответы, такие как вырабатывание нового антитела против антигена.
Настоящее изобретение отличается тем, что в нем Fc-фрагмент иммуноглобулина и белковое лекарственное средство связаны друг с другом в виде не-пептидного полимера.
Используемый здесь термин “не-пептидный полимер” означает биологически совместимый полимер, включающий два или более повторяющихся звена, связанных друг с другом ковалентной связью, за исключением пептидной связи.
Не-пептидный полимер, подходящий для использования по настоящему изобретению, может быть выбран из группы, включающей полиэтиленгликоль, полипропиленгликоль, сополимеры этиленгликоля и пропиленгликоля, полиоксиэтилированные полиолы, поливиниловый спирт, полисахариды, декстран, поливинилэтиловый эфир, биологически разлагаемые полимеры, такие как PLA (поли(молочная кислота)) и PLGA (сополимер молочной и гликолевой кислоты), липидные полимеры, хитины, гиалуроновую кислоту и их комбинации. Наиболее предпочтительным является полиэтиленгликоль (PEG). Его производные также хорошо известны и могут быть легко получены любым специалистам, и такие производные входят в объем настоящего изобретения. Молекулярная масса не-пептидного полимера, предпочтительно, составляет от 1 до 100 кДа, а более предпочтительно, от 1 до 20 кДа. Кроме того, не-пептидным полимером настоящего изобретения, связанным с Fc-фрагментом иммуноглобулина, может быть один полимер или комбинация полимеров различных типов.
Не-пептидный полимер, используемый в настоящем изобретении, имеет реакционно-способную группу, которая может связываться с Fc-фрагментом иммуноглобулина и белковым лекарственным средством.
Не-пептидный полимер имеет реакционно-способную группу у обоих концов, которая предпочтительно выбрана из группы, состоящей из реакционно-способной альдегидной группы, пропионилальдегидной группы, бутилальдегидной группы, малеимидной группы и сукцинимидного производного. Таким сукцинимидным производным могут быть сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил или сукцинимидилкарбонат. В частности, если такой не-пептидный полимер имеет реакционно-способную альдегидную группу по обоим концам, то он эффективно связывается по обоим концам с физиологически активным полипептидом и с Fc-фрагментом иммуноглобулина, продуцируя, при этом, лишь минимальные неспецифические реакции. Конечный продукт, продуцированный путем восстановительного алкилирования посредством альдегидной связи, является гораздо более стабильным, чем продукт, полученный с использованием амидной связи.
Реакционно-способные группы по обоим концам не-пептидного полимера могут быть одинаковыми или различными. Так, например, не-пептидный полимер на одном своем конце может иметь малеимидную группу, а на другом конце - альдегидную группу, пропионилальдегидную группу или бутилальдегидную группу. Если полиэтиленгликоль (PEG), имеющий реакционно-способную гидроксигруппу по обоим концам, используется в качестве не-пептидного полимера, то такая гидроксигруппа может быть активирована различными реакционно-способными группами путем проведения известных химических реакций, либо для получения белкового конъюгата настоящего изобретения может быть использован коммерчески доступный PEG, имеющий модифицированную реакционно-способную группу.
С другой стороны, в настоящем изобретении, комплекс Fc-фрагмента иммуноглобулина и не-пептидного полимера присоединяют к физиологически активному полипептиду с образованием белкового конъюгата.
Используемые здесь термины “физиологически активный полипептид”, “физиологически активный белок”, “активный полипептид”, “полипептидное лекарственное средство” или “белковое лекарственное средство” являются взаимозаменяемыми, и отличаются тем, что присутствуя в физиологически активной форме, они обладают различными физиологическими функциями in vivo.
Недостатком белкового лекарственного средства является отсутствие способности поддерживать физиологическое действие в течение длительного периода времени, что обусловлено присущим ему свойством легко денатурироваться или разлагаться под действием протеолитических ферментов, присутствующих в организме. Однако, если полипептидное лекарственное средство присоединяют к Fc-фрагменту иммуноглобулина по настоящему изобретению с образованием конъюгата, то такое лекарственное средство обладает повышенной структурной стабильностью и увеличенным временем полужизни до разложения. Кроме того, полипептид, конъюгированный с Fc-фрагментом, менее подвержен снижению физиологической активности, чем другие известные полипептидные лекарственные препараты. Поэтому, по сравнению с биологической доступностью in vivo стандартных полипептидных лекарственных средств, конъюгат по настоящему изобретению, состоящий из полипептида и Fc-фрагмента иммуноглобулина, отличается тем, что он обладает значительно лучшей биологической доступностью in vivo. Это также наглядно проиллюстрировано в описании вариантов осуществления изобретения. То есть, при связывании с Fc-фрагментом иммуноглобулина по настоящему изобретению, лекарственные средства на основе IFNα, G-CSF, hGH и других белков обнаруживают примерно 2-6-кратное увеличение биологической доступности in vivo по сравнению с их стандартными формами, конъюгированными с одним PEG или с PEG и альбумином (таблицы 8, 9 и 10).
С другой стороны, конъюгат белка и Fc-фрагмента иммуноглобулина по настоящему изобретению отличается тем, что он не является гибридом, полученным стандартным рекомбинантным методом. В рекомбинантном методе, гибридную форму Fc-фрагмента иммуноглобулина и активного полипептида, используемого в качестве лекарственного средства, получают так, чтобы указанный полипептид был присоединен к N-концу или С-концу Fc-фрагмента, в результате чего он экспрессируется и подвергается укладке как один полипептид, продуцируемый из нуклеотидной последовательности, кодирующей его гибридную форму.
Это приводит к резкому снижению активности полученного гибридного белка, поскольку активность белка, как физиологически функционального вещества, определяется конформацией этого белка. Таким образом, при присоединении полипептидного лекарственного средства к Fc-фрагменту рекомбинантным методом, не наблюдается какого-либо влияния на биологическую доступность in vivo, даже если этот гибридный белок имеет повышенную структурную стабильность. Кроме того, поскольку такой гибридный белок часто имеет неправильную укладку, а поэтому экспрессируется в виде телец включения, то такой метод присоединения, применяемый для получения белка и его выделения, является экономически невыгодным. Кроме того, если активная форма полипептида является гликозилированной, то такой полипептид должен экспрессироваться в эукариотических клетках. В этом случае, Fc также является гликозилированным, и такое гликозилирование может индуцировать нежелательные иммунные ответы in vivo.
Таким образом, лишь применение настоящего изобретения позволяет получить конъюгат глигозилированного активного полипептида и агликозилированного Fc-фрагмента иммуноглобулина, и позволяет решить все вышеуказанные проблемы, включая увеличение выхода белка, поскольку два компонента этого комплекса получают отдельно и выделяют с использованием самых эффективных систем.
С другой стороны, физиологически активным полипептидом, используемым в данном белковом конъюгате, являются, например, гормоны, цитокины, интерлейкины, белки, связывающиеся с интерлейкином, ферменты, антитела, факторы роста, факторы регуляции транскрипции, факторы свертывания крови, вакцины, структурные белки, белки или рецепторы лигандов, антигены клеточной поверхности, антагонисты рецепторов и их производные.
Более конкретно, неограничивающими примерами физиологически активного полипептида является человеческий гормон роста, релизинг-фактор гормона роста, пептид, высвобождающий гормон роста, интерфероны и рецепторы интерферона (например, интерферон-α, -β и -γ, водорастворимый рецептор интерферона 1 и т.п.), колониестимулирующие факторы, интерлейкины (например, интерлейкин-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -12, -13, -14, -15, -16, -17, -18, -19, -20, -21, -22, -23, -24, -25, -26, -27, -28, -29, -30 и т.п.) и рецепторы интерлейкина (например, рецептор IL-1, рецептор IL-4 и т.п.), ферменты (например, глюкоцереброзидаза, идуронат-2-сульфатаза, альфа-галактозидаза-А, альфа-L-идуронидаза, бутирилхолинэстераза, хитиназа, глутамат-декарбоксилаза, имиглюцераза, липаза, уриказа, ацетилгидролаза фактора активации тромбоцитов, нейтральная эндопептидаза, миелопероксидаза и т.п.), интерлейкин- и цитокинсвязывающие белки (например, IL-18bp, TNF-связывающий белок и т.п.), фактор активации макрофагов, пептид макрофага, В-клеточный фактор, Т-клеточный фактор, белок А, ингибитор аллергии, гликопротеины некроза клеток, иммунотоксин, лимофтоксин, фактор некроза опухоли, супрессоры опухолей, метастатический фактор роста, антитрипсин альфа-1, альбумин, альфа-лактальбумин, аполипопротеин-Е, эритропоэтин, высокогликозилированный эритропоэтин, ангиопоэтины, гемоглобин, тромбин, пептид, активирующий рецептор тромбина, тромбомодулин, фактор VII, фактор VIIa, фактор VIII, фактор IX, фактор XIII, фактор активации плазминогена, фибринсвязывающий пептид, урокиназа, стрептокиназа, гирудин, белок С, С-реактивный белок, ингибитор ренина, ингибитор коллагеназы, супероксиддисмутаза, лептин, тромбоцитарный фактор роста, эпителиальный фактор роста, эпидермальный фактор роста, ангиостатин, ангиотензин, фактор роста костей, белок, стимулирующий рост костей, кальцитонин, инсулин, атриопептин, фактор, индуцирующий образование хряща, элкатонин, фактор активации соединительной ткани, ингибитор пути тканевого фактора, фолликулостимулирующий гормон, лютеинизирующий гормон, фактор высвобождения лютеинизирующего гормона, факторы роста нервной тка