Производные имидазола iii
Иллюстрации
Показать всеНастоящее изобретение относится к производным имидазола общей формулы I
где R1 обозначает галоид, низший алкил; R2 обозначает низший алкил или C3-C6-циклоалкил; R3 обозначает низший алкил, C3-C6-циклоалкил, -(CH2)n-C3-C6-циклоалкил, -(CH2)n-CN или
-(СН2)n-O-(низш.)алкил, (низш.)алкоксиарил, Fn-R5, где R5 является низшим алкилом или низшим алкенилом; n принимает значения 1, 2 или 3; R4 является водородом или CH2R5, где R5 является водородом, C1-C6-алкилом, C3-C12-циклоалкилом, равно как и его фармацевтически приемлемые соли. Также изобретение относится к способам получения соединений формулы I, лекарственному средству на основе соединения формулы I и его применению. Технический результат: получены новые производные имидазола, полезные при лечении или профилактике расстройств, опосредованных действием глутаматного рецептора mGluR5. 6 н. и 12 з.п. ф-лы.
Реферат
Объектами настоящего изобретения являются производные имидазола общей формулы
в которых R1 обозначает галоид, низший алкил, (низш.)алкоксигруппу, CF3, CF2H, OCF3, OCF2H или цианогруппу;
R2 обозначает низший алкил или циклоалкил;
R3 обозначает низший алкил, циклоалкил, -(СН2)n-циклоалкил, -(CH2)n-CN или -(СН2)n-O-(низш.)алкил, (низш.)алкоксиарил, Fn-R5, где R5 является низшим алкилом или низшим алкенилом;
n принимает значения 1, 2 или 3;
R4 является водородом, С(O)Н, или CH2R5, где R5 является водородом, ОН, C1-C6-алкилом, C3-C12-циклоалкилом,
равно как и их фармацевтически приемлемые соли.
Недавно было неожиданно обнаружено, что соединения общей формулы I являются метаботропными антагонистами глутаматных рецепторов. Соединения формулы I отмечены наличием ценных терапевтических свойств. Они могут быть применены при лечении или профилактике расстройств, опосредованных действием глутаматного рецептора mGluR5.
В центральной нервной системе (ЦНС) передача раздражений происходит путем взаимодействия нейромедиатора, высвобожденного нейроном, с нейрорецептором.
Глутамат является главным возбуждающим нейромедиатором в мозгу и играет уникальную роль во множестве функций центральной нервной системы (ЦНС). Зависящие от глутамата рецепторы раздражений подразделяются на две основные группы. Первая основная группа, а именно ионотропные рецепторы, образует контролируемые лигандами ионные каналы. Метаботропные глутаматные рецепторы (mGluR) принадлежат ко второй основной группе и, помимо этого, принадлежат к семейству рецепторов, связанных с гуаниннуклеотидсвязывающими белками (G-белками).
В настоящее время известно восемь различных представителей семейства mGluR, среди которых некоторые даже имеют подтипы. Согласно их гомологии последовательностей, механизмам передачи сигнала и селективности в отношении агонистов, данные восемь рецепторов могут быть подразделены на три подгруппы: mGluR1 и mGluR5 принадлежат к I группе, mGluR2 и mGluR3 принадлежат ко II группе и mGluR4, mGluR6, mGluR7 и mGluR8 принадлежат к III группе.
Лиганды метаботропных глутаматных рецепторов, принадлежащих к первой группе, могут быть использованы для лечения или профилактики острых и/или хронических неврологических расстройств, таких как психоз, эпилепсия, шизофрения, болезнь Альцгеймера, расстройства познавательной функции и памяти, равно как и хроническая и острая боль.
Другими возникающими в связи с этим показаниями к лечению являются ограничение функции мозга, вызванное операциями шунтирования или трансплантатами, плохое кровоснабжение мозга, травмы спинного мозга, травмы головы, вызванная беременностью кислородная недостаточность, остановка сердца и гипогликемия. Дополнительными показаниями к лечению являются ишемия, хорея Хантингтона, амиотрофический латеральный склероз (ALS), вызванное СПИДом слабоумие, травмы глаза, перерождение сетчатки, идиопатический паркинсонизм или паркинсонизм, вызванный лекарственными средствами, равно как и состояния, приводящие к функциям, связанным с недостатком глутамата, таким как, например, мышечные спазмы, конвульсии, мигрень, недержание мочи, привыкание к никотину, привыкание к опиатам, беспокойство, рвота, двигательное расстройство и депрессии.
Расстройствами, целиком или частично опосредованными действием mGluR5, являются, например, острые, травматические ли хронические дегенеративные процессы в нервной системе, такие как болезнь Альцгеймера, старческое слабоумие, болезнь Паркинсона, хорея Хантингтона, амиотрофический латеральный склероз и рассеянный склероз, психиатрические заболевания, такие как шизофрения и беспокойство, депрессия, боль и лекарственная зависимость (Expert Opin. Ther. Patents (2002), 12, (12)).
Селективные антагонисты mGluR5 являются особенно полезными для лечения беспокойства и боли.
Объектами настоящего изобретения являются соединения формулы I и их фармацевтически приемлемые соли, вышеупомянутые соединения в качестве фармацевтически активных веществ и их получение.
Объектом настоящего изобретения также является способ получения соединения согласно общей формуле I, следующий общим методикам, как это указано выше для соединений формулы I.
Кроме того, объектами настоящего изобретения также являются лекарственные средства, содержащие одно или более из соединений по настоящему изобретению и фармацевтически приемлемые наполнители, для лечения и профилактики расстройств, опосредованных действием рецептора mGluR5, таких как острые и/или хронические неврологические расстройства, в частности беспокойство и хроническая или острая боль.
Объектами настоящего изобретения также является применение соединения согласно настоящему изобретению, равно как и его фармацевтически приемлемой соли, для производства лекарственных средств для лечения и профилактики расстройств, опосредованных действием рецептора mGluR5, как это указано выше.
Нижеследующие определения общих терминов, используемых в описании настоящего изобретения, действительны вне зависимости от того, используются ли эти термины по отдельности или в сочетании друг с другом.
Термин “низший алкил”, используемый в описании настоящего изобретения, обозначает неразветвленные или разветвленные насыщенные углеводородные остатки, содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил и им подобные.
Термин “низший алкенил” обозначает неразветвленные или разветвленные углеводородные остатки, содержащие от 2 до 10 атомов углерода, предпочтительно от 2 до 6 атомов углерода и одну или более олефиновую двойную связь, предпочтительно одну олефиновую двойную связь, такие как винил, 1-пропенил, 2-пропенил(аллил) или 2-бутенил (кротил).
Термин “(низш.)алкокси” обозначает -O-(C1-C6)алкильную группу, в которой алкил соответствует вышеприведенному определению, такую как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, трет-бутоксигруппа, пентилоксигруппа и гексилоксигруппа, включая их изомеры.
Термин “арил” обозначает одновалентный ароматический карбоциклический радикал, состоящий из одного индивидуального цикла. Предпочтительным арильным радикалом является фенил.
Термин “галоид” (“галоген”) обозначает фтор, хлор, бром и иод.
Термин “циклоалкил” обозначает насыщенную карбоциклическую группу, содержащую от 3 до 6 атомов углерода.
Термин “фармацевтически приемлемая соль” относится к любой соли, производной от любой неорганической или органической кислоты или основания.
Объектами настоящего изобретения также являются соединения формулы IA
в которых R1 обозначает галоид, низший алкил, (низш.)алкоксигруппу, CF3 или цианогруппу;
R2 обозначает низший алкил или циклоалкил;
R3 обозначает низший алкил, циклоалкил, -(СН2)n-циклоалкил, -(CH2)n-CN или -(СН2)n-O-(низш.)алкил;
n принимает значения 1, 2 или 3,
равно как и их фармацевтически приемлемые соли.
Особенно предпочтительными являются те соединения, в которых R3 является -(СН2)n-циклоалкилом, а остальные определения остаются такими, как они описаны выше, например следующие соединения:
4-(1-циклопропилметил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин,
4-(1-циклобутилметил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин,
2-хлор-4-(1-циклопропилметил-2-метил-1Н-имидазол-4-илэтинил)пиридин или
2-хлор-4-(1-циклобутилметил-2-метил-1Н-имидазол-4-илэтинил)пиридин.
Особенно предпочтительными являются также те соединения, в которых R3 является низшим алкилом, например следующие соединения:
4-(1,2-диметил-1Н-имидазол-4-илэтинил)-2-метилпиридин,
4-(1-изопропил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин,
4-(1-изобутил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин или
2-хлор-4-(1-изобутил-2-метил-1Н-имидазол-4-илэтинил)пиридин.
Также предпочтительными являются те соединения, в которых R3 является -CH2-CN или -(CH2)2-O-(низш.)алкилом, например следующие соединения:
[2-метил-5-(2-метилпиридин-4-илэтинил)имидазол-1-ил]ацетонитрил или
4-[1-(2-метоксиэтил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин.
Кроме того, предпочтительными являются те соединения, в которых R3 является Fn-R5, например следующие соединения:
4-[1-(2,2-дифторэтил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин,
2-хлор-4-[1-(2,2-дифторэтил)-2-метил-1Н-имидазол-4-илэтинил]пиридин,
4-[1-((Е)-2-фторвинил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин,
2-хлор-4-[2-метил-1-(2,2,2-трифторэтил)-1Н-имидазол-4-илэтинил]пиридин или
2-метил-4-[2-метил-1-(2,2,2-трифторэтил)-1Н-имидазол-4-илэтинил]пиридин.
Соединения формулы I или IA по настоящему изобретению могут быть получены согласно способу, включающему:
(а) введение соединения формулы II
в котором R1, R2 и R4 принимают указанные выше значения, в реакцию с соединением формулы III
,
в котором R3 принимает указанные выше значения, a Z является галоидом или метилсульфогруппой (OSO2CH3), или
(б) введение соединения формулы IV
в котором R2, R3 и R4 принимают указанные выше значения, в реакцию с соединением формулы V
в котором R1 принимает указанные выше значения, а Х является галоидом, или
(в) введение соединения формулы VI
в котором R2, R3 и R4 принимают указанные выше значения, a hal обозначает галоид, в реакцию с соединением формулы VII
в котором R1 принимает указанные выше значения, a Y является триметилсилильной группой или водородом,
и, если это требуется, преобразование полученных соединений в форму фармацевтически приемлемых кислотно-аддитивных солей.
Реакция, описанная в пункте (а), может быть осуществлена в соответствии со стандартными методиками, например, путем нагревания соединения формулы II и соединения формулы III, в котором Z является галоидом, с основанием, таким как гидрид натрия, в растворителе, таким как тетрагидрофуран (ТГФ). Реакция, описанная в пункте (б), может быть осуществлена посредством сочетания по Соногашире соединения формулы IV и соединения формулы V в присутствии, например, CuI, (Ph3P)2PdCl2, триэтиламина в растворителе, таком как тетрагидрофуран или диметилформамид [Sonogashira и др., Synthesis 777 (1977)]. В одном из вариантов осуществления настоящего изобретения Х обозначает в соединениях формулы V бром или иод. Реакция, описанная выше в пункте (в) может быть, например, осуществлена в присутствии CuI, (Ph3P)2PdCl2, триэтиламина, фторида тетра-н-бутиламмония в растворителе, таком как тетрагидрофуран или диметилформамид.
Солевые формы получают с помощью стандартных методик, известных специалистам в данной области.
Соединения формул III и V являются коммерчески доступными, или способы их получения известны специалистам в данной области.
Соединения общей формулы I и их фармацевтически приемлемые соли могут также быть получены по нижеприведенной общей методике, включающей:
а) введение соединения формулы II
в реакцию с соединением формулы III
в котором R3 принимает указанные выше значения, a Z является галоидом, что приводит к соединению формулы IA
в котором R1, R2 и R3 принимают указанные выше значения, a “Hal” предпочтительно является хлором, бромом или иодом, и,
если это требуется, когда R4 не является водородом,
б) введение соединения IA в реакцию с соединением формулы VIII
,
что приводит к соединению формулы I
в котором R1, R2, R3 и R4 принимают указанные выше значения, и,
если это требуется, преобразование полученных соединений в форму фармацевтически приемлемых кислотно-аддитивных солей.
Соединения могут быть синтезированы по методике, описанной на следующих схемах.
Схема 1
Схема 2
Схема 3
где все группы принимают указанные выше значения.
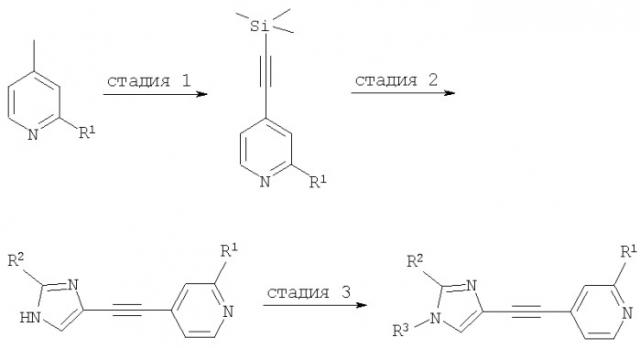
Вышеприведенная схема 1 описана ниже в подробностях на примере получения соединения, в котором R1 является хлором, R2 является метилом, a R3 является изобутилом.
Стадия 1
Растворяют 2-хлор-4-иодпиридин в ТГФ и триэтиламине. Получаемую смесь вакуумируют и несколько раз продувают аргоном для удаления кислорода из раствора. Затем добавляют трифенилфосфин и хлорид бис(трифенилфосфин)палладия(II) и перемешивают реакционную смесь при комнатной температуре в течение приблизительно 1 часа. После этого добавляют иодид меди (I) и триметилсилилацетилен. Реакционную смесь перемешивают при комнатной температуре в течение ночи, а затем обрабатывают обычным способом. Искомый продукт используют без какой-либо дополнительной очистки на следующей стадии.
Стадия 2
Раствор 1. Растворяют 2-хлор-4-триметилсиланилэтинилпиридин, получаемый на стадии 1, и 5-иод-2-метил-1Н-имидазол (синтез: M.D.Cliff, S.G.Pyne, Synthesis 1994, 681-682) в ТГФ и N,N-диметилформамиде (ДМФ). Получаемую смесь вакуумируют и несколько раз продувают аргоном для удаления кислорода из раствора.
Раствор 2. Растворяют трифенилфосфин, хлорид бис(трифенилфосфин)палладия(II), иодид меди (I) и триэтиламин в ТГФ. Данную смесь также вакуумируют и несколько раз продувают аргоном для удаления кислорода из раствора.
Раствор 2 нагревают до температуры приблизительно 40°С и добавляют по каплям раствор 1. Реакционную смесь нагревают до температуры приблизительно 60°С и добавляют по каплям в течение 45 минут раствор фторида тетрабутиламмония. Затем реакционную смесь перемешивают при комнатной температуре в течение ночи. После этого выпаривают растворитель. Остаток обрабатывают и очищают общепринятым способом.
Стадия 3
Гидрид натрия суспендируют в ТГФ. Добавляют раствор 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина в ТГФ и перемешивают реакционную смесь при комнатной температуре в течение приблизительно 30 минут. Затем добавляют раствор изобутилбромида в ТГФ и продолжают перемешивание в течение ночи. Продукт выделяют и очищают общепринятым способом.
Если согласно вышеприведенной схеме получают в качестве конечных продуктов смесь двух региоизомеров, смесь может быть подвергнута разделению с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) (колонка: chiralpak AD, элюент: гептан/этанол, 4/1).
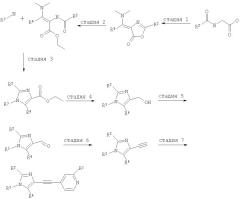
Вышеприведенная схема 2 описана ниже в подробностях на примере получения соединения, в котором R1 является хлором, R2 является метилом, R3 является циклопропилом, а R4 является метилом.
Стадия 1
Смешивают N-ацетилглицин и хлорангидрид фосфорной кислоты и охлаждают смесь до температуры 5°С. Медленно добавляют по каплям в течение 30 минут при температуре 5-10°С N',N-диметилацетамид (реакция сопровождается выделением тепла!). Реакционную смесь перемешивают при температуре 45°С в течение 2,5 часов, а затем охлаждают до комнатной температуры. Затем добавляют хлористый метилен и выливают смесь в воду со льдом. Смесь приводят к рН 8 с помощью гидроксида аммония, после чего обрабатывают и очищают общепринятым способом.
Стадия 2
Растворяют 4-[1-диметиламиноэт-(Z)-илиден]-2-метил-4Н-оксазол-5-он в этаноле и добавляют при комнатной температуре гидрид натрия. Раствор темного цвета кипятят с обратным холодильником в течение 1 часа. После этого выпаривают растворитель и используют неочищенный продукт без какой-либо дополнительной очистки на следующей стадии.
Стадия 3
Перемешивают раствор этилового эфира (Z)-2-ацетиламино-3-диметиламинобут-2-еновой кислоты и циклопропиламина в уксусной кислоте при комнатной температуре в течение 2 часов. После этого реакционную смесь медленно разбавляют водой и выпаривают под вакуумом при температуре 35°С. К остатку добавляют воду и снова выпаривают при температуре 35°С. В результате двукратного повторения аналогичной процедуры с толуолом получают неочищенное промежуточное соединение, которое кипятят с обратным холодильником в гексаметилдисилазане совместно с мелким порошком сульфата аммония в течение ночи при температуре 145°С. После этого реакционную смесь обрабатывают и очищают общепринятым способом.
Стадия 4
Растворяют этиловый эфир 1-циклопропил-2,5-диметил-1Н-имидазол-4-карбоновой кислоты в безводном ТГФ и охлаждают до температуры 0°С. Добавляют по каплям алюмогидрид лития и перемешивают в течение 1 часа при температуре 0°С. Прекращают реакцию и обрабатывают реакционную смесь обычным способом. Искомый продукт используют без какой-либо дополнительной очистки на следующей стадии.
Стадия 5
Растворяют (1-циклопроипл-2,5-диметил-1Н-имидазол-4-ил)метанол в хлористом метилене. Добавляют оксид марганца(IV) и перемешивают реакционную смесь при кипячении с обратным холодильником в течение 2 часов. Суспензию профильтровывают через прокладку с фильтрующим веществом Dicalite Speed Plus и выпаривают растворитель, что приводит к искомому продукту.
Стадия 6
Растворяют диметиловый эфир (1-диазо-2-оксопропил)фосфокислоты в метаноле. Добавляют карбонат калия. Затем добавляют по каплям при комнатной температуре раствор 1-циклопропил-2,5-диметил-1Н-имидазол-4-карбальдегида в метаноле. Реакционную смесь перемешивают при комнатной температуре в течение ночи, после чего обрабатывают и очищают общепринятым способом.
Стадия 7
Растворяют 2-хлор-4-иодпиридин в ТГФ и триэтиламине. Получаемую смесь вакуумируют и несколько раз продувают аргоном для удаления кислорода из раствора. Затем добавляют трифенилфосфин и хлорид бис(трифенилфосфин)палладия(II) и перемешивают реакционную смесь при комнатной температуре в течение приблизительно 1 часа. После этого добавляют иодид меди(I) и 1-циклопропил-4-этинил-2,5-диметил-1Н-имидазол. Реакционную смесь перемешивают при комнатной температуре в течение ночи, после чего обрабатывают и очищают общепринятым способом.
Вышеприведенная схема 3 описана ниже в подробностях на примере получения соединения, в котором R1 является хлором, R2 является метилом, R3 является 1,1-дифторэтилом, а R4 является водородом.
Стадия 1
Суспендируют гидрид натрия в ТГФ. Добавляют раствор 5-иод-2-метил-1Н-имидазола (синтез: M.D.Cliff, S.G.Pyne, Synthesis 1994, 681-682) в ТГФ и перемешивают реакционную смесь при комнатной температуре в течение приблизительно 30 минут. Затем добавляют раствор 2-бром-1,1-дифторэтана в ТГФ и продолжают перемешивание в течение ночи. Продукт выделяют и очищают общепринятым способом.
Если согласно вышеприведенной схеме получают в качестве конечных продуктов смесь двух региоизомеров, смесь может быть подвергнута разделению с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) (колонка: chiralpak AD, элюент: гептан/этанол, 4/1).
Стадия 2
Раствор 1. Растворяют 2-хлор-4-триметилсиланилэтинилпиридин и 1-(2,2-дифторэтил)-4-иод-2-метил-1Н-имидазол в ТГФ и ДМФ. Получаемую смесь вакуумируют и несколько раз продувают аргоном для удаления кислорода из раствора.
Раствор 2. Растворяют трифенилфосфин, хлорид бис(трифенилфосфин)палладия(II), иодид меди(I) и триэтиламин в ТГФ. Данную смесь также вакуумируют и несколько раз продувают аргоном для удаления кислорода из раствора.
Раствор 2 нагревают до температуры приблизительно 40°С и добавляют по каплям раствор 1. Реакционную смесь нагревают до температуры приблизительно 60°С и добавляют по каплям в течение 45 минут раствор фторида тетрабутиламмония. Затем реакционную смесь перемешивают при комнатной температуре в течение ночи. После этого выпаривают растворитель. Остаток обрабатывают и очищают общепринятым способом.
Фармацевтически приемлемые соли соединений формулы I могут быть легко получены согласно общеизвестным самим по себе способам, принимая во внимание природу соединения, которое требуется перевести в форму соли. Для образования фармацевтически приемлемых солей основных соединений формулы I подходят неорганические или органические кислоты, такие как, например, соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота или лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфокислота, n-толуолсульфокислота и им подобные. Соединения, содержащие щелочные металлы или щелочноземельные металлы, например натрий, калий, кальций, магний и им подобные, основные амины или основные аминокислоты подходят для образования фармацевтически приемлемых солей кислотных соединений.
Соединения формулы I и их фармацевтически приемлемые соли являются, как уже было упомянуто выше, антагонистами метаботропных глутаматных рецепторов и могут быть применены для лечения или профилактики заболеваний, опосредованных действием рецептора mGluR5, таких как острые и/или хронические неврологические расстройства, расстройства познавательной функции и памяти, равно как и хроническая и острая боль. Поддающиеся лечению неврологические расстройства включают, например, эпилепсию, шизофрению, беспокойство, острые, травматические или хронические дегенеративные процессы в нервной системе, такие как болезнь Альцгеймера, старческое слабоумие, хорея Хантингтона, амиотрофический латеральный склероз, рассеянный склероз, вызванное СПИДом слабоумие, травмы глаза, перерождение сетчатки, идиопатический паркинсонизм или паркинсонизм, вызванный лекарственными средствами, равно как и состояния, приводящие к функциям, связанным с недостатком глутамата, таким как, например, мышечные спазмы, конвульсии, мигрень, недержание мочи, привыкание к никотину, психозы, привыкание к опиатам, беспокойство, рвота, двигательное расстройство и депрессии. Другими показаниями к лечению являются ограничение функции мозга, вызванное операциями шунтирования или трансплантатами, плохое кровоснабжение мозга, травмы спинного мозга, травмы головы, вызванная беременностью кислородная недостаточность, остановка сердца и гипогликемия.
Соединения формулы I и их фармацевтически приемлемые соли особенно полезны в качестве анальгетиков. Поддающиеся лечению виды боли включают боли при воспалениях, такие как артрит и ревматоидные заболевания, васкулит, невропатические боли, такие как тригеминальная или герпетическая невралгия, боли при диабетической невропатии, каузалгию, гипералгезию, тяжелые хронические боли, послеоперационные боли и боли, связанные с различными состояниями, такими как рак, ангина, почечные колики или колики желчных путей, менструация, мигрень и подагра.
Фармакологическую активность соединений испытывают с помощью следующего способа.
Для испытаний на связывание комплементарную ДНК (кДНК), кодирующую человеческий рецептор mGlu 5а, временно трансфектируют в клетки ядерного антигена вируса Эпштейна-Барра (EBNA) с помощью методики, описанной Schlaeger и Christensen [Cytotechnology 15:1-13 (1998)]. Гомогенаты клеточных мембран сохраняют при температуре -80°C до дня анализа, когда их размораживают, суспендируют заново и гомогенизируют с помощью гомогенизатора Polytron в буферном растворе для связывания, содержащем 15 мМ трис-HCl, 120 мМ NaCl, 100 мМ KCl, 25 мМ CaCl2, 25 мМ MgCl2, при рН 7,4 до достижения конечной концентрации для анализа, составляющей 20 мкг белка на ячейку.
Изотермы насыщения определяют посредством добавления к вышеописанным мембранам двенадцати различных концентраций [3Н]2-метил-6-(фенилэтинил)пиридина (МРЕР) (0,04-100 нМ в общем объеме 200 мкл) в течение 1 часа при температуре 4°С. Сравнительные эксперименты осуществляют с использованием фиксированной концентрации [3Н]МРЕР (2 нМ), а значения концентрации испытываемых соединений, обеспечивающей 50% ингибирование (IC50), определяли на основании 11 концентраций (0,3-10000 нМ). Инкубирование осуществляли в течение 1 часа при температуре 4°С.
По окончании инкубирования мембраны отфильтровывают на фильтре Unifilter (белые 96-ячеечные планшеты для микротитрования с присоединенным стекловолоконным фильтром GF/C, предварительно инкубированным а течение I часа в содержащем 0,1% полиэтиленимина (PEI) буферном растворе для промывания, Packard BioScience, Meriden, CT) со сборником Filtermate 96 (Packard BioScience) и троекратно промывают холодным буферным раствором, содержащим 50 мМ трис-HCl, рН 7,4. Неспецифическое связывание измеряли в присутствии 10 мкМ МРЕР. Радиоактивность на фильтре измерялась в течение 3 минут с помощью сцинтилляционного счетчика для планшетов для микротитрования Packard Top-count с поправкой на тушение сигнала, получаемой после добавления 45 мкл вещества Microscint 40 (Canberra Packard S.A., Zürich, Switzerland) и встряхивания в течение 20 минут.
Для функциональных анализов осуществляют измерения [Са2+]i, как это было ранее описано в Porter и др. [Br. J. Pharmacol. 128: 13-20 (1999)], на рекомбинантных человеческих рецепторах mGlu 5a в клетках эпителиальных клетках почек человеческого эмбриона (НЕК-293). В клетки помещают флуоресцентный индикатор тетракис(ацетоксиметиловый) эфир 4-(6-ацетоксиметокси-2,7-дифтор-3-оксо-9-ксантенил)-4'-метил-2,2'-(этилендиокси)дианилин-N,N,N',N'-тетрауксусной кислоты (Fluo 4-AM) (производится компанией FLUKA, конечная концентрация 0,2 мкМ). Измерения [Са2+]i осуществляли с помощью устройства для считывания распределения флуоресценции с планшетов (FLIPR, Molecular Devices Corporation, La Jolla, СА, USA). Измерение количества антагониста осуществляют после предварительного пятиминутного инкубирования с испытуемыми соединениями и последующего добавления субмаксимального количества агониста.
Кривые ингибирования (количества антагониста) аппроксимировали четырехпараметрическим логистическим уравнением, из которого определяли величины IC50 и коэффициента Хилла, используя программу для итеративной аппроксимации нелинейными зависимостями (Xcel fit).
Ниже приведены величины констант ингибирования (Ki), полученные в испытаниях на связывание. Величины Ki определяют по следующей формуле:
Ki=IC50/[1+L/Kd],
в которой величины IC50 есть такие концентрации испытуемых соединений, которые вызывают 50% ингибирование конкурирующего радиоактивного лиганда ([3Н]МРЕР). L обозначает концентрацию радиоактивного лиганда, использованную в испытании на связывание, в величины константы диссоциации (Kd) для радиоактивного лиганда определяли эмпирически для каждой серии приготовленных мембран.
Соединения по настоящему изобретению являются антагонистами рецептора mGluR 5a. Активности соединений формулы I, измеренные согласно вышеописанному анализу, находятся в пределах Ki<200 нМ.
| Номер примера | Ki (нМ) | Номер примера | Ki (нМ) |
| 2 | 68 | 13 | 28 |
| 4 | 38 | 21 | 54 |
| 6 | 33 | 22 | 95 |
| 7 | 122 | ||
| 8 | 191 | ||
| 12 | 49 |
Соединения формулы I и их фармацевтически приемлемые соли могут быть применены в качестве лекарственных средств, например, в форме фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в виде таблеток, таблеток с оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение может также быть осуществлено перректально, например, в виде суппозиториев, или парентерально, например, в форме растворов для инъекций.
Соединения формулы I и их фармацевтически приемлемые соли могут быть обработаны для получения фармацевтических препаратов совместно с фармацевтически инертными неорганическими или органическими носителями. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и подобные им вещества могут быть использованы, например, в качестве подобных носителей для таблеток, таблеток с оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и подобные им вещества; однако, в зависимости от природы активного вещества, обычно в случае мягких желатиновых капсул не требуется никаких носителей. Подходящими носителями для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и им подобные вещества. Адъюванты, такие как спирты, полиолы, глицерин, растительные масла и подобные им вещества, могут быть использованы в водных растворах для инъекций водорастворимых солей соединений формулы I, но они, как правило, не являются необходимыми. Подходящими носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и подобные им вещества.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизирующие вещества, стабилизаторы, увлажняющие вещества, эмульгаторы, подсластители, красители, ароматизаторы, соли для варьирования осмотического давления, буферные растворы, маскирующие вещества или антиоксиданты. Они также могут содержать другие терапевтически ценные вещества.
Как это упоминалось ранее, лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемые соли и терапевтически приемлемый наполнитель, также являются объектами настоящего изобретения, равно как им является и способ изготовления таких лекарственных средств, включающей приведение одного или более соединений формулы I или их фармацевтически приемлемых солей и, если это требуется, одного или более других терапевтически ценных веществ в форму галенова препарата совместно с одним или более терапевтически инертным носителем.
Дозировка может варьироваться в широких пределах и безусловно должна быть приспособлена к индивидуальным потребностям в каждом конкретном случае. В общем случае эффективная дозировка для перорального или парентерального введения находится в пределах 0,01-20 мг/кг в сутки, причем дозировка в пределах 0,1-10 мг/кг в сутки является предпочтительной для всех описанных показаний. Суточная дозировка для взрослого человека с массой тела 70 кг находится соответственно в пределах 0,7-1400 мг в сутки, предпочтительно от 7 до 700 мг в сутки.
Нижеследующие примеры приводятся для дальнейшего разъяснения настоящего изобретения.
Пример 1
4-(1,2-Диметил-1Н-имидазол-4-илэтинил)-2-метилпиридин
Суспендируют гидрид натрия (76 мг, 55%, 1,57 ммоль) в 2 мл безводного ТГФ. Добавляют раствор 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина (150 мг, 0,76 ммоль) в 8 мл безводного ТГФ и перемешивают реакционную смесь при комнатной температуре в течение 30 минут. Затем добавляют раствор метилиодида (142 мг, 1,00 ммоль) в 1 мл безводного ТГФ и продолжают перемешивание в течение ночи. После этого реакционную смесь выливают в 70 мл воды и троекратно экстрагируют этилацетатом (каждая порция 70 мл). Объединенные органические экстракты высушивают над сульфатом натрия, фильтруют и выпаривают. Неочищенный продукт подвергают очистке с помощью флэш-хроматографии на силикагеле (элюент: хлористый метилен/метанол, градиент от 100:0 к 90:10) и получают смесь двух региоизомеров. Данная смесь может быть разделена с помощью ВЭЖХ (колонка: chiralpak AD, элюент: гептан/этанол 4/1), что приводит к получению искомого соединения в виде твердого вещества белого цвета (40 мг, 25%), Масс-спектр (МС): m/e=212,2 (М+Н+).
Пример 2
4-(1-Изопропил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин
Указанное в заглавии соединение, МС: m/e=240,3 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и изопропилбромида.
Пример 3
4-(1-Изобутил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин
Указанное в заглавии соединение, МС: m/e=254,2 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и изобутилбромида.
Пример 4
4-(1-Циклопропилметил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин
Указанное в заглавии соединение, МС: m/e=252,1 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и циклопропилметилбромида.
Пример 5
4-(1-Циклобутилметил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин
Указанное в заглавии соединение, МС: m/e=266,2 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и циклобутилметилбромида.
Пример 6
[2-Метил-4-(2-метилпиридин-4-илэтинил)имидазол-1-ил]ацетонитрил
Указанное в заглавии соединение, МС: m/e=237,2 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и бромацетонитрила.
Пример 7
4-[1-(2-Метоксиэтил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заглавии соединение, МС: m/e=256,2 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и (2-бромэтил)метилового эфира.
Пример 8
2-Хлор-4-(1-изобутил-2-метил-1Н-имидазол-4-илэтинил)пиридин
Указанное в заглавии соединение, МС: m/e=274,1 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и 1-бром-2-метилпропана.
Пример 9
2-Хлор-4-(1-циклопропилметил-2-метил-1Н-имидазол-4-илэтинил)пиридин
Указанное в заглавии соединение, МС: m/e=272,2 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и циклопропилметилбромида.
Пример 10
2-Хлор-4-(1-циклобутилметил-2-метил-1Н-имидазол-4-илэтинил)пиридин
Указанное в заглавии соединение, МС: m/e=286,1 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и циклобутилметилбромида.
Пример 11
2-Метил-4-[2-метил-1-(2-феноксиэтил)-1Н-имидазол-4-илэтинил]пиридин
Указанное в заглавии соединение, МС: m/e=318,1 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и 2-феноксиэтилбромида.
Пример 12
2-Хлор-4-(1,2-диметил-1Н-имидазол-4-илэтинил)пиридин
Указанное в заглавии соединение, МС: m/e=232,1 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и метилиодида.
Пример 13
4-(2-Циклопропил-1-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин
Стадия 1. 2-Циклопропил-4-иод-1-метил-1H-имидазол
Указанное в заглавии соединение, МС: m/e=249,1 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-циклопропил-5-иод-1Н-имидазола (пример В) и метилиодида.
Стадия 2. 4-(2-Циклопропил-1-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин
Указанное в заглавии соединение, МС: m/c=238,1 (М+Н+), получают в соответствии с общим способом, описанным в примере А, стадия 2, исходя из 2-хлор-4-триметилсиланилэтинилпиридина и 2-циклопропил-4-иод-1-метил-1Н-имидазола.
Пример 14
2-Хлор-4-(1-изопропил-2-метил-1Н-имидазол-4-илэтинил)пиридин
Указанное в заглавии соединение, МС: m/e=260,6 (М+Н+), получают в соответствии с общим способом, описанным в примере 1, исходя из 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина и изопропилбромида.
Пример 15
4-(2-Циклопропил-1-изопропил-1Н-имидазол-4-илэтинил)-2-метилпиридин
Стадия 1. 2-Циклопропил-4-иод-1-изопропил-1Н-имидазол
Указанное в заглавии соединение, МС: m/e