Составы пантопразола, состоящие из множества частиц
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и касается множественных частиц пантопразола натрия, обладающих сниженным высвобождением в условиях желудка и быстрым высвобождением при нейтральном рН, имеющих сферическое ядро из пантопразола или его энантиомера или его соли, и одного или более эксципиентов, содержащих поверхностно-активное вещество, при соотношении пантопразол : поверхностно-активное вещество от 10:1 до 5:3 и 2-7% ПАВ на ядро, и первичное изолирующее покрытие и кишечнорастворимое покрытие, где указанные частицы с покрытием имеют размер 0,7-1,25 мм в диаметре. Частицы обладают уменьшенным высвобождением в условиях желудка и быстрым высвобождением при нейтральном рН. 7 н. и 25 з.п. ф-лы, 6 табл.
Реферат
Пантопразол, 5-(дифторметокси)-2-[(3,4-диметокси-2-пиридил)метилсульфинил]-1Н-бензимидазол, представляет собой ингибитор H+/K+-аденозинтрифосфата (АТФ) (также известный как ингибитор кислотной помпы или протонной помпы (ИПП)) - фермента, присутствующего в париетальных клетках желудка. Считается, что эти препараты метаболизируются в париетальных клетках до активных сульфонамидных метаболитов, которые инактивируют сульфгидрильную группу протонного насоса, тем самым, уменьшая секрецию водородных ионов. В целом, ИПП представляют собой липофильные слабые основания с плохой растворимостью в воде при низком pH. Многие ИПП нестабильны в растворах с низким pH и подвергаются быстрой деградации, катализируемой кислотой, но они относительно устойчивы при нейтральном или высоком pH.
Находящиеся в настоящее время в продаже пероральные составы пантопразола натрия представляют собой монолитные таблетки c покрытием. См., например, патент США 5997903, в котором описываются пероральные формы пантопразола, которые состоят из ядра, промежуточного слоя и наружного слоя. Используемое в настоящее время покрытие имеет тенденцию вызывать нежелательное прилипание таблетки к желудочно-кишечному тракту.
Составы, состоящие из множества частиц, по своей природе рассеивания в желудочно-кишечном тракте демонстрируют сниженное влияние пищи и вариабельность времени опорожнения желудка, что ведет к снижению вариабельности как между разными пациентами, так и у одного пациента, по сравнению с монолитными таблетками (Intl. Journal of Pharmaceutics 140 [1996] 229-235).
В прошлом были сделаны несколько неудачных попыток создать состав пантопразола, состоящий из множества частиц. Однако эти попытки давали множественные частицы, не биоэквивалентные таблеткам; была обнаружена лишь 70%-я относительная биодоступность. Другая попытка с использованием иных технологий - покрытия сахарных гранул и экструзии/сферонизации - дала продукт, который не обеспечивал адекватного высвобождения в кислых средах. Кроме того, эти попытки давали продукт, который был нестабилен, что наблюдалось по изменению цвета во время хранения при комнатной температуре.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к устойчивому составу пантопразола, состоящему из множества частиц, который обеспечивает сниженную вариабельность как между разными пациентами, так и у одного пациента.
В одном варианте осуществления множественные частицы пантопразола по изобретению состоят из шаровидного ядра, содержащего пантопразол или его энантиомер, или его соль, или гидрат, по меньшей мере одно поверхностно-активное вещество, по меньшей мере одно вещество, ускоряющее распад, и от приблизительно 1% до приблизительно 2% мас./мас. воды; кишечнорастворимого покрытия на ядре, причем указанное кишечнорастворимое покрытие содержит сополимер метакриловой кислоты и метакрилатов в количестве от приблизительно 15 приблизительно до 45% мас./мас. сферического ядра; где указанные множественные частицы имеют средний размер приблизительно 1 мм в диаметре.
Предпочтительно, препараты по изобретению, состоящие из множества частиц, устойчивы при хранении при комнатной температуре в течение по меньшей мере двенадцати месяцев. Основываясь на анализе трендов с использованием данных за двенадцать месяцев при комнатной температуре и 6 месяцев при 40°C/75% относительной влажности (ОВ), доступных к настоящему времени, множественные частицы по изобретению должны иметь срок годности более 2 лет. Как правило, состав по изобретению, состоящий из множества частиц, считают устойчивым, если он сохраняет от 90% до 110% своей активности при хранении в течение срока годности.
Этот препарат пантопразола по изобретению, состоящий из множества частиц, менее склонен прилипать к кишечным стенкам, назогастральным зондам и гастростомическим трубкам и материалу упаковки, тем самым обеспечивая предсказуемую доставку лекарственного продукта к участку высвобождения лекарственного средства. Он также обеспечивает раннее начало действия по ослаблению желудочно-кишечной боли и имеет увеличенную продолжительность действия. Этот состав можно использовать в педиатрии и вводить пациентам, которым трудно глотать твердую пищу. Этот состав также делает возможным введение лекарственного средства через назогастральные зонды и гастростомические трубки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к составу пантопразола, состоящему из множества частиц, имеющему уникальную комбинацию эксципиентов и поверхностно-активного вещества (например, полисорбата 80), которые совместимы с пантопразолом натрия в присутствии среды с щелочным pH. Кроме того, изобретение относится к способу, в котором используются низкое усилие сдвига во время грануляции и низкая температура во время сушки препарата, состоящего из множества частиц. Этот способ вносит свой вклад в стабильность ядра множественных частиц по изобретению.
В одном аспекте изобретение относится к составам пантопразола, состоящим из множества частиц, которые обладают уменьшенным высвобождением в условиях желудка и быстрым высвобождением при нейтральном pH, т.е. в нижележащих отделах желудочно-кишечного тракта.
Состав пантопразола натрия по изобретению, состоящий из множества частиц, обеспечивает расширенную систему для введения пантопразола пациентам. Имеющийся в настоящее время на рынке состав представляет собой сплошную монолитную таблетку. Настоящий состав, состоящий из множества сферических частиц, который можно приспособить к использованию в капсуле или пакете из фольги, может быть приготовлен методом экструзии/сферонизации плюс нанесения покрытия.
Композиция, состоящая из множественных частиц по изобретению и кишечнорастворимого покрытия, например, Eudragit, делает возможным сниженное высвобождение при низком pH (~1) и быстрое высвобождение при нейтральном pH (~7). При этом обеспечивается более быстрое создание уровней лекарственного средства в крови у пациентов и, таким образом, более быстрое начало действия. Меньшая величина Tlag состава, состоящего из множества частиц, по сравнению с Tlag сплошной монолитной таблетки, основанная на данных, полученных на собаках, указывает на более быстрое начало действия состава, состоящего из множества частиц.
Применение состава, состоящего из множества частиц, облегчает использование в педиатрии и введение пациентам, у которых затруднено глотание, путем рассеивании сфероидов в суспендирующей жидкости или разбрызгивания/рассеивания в жидкости с низким pH, такой как яблочный соус, перед введением. Суспендирующая жидкость может быть создана до введения путем перемешивания смеси порошкового материала с водой. Более мелкий размер множества частиц в капсуле или упаковке, или любой другой емкости также делает возможным дозирование через назогастральный зонд или гастростомическую трубку.
Этот состав делает возможным более быстрое ослабление желудочно-кишечной боли и увеличенную продолжительность действия (длительное высвобождение) по сравнению с таблетками, имеющимися на рынке в настоящее время.
I. Множественные частицы по изобретению
Предпочтительно, множественные частицы находятся в диапазоне приблизительно от 0,1 до 2 мм или от 0,5 мм до 1,5 мм, или от 0,7 мм до 1,25 мм, или от 0,8 мм до 1 мм. В одном варианте осуществления диаметр множественных частиц в композиции по изобретению составляет в среднем приблизительно 1 мм.
Как правило, размер множественных частиц по изобретению не превышает 1 мм, чтобы облегчить проход через назогастральные зонды.
Множественные частицы по изобретению состоят, как минимум, из сферического ядра с кишечнорастворимым покрытием на ядре. Между ядром и кишечнорастворимым покрытием может быть нанесено первичное изолирующее покрытие, например, состоящее из покрытия из гидроксипропилметилцеллюлозы (гипромеллозы). Кроме того, на кишечнорастворимое покрытие может быть нанесено завершающее изолирующее покрытие, например, покрытие из гидроксипропилметилцеллюлозы (гипромеллозы). Сферическое ядро состоит, как минимум, из пантопразола или его соли и поверхностно-активного вещества.
Используемый в настоящем документе, если контекст не требует другого, термин 'пантопразол' относится к 5-(дифторметокси)-2-[(3,4-диметокси-2-пиридил)метилсульфинил]-1Н-бензимидазолу и его энантиомерам, и термин 'соединение пантопразола' включает пантопразол и энантиомеры, и их соли и гидраты. Активное соединение, пантопразол, описан в европейском патенте 166287, где описано его получение, и доступен для приобретения под товарным названием PROTONIX®. Примеры фармацевтически приемлемых солей пантопразола среди других включают, например, натриевую, магниевую и кальциевую; прочие описаны в европейском патенте 166286, который включен в настоящий документ посредством ссылки. Выбор подходящей соли не служит ограничением изобретения. В одном варианте осуществления соль является натриевой. Как правило, соединение пантопразола присутствует в диапазоне приблизительно от 5 до 50% мас./мас., более предпочтительно приблизительно от 20 до 45% мас./мас. от общего количества множественных частиц.
Подходящие поверхностно-активные вещества известны специалистам в данной области техники. Однако особенно желательными являются лаурилсульфат натрия, полисорбаты, включая, например, полисорбат 80, и смеси данных компонентов. Как правило, поверхностно-активное вещество присутствует в ядре в количестве от приблизительно 2 до приблизительно 7% мас./мас. и желательно приблизительно 5% мас./мас. ядра. В другом варианте осуществления поверхностно-активное вещество присутствует в соотношении лекарственное средство: поверхностно-активное вещество от приблизительно 5:3 (например, сесквигидрат пантопразола натрия к лаурилсульфату натрия) до приблизительно 10:1 (например, сесквигидрат пантопразола натрия к полисорбату 80). Выяснилось, что поверхностно-активные вещества в препарате увеличивают смачиваемость и, тем самым, скорость и объем высвобождения и всасывания пантопразола натрия из препарата по изобретению, состоящего из множества частиц.
Сферическое ядро может дополнительно содержать вещество, ускоряющее распад, регулятор pH и необязательно связующее или другой эксципиент, такой как гидроксипропилметилцеллюлоза (например, гипромеллоза 2208). Соответственно, общее количество в ядре вещества (веществ), ускоряющего(щих) распад, составляет от приблизительно 15% мас./мас. до приблизительно 80% мас./мас. или от приблизительно 20% мас./мас. до приблизительно 70% мас./мас., или от приблизительно 25% мас./мас. до приблизительно 45% мас./мас., или от приблизительно 30% мас./мас. до приблизительно 42% мас./мас. В одном варианте осуществления отношение общего количества лекарственного средства к связующему составляет от приблизительно 50:1 до приблизительно 40:1 по массе. Общее количество регулятора pH в препарате может составлять от приблизительно 0,1% мас./мас. до приблизительно 10% мас./мас. множественных частиц или от приблизительно 1% мас./мас. до приблизительно 8% мас./мас., или от приблизительно 3% мас./мас. до приблизительно 7% мас./мас. Однако эти проценты при необходимости или желательности могут регулироваться специалистом в данной области техники.
Вещество, ускоряющее распад, может быть выбрано из числа других известных веществ, ускоряющих распад, включая среди прочих, например, целлюлозу и кросповидон. В одном варианте осуществления вещество, ускоряющее распад, выбрано из микрокристаллической целлюлозы и кросповидона и их смесей. Связующее может быть выбрано из числа известных связующих, включая среди прочих, например, целлюлозу и повидон. В одном варианте осуществления связующее представляет собой гидроксипропилметилцеллюлозу (гипромеллозу). Подходящие регуляторы pH включают среди прочих, например, карбонат натрия, бикарбонат натрия, карбонат калия, карбонат лития. Прочие подходящие компоненты будут легко очевидны специалисту в данной области техники.
В одном варианте осуществления сферическое ядро содержит мас./мас. сухого ядра без покрытия, приблизительно 45% сесквигидрата пантопразола натрия (приблизительно 40% свободного пантопразола), приблизительно от 25 до 30% и предпочтительно приблизительно 27% микрокристаллической целлюлозы, приблизительно 4-6% и предпочтительно приблизительно 5% полисорбата 80, приблизительно от 14 до 16% и предпочтительно приблизительно 15% кросповидона, приблизительно от 0,5 до 2% и предпочтительно приблизительно 1% гипромеллозы 2208, приблизительно от 5 до 8% и предпочтительно приблизительно 6,5% карбоната натрия. В одном варианте осуществления сферическое ядро содержит:
| пантопразола натрия сесквигидрата | 45,24% мас./мас. |
| микрокристаллической целлюлозы | 27,25% мас./мас. |
| полисорбата 80 | 5% мас./мас. |
| кросповидона | 15% мас./мас. |
| гипромеллозы 2208 | 1% мас./мас. |
| карбоната натрия | 6,5% мас./мас. |
В другом варианте осуществления сферическое ядро содержит:
| Ингредиенты | Количество на капсулу | % мас./мас. от общей массы множественных частиц |
| Пантопразола натрия сесквигидрат | 45,11 | 21,911 |
| Микрокристаллическая целлюлоза, NF/EP (Avicel PH 101) | 27,39 | 13,304 |
| Полисорбат 80, NF, полученный из растений | 5,00 | 2,429 |
| Кросповидон, NF (Polyplasdone XL) | 15,00 | 7,286 |
| ГПМЦ USP/EP (Methocel) K3 | 1,00 | 0,486 |
| Карбонат натрия, NF | 6,50 | 3,157 |
| Очищенная вода, USP/BP/EP | q.s., чтобы создать влажную массу* | |
| Всего | 100,00 мг | 48,573 |
Хотя влага удаляется из ядра во время процесса сушки, который описывается ниже, ядро предпочтительно сохраняет от приблизительно 1% до приблизительно 2% мас./мас. воды. Не желая быть связанными теорией, изобретатели полагают, что это содержание воды способствует стабильности этих множественных частиц по сравнению с неудавшимися попытками формирования множественных частиц пантопразола из известного уровня техники.
Перед нанесением кишечнорастворимого покрытия необязательно может быть нанесено первичное изолирующее покрытие (или подстилающее покрытие) непосредственно на ядро. Хотя компоненты этого изолирующего покрытия могут быть изменены специалистом в данной области техники, особенно подходящее, первичное изолирующее покрытие состоит из гидроксипропилметилцеллюлозы (гипромеллозы) и воды. Например, подходящее первичное изолирующее покрытие может быть нанесено в виде 7,5% мас./мас. раствора гипромеллозы.
Как правило, такое первичное изолирующее покрытие составляет от приблизительно 2% мас./мас. до приблизительно 4% мас./мас. ядра без покрытия или от приблизительно 1% мас./мас. до приблизительно 2% мас./мас. множественных частиц с покрытием. В одном варианте осуществления множественные частицы с подстилающим покрытием содержат:
| Ингредиенты | Количество на капсулу | % мас./мас. от общей массы множественных частиц |
| A. Подстилающее покрытие: | 4,00 мг | 1,943 |
| Шарики пантопразола натрия (40 мг пантопразола на 100 мг шариков) | 100,00 мг | 48,573 |
| Гидроксипропилметилцеллюлоза 2910, USP, 6cps | 4,00 мг | 1,943 |
| Очищенная вода, USP/BP/EP* удаляется в процес-се приготовления | 9,33 мг* | |
| Всего | 104,00 мг | 50,516 |
Кишечнорастворимое покрытие наносится на первичное изолирующее покрытие, если оно имеется, или непосредственно на сферическое ядро, не имеющее покрытия. Соответственно, кишечнорастворимое покрытие наносится таким, что оно покрывает ядро в количестве приблизительно от 15 до 45% мас./мас. или от приблизительно 20% мас./мас. до приблизительно 30% мас./мас., или от приблизительно 25% мас./мас. до 30% мас./мас. множественных частиц. В одном варианте осуществления кишечнорастворимое покрытие составляет приблизительно от 27,5 до 32,5% мас./мас. множественных частиц. Соответственно, кишечнорастворимое покрытие содержит продукт, который представляет собой сополимер метакриловой кислоты и метакрилатов, такой как доступный для приобретения Eudragit L 30D-55. В одном варианте осуществления кишечнорастворимое покрытие состоит из сополимера Eudragit L30D-55, талька, триэтилцитрата, гидроксида натрия и воды. Конкретнее, кишечнорастворимое покрытие может содержать приблизительно 30% мас./мас. от множественных частиц покрытия Eudragit L 30D-55 (нанесенного в виде 30 мас.% дисперсии); приблизительно 15% мас./мас. талька, приблизительно 3% триэтилцитрата; регулятор pH, такой как гидроксид натрия, и воду. Другие подходящие материалы, которые могут быть выбраны для использования в кишечнорастворимом покрытии, включают, например, фталат гидроксипропилметилцеллюлозы, фталат ацетата целлюлозы и т.п.
В одном варианте осуществления изобретение относится к множественным частицам по изобретению с подстилающим покрытием, которое находится вокруг ядра, и кишечнорастворимым покрытием следующего состава:
| Игредиенты | Количество на капсулу | % мас./мас. от общей массы множественных частиц |
| Ядро + подстилаю-щее покрытие | 100,20 мг | 48,67 |
| Eudragit L30D-55 | 208,00 мг62,40 (твердое вещество) | 30,309 |
| Тальк, USP, Altalc 500V | 31,20 мг | 15,155 |
| Гидроксид натрия, NF 1Н раствор | 9,30 мг0,36 (твердое вещество) | 0,175 |
| Триэтилцитрат, PG/NF | 6,24 мг | 3,031 |
| Очищенная вода, USP/BP/EP* удаляется в процессе приготовления | 183,38 мг* | |
| Всего | 204,20 мг | 99,186 |
В одном варианте осуществления множественные частицы с кишечнорастворимым покрытием дополнительно покрываются завершающим изолирующим покрытием. Соответственно, это завершающее изолирующее покрытие содержит гидроксипропилметилцеллюлозу и составляет приблизительно от 0,1% мас./мас. до 10% мас./мас. множественных частиц с покрытием, от 0,1% мас./мас. до приблизительно 5% мас./мас. или приблизительно от 0,2% мас./мас. до приблизительно 4% мас./мас.
В одном варианте осуществления на кишечнорастворимое покрытие наносится завершающее изолирующее покрытие из гидроксипропилметилцеллюлозы в воде (которая удаляется во время обработки) в количестве от 0,5 до 1% мас./мас. множественных частиц. После этого на завершающее изолирующее покрытие необязательно может быть нанесено покрытие из талька в количестве от приблизительно 0,05 мас./мас. до приблизительно 1% мас./мас. и предпочтительно от 0,1% мас./мас. до 0,5% мас./мас.
В одном варианте осуществления полученный в результате состав по изобретению, состоящий из множества частиц, достигает геометрического среднего AUC для отношения тестируемого продукта/стандарта от 89 до 94 с 90%-м доверительным интервалом для отношения от 84 до 100 или достигает геометрического среднего Cmax для отношения тестируемого продукта/стандарта от 62 до 66 с 90%-м доверительным интервалом для отношения от 56 до 74, или профиля растворения in vitro, приведенного ниже:
| Среда | Время | % Высвобождения лекарственного средства | |||
| Начальное | 6 мес @ 25°C/60% ОВ | 6 мес @ 40°C/75% ОВ | Цель | ||
| Кислота (pH 1,0) | 2 ч | 0,33 | 0,45 | 0,6 | НБ 10% |
| Затем щелочной буфер (pH 6,8) | 3 мин | - | 0,91 | 0,85 | - |
| 6 мин | - | 3,61 | 1,83 | - | |
| 9 мин | - | 52,25 | 16,45 | - | |
| 12 мин | - | 89,65 | 75,15 | - | |
| 15 мин | 101,58 | 97,15 | 91,92 | - | |
| 30 мин | 105,29 | 100,67 | 98,96 | - | |
| 45 мин | 105,29 | 100,57 | 99,14 | НМ 75% | |
| 60 мин | 105,06 | 100,52 | 99,07 | - |
В другом варианте осуществления полученный в результате состав по изобретению, состоящий из множества частиц, достигает в среднем AUC 5451-5629 нг·ч/мл и среднего Cmax 1865-1929 нг/мл или профиля растворения in vitro, который показан ниже.
| Партия | % Высвобождения лекарственного средства* | |||
| Кислота 2 ч | Буфер (мин) | |||
| 15 | 30 | 45 | ||
| Начальная | 0,08 | 101,77 | 107,44 | 107,38 |
| 6 мес @40°C/75% ОВ | 0,73 | 95,44 | 101,12 | 101,21 |
| 12 мес @25°C/60% ОВ | 0,30 | 96,11 | 101,92 | 102,20 |
| *Спецификации: кислота через 2 ч - НБ 10,0%; буфер через 45 мин - НМ 75% |
Однако изобретение не ограничивается этими типовыми профилями.
Не желая быть связанными теорией, авторы считают, что слой завершающего изолирующего покрытия из гидроксипропилметилцеллюлозы обеспечивает физический барьер для сниженного контакта между мукоадгезивным слоем Eudragit и верхними отделами ЖКТ, тем самым, делая возможным надежный транзит множественных частиц к среде с надлежащим pH в ЖКТ для эффективного высвобождения и всасывания лекарственного средства. Кроме того, слой завершающего изолирующего покрытия из гидроксипропилметилцеллюлозы придает противоприлипающие свойства множественным частицам, и, таким образом, множественные частицы не прилипают к материалу упаковки и/или назогастральному зонду. Множественные частицы по изобретению применимы для введения через назогастральный зонд, а также в пищевых растворителях, особенно кислых пищевых растворителях.
II. Способ получения составов по изобретению, состоящих из множества частиц
В другом аспекте изобретение относится к способу получения составов по изобретению, состоящих из множества частиц.
Как правило, соединения пантопразола без покрытия получают следующим образом. Сухие компоненты, включающие по меньшей мере соединение пантопразола и связующее, смешиваются сухими в подходящем смесителе при низких усилиях сдвига. Подходящие низкие усилия сдвига могут быть легко достигнуты при использовании, например, смесителя Хобарта в диапазоне приблизительно от 25 об/мин до 35 об/мин и наиболее предпочтительно 32 об/мин. Однако специалист в данной области техники будет в состоянии достигнуть сопоставимых низких усилий сдвига, используя отличающееся оборудование с количеством оборотов в минуту, приспособленным к адекватным параметрам настройки низких усилий сдвига для выбранного оборудования. Необязательно можно заменить или дополнительно включить на данной стадии гидроксипропилметилцеллюлозу или кросповидон. Дополнительно на данной стадии можно включить регулятор pH.
Затем в смесь вводят жидкие компоненты, например поверхностно-активное вещество и воду, чтобы путем смешивания при низких усилиях сдвига получить гранулированный продукт. Подходящие низкие усилия сдвига могут быть легко достигнуты, используя, например, смеситель Хобарта, в диапазоне приблизительно от 25 об/мин до 35 об/мин и наиболее предпочтительно 32 об/мин. Однако специалист в данной области техники будет в состоянии достигнуть сопоставимых низких усилий сдвига, используя отличающееся оборудование с количеством оборотов в минуту, приспособленным к адекватным параметрам настройки низких усилий сдвига для выбранного оборудования. Грануляцию затем экструдируют и сферонизируют посредством подходящего устройства (например, экструдера/сферонизатора NICA), и полученные в результате сфероиды сушат, просеивают и необязательно смешивают перед хранением.
Изобретатели обнаружили, что стабильность смеси значимо возрастает, если множественные частицы по изобретению сушат при низких температурах. Желательно, чтобы сферические ядра множественных частиц пантопразола по изобретению сушились до процента (%) потерь при высушивании (ППВ) от 3,4% до 4,3%. Используемая в настоящем изобретении сушка при низких температурах относится к температуре, не превышающей примерно 40°C в течение от 10 до 12 ч. Если условия сушки выходят за рамки этой температуры и периода времени, обнаруживаются примеси, которые способствуют неустойчивости. В одном варианте осуществления сушка ядра производится в диапазоне от 35°C до 40°C или приблизительно от 37°C до 39°C в течение приблизительно от 8 до 72 ч. В другом варианте осуществления ядро сушат при приблизительно 40°C в течение от 10 до 12 ч. Соответственно, если, как описано, наносятся слои покрытий, температура сушки для различных слоев покрытий тоже находится в указанном диапазоне.
На множественные частицы без покрытия необязательно может быть наложено первичное изолирующее покрытие из гидрофильного полимера. Например, первичное изолирующее покрытие, состоящее из гидроксипропилметилцеллюлозы и очищенной воды, может быть нанесено в устройстве для нанесения покрытий с псевдоожиженным слоем, например, с помощью распыления.
Кишечнорастворимое покрытие может быть нанесено непосредственно на сферическое ядро без покрытия, т.е. множественные частицы без покрытия, или может быть нанесено на первичное изолирующее покрытие. Кишечнорастворимое покрытие, описанное выше, обычно наносится в устройстве Wurster для нанесения покрытий с псевдоожиженным слоем.
В одном варианте осуществления завершающее изолирующее покрытие наносится на кишечнорастворимое покрытие, и на заключительном этапе перед заполнением подходящей упаковочной единицы множественными частицами необязательно используется тальк.
Множественные частицы по изобретению могут находиться в любой подходящей форме, включая, например, гранулы, пеллеты, шарики, минитаблетки, сферулы, зернышки, микрокапсулы, миллисферы, нанокапсулы, микросферы, пластинки, таблетки и капсулы, в зависимости от желаемого пути введения.
III. Составы, наборы и способы доставки
В другом варианте осуществления настоящее изобретение относится к продуктам, содержащим множественные частицы пантопразола по изобретению.
Соответственно, композиции по изобретению, состоящие из множества частиц, составляют таким образом, чтобы пациент получил подходящее количество пантопразола, например, от 5 мг до 200 мг, от приблизительно 10 мг до приблизительно 100 мг или приблизительно 40 мг (измеренных по свободному пантопразолу). Предпочтительно составы являются такими, что подходящая доза вводится в виде разовой дозы. Эти дозы могут вводиться ежедневно в течение подходящего промежутка времени, например, от 4 недель до 8 недель, но могут вводиться более короткое время, например, от 3 дней до 3 недель, от одной недели до 3 месяцев или более длительное время, например, более 6 месяцев или дольше. Эти композиции могут вводиться индивидуально или в комбинации с антацидом или другой подходящей композицией.
В одном варианте осуществления изобретение относится к способу лечения людей путем введения эффективной дозы множественных частиц пантопразола такой, что достигаются площадь под кривой (AUC), по меньшей мере биоэквивалентная 40 мг таблетке Protonix®, и Cmax, приведенные в таблице VI.
В одном варианте осуществления множественные частицы пантопразола упаковываются для использования пациентом или тем, кто за ним ухаживает. Например, множественные частицы могут быть упакованы в фольгу или другую подходящую тару и являются подходящими для смешивания с продуктом питания (например, яблочным соусом и другими кислыми пищевыми растворителями) или с напитком для употребления пациентом.
Препараты пантопразола по изобретению, состоящие из множества частиц, применимы для лечения болезни гастроэзофагеального рефлюкса (GERD), язвы желудка и двенадцатиперстной кишки и синдрома Золлингера-Эллисона.
В другом варианте осуществления множественные частицы пантопразола суспендированы в физиологически совместимой суспендирующей жидкости.
В еще одном варианте осуществления множественные частицы пантопразола расфасованы в капсулы, таблетки в виде капсул или тому подобные для перорального приема.
В еще одном дополнительном варианте осуществления изобретение относится к способу лечения пациента путем введения эффективной дозы множественных частиц пантопразола по изобретению.
Следующие примеры иллюстрируют определенные варианты осуществления изобретения и не являются ограничением настоящего изобретения.
ПРИМЕР 1 - СОСТАВЫ ПАНТОПРАЗОЛА НАТРИЯ, СОСТОЯЩИЕ ИЗ МНОЖЕСТВА ЧАСТИЦ
Используя экструдер/сферонизатор NICA во время начальной разработки состава, получают несколько опытных образцов множественных частиц без покрытия, чтобы получить целевой профиль немедленного высвобождения, подобный или более быстрый, чем профиль таблеток пантопразола натрия без покрытия, в настоящее время доступных как таблетки Protonix (20 мг и 40 мг). Во время приготовления четырех партий множественных частиц без покрытия оценивали уровни вещества, ускоряющего распад (кросповидона), - от 5 до 28,5%, и связующего (гидроксипропилметилцеллюлозы) - от 0,5 до 1%.
A. Приготовление множественных частиц пантопразола натрия без покрытия
Конкретнее, в смесителе Хобарта сухими перемешивали сесквигидрат пантопразола натрия, микрокристаллическую целлюлозу, гидроксипропилметилцеллюлозу (гипромеллоза 2208), кросповидон и карбонат натрия. Затем в смеситель Хобарта добавляли полисорбат 80, NF (полученный из растений) и очищенную воду, USP. Полученный в результате гранулированный продукт экструдировали и сферонизовали в экструдере/сферонизаторе NICA®, и сфероиды сушили в лотках при температуре, не превышавшей 40°C, и просеивали, после чего переносили в блендер PK. Окончательные сфероиды хранили в цилиндрических контейнерах.
Одну из партий (партия на приблизительно 200 г) с 15% кросповидона, ускоряющего распад таблеток, и с 1% гидроксипропилметилцеллюлозы (гипромеллозы 2208) выбрали в качестве опытного образца со схожим профилем высвобождения. Сито, через которое просеивались сфероиды без покрытия из данной партии, имело размер ячеек от 500 до 1000 микронов.
B. Партия лабораторного опытного образца (партия A)
Приблизительно 100 граммов этих сфероидов без покрытия были покрыты в 3" устройстве для нанесения покрытий Wurster с псевдоожиженным слоем Eudragit L30D-55 и гипромеллозой, что дало в результате множественные частицы с кишечнорастворимым покрытием.
Во время нанесения покрытия для этой партии уровень гидроксипропилметилцеллюлозы (ГПМЦ) в первичном изолирующем покрытии составлял 4% от массы множественных частиц без покрытия. Процентное содержание мас./мас. использованного сухого полимера Eudragit L30D-55 составило 22,16%. В партии с покрытием в камеру для нанесения покрытий был введен тальк в виде сухого порошка вместо того, чтобы быть частью суспензии. Это происходило из-за малого размера наконечника (0,5 мм), использованного для нанесения покрытия на партию в 100 г, которая потенциально могла сбиться в комья. Процентное содержание талька и триэтилцитрата, использованных для лабораторной партии, были меньше, чем в клинических партиях, которых приготовляли впоследствии. Множественные частицы вручную расфасовывали в капсулы № 2 из ГПМЦ с массой наполнения 206 мг. Капсулы проверяли in vitro в 0,1 Н HCl и фосфатном буфере с pH 6,8. Как и требовалось, менее 1% было высвобождено в кислой среде через 2 ч и более 80% было высвобождено в основной среде через 45 мин.
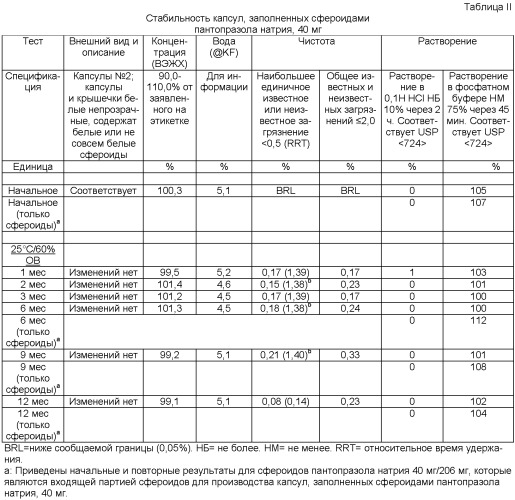
Эти капсулы проверяли на собаках. Cmax и AUC сравнивали с имеющейся в настоящее время на рынке 20 мг таблеткой Protonix (и значения экстраполировались на количество 40 мг). Было замечено, что, как и требовалось, в фосфатном буфере с pH 6,8 эти множественные частицы высвобождали лекарственное средство с гораздо большей скоростью, чем имеющаяся в настоящее время на рынке таблетка Protonix. Завершающее изолирующее покрытие состоит из гидроксипропилметилцеллюлозы (гипромеллозы) и воды. Эту партию упаковали в виде сфероидов в прозрачные стеклянные флаконы и подвергали испытанию на стабильность в форсированных условиях (30°C/65% относительной влажности (ОВ) и 40°C/75% ОВ). Стабильность проверяли в течение 3 месяцев. Активность и результаты растворения приведены в таблице I. Множественные частицы были устойчивы в течение трех месяцев, и доза множественных частиц, эквивалентная 40 мг, расфасованная в капсулы в каждый момент времени стабильности, отвечала всем критериям растворения и стабильности.
Растворение проверяли путем расфасовки хранимых сфероидов в оболочки капсул и растворения в 0,1 Н HCl (целевое высвобождение через 2 ч: не более (НБ) 10%), за которым следовало растворение в фосфатном буфере с pH 6,8 (целевое высвобождение через 45 мин: не менее (НМ) 75%). Критерии приемки дополнительно требовали 90-110% концентрации от указанной на этикетке.
| Таблица IСтабильность множественных частиц в прозрачныхстеклянных флаконах | ||||
| Тест | Время | Концентрация (ВЭЖХ), % на этикетке | Растворение - процент высвобождения (в среднем) | |
| Единица | 0,1 Н HCl | Вторичное растворение в фосфатном буфере | ||
| Начальная | 100,0% | 0,9% | 91,6% | |
| Комнатная температура | 1 мес | 97,2% | 0,8% | 88,5% |
| 7 мес | 108,5% | 0,8% | 94,1% | |
| 30°C/60% ОВ | 1 мес | 99,3% | 0,5% | 83,4% |
| 2 мес | 98,3% | NA | NA | |
| 3 мес | 104,4% | 0,7% | 82,2% | |
| 40°C/75% ОВ | 1 мес | 95,4% | 0,7% | 86,11 |
| 2 мес | 97,3% | NA | NA | |
| 3 мес | 102,7% | 0,7% | 89,4% | |
| 1У одной капсулы - 78%-е высвобождение. |
ПРИМЕР 2 - СОСТАВЫ ПАНТОПРАЗОЛА НАТРИЯ С ПОКРЫТИЕМ, СОСТОЯЩИЕ ИЗ МНОЖЕСТВА ЧАСТИЦ (ПАРТИЯ B)
На основе лабораторной партии A получали следующую партию увеличенного масштаба - 1400 г - с использованием 7" устройства для нанесения покрытий Wurster с псевдоожиженным слоем. Во время нанесения покрытия на эту партию уровень гидроксипропилметилцеллюлозы в первичном изолирующем покрытии составил 2% массы множественных частиц без покрытия по сравнению с 4% у партии A с покрытием. Процентное содержание мас./мас. использованного сухого полимера, Eudragit L30D-55, составило 22,16% мас./мас. Кроме того, тальк добавляли непосредственно к суспензии покрытия, поскольку использовался больший размер наконечника (1 мм).
Начальное высвобождение множественных частиц с покрытием в 0,1Н кислоте было высоким (9,0%) и очень близким к пределу 10%. Эта партия (B) не отвечала критериям стабильности и растворения при испытании в форсированных условиях (30°C/60% относительной влажности (ОВ) и 40°C/75% ОВ). Испытание этой партии показало, что первичное изолирующее покрытие, составляющее боле 2% множественных частиц без покрытия, повышает стабильность множественных частиц. Кроме того, использование большего количества кишечнорастворимого полимера может быть полезным, чтобы управлять высвобождением в кислой среде, поскольку масштаб процесса увеличивается.
ПРИМЕР 3 - ПОЛУЧЕНИЕ ПАРТИИ МНОЖЕСТВЕННЫХ ЧАСТИЦ ПАНТОПРАЗОЛА БОЛЬШЕГО МАСШТАБА
A. Техническая Партия
Используя экструдер/сферонизатор NICА, приготовили 36-килограммовую техническую партию множественных частиц без покрытия, и на 20 кг этой партии было нанесено кишечнорастворимое покрытие в машине Glatt GPCG-15, что дало в результате 32-килограммовую партию множественных частиц с покрытием. Процентное содержание мас./мас. использованного сухого полимера, Eudragit L30D-55, составило 22,16% мас./мас. Эта партия была расфасована в капсулы №3 из ГПМЦ с массой наполнения 156 мг. Высвобождение в 0,1Н HCl через 2 ч превышало желаемые 10%. Основываясь на этом, принимая во внимание влияния увеличенного масштаба, для клинической партии были сделаны незначительные корректировки формулы и процесса.
B. Клиническая партия
Две 12-килограммовых подпартии влажной гранулированной массы экструдировали и сферонизировали на экструдере/сферонизаторе NICA, что дало в результате влажные множественные частицы. Множественные частицы сушили в лотках при 40°C в течение 10-12 ч до желаемых % ППВ от 3,4% до 4,3%. Партию просеяли, и только 16 кг множественных частиц без покрытия использовали для нанесения покрытия, чтобы обеспечить однородность и завершенность покрытия в машине GPCG-15. Просеянные множественные частицы без покрытия покрывали первичным изолирующим покрытием из гидроксипропилметилцеллюлозы, затем кишечнорастворимым покрытием из Eudragit L30D-55, затем завершающим покрытием из гидроксипропилметилцеллюлозы, что в результате дало 33 кг множественных частиц с покрытием. Эта партия была расфасована в капсулы №2 из ГПМЦ с массой наполнения 206 мг.
Высвобождение в 0,1Н HCl через 2 ч было меньше 10%-го предела, а в фосфа