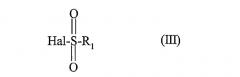Производные n-(1,5-дифенил-1н-пиразол-3-ил)сульфонамида со сродством к рецепторам cb1
Иллюстрации
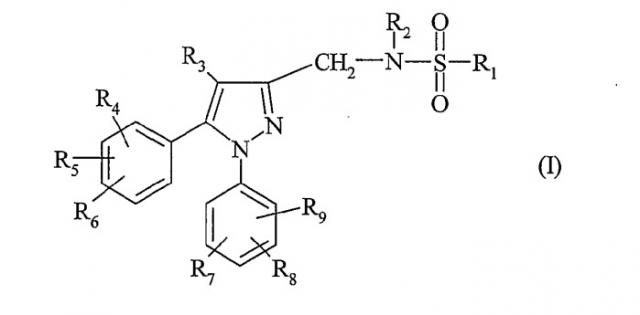
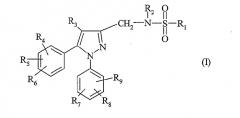
Показать всеОбъектом настоящего изобретения являются соединения, отвечающие формуле (I) в состоянии основания или кислотно-аддитивной соли, способ их получения и фармацевтическая композиция на их основе. В указанной формуле R1 означает (С1-С6)алкил; (С3-С7)циклоалкил, не замещенный или замещенный один или несколько раз; (С3-С7)циклоалкилметил, не замещенный или замещенный один или несколько раз; фенил, не замещенный или замещенный; бензил, незамещенный или одно- или двукратно замещенный; тиенил, не замещенный или замещенный; R2 означает атом водорода или (С1-С3)алкил; R3 означает (С1-С5)алкил; R4, R5, R6, R7, R8 и R9 каждый независимо означает атом водорода, атом галогена, (С1-С7)алкил, (С1-С5)алкокси или трифторметильный радикал; n означает 0, 1 или 2; Alk означает (С1-С4)алкил. 3 н. и 2 з.п. ф-лы, 5 табл.
Реферат
Объектом настоящего изобретения являются производные N-[(1,5-дифенил-1H-пиразол-3-ил)метил]сульфонамида, их получение и их применение в терапии.
Производные дифенилпиразола, имеющие сродство к рецепторам CB1 каннабиноидов, описаны, в частности, в патентах EP 0576357, EP 0656354 и US 5624941.
Теперь обнаружены новые производные N-[(1,5-дифенил-1H-пиразол-3-ил)метил]сульфонамида, которые обладают свойствами антагонистов каннабиноидных рецепторов CB1.
Объектом настоящего изобретения являются соединения, отвечающие формуле (I)
в которой:
- R1 означает (C1-C6)алкил;
(C3-C7)циклоалкил, не замещенный или замещенный один или несколько раз (C1-C3)алкильной группой;
(C3-C7)циклоалкилметил, не замещенный или замещенный один или несколько раз в карбоцикле (C1-C3)алкилом;
фенил, незамещенный или моно-, ди- или тризамещенный заместителем, выбранным независимо из атома галогена, (C1-C4)алкила, (C1-C3)алкокси, циано, трифторметильного радикала, трифторметоксильного радикала, группы S(O)nAlk, (C1-C3)алкилкарбонильной группы, фенила;
бензил, незамещенный или моно- или дизамещенный заместителем, выбранным независимо из атома галогена, алкила, (C1-C3)алкокси; трифторметильного радикала;
тиенил, не замещенный или замещенный атомом галогена или изоксазолилом;
- R2 означает атом водорода или (C1-C3)алкил;
- R3 означает атом водорода или (C1-C5)алкил;
- R4, R5, R6, R7, R8 и R9 каждый означает независимо атом водорода, атом галогена, (C1-C7)алкил, (C1-C5)алкокси, трифторметильный радикал или группу S(O)nAlk;
- n означает 0, 1 или 2;
- Alk означает (C1-C4)алкил.
Соединения формулы (I) могут содержать один или несколько асимметричных атомов углерода. Следовательно, они могут существовать в виде энантиомеров или диастереомеров. Эти энантиомеры, диастереомеры, а также их смеси, в том числе рацемические смеси, являются частью изобретения.
Соединения формулы (I) могут существовать в виде оснований или кислотно-аддитивных солей. Такие кислотно-аддитивные соли составляют часть изобретения.
Эти соли преимущественно получены с фармацевтически приемлемыми кислотами, но и соли других кислот, пригодных для очистки или выделения соединений формулы (I), также являются частью изобретения.
Соединения формулы (I) могут также существовать в виде гидратов или сольватов, а именно в виде ассоциатов или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть изобретения.
Под атомом галогена понимается атом брома, хлора, фтора или йода.
Под (C1-C3)алкилом или соответственно (C1-C4)алкилом, (C1-C5)алкилом, (C1-C6)алкилом или (C1-C7)алкилом понимают линейный или разветвленный алкильный радикал с 1-3 атомами углерода или соответственно с 1-4 атомами углерода, с 1-5 атомами углерода, 1-6 атомами углерода или 1-7 атомами углерода, такие как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, втор-бутильный, трет-бутильный, пентильный, изопентильный, гексильный, изогексильный, гептильный радикал.
Под (C1-C3)алкокси или, соответственно, (C1-C5)алкокси понимают линейный или разветвленный алкоксильный радикал с 1-3 атомами углерода или, соответственно, 1-5 атомами углерода, такой как метоксильный, этоксильный, пропоксильный, изопропоксильный, бутоксильный, втор-бутоксильный, трет-бутоксильный, пентоксильный, изопентоксильный радикал.
Под (C3-C7)циклоалкилом понимают циклическую алкильную группу с 3-7 атомами углерода, такую как циклопропильная, циклобутильная, циклопентильная, циклогексильная, циклогептильная группа.
Из соединений формулы (I) - объектов изобретения можно назвать предпочтительные соединения, которые определяются следующим образом:
- R1 означает
этил, изопропил, н-бутил;
циклогексил;
циклогексилметил;
2-хлорфенил, 3-хлорфенил, 2-фторфенил, 3-хлор-4-фторфенил, 4-бром-2-этилфенил, 3-метилфенил, 4-трет-бутилфенил, 3,5-диметилфенил, 3-метоксифенил, 4-метоксифенил, 3-цианофенил, 4-цианофенил, 2-(трифторметил)фенил, 3-(трифторметил)фенил, 4-(трифторметил)фенил, 3,5-бис(трифторметил)фенил, 2-(трифторметокси)фенил, 3-(трифторметокси)фенил, 2-(метилсульфонил)фенил, 3-(метилсульфонил)фенил, 3-ацетилфенил, 3-бифенил, 2-бифенил;
3-хлорбензил, 2-фторбензил, 4-фторбензил, 3-(трифторметил)бензил, 4-(трифторметил)бензил;
5-бром-2-тиенил; 5-изоксазол-3-ил-2-тиенил;
- и/или R2 означает атом водорода или метил;
- и/или R3 означает метил или этил;
- и/или R4 означает атом водорода;
- и/или R5 находится в положении -4- фенила и означает атом брома, хлора, фтора или метокси;
- и/или R6 означает атом водорода;
- и/или R7 означает атом водорода;
- и/или R8 находится в положении -4- фенила и означает атом водорода, атом хлора, атом фтора;
- и/или R9 находится в положении -2- фенила и означает атом хлора или фтора; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
Из последних предпочтительных соединений особенно предпочтительны соединения формулы (I), в которых:
- R1 означает
этил, изопропил, н-бутил;
циклогексил;
циклогексилметил;
2-хлорфенил, 3-хлорфенил, 2-фторфенил, 3-хлор-4-фторфенил, 4-бром-2-этилфенил, 3-метилфенил, 4-трет-бутилфенил, 3,5-диметилфенил, 3-метоксифенил, 4-метоксифенил, 3-цианофенил, 4-цианофенил, 2-(трифторметил)фенил, 3-(трифторметил)фенил, 4-(трифторметил)фенил, 3,5-бис(трифторметил)фенил, 2-трифторметокси)фенил, 3-(трифторметокси)фенил, 2-(метилсульфонил)фенил, 3-(метилсульфонил)фенил, 3-ацетилфенил, 3-бифенил, 2-бифенил;
3-хлорбензил, 2-фторбензил, 4-фторбензил, 3-(трифторметил)бензил, 4-(трифторметил)бензил;
5-бром-2-тиенил; 5-изоксазол-3-ил-2-тиенил;
- R2 означает атом водорода или метил;
- R3 означает метил или этил;
- R4 означает атом водорода;
- R5 находится в положении -4- фенила и означает атом брома, хлора, фтора или метокси;
- R6 означает атом водорода;
- R7 означает атом водорода;
- R8 находится в положении -4- фенила и означает атом водорода, атом хлора, атом фтора;
- R9 находится в положении -2- фенила и означает атом хлора или фтора;
в состоянии основания или кислотно-аддитивной соли, а также в состоянии гидрата или сольвата.
Из соединений формулы (I) - объектов изобретения можно, в частности, назвать следующие соединения:
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]бутан-1-сульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]циклогексансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]циклогексилметансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-3-хлорбензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-4-трет-бутилбензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-3-метоксибензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-4-метоксибензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-4-(трифторметил)бензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-2-(метилсульфонил)бензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-1-(3-хлорфенил)метансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-1-[3-(трифторметил)фенил]метансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-3-хлор-4-фторбензолсульфонамид;
- N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-бутан-1-сульфонамид;
- 3-хлор-N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]бензолсульфонамид;
- 4-трет-бутил-N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]бензолсульфонамид;
- N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-3-метоксибензолсульфонамид;
- N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-3-цианобензолсульфонамид;
- N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-4-(трифторметил)бензолсульфонамид;
- N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-2-(трифторметокси)бензолсульфонамид;
- N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-2-(метилсульфонил)бензолсульфонамид;
- 3-хлор-N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-4-фторбензолсульфонамид;
- 4-бром-N-[[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-2-этилбензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]этансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]пропан-2-сульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]бутан-1-сульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]циклогексансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-1-циклогексилметансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-3-хлорбензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-2-хлорбензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-3-метилбензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-4-трет-бутилбензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-4-метоксибензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-3-метоксибензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-4-(трифторметил)бензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-3-(трифторметил)бензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-2-(трифторметил)бензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-3-(трифторметокси)бензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-2-(трифторметокси)бензолсульфонамид;
- 3-ацетил-N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]бензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1Н-пиразол-3-ил]метил]бифенил-3-сульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-1-[4-(трифторметил)фенил]метансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-1-[3-(трифторметил)фенил]метансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-3,5-диметилбензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-3,5-бис(трифторметил)бензолсульфонамид;
- 3-хлор-N-[[1-(2-хлорфенил)-5-(4-хлорфенил)-4-метил-1H-пиразол-3-ил]метил]бензолсульфонамид;
- N-[[1-(2-хлорфенил)-5-(4-хлорфенил)-4-метил-1H-пиразол-3-ил]метил]-2-фторбензолсульфонамид;
- N-[[1-(2-хлорфенил)-5-(4-хлорфенил)-4-метил-1Н-пиразол-3-ил]метил]-3-цианобензолсульфонамид;
- N-[[1-(2-хлорфенил)-5-(4-хлорфенил)-4-метил-1H-пиразол-3-ил]метил]-3-метоксибензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-3-метоксибензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]-3-цианобензолсульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-1-(2-фторфенил)метансульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-1-(4-фторфенил)метансульфонамид;
- 5-бром-N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]тиофен-2-сульфонамид;
- N-[[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метил]-5-изоксазол-3-илтиофен-2-сульфонамид;
- 3-хлор-N-[[1-(2,4-дихлорфенил)-5-(4-метоксифенил)-4-метил-1H-пиразол-3-ил]метил]бензолсульфонамид;
N-[[1-(2,4-дихлорфенил)-5-(4-метоксифенил)-4-метил-1H-пиразол-3-ил]метил]-3-метилбензолсульфонамид;
в виде основания или кислотно-аддитивной соли, а также в состоянии гидрата или сольвата.
Далее под защитной группой Pg понимается группа, которая позволяет, с одной стороны, защитить реакционноспособную функциональную группу, такую как гидрокси или аминогруппа, во время синтеза, а, с другой стороны, регенерировать реакционноспособную функциональную группу в конце синтеза в неизменном виде.
Примеры защитных групп, а также способы защиты и удаления защиты приведены в "Protective Group in Organic Synthesis", Green et al., 2nd Edition (John Wiley & Sons, Inc., New York), 1991.
Под уходящей группой в дальнейшем изложении понимается группа, которая легко может быть отщеплена от молекулы путем гетеролитического разрыва связи с уходом пары электронов. Эта группа также может быть легко замещена другой группой, например, в реакции замещения. Такими уходящими группами являются, например, галогены или активированная гидроксигруппа, такая как метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат и т.д. Примеры уходящих групп, а также ссылки на их получение даны в "Advances in Organic Chemistry", J. March, 3rd Edition, Wiley Interscience, 1985, p. 310-316.
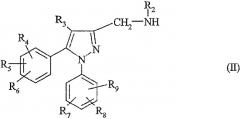
Согласно изобретению соединения формулы (I) можно получить по способу, который отличается тем, что в присутствии основания и в растворителе соединение формулы
в которой R2, R3, R4, R5, R6, R7, R8 и R9 определены для соединения формулы (I), вводят в реакцию с сульфонилгалогенидом формулы
в которой R1 определен для соединения формулы (I), а Hal означает атом галогена.
При необходимости соединение формулы (I) переводят в одну из его кислотно-аддитивных солей.
Реакция проводится в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как дихлорметан или тетрагидрофуран, и при температуре, составляющей от комнатной температуры и до температуры кипения растворителя. Реакция проводится предпочтительно с применением соединения формулы (III), в которой Hal означает атом хлора.
Согласно другому варианту способа соединение формулы (I), в которой R2 означает (C1-C3)алкил, можно получить реакцией соединения формулы (I), в которой
R2=H, с галогенидом (C1-C3)алкила, в присутствии основания, такого как гидрид натрия или карбонат калия, в растворителе, таком как N,N-диметилформамид, и при температуре, составляющей от комнатной температуры и до температуры кипения растворителя.
Полученные таким образом соединения формулы (I) могут быть в дальнейшем отделены от реакционной среды и очищены согласно классическим методам, например, путем кристаллизации или хроматографии.
Соединения формулы (II) получаются по реакции соединения формулы
в которой R3, R4, R5, R6, R7, R8 и R9 такие, как определено для соединения формулы (I), и Y означает уходящую группу, такую как определено выше, предпочтительно атом галогена или активированную гидроксигруппу, такую, как метансульфонатная, бензолсульфонатная, п-толуолсульфонатная или трифлатная группа, с соединением формулы
в которой R2 такой, как определено для соединения формулы (I).
Реакция проводится в растворителе, таком как N,N-диметилформамид, ацетонитрил, дихлорметан, толуол или пропан-2-ол, и в присутствии или в отсутствие основания. Когда используют основание, его выбирают из органических оснований, таких как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин. Реакция проводится при температуре, составляющей от 0°C до температуры кипения растворителя.
Согласно одному варианту соединение формулы (II), в которой R2=H, можно также получить по реакции соединения формулы (IV), в которой Y=Cl, с 1,3,5,7-тетраазатрицикло[3.3.13,7]деканом (или гексаметилентетрамином) с последующим гидролизом сильной кислотой, такой как соляная кислота.
Соединения формулы (III) имеются в продаже или описаны в литературе, или могут быть получены методами, которые описаны в литературе, такой как в J. Org. Chem. USSR, 1970, 6, 2454-2458; J. Am. Chem. Soc., 1952, 74, 2008; J. Med.Chem., 1977, 20(10), 1235-1239; EP 0469984; WO 95/18105.
Например, соединения формулы (III) могут быть получены галогенированием соответствующих сульфоновых кислот или их солей, например их натриевых или калиевых солей. Реакция проводится в присутствии галогенирующего агента, такого как оксохлорид фосфора, тионилхлорид, трихлорид фосфора, трибромид фосфора или пентахлорид фосфора, без растворителя или в растворителе, таком как галогенированный углеводород или N,N-диметилформамид, и при температуре, составляющей от -10°C до 200°C.
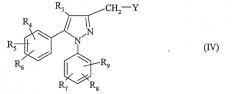
Соединения формулы (IV) получаются из соединений формулы
в которой R3, R4, R5, R6, R7, R8 и R9 такие, как определено для соединения формулы (I), по классическим способам, указанным ранее.
Так, например, когда в соединение формулы (IV) Y означает атом галогена, соединение формулы (VI) обрабатывают агентом галогенирования, таким как PCl5,
PBr3, HBr или BBr3, в растворителе, таком как дихлорметан, и при температуре, составляющей от 0°C до комнатной температуры.
Когда в соединении формулы (IV) Y означает метансульфонат, бензолсульфонат, п-толуолсульфонат или трифторметансульфонат, соединение формулы (VI) вводят в реакцию с сульфонилхлоридом формулы X-SО2-Cl, в которой X означает метил, фенил, п-толил или трифторметил. Реакция проводится в присутствии основания, такого как триэтиламин, пиридин или N,N-диизопропилэтиламин, в растворителе, таком как дихлорметан или толуол, и при температуре, составляющей от -20°C и до температуры кипения растворителя.
Соединения формулы (V) известны.
Соединения формулы (VI) получаются по реакции восстановления соединений формулы
в которой R3, R4, R5, R6, R7, R8 и R9 таковы, как определено для соединения формулы (I), и Z означает гидрокси или (C1-C2)алкокси.
Реакция проводится в присутствии восстановителя, такого как боргидрид натрия или гидрид алюминия и лития, в растворителе, таком как тетрагидрофуран, и при температуре, составляющей от -20°C до комнатной температуры. Когда восстанавливают соединение формулы (VII), в которой Z=OH, кислота может быть перед этим активирована реакцией с этилхлорформиатом в присутствии триэтиламина.
Соединения формулы (VII) известны и получаются по известным методам, таким как описанные в документах EP 0656354, EP 0576357 или в WO 00/46209.
В следующих примерах описано получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими и только иллюстрируют настоящее изобретение. Номера приведенных в примерах соединений соответствуют номерам, приведенным ниже в таблице V, в которой показаны химические структуры и физические свойства некоторых соединений согласно изобретению.
В синтезах и в примерах используются следующие сокращения:
эфир: диэтиловый эфир
изоэфир: диизопропиловый эфир
ДМСО: диметилсульфоксид
ДМФ: N,N-диметилформамид
ТГФ: тетрагидрофуран
ДХМ: дихлорметан
AcOEt: этилацетат
DIPEA: диизопропилэтиламин
TFA: трифторуксусная кислота
2н. солянокислый эфир: 2н. раствор соляной кислоты в диэтиловом эфире
F: температура плавления
TA: комнатная температура
Eb: температура кипения
ВЭЖХ: высокоэффективная жидкостная хроматография
Силикагель H: силикагель 60 H, продаваемый Merck (Дармштадт)
Буферный раствор pH 2: раствор 16,66 г KHSО4 и 32,32 г K2SО4 в 1 литре воды.
Спектры ядерного магнитного резонанса регистрируют при 200 МГц в ДМСО-d6. При интерпретации спектров используются следующие сокращения: с: синглет, д: дублет, т: триплет, мас: массовый, м: мультиплет, шир.с: широкий синглет.
Соединения согласно изобретению анализируют по совокупности ЖХ/УФ/МС (жидкостная хроматография/УФ-детектирование/масс-спектрометрия). Измеряют молекулярный пик (MH+) и время удерживания (tr) в минутах.
Применяемый прибор, поставляемый Agilent, состоит из хроматографа HP 1100, оборудованного детектором на диодной матрице фирмы Agilent и квадрупольным масс-спектрометром MSD Quad.
Метод A:
Используют колонку Xterra Waters® MS C18 производства Waters, 2,1 x 30 мм, 3,5 мкм, при комнатной температуре, расход 1 мл/мин.
Элюент является следующим соединением:
- растворитель A: 0,025% трифторуксусной кислоты (TFA) в воде;
- растворитель B: 0,025% TFA в ацетонитриле.
Градиент: Процентная доля растворителя B меняется от 0 до 100% за 2 минуты с горизонтальным участком при 100% B в течение 1 минуты.
УФ-детектирование проводится в интервале от 210 нм до 400 нм, а измерение массы - в режиме химической ионизации при атмосферном давлении.
Метод B:
Используют колонку Symmetry C18 2,1x50 мм, 3,5 мкм, при 30°C, скорость 0,4 мл/минута.
Элюент является следующим соединением:
- растворитель A: 0,005% трифторуксусной кислоты (TFA) в воде при pH 3,15;
- растворитель B: 0,005% TFA в ацетонитриле.
Градиент:
| Время (минуты) | %A | %B |
| 0 | 100 | 0 |
| 10 | 10 | 90 |
| 15 | 10 | 90 |
| 16 | 100 | 0 |
| 20 | 100 | 0 |
УФ-детектирование проводится при λ=210 нМ и определение массы проводится в режиме положительной электроспрей-ионизации (ESI).
Метод C:
Используют колонку C18 2,1x50 мм, 3,5 мкм, при 30°C, скорость 0,4 мл/минута.
Элюент является следующим соединением:
- растворитель A: 0,005% TFA в воде при pH 3,15;
- растворитель B: 0,005% TFA в ацетонитриле.
Градиент:
| Время (минуты) | %A | %B |
| 0 | 100 | 0 |
| 20 | 10 | 90 |
| 30 | 10 | 90 |
| 35 | 100 | 0 |
| 40 | 100 | 0 |
УФ-детектирование проводится при λ=210 нМ, а определение массы проводится в режиме положительной электроспрей-ионизации (ESI).
Метод D:
Используют колонку Xterra MS C18 2,1x50 мм, 3,5 мкм, при 30°C, скорость 0,4 мл/минута.
Элюент является следующим соединением:
- растворитель A: ацетат аммония (AcONH4) 10 нМ в воде при pH 7;
- растворитель B: ацетонитрил.
Градиент:
| Время (минуты) | %A | %B |
| 0 | 100 | 0 |
| 10 | 10 | 90 |
| 15 | 10 | 90 |
| 16 | 100 | 0 |
| 20 | 100 | 0 |
УФ-детектирование проводится при λ=220 нМ, а определение массы - в режиме положительной электроспрей-ионизации (ESI).
Метод E:
Используют колонку Xterra MS C18 2,1x50 мм, 3,5 мкм, при 30°C, скорость 0,4 мл/минута.
Элюент является следующим соединением:
- растворитель A: AcONH4 10 нМ в воде при pH 7;
- растворитель B: ацетонитрил.
Градиент:
| Время (минуты) | %A | %B |
| 0 | 100 | 0 |
| 20 | 10 | 90 |
| 30 | 10 | 90 |
| 35 | 100 | 0 |
| 40 | 100 | 0 |
СИНТЕЗ
1. Получение соединений формулы (VII).
Синтез 1.1
5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1Н-пиразол-3-карбоновая кислота.
(VII): R3=-CH3; R4=H; R5=4-Br; R6=H; R7=H; R8=4-CL; R9=2-Cl; Z=-OH.
A) Литиевая соль этил-[4-(4-бромфенил)-3-метил-2-оксо-4-оксидобут-3-еноата].
Раствор 43 г литиевой соли гексаметилдисилазана в 300 мл эфира охлаждают до -60°C, по каплям добавляют раствор 50 г 4-бромпропиофенона в 500 мл эфира и оставляют перемешиваться, пока температура не поднимется до -30°C. Затем добавляют 38 г диэтилоксалата и оставляют перемешиваться на 18 часов, повышая температуру до TA. Образованный осадок отжимают, промывают его эфиром и сушат в вакууме. Получено 62 г ожидаемого продукта.
B) этил-[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоксилат].
К раствору 30 г соединения, полученного на предыдущем этапе, в 150 мл уксусной кислоты добавляют 20 г хлоргидрата 2,4-дихлорфенилгидразина и кипятят с обратным холодильником в течение 3 часов. После охлаждения до TA реакционную смесь вливают в смесь воды со льдом, экстрагируют эфиром, органическую фазу промывают насыщенным раствором NaCl, сушат над MgSO4, растворитель частично выпаривают в вакууме и образовавшийся кристаллизованный продукт отжимают. Получено 33,4 г ожидаемого продукта.
C) 5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоновая кислота.
К раствору 26 г соединения, полученного на предшествующем этапе, в 50 мл EtOH добавляют 6,5 г KOH, затем 20 мл воды и кипятят с обратным холодильником в течение 2 часов. После охлаждения до TA реакционную смесь вливают в смесь воды со льдом, содержащую 10 мл концентрированной HCl, образованный осадок отжимают, промывают в воде и сушат в вакууме. Получено 24 г ожидаемого продукта.
Синтез 1.2
метил-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоксилат].
(VII): R3=-CH3; R4=H; R5=4-Cl; R6=H; R7=H; R8=4-Cl; R9=2-Cl; Z=-OCH3.
A) 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоновая кислота.
Это соединение получают в соответствии со способом проведения синтеза, описанным в EP 0656354B.
B) метил-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоксилат].
К раствору 30 г соединения, полученного на предыдущем этапе, в 500 мл MeOH добавляют 3 г пара-толуолсульфоновой кислоты и кипятят с обратным холодильником в течение 2 часов. Реакционную смесь концентрируют вдвое, образовавшийся осадок отжимают, промывают его MeOH и сушат. Получено 30 г ожидаемого продукта.
Синтез 1.3
5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-карбоновая кислота.
(VII): R3=-CH2CH3; R4=H; R5=4-Br; R6=H; R7=H; R8=4-Cl; R9=2-Cl; Z=-OH.
Это соединение получают в соответствии с порядком проведения синтеза, описанным в WO 00/46209.
Следуя порядку проведения синтеза, описанному выше в синтезе 1, получают соединения формулы (VII), приведенные ниже в таблице I.
| Получение | R3 | R5 | R8 | R9 | Z |
| 1.1 | -CH3 | Br | Cl | Cl | -OH |
| 1.2 | -CH3 | Cl | Cl | Cl | -OCH3 |
| 1.3 | -CH2CH3 | Br | Cl | Cl | -OH |
| 1.4 | -CH3 | Cl | H | Cl | -OCH2CH3 |
| 1.5 | -CH3 | F | H | Cl | -OCH2CH3 |
| 1.6 | -CH3 | -OCH3 | H | Cl | -OCH2CH3 |
| 1.7 | -CH3 | -OCH3 | H | F | -OCH2CH3 |
| 1.8 | -CH3 | -OCH3 | Cl | Cl | -OCH2CH3 |
| 1.9 | -CH3 | -OCH3 | F | F | -OCH2CH3 |
2. Получение соединений формулы (VI).
Синтез 2.1
[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метанол.
(VI):R3=-CH3; R4=H; R5=4-Br; R6=H; R7=H; R8=4-Cl; R9=2-Cl.
Смесь 24 г соединения, полученного в синтезе 1.1, в 200 мл ТГФ охлаждают до -10°C, добавляют 7,8 мл триэтиламина, затем по каплям добавляют 5,38 мл этилхлорформиата и оставляют перемешиваться 15 минут при -10°C. Затем при температуре ниже -10°C добавляют за один раз 6,3 г боргидрида натрия, затем по каплям добавляют 100 мл MeOH и оставляют перемешиваться на 30 минут при 0°C. Реакционную смесь гидролизуют путем добавления 100 мл 10%-ной HCl, концентрируют в вакууме, осадок вводят в воду, экстрагируют AcOEt, органическую фазу промывают насыщенным раствором NaCl, сушат над MgSO4 и растворитель выпаривают в вакууме. Остаток подвергают хроматографии на силикагеле, элюируя смесью циклогексан/AcOEt (75/25; об./об.). Получено 22 г ожидаемого продукта.
Синтез 2.2
[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метанол.
(VI): R3=-CH3; R4=H; R5=4-Cl; R6=H; R7=H; R8=4-Cl; R9=2-Cl.
Охлаждают до -5°C раствор 30 г соединения, полученного в синтезе 1.2, в 500 мл ТГФ, малыми порциями добавляют, поддерживая температуру в интервале от -5°C до 0°C, 4,6 г гидрида алюминия и лития и оставляют перемешиваться 1 час при TA. Реакционную смесь охлаждают до 0°C, гидролизуют путем добавления 20 мл 1N NaOH, неорганическую фазу отфильтровывают, промывают ТГФ и фильтрат концентрируют в вакууме. Остаток экстрагируют эфиром, органическую фазу промывают насыщенным раствором NaCl, сушат над Na2SО4 и растворитель частично выпаривают в вакууме. Образовавшийся осадок отжимают, промывают его эфиром и сушат. Получено 25 г ожидаемого продукта.
Синтез 2.3
[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол-3-ил]метанол.
(VI): R3=-CH2CH3; R4=H; R5=4-Br; R6=H; R7=H; R8=4-Cl; R9=2-Cl.
Охлаждают до -10°C смесь 24,6 г соединения, полученного в синтезе 1.3, в 200 мл ТГФ, добавляют 7,8 мл триэтиламина, затем по каплям добавляют 5,38 мл хлорформиата этила и оставляют перемешиваться на 15 минут при -10°C. Затем при температуре ниже -10°C добавляют за один раз 6,3 г боргидрида натрия, затем по каплям добавляют 100 мл MeOH. Реакционную смесь гидролизуют при 0°C путем добавления 100 мл 10%-ной HCl, затем концентрируют в вакууме. Остаток экстрагируют AcOEt, органическую фазу два раза промывают 50 мл насыщенного раствора NaCl, сушат над Na2SO4 и растворитель выпаривают в вакууме. Остаток подвергают хроматографии на силикагеле, элюируя смесью циклогексан/AcOEt (60/40; об./об.). Получено 20 г ожидаемого продукта.
Следуя порядку проведения синтеза, описанному выше в синтезах 2, получают соединения формулы (VI), приведенные ниже в таблице II.
| Таблица II | ||||
| Синтез | R3 | R5 | R8 | R9 |
| 2.1 | -CH3 | Br | Cl | Cl |
| 2.2 | -CH3 | Cl | Cl | Cl |
| 2.3 | -CH2CH3 | Br | Cl | Cl |
| 2.4 | -CH3 | Cl | H | Cl |
| 2.5 | -CH3 | F | H | Cl |
| 2.6 | -CH3 | -OCH3 | H | Cl |
| 2.7 | -CH3 | -OCH3 | H | F |
| 2.8 | -CH3 | -OCH3 | Cl | Cl |
| 2.9 | -CH3 | -OCH3 | F | F |
3. Получение соединений формулы (IV)
Синтез 3.1
5-(4-бромфенил)-3-(хлорметил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол.
(IV): R3=-CH3; R4=H; R5=4-Br; R6=H; R7=H; R8=4-Cl; R9=2-Cl; Y=Cl.
Раствор 20 г соединения, полученного в синтезе 2.1, в 250 мл ДХМ охлаждают до 0°C в атмосфере азота, малыми порциями при температуре ниже 5°C добавляют 10,6 г пентахлорида фосфора и оставляют перемешиваться на 2 часа, повышая температуру до TA. Реакционную смесь вливают в 150 мл смеси воды со льдом и оставляют перемешиваться на 10 минут. Экстрагируют ДХМ, органическую фазу промывают 5%-ным раствором NaHCO3, насыщенным раствором NaCl, сушат над MgSO4 и растворитель выпаривают в вакууме. Получено 24 г ожидаемого продукта.
Синтез 3.2
3-(хлорметил)-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол.
(IV): R3=-CH3; R4=H; R5=4-Cl; R6=H; R7=H; R8=4-Cl; R9=2-Cl; Y=Cl.
Раствор 25 г соединения, полученного в синтезе 2.2, в 250 мл ДХМ охлаждают до 0°C в атмосфере азота, малыми порциями при температуре, составляющей от 0°C до 5°C, добавляют 14,8 г пентахлорида фосфора и оставляют перемешиваться на 3 часа, повышая температуру до TA. Реакционную смесь вливают в 200 мл воды и оставляют перемешиваться на 10 минут. После отстаивания органическую фазу промывают насыщенным раствором NaHCO3, насыщенным раствором NaCl, сушат над Na2SО4 и растворитель выпаривают в вакууме. Получено 25 г ожидаемого продукта в виде пены.
Синтез 3.3
5-(4-бромфенил)-3-(хлорметил)-1-(2,4-дихлорфенил)-4-этил-1H-пиразол.
(IV): R3=-CH2CH3; R4=H; R5=4-Br; R6=H; R7=H; R8=4-Cl; R9=2-Cl; Y=Cl.
Это соединение получают в соответствии с порядком проведения синтеза, описанном в синтезе 3.2, исходя из 9 г соединения, полученного в синтезе 2.3, в 200 мл ДХМ и 4,6 г пентахлорида фосфора. Получено 9,4 г ожидаемого продукта.
Следуя порядкам проведения синтеза, описанным выше в синтезах 3, получают соединения формулы (IV), приведенные ниже в таблице III.
| Таблица III | |||||
| Синтез | R3 | RS | R8 | R9 | Y |
| 3.1 | -CH3 | Br | Cl | Cl | Cl |
| 3.2 | -CH3 | Cl | Cl | Cl | Cl |
| 3.3 | -CH2CH3 | Br | Cl | Cl | Cl |
| 3.4 | -CH3 | Cl | H | Cl | Cl |
| 3.5 | -CH3 | F | H | Cl | Cl |
| 3.6 | -CH3 | -OCH3 | H | Cl | Cl |
| 3.7 | -CH3 | -OCH3 | H | F | Cl |
| 3.8 | -CH3 | -OCH3 | Cl | Cl | Cl |
| 3.9 | -CH3 | -OCH3 | F | F | Cl |
4. Получение соединений формулы (II)
Синтез 4.1
Хлоргидрат [[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-метил-1Н-пиразол-3-ил]метил]амина.
(II), HCl: R2=H; R3=-CH3; R4=H; R5=4-Br; R6=H; R7=H; R8=4-Cl; R9=2-Cl.
К раствору 20 г соединения, полученного в синтезе 3.1, в 200 мл хлороформа добавляют 7 г гексаметилентетрамина и оставляют перемешиваться на 5 дней при TA. Затем добавляют 50 мл эфира, отжимают образовавшийся осадок и сушат его. Осадок вводят в 50 мл EtOH, добавляют 15 мл концентрированной HCl и нагревают до 50°C в течение 5 часов. Отфильтровывают белую нерастворимую фракцию и фильтрат концентрируют в вакууме. Остаток вводят в эфир, органическую фазу промывают 50 мл 5N NaOH, сушат над Na2SO4 и растворитель выпаривают в вакууме. Остаток вводят в 2N раствор солянокислого эфира, образованный осадок отжимают, промывают его эфиром и сушат. Получено 14,37 г ожидаемого продукта.
Синтез 4.2
Хлоргидрат [[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метил]амина.
(II), HCl: R2=H; R3=-CH3; R4=H; R5=4-Cl; R6=H; R7=H; R8=4-Cl; R9=2-Cl.
Это соединение получают в соответствии с порядком проведения синтеза, описанным в синтезе 4.1, исходя из 25 г соединения, полученного в синтезе 3.2, в 150 мл хлороформа, 9 г гексаметилентетрамина, 100 мл эфира, 250 мл EtOH и 30 мл концентрированной HCl. Получено 24 г ожидаемого продукта.
Синтез 4.3
Хлоргидрат [[5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этил-1Н-пиразол-3-ил]метил]амина.
(II), HCl: R2=H; R3=-CH2CH3; R4=H; R5=4-Br; R6=H; R7=H; R8=4-Cl; R9=2-Cl.
К раствору 9 г соединения, полученного в синтезе 3.3, в 100 мл хлороформа добавляют 2,9 г гексаметилентетрамина и оставляют перемешиваться на 10 дней при TA. Затем добавляют 50 мл эфира, оставляют перемешиваться на 10 минут, реакционную смесь вдвое концентрируют в вакууме, добавляют 50 мл эфира и образованный осадок отжимают. Осадок вводят в 50 мл EtOH, добавляют 15 мл концентрированной HCl и кипятят с обратным холодильником в течение 2 часов. Отфильтровывают нерастворимую белую фракцию и фильтрат концентрируют в вакууме. Остаток экстрагируют эфиром, органическую фазу промывают 20 мл 1N NaOH, насыщенным раствором NaCl, сушат над Na2SO4 и растворитель выпаривают в вакууме. Остаток вводят в 2N раствор солянокислого эфира и образованный осадок отжимают. Получено 8,5 г ожидаемого продукта.
Следуя порядкам проведения синтеза, описанным выше в синтезах 4, получают соединения формулы (II), приведенные ниже в таблице IV.
| Таблица IV | |||||
| Синтез | R2 | R3 | R5 | R8 | R9 |
| 4.1 | H | -CH3 | Br | Cl | Cl |
| 4.2 | H | -CH3 | Cl | Cl | Cl |
| 4.3 | H | -CH2CH3 | Br | Cl | Cl |
| 4.4 | H | -CH3 | Cl | H | Cl |
| 4.5 | H | -CH3 | F | H | Cl |
| 4.6 | H | -CH3 | -OCH3 | H | Cl |
| 4.7 | H | -CH3 | -OCH3 | H | F |
| 4.8 | H | -CH3 | -OCH3 | Cl | Cl |
| 4.9 | H | -CH3 | -OCH3 | F | F |
5. Получение соединений формулы (III)
Циклогексансульфонилхлорид.
Смесь 25 г циклогексантиола в 83 мл уксусной кислоты и 4 мл воды охлаждают до 0°С, затем барботируют в тече