Новые производные пиридина, способ их получения и содержащая их фармацевтическая композиция
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным пиридина или их фармацевтически приемлемым солям общей формулы 1:
где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, амино, C1-С6низший алкил, С2-С6низший алкенил, C1-С3низший алкокси, C1-С10алкиламино, С4-С9циклоалкиламино, С4-С9гетероциклоалкиламино, C1-С10аралкиламино, ариламино, ациламино, насыщенный гетероциклил, ацилокси, арил, гетероарил, C1-С10аралкил, арилокси; Х представляет собой атом кислорода или серы; Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода; вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы; вышеуказанные гетероарильные и насыщенные гетероциклические группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота и атома серы; или конденсированное гетероциклическое кольцо; и вышеуказанные арильные и гетероарильные группы являются такими, что от 1 до 4 заместителей, выбранных из группы, включающей галоген, C1-С6низший алкил, C1-С6низший алкокси, являются замещенными, причем упомянутые соединения или их фармацевтически приемлемая соль формулы 1 не являются следующими соединениями
6-метил-3,4-дигидро-пирано [3,4-с]пиридин-1-он, 5-винил-3,4-дигидро-пирано[3,4-с]пиридин-1-он, 6-метил-8-фуран-2-ил-3,4-дигидропирано [3,4-с]пиридин-1-он,
3-трет-бутил-5,6,7,8-тетрагидро-[2,7]нафтиридин-8-он и диметиловый эфир (3S)-6,8-диметил-1-оксо-1,2,3,4-тетрагидро-[2,7]нафтиридин-3,5-дикарбоновой кислоты.
Эти соединения обладают ингибирующим действием в отношении образования цитокинов, которые включены в воспалительные реакции, таким образом могут быть использованы в качестве терапевтических средств для лечения заболеваний, относящихся к воспалениям, иммунным заболеваниям, хроническим воспалениям, а также средствам, обладающим противовоспалительным и болеутоляющим действием. Кроме того, настоящее изобретение относится к способам получения вышеуказанных веществ и фармацевтической композиции, содержащей вышеуказанные вещества. 9 н. и 12 з.п. ф-лы, 9 табл.
Реферат
Область техники изобретения
Настоящее изобретение относится к новым производным пиридина, обладающим ингибиторной активностью в отношении продуцирования цитокинов, которые, как известно, вовлечены в воспалительные реакции, и поэтому указанные производные могут быть использованы в качестве терапевтических средств при лечении заболеваний, связанных с воспалением, иммунным, хроническим воспалением, а также в качестве средства, обладающего противовоспалительным и анальгезирующим действием. Кроме того, настоящее изобретение относится к способу получения вышеуказанных производных и к содержащей их фармацевтической композиции.
Предпосылки изобретения
Воспалительная реакция, защитный механизм организма состоит из крайне сложной передачи биологических сигналов, запускаемой при иммунологическим восприятием воспалений или поражений и вызываемой различными цитокинами воспаления. Обычно заболевание, разрушающее нормальные ткани в результате расстройств при такой воспалительной реакции, называют “воспалительным заболеванием” и для выяснения деталей этого механизма по всему миру проводились обширные исследования. Кроме того, повышение количества воспалительных цитокинов связано с различными аутоиммунными заболеваниями.
Система передачи сигналов, связанная с воспалением, представляет собой серии цепных реакций фосфорилирование-дефосфорилирование и, в основном, делится на три стадии: 1) начальная стадия передачи воспалительного сигнала в биомембране с биомембранным рецептором, запуская таким образом серию цепных реакций передачи сигналов; 2) терминальная стадия контроля экспрессии генов, кодирующих белок, связанный с воспалением, с помощью транскрипционных факторов ядра; и 3) промежуточная стадия, которая включает серию цепных реакций передачи сигналов, которая является звеном между начальной стадией и терминальной стадией.
Примерами хорошо известного воспалительного сигнального фактора в начальной стадии являются фактор некроза опухоли (TNF; также называемый TNF-α) и интерлейкин-1 (IL-1). Примерами хорошо известного воспалительного сигнального фактора в терминальной стадии являются активирующий белок-1 (AP-1; активирующий белок-1), транскрипционный фактор каппа B ядра (NFκB) и фактор активированных T-клеток ядра (NFAT). Цепные реакции в промежуточной стадии не достаточно изучены, но очевидно, что липокортин, циклооксигеназа-1,2 и PLA2 включены в эту стадию.
Что касается факторов воспаления, то TNF-α, продуцируемый, главным образом, активированными макрофагами и T-клетками, является наиболее эффективным цитокином и стимулирует продуцирование других таких воспалительных цитокинов, как IL-1, IL-6 и IL-8, а также продукцию таких транскрипционных факторов, как NK-κB и с-jun/Ap-1. На самом деле, TNF-α связан с развитием воспалительных заболеваний или таких иммунных заболеваний, как токсический шок, инсулинозависимый сахарный диабет, рассеянный склероз, ревматоидный артрит, остеоартрит, болезнь Крона и язвенный колит. В частности, TNF-α также связан с хроническими воспалительными заболеваниями, такими как псориатический артрит, псориаз, анкилозирующий спондилит, болезнь Стилла у взрослых, полимиозит, дерматомиозит и васкулит, такой как болезнь Бехчета и грануломатоз Вегенера. IL-1 также представляет собой сильный воспалительный цитокин, сопоставимый с TNF-α и усиливающий экспрессию таких генов, как PLA2 2, COX-2 и iNOS, и в результате, повышает продукцию PAF, PGE2 и NO, таким образом индуцируя воспалительные реакции. IL-1α и IL-1β оба связаны с аутоиммунными заболеваниями, такими как ревматоидный артрит и инсулинозависимый сахарный диабет. IL-1β, подобно TNF-α, также является важным медиатором септического шока и сердечно-легочной недостаточности, острого респираторного синдрома и полиорганной недостаточности. IL-6 представляет собой многофункциональный цитокин, продуцируемый различными клетками, и связан с заболеваниям, таким как множественная миелома, псориаз, постклимактерический остеопороз, травма ЦНС, вирусный и бактериальный минингит, болезнь Кастлемана, гломерулонефрит, деменция при СПИДе, некоторые нервные заболевания, такие как болезнь Альцгеймера, специфическая лейкемия и системная красная волчанка. IFN-γ первоначально продуцируется T-клетками и NK-клетками и связан с реакцией “трансплантат против хозяина”, астмой и другими воспалительными заболеваниями, такими как атопическое заболевание. Кроме того, IL-8 связан с такими заболеваниями, как инсульт, инфаркт миокарда, острый респираторный дистресс синдром, посттравматическое полиорганное поражение, острый гломерулонефрит, дерматит, гнойный менингит или другие поражения ЦНС, парагемодиализ и некротический энтероколит.
Кроме того, простагландины, как известно, играют важную роль в воспалительной реакции. Ингибирование продукции простагландинов, главным образом, PGG2, PGH2 и PGE2, играет основную роль в разработке противовоспалительных средств. Например, продукция простагландинов может быть ингибирована путем ингибирования циклооксигеназы (COX), которая индуцирована воспалительными цитокинами. Следовательно, продукция простагландинов может быть ингибирована путем ингибирования цитокинов.
Таким образом, как указано выше, уменьшение количества цитокинов может быть эффективным способом лечения воспалительных заболеваний, а также иммунных заболеваний.
Недавно авторам настоящего изобретения удалось синтезировать производные пиридина с новой структурой, также они обнаружили, что эти новые производные ингибируют продукцию цитокинов, вовлеченных в воспалительные реакции, в частности, что они обладают превосходным ингибирующим действием в отношении продукции TNF-α, IL-1, IL-6, IFN-γ и PGE2. Таким образом, авторы настоящего изобретения обнаружили, что новые соединения, синтезированные ими, обладают превосходным терапевтическим действием в отношении таких заболеваний, как воспалительные заболевания, иммунные заболевания и хронические воспалительные заболевания, а также могут использоваться в качестве средств, обладающих противовоспалительным и анальгезирующим действием, и, таким образом, осуществили настоящее изобретение.
Следовательно, в предпочтительном варианте осуществления, настоящее изобретение относится к новым производным пиридина.
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу получения вышеуказанных производных пиридина.
Еще в другом предпочтительном варианте осуществления настоящее изобретение относится к фармацевтической композиции, которая может использоваться для лечения таких заболеваний, вызванных цитокинами, как воспалительные заболевания, иммунные заболевания, хронические воспалительные заболевания, и также может использоваться в качестве противовоспалительного и анальгезирующего средства.
Подробное описание изобретения
Настоящее изобретение относится к производным пиридина, представленным следующей формулой 1, и их фармацевтически приемлемым солям
где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, циано, нитро, ацил, гидрокси, амино, C1-C6низший алкил, C2-C6низший алкенил, C1-C6низший алкокси, C1-C6алкилтио, C1-C10алкиламино, C4-C9циклоалкиламино, C4-C9гетероциклоалкиламино, C1-C10аралкиламино, ариламино, ациламино, насыщенную гетероциклическую группу, ацилокси, C1-C6алкилсульфинил, C1-C6алкилсульфонил, C1-C6алкилсульфониламино, арилсульфинил, арилсульфонил, арилсульфониламино, арил, гетероарил, C1-C10аралкил, C1-C10гетероаралкил, арилокси и гетероарилокси группу; или R1, R2, R3, R4, R5, R6 и R7 независимо образуют кольцо путем связывания с соседней группой заместителя;
X представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода, C1-C6низший алкил, ацил, арил, гетероарил, C1-C10аралкил и C1-C10гетероаралкильную группу; или образует кольцо путем связывания с соседней группой заместителя R6 или R7;
вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы;
вышеуказанные гетероарильная и насыщенная гетероциклическая группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 3 гетероатомов, выбранных из атома кислорода, азота и серы; или конденсированное гетероциклическое кольцо; и
вышеуказанные арильная и гетероарильная группы являются такими, что от 1 до 4 групп заместителей, выбранных из группы, включающей галоген, гидрокси, C1-C6низший алкил, низший C1-C6алкокси, амино, циано, нитро, карбонил и карбоксильную группу, являются замещенными.
Производные пиридина, представленные вышеуказанной формулой 1, могут образовывать фармацевтически приемлемые соли путем взаимодействия с кислотой, такой как соляная кислота, бромистая кислота, серная кислота, фосфорная кислота, метансульфоновая кислота, уксусная кислота, лимонная кислота, фумаровая кислота, молочная кислота, малеиновая кислота, янтарная кислота и винная кислота.
Кроме того, производные пиридина, представленные вышеуказанной формулой 1, могут образовывать фармацевтически приемлемые соли путем взаимодействия с ионами такого щелочного металла, как натрий и калий, или ионом аммония. Таким образом, новые соединения, полученные в соответствии с настоящим изобретением, охватывают также фармацевтически приемлемые соли производных пиридина, представленных вышеуказанной формулой 1.
В предпочтительном варианте осуществления настоящего изобретения производные пиридина, представленные вышеуказанной формулой 1, являются такими, как указано далее:
таким образом, в вышеуказанной формуле 1, R1, R2 и R3 независимо выбраны из группы, включающей атом водорода, галоген, гидрокси, C1-C6низший алкил, C2-C6низший алкенил, C1-C6низший алкокси, арилокси, амино, C1-C6алкиламино,
C1-C10аралкиламино, ариламино, ациламино, насыщенную гетероциклическую группу, арил, гетероарил и C1-C10гетероаралкильную группу; или соседние R2 и R3 образуют кольцо путем связывания друг с другом;
R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, C1-C6низший алкил и арильную группу; или R4, R5, R6 и R7 независимо образуют кольцо путем связывания с соседней группой заместителя;
X представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода, C1-C6низший алкил, арил и C1-C10аралкильную группу;
арильная группа представляет собой фенильную группу;
гетероарильная и насыщенная гетероциклическая группы выбраны из фурана, тиофена, пиридина, пиперидина, пиперазина, морфолина, пиролидина и бензодиоксола; и
арильная и гетероарильная группы являются такими, что от 1 до 4 групп заместителей, выбранных из группы, включающей галоген, гидрокси, C1-C6низший алкил, C1-C6низший алкокси, амино, циано, нитро, карбонил и карбоксильную группу, являются замещенными.
Более конкретно, производные пиридина, представленные вышеуказанной формулой 1, могут быть дополнительно определены следующим образом. То есть, производные пиридина, представленные вышеуказанной формулой 1, представляют собой:
3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
5-винил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6,8-дихлор-3,4-дигидропирано[3,4-c]пиридин-1-он,
6,8-дигидрокси-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
сложный эфир 6-метил-1-оксо-3,4-дигидро-1H-пирано-[3,4-c]пиридин-8-илуксусной кислоты,
8-метокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6,8-диметил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-тиофен-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-пиридин-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-фторфенил)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-хлорфенил)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-морфолин-4-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-(4-метилпиперазин-1-ил)-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-(4-пиримидин-2-илпиперазин-1-ил)-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-фторфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-хлорфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-трифторметилфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-п-толиламино-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фениламино-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фенетиламино-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-[(бензо[1,3]диоксол-5-илметил)амино]-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фенокси-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-бензиламино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-метоксибензиламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-амино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-ацетамидо-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-бензамидо-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-хлор-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-метил-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
сложный эфир 1-оксо-6-фенил-3,4-дигидро-1H-пирано-[3,4-c]пиридин-8-илуксусной кислоты,
8-метокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-метиламино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-диметиламино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-фенил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-морфолин-4-ил-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-фенил-8-пиролидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-фторфениламино)-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-метоксибензиламино)-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-амино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-ацетамидо-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-бензамидо-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-гидрокси-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-хлор-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-метил-6-(тиофен-2-ил)-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-(фуран-2-ил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-(бензо[d][1,3]диоксол-6-ил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-(4-(диметиламино)фенил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-хлор-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-пропил-6-хлор-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-морфолин-4-ил-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
сложный эфир 1-оксо-6-пропил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-илуксусной кислоты
8-(4-метоксибензиламино)-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-амино-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
N-(1-оксо-6-пропил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-ил)ацетамид,
3,4-дигидро-2-окса-аза-фенантрен-1-он,
3,4-дигидропирано[3,4-c]пиридин-1-тион,
2-(4-метоксибензил)-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
3,4-дигидро-2H-[2,7]нафтиридин-1-он,
2-бензил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
3-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
3-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
8-метил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
2,8-диметил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
2-бензил-8-метил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
6-циклогексил-8-гидрокси-3,4-дигидропирано[3,4-c]пиридин-1-он,
метиловый эфир 6-циклогексил-1-оксо-3,4-дигидро-1H-пирано-[3,4-c]пиридин-8-илуксусной кислоты,
8-хлор-6-циклогексил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-циклогексил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-циклогексил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-амино-6-циклогексил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
метиловый эфир 6-изопропил-1-оксо-3,4-дигидро-1H-пирано-[3,4-c]пиридин-8-илуксусной кислоты,
8-хлор-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-изопропил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-c]пиридин-1-он; и
их фармацевтически приемлемые соли.
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу получения производных пиридина, представленных вышеуказанной формулой 1.
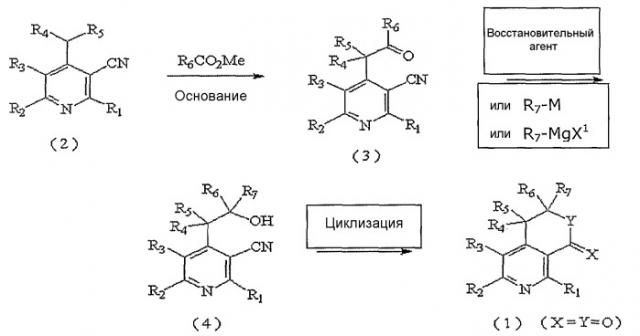
Производные пиридина по настоящему изобретению, представленные вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода, могут быть получены 3-мя различными способами в соответствии со следующими реакционными схемами 1, 2 и 3.
На реакционной схеме 1 вкратце показан первый способ получения производных пиридина по настоящему изобретению, представленных вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
Схема 1
На вышеуказанной реакционной схеме 1, R1, R2, R3, R4, R5, R6,
R7, X и Y являются такими, как определено выше, и M представляет собой атом щелочного металла, и X1 представляет собой атом галогена.
Соединение, представленное вышеуказанной формулой 2, которое используется в качестве исходного продукта в вышеописанном способе, может быть легко получено известным способом (J. Org. Chem., Vol. 41, No. 15,2542,1976; Pharmazie, 38(9), 591,1983)).
В соответствии со способом, показанным на вышеуказанной реакционной схеме 1, соединение, представленное вышеуказанной формулой 2, сначала растворяют в безводном инертном апротонном растворителе, после добавления по каплям основания, перемешивают при температуре от около -100°C до около -40°C, снова по каплям добавляют алкиловый эфир, предпочтительно, метиловый эфир (R6COOMe), и оставляют взаимодействовать от около 2 до около 8 часов при температуре от -78°C до комнатной и получают соединение, представленное вышеуказанной формулой 3.
В вышеуказанной реакции используемый апротонный растворитель включает: тетрагидрофуран (ТГФ), диэтиловый эфир, диоксан и, предпочтительно, ТГФ. Примеры используемого основания включают: бис(триметилсилил)амид лития (LHMDS), бис(триметилсилил)амид калия (KHMDS), диизопропиламид лития (LDA), гидрид натрия (NaH), гидрид калия (KH) и гидрид лития (LiH), и, предпочтительно, LHMDS.
Далее, к соединению вышеуказанной формулы 3 добавляют восстановитель или металлический реагент, содержащий R7, и оставляют взаимодействовать при температуре от 0°C до комнатной при перемешивании от 6 до 12 часов и получают соединение спирта, представленное вышеуказанной формулой 4.
Примеры используемого восстановителя включают боргидрид натрия (NaBH4) или боргидрид лития (LiBН4).
Примеры используемого металлического реагента, содержащего R7, включают реагент щелочного металла, представленный формулой R7M, или реагент Гриньяра, представленный формулой R7MgX1, где R7 является таким же, как определено выше, M представляет собой щелочной металл, такой как литий, калий и натрий, X1 представляет собой атом галогена.
Далее, спиртовое соединение, представленное вышеуказанной формулой 4, подвергают циклизации нагреванием с обратным холодильником от 6 до 12 часов в присутствии концентрированной HCl, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
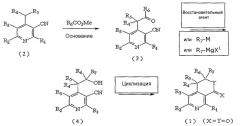
На следующей реакционной схеме 2 вкратце показан второй способ получения соединения, представленного вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
Схема 2
На вышеописанной реакционной схеме 2, R1, R2, R3, R4, R5, R6, R7, X и Y являются такими, как определено выше.
В соответствии со способом, показанным на вышеописанной реакционной схеме 2, соединение, представленное вышеуказанной формулой 2, сначала подвергают взаимодействию с алкилкарбонильным соединением, представленным R6COR7 (R6 и R7 являются такими, как определено выше), вместе с основанием в присутствии безводного инертного апротонного растворителя, и получают соединение, представленное вышеуказанной формулой 4.
В вышеописанной реакции примеры апротонного растворителя включают: тетрагидрофуран (ТГФ), диэтиловый эфир и диоксан, и, предпочтительно, ТГФ.
Примеры используемого основания включают: бис(триметилсилил)амид лития (LHMDS), бис(триметилсилил)амид калия (KHMDS), диизопропиламид лития (LDA), гидрид натрия (NaH), гидрид калия (KH) и гидрид лития (LiH), и, предпочтительно, LHMDS.
Далее, спиртовое соединение, представленное вышеуказанной формулой 4, подвергают циклизации аналогичным образом, как показано выше на реакционной схеме 1, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляет собой атом кислорода.
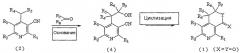
На следующей реакционной схеме 3 вкратце показан третий способ получения соединения, представленного вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
Схема 3
На вышеописанной реакционной схеме 3, R1, R2, R3, R4, R5, X и Y являются такими, как определено выше, и X1 представляет собой атом галогена.
В соответствии со способом, показанным на вышеуказанной реакционной схеме 3, соединение, представленное вышеуказанной формулой 2, сначала подвергают взаимодействию с алкоксиметильным соединением, представленным ROCH2X1 (R представляет собой C1-C6низший алкил, арил или аралкильную группу, предпочтительно, метил, этил или бензильную группу, X1 представляет собой атом галогена), вместе с основанием в присутствии безводного инертного апротонного растворителя, и получают соединение, представленное вышеуказанной формулой 7.
В вышеописанной реакции примеры апротонного растворителя включают: тетрагидрофуран (ТГФ), диэтиловый эфир и диоксан, и, предпочтительно, ТГФ.
Примеры используемого основания включают: бис(триметилсилил)амид лития (LHMDS), бис(триметилсилил)амид калия (KHMDS), диизопропиламид лития (LDA), гидрид натрия (NaH), гидрид калия (KH) и гидрид лития (LiH), и, предпочтительно, LHMDS.
Далее, соединение, представленное вышеуказанной формулой 7, подвергают циклизации аналогичным образом, как показано выше на реакционной схеме 1, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
На следующей реакционной схеме 3 вкратце показан третий способ получения соединения, представленного вышеуказанной формулой 1, где R6 и R7, каждый в отдельности, представляют собой атом водорода, и X и Y, каждый в отдельности, представляют собой атом кислорода.
Производные пиридина по настоящему изобретению, представленные вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8, могут быть получены 4-мя различными способами в соответствии со следующими реакционными схемами 4, 5, 6 и 7.
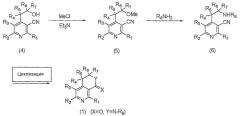
На реакционной схеме 4 вкратце показан первый способ получения производных пиридина по настоящему изобретению, представленных вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
Схема 4
На вышеописанной реакционной схеме 4, R1, R2, R3, R4, R5, R6, R7, R8, X и Y являются такими, как определено выше.
В соответствии со способом, показанным на вышеописанной реакционной схеме 4, соединение, представленное вышеуказанной формулой 4, сначала подвергают взаимодействию с метансульфонилхлоридом (MsCl) или п-толуолсульфонилхлоридом вместе с основанием, таким как пиридин или триэтиламин (Et3N), в присутствии органического растворителя, и получают соединение, представленное вышеуказанной формулой 5.
В вышеописанной реакции предпочтительные примеры органического растворителя представляют собой метиленхлорид (CH2Cl2) или хлороформ (CHCl3).
Далее, соединение, представленное вышеуказанной формулой 5, подвергают взаимодействию с соединением амина, представленным R8NH2, где R8 является таким же, как определено выше, с получением соединения, представленного вышеуказанной формулой 6, которое затем циклизуют в кислой среде, например в спиртовом растворе, содержащем соляную кислоту или серную кислоту, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
На следующей реакционной схеме 5 вкратце показан второй способ получения соединения, представленного вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
Схема 5
На вышеописанной реакционной схеме 5, R1, R2, R3, R4, R5, R6, R7, R8, X и Y являются такими, как определено выше.
В соответствии со способом, показаным на вышеуказанной реакционной схеме 5, соединение, представленное вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляет собой атом кислорода, сначала подвергают взаимодействию с соединением амина, представленного R8NH2, где R8 является таким же, как определено выше, с получением соединения вышеуказанной формулы 8, которое затем циклизуют, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
В вышеописанной реакции циклизацию выполняют взаимодействием с трифенилфосфином и диэтилазодикарбоксилатом в присутствии органического растворителя, такого как тетрагидрофуран.
На следующей реакционной схеме 6 вкратце показан третий способ получения соединения, представленного вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
На вышеописанной реакционной схеме 6, R1, R2, R3, R4, R5, R6, R7, R8, X и Y являются такими, как определено выше, и R9 представляет собой бензильную или 4-метоксибензильную группу.
В соответствии со способом, показанным на вышеуказанной реакционной схеме 6, соединение, представленное вышеуказанной формулой 1, где R9 представляет собой бензильную или 4-метоксибензильную группу, сначала подвергают восстановлению с помощью катализатора на основе палладия в присутствии спиртового растворителя, или подвергают взаимодействию с кислотным реагентом, таким как п-толуолсульфоновая кислота или трифторацетат, в присутствии органического растворителя, такого как толуол или метиленхлорид, с получением соединения вышеуказанной формулы 1, которое затем циклизуют и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой NH.
Далее, вышеуказанное соединение формулы 1, где X представляет собой атом кислорода и Y представляет собой NH, подвергают взаимодействию с алкилирующим агентом, представленным R8X (R8 является таким же, как определено выше и X представляет собой атом галогена), вместе с таким основанием, как гидрид натрия, гидрид калия, гидрид лития, карбонат калия и карбонат натрия, в присутствии такого органического растворителя, как тетрагидрофуран или диметилформамид, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
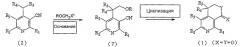
На следующей реакционной схеме 7 вкратце показан четвертый способ получения производного пиридина, представленного вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
Схема 7
На вышеописанной реакционной схеме 7, R1, R2, R3, R4, R5, R8, X и Y являются такими, как определено выше, и X1 представляет собой атом галогена.
В соответствии со способом, показанным на вышеописанной реакционной схеме 7, соединение, представленное вышеуказанной формулой 1, где R5 представляет собой атом водорода, сначала подвергают взаимодействию с N,N-диметилформамиддиметилацеталем в присутствии апротонного растворителя, такого как тетрагидрофуран или диметилформамид, и получают соединение, представленное вышеуказанной формулой 9, которое затем циклизуют в кислой среде, такой как серная кислота или уксусная кислота, и получают соединение, представленное вышеуказанной формулой 10.
Далее, вышеуказанное соединение, представленное формулой 10, подвергают взаимодействию с алкилирующим реагентом, представленным R8X1 (R8 является таким же, как определено выше и X1 представляет собой атом галогена), вместе с основанием, таким как гидрид натрия, гидрид калия, гидрид лития, карбонат калия и карбонат натрия, в присутствии органического растворителя, такого как тетрагидрофуран или диметилформамид, и получают соединение, представленное вышеуказанной формулой 11.
Далее, вышеуказанное соединение, представленное формулой 11, подвергают восстановлению с помощью катализатора на основе палладия и газообразного водорода в присутствии спиртового растворителя и получают соединение, представленное вышеуказанной формулой 1, где R5, R6 и R7, каждый в отдельности, представляет собой атом водорода, X представляет собой атом кислорода и Y представляет собой N-R8.
Между тем, в соответствии с вышеуказанной реакционной схемой 7, когда вышеуказанное соединение, представленное формулой 1, подвергают восстановлению с помощью катализатора на основе палладия и газообразного водорода в присутствии спиртового растворителя, также получают соединение вышеописанной формулы 1, где R5, R6 и R7, каждый в отдельности, представляет собой атом водорода, X представляет собой атом кислорода и Y представляет собой N-R8.
Далее, вышеуказанное соединение, представленное формулой 1, где Y представляет собой NH, подвергают взаимодействию с алкилирующим агентом, представленным R8X1 (R8 является таким же, как определено выше и X1 представляет собой атом галогена), вместе с таким основанием, как гидрид натрия, гидрид калия, гидрид лития, карбонат калия и карбонат натрия, в присутствии такого органического растворителя, как тетрагидрофуран или диметилформамид, и получают соединение, представленное вышеуказанной формулой 1, где R5, R6 и R7, каждый в отдельности, представляет собой атом водорода, X представляет собой атом кислорода и Y представляет собой N-R8.
На следующей реакционной схеме 8 вкратце показан способ одновременного получения производных пиридина, представленных вышеуказанной формулой 1, где R5 представляет собой атом водорода и X и Y, каждый в отдельности, представляют собой атом кислорода, а также производных пиридина, представленных вышеуказанной формулой 1, где R5 представляет собой атом водорода, X представляет собой атом кислорода, X представляет собой атом кислорода и Y представляет собой NH.
Схема 8
На вышеописанной реакционной схеме 8, R1, R2, R3, R4, R6, R7, X и Y являются такими, как определено выше.
В соответствии со способом, показанным на вышеописанной реакционной схеме 8, соединение, представленное вышеуказанной формулой 4, где R5 представляет собой атом водорода, сначала подвергают взаимодействию с таким основанием, как гидроксид натрия, гидроксид калия, карбонат натрия и карбонат калия, в присутствии спиртового растворителя и получают соединение, представленное вышеуказанной формулой 12.
Затем вышеуказанное соединение, представленное формулой 12, подвергают циклизации в кислой среде, такой как фосфорная кислота, и одновременно получают производные пиридина, представленные вышеуказанной формулой 1, где R5 представляет собой атом водорода и X и Y каждый в отдельности представляет собой атом кислорода, а также производные пиридина, представленные вышеуказанной формулой 1, где R5 представляет собой атом водорода, X представляет собой атом кислорода и Y представляет собой NH.
На следующей реакционной схеме 9 вкратце показан способ получения производных пиридина, представленных вышеуказанной формулой 1, где X представляет собой атом серы, Y представляет собой атом кислорода или N-R8.
Схема 9
На вышеописанной реакционной схеме 9, R1, R2, R3, R4, R6, R7, R8, X и Y являются такими, как определено выше.
В соответствии со способом, показанным на вышеописанной реакционной схеме 9, соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода, подвергают взаимодействию с сульфирующим реагентом, например, реагентом Лавессона (Lawesson), при относительно высокой температуре и легко получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом серы.
Далее, из производных пиридина по настоящему изобретению, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой амино, С1-С10алкиламино, C4-C9циклоалкиламино, C4-C9гетероциклоалкиламино, ариламино, ациламино, C1-C6алкилсульфониламино и арилсульфониламино группу, может быть получено следующим способом. Так, соединение, представленное формулой 1, где R1,
R2 или R3, каждый в отдельности, представляют собой атом галогена, может быть преобразовано в соединение, представленное формулой 1, где R1, R2 или R3 представляют собой амино, C1-C10алкиламино, C4-C9циклоалкиламино, C4-C9гетероциклоалкиламино, ариламино, ациламино, C1-C6алкилсульфониламино и арилсульфониламино группу, взаимодействием его с соответствующим соединением амина в присутствии органического растворителя. В вышеуказанной реакции аминирования в качестве катализатора реакции предпочтительно использовать триэтиламин и в качестве реакционного растворителя этанол или ацетонитрил.
Кроме того, из производных пиридина по настоящему изобретению, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой бензиламино или 4-метоксибензиламино, может быть преобразовано в соединение, представленное формулой 1, где R1, R2 или R3 представляют собой амины, восстановлением. Вышеуказанное восстановление может быть проведено с использованием катализатора на основе палладия в присутствии спиртового растворителя, или, альтернативно, с использованием кислотного реагента, такого как п-толуолсульфоновая кислота или трифторуксусная кислота, в присутствии органического растворителя, такого как толуол или метиленхлорид.
Далее, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой аминогруппы, может быть пребразовано в соединение, представленное формулой 1, где R1, R2 или R3 представляют собой ациламино, C1-C6алкилсульфониламино или арилсульфониламино группу. Вышеуказанные реакции ацилирования или сульфонилирования могут быть выполнены с использованием ацилирующего агента или сульфонирующего агента вместе с таким основанием, как триэтилам