Пищевой продукт и напиток, модулирующий кишечную флору человека, пищевые добавки, способы их получения и применения препаратов арабиноксилана
Иллюстрации
Показать всеНастоящее изобретение относится к пищевой промышленности и касается применения препаратов арабиноксилана в качестве пребиотических пищевых добавок в составе пищевых продуктов и напитков. Пищевой продукт или напиток, модулирующий кишечную флору человека, содержит пищевую добавку, включающую 0,25-5 г арабиноксиланов на порцию. При этом указанные арабиноксиланы имеют среднюю степень полимеризации (DP) от 5 до 50. Пищевая добавка для получения пищевого продукта или напитка может содержать, по меньшей мере, 15% арабиноксиланов, имеющих DP от 7 до 20. Причем арабиногалактаны имеют среднюю DP, равную 6, если отношение арабинозы к ксилозе (А/Х) составляет 0,4, или арабиногалактаны имеют среднюю DP, равную 8, если отношение А/Х составляет 0,5. Представлены также способы получения пищевой добавки на основе арабиногалактанов. Изобретение позволяет получить продукты с высоким бифидогенным эффектом. 8 н. и 25 з.п. ф-лы, 16 ил., 7 табл.
Реферат
Настоящее изобретение относится к применению препаратов арабиноксилана в качестве пребиотических пищевых добавок и к способам улучшения состояния желудочно-кишечного тракта людей посредством дополнения их рациона упомянутыми добавками. В предпочтительном варианте осуществления препараты арабиноксилана получены из натуральных источников, таких как растительный материал, и более предпочтительно из зерновых культур.
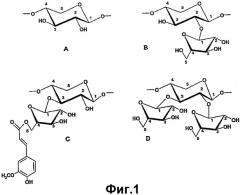
Изобретение касается положительного влияния пищевых продуктов с данными некрахмальными полисахаридами (NSP) на состояние желудочно-кишечного тракта и, конкретнее, на микробиоту кишечника. NSP включают ряд соединений, обладающих различными физико-химическими свойствами. Арабиноксиланы, также называемые пентозанами, являются важной группой NSP зерновых культур и состоят из главной цепи из β-1,4-связанных групп D-ксилопиранозила, с которыми связаны О-2 и/или О-3 группы α-L-арабино-фуранозила. В типичном арабиноксилане встречаются незамещенные, монозамещенные и двузамещенные остатки ксилозы (см. фиг.1). Арабиноксиланы бывают либо экстрагируемые водой, либо неэкстрагируемые водой. Последние могут быть частично солюбилизированы в условиях щелочной среды или с помощью применения энзимов и связывания больших количеств воды. Экстрагируемые водой арабиноксиланы имеют необычный потенциал формирования вязкости. В целом, в зависимости от источника и способа экстракции, они имеют очень высокую молекулярную массу (до 800000 дальтон). Несмотря на то, что они являются только вспомогательными компонентами, они важны для функциональности зерновых культур в биотехнологических процессах, таких как продукция пшеничного крахмала, пасты и пива, хлебопекарное производство и в других областях пищевой промышленности.
Было показано, что некоторые типы олигосахаридов, полученных из арабиноксилана или ксилана (незамещенный полимер β-1,4-связанных групп D-ксилопиранозила), обладают пребиотическими свойствами. Пребиотиками являются соединения, обычно негликозидные олигосахариды, которые не могут быть переварены ферментами верхнего отдела желудочно-кишечного тракта, но селективно ферментируются некоторыми типами кишечных бактерий в толстой кишке (Gibson and Roberfroid, 1995; Roberfroid, 1988; Van Loo, 2004). Наличие пребиотиков в рационе вызывает сдвиг в составе популяции бактерий кишечника, обычно характеризующийся относительным повышением видов Lactobacillus и Bifidobacterium. Этому сдвигу микробиоты кишечника сопутствует улучшение общего самочувствия, уменьшение кишечных инфекций, повышение уровня короткоцепочечных жирных кислот в кишечнике, лучшая адсорбция минералов и подавление инициирования рака толстой кишки (Van Loo, 2004). Было показано, что препараты ксило-олигосахаридов (XOS, олигосахариды, состоящие из β-1,4-связанных групп D-ксилопиранозила) с преобладанием олигосахаридов со степенью полимеризации (DP) 2-3 (ксилобиоза и ксилотриоза) вызывают значительное повышение уровня бифидобактерий в фекалиях и слепой кишке крыс (EP 0265970B1; Campbell et al., 1997; Hsu et al., 2004) и толстой кишке людей (Okazaki et al., 1990). Подобные богатые ксилобиозой препараты XOS также подавляют ранние симптомы химически индуцированного канцерогенеза в толстой кишке у крыс (Hsu et al., 2004) и повышают всасывание кальция (Toyoda et al., 1993). Также показано, что препарат, состоящий преимущественно из арабиноксило-олигосахаридов (AXOS) с DP 3-5 (арабиносилксилобиоза, арабиносилксилотриоза, арабиносилксилотетраоза и диарабиносилксилотетраоза), повышает уровень бифидобактерий в кишечнике крыс и мышей (Yamada et al., 1993).
Основным недостатком современных коммерческих препаратов XOS, сильно ограничивающим их коммерческий потенциал, является их очень высокая цена по сравнению с другими олигосахаридами, указывающая на то, что современные производственные процессы не эффективны. Описан способ производства пребиотических препаратов с преобладанием XOS с DP 2-3, включающий химическую экстракцию ксилана из продуктов на растительной основе (твердая древесина, сердцевина кукурузного початка, оболочка семени хлопчатника, пшеничные отруби или зерна, используемые для пивоварения), применяя растворы NaClO и высококонцентрированные растворы KOH, с последующим ферментативным гидролизом экстрагированного ксилана с помощью ферментов эндоксиланаз (EP 0265970B1). Подобный способ применялся для изготовления пребиотического препарата AXOS (препарат AXOS с DP 3-5) и включал химическую экстракцию арабиноксилана с применением концентрированного щелочного раствора, с последующим удалением солей ферментативным гидролизом эндоксиланазой и хроматографией на углеродной колонке (Yamada et al., 1993). Главный недостаток этих способов состоит в том, что химическая экстракция ксилана или арабиноксилана неблагоприятна для окружающей среды и требует дорогостоящего удаления химикатов с помощью экстенсивного диализа или ультрафильтрации, прежде чем может быть выполнен ферментативный гидролиз. Другой способ получения XOS или AXOS включает гидротермальный аутогидролиз твердой древесины или зерен, используемых для пивоварения. В этом способе суспензия растительного материала нагревается в специальном реакторе до 150-190°C в течение 20-60 минут (EP 0265970B1; Kabel et al., 2002; Carvalheiro et al., 2004). Недостаток этого способа состоит в том, что из-за высокой температуры реакции образуются побочные продукты, такие как фурфурол, гидроксиметилфурфурол и левулиновая кислота, присутствие которых в продуктах питания нежелательно (Carvalheiro et al., 2004).
Описанные в настоящее время пребиотические препараты XOS и AXOS имеют среднюю степень полимеризации, которая равна либо 2 (EP 0265970B1), либо 4 (Yamada et al., 1993). Для применения, в частности, в пищевой области эти препараты имеют некоторые недостатки. Во-первых, препараты богаты ксилозой, которая имеет сладкий вкус, приблизительно 60% сладости сахарозы (Suntory, xylo-oligosaccharide, brochure and product sheet, 2001). Для некоторых областей применения сладкий вкус может оказаться желательным, но для других областей применения более желателен более нейтральный вкус. Ксило-олигосахариды с низкой средней степенью полимеризации также имеют сладкий вкус, приблизительно 40% от сладкого вкуса сахарозы (Suntory, xylo-oligosaccharide, brochure and product sheet, 2001). Во-вторых, препараты с низкой средней степенью полимеризации имеют уровень энергии, который не желателен для компонентов низкокалорийных пищевых продуктов. Для вычисления величины энергии ксило-олигосахаридов, считается, что величина энергии на грамм метаболизируемой ксилозы составляет 4 калории, на грамм ксилобиозы и ксилотриозы составляет 2 калории и на грамм ксило-арабиноолигосахаридов с DP>4 составляет 0 калорий (Suntory, xylo-oligosaccharide, brochure and product sheet, 2001).
Настоящее изобретение касается пищевых добавок, включающих арабиноксиланы, которые полезным образом модулируют кишечную флору человека. Кроме того, изобретение касается некоторых продуктов питания и напитков, содержащих добавки, наряду со способами получения упомянутых добавок.
На чертежах:
Фиг.1: Структурные элементы арабиноксиланов. A: незамещенный остаток [β]-D-ксилопиранозила. B: Остаток [β]-D-ксилопиранозила, замещенный в O-2 молекулой [α]-L-арабинофуранозила. C: Остаток [β]-D-ксилопиранозила, замещенный в O-3 молекулой [α]-L-арабинофуранозила. D: Остаток [β]-D-ксилопиранозила, замещенный в O-2 и O-3 молекулами [α]-L-арабинофуранозила. Структура C показывает связь феруловой кислоты с О-5 молекулы [α]-L-арабинофуранозила.
Фиг.2: HPSEC профили молекулярных масс различных препаратов AXOS. Применялась колонка Shodex SB-806 HQ (300x8 мм, Showa, Denko K.K., Tokyo, Japan). Элюирующие объемы стандартного пуллулана с молекулярной массой 78,8×104, 40,4×104, 21,2×104, 11,2×104, 4,73×104, 2,28×104, 1,18×104, 0,59×104 Да и глюкозы (180 Да) обозначены слева направо символом "×".
Фиг.3: Распад составляющих моносахаридов AXOS-15-0,27 (A), Xylooligo-95P (B) и фрукто-олигосахаридов (C) в процентах в течение различного времени инкубации при 100°C при pH 2, 3, 7 и 11.
Фиг.4: Гидролиз AXOS-15-0,27 (A), Xylooligo-95P (B) и фрукто-олигосахаридов (C) в процентах в течение различного времени инкубации при 100°C при pH 2, 3 и 7.
Фиг.5: Гидролиз связей ксилозы (A) и связей арабинозы (B) в AXOS-15-0,27 в процентах в течение различного времени инкубации при 100°C при pH 2,3 и 7.
Фиг.6: Сладкий вкус AXOS-15-0,27, Xylooligo-95P и сахарозы. Построенные кривые показывают суммарный процент субъектов (n=20), распознающих сладкий вкус, в зависимости от концентрации соединения в г/л.
Фиг.7: HPSEC профили молекулярных масс фракций олигосахарида, полученных после ультрафильтрации AXOS, полученного с помощью обработки эндоксиланазой скребкового WU-AX. Применяемые мембраны имели MMCO 5 кДа (панель A), 10 кДа (панель B) и 30 кДа (панель C). Применялась колонка Shodex SB-802,5 HQ (300×8 мм, Showa, Denko K.K., Tokyo, Japan). В качестве маркеров молекулярной массы применялись стандартные P-82 Shodex пуллуланы с молекулярной массой 11,2×104, 4,73×104, 2,28×104, 1,18×104 и 0,59×104 Да, стандартные ксило-олигосахариды с молекулярной массой 810 (DP6), 678 (DP5), 546 (DP4), 414 (DP3) и 282 Да (DP2) и глюкоза с молекулярной массой 180 Да, и их соответствующий элюирующий объем обозначен символом "x" слева направо.
Фиг.8: HPSEC профили молекулярных масс фракций олигосахарида, полученных после ультрафильтрации с помощью последовательного прохождения через мембраны с MMCO 10 кДа и 30 кДа AXOS, полученного с помощью обработки эндоксиланазой скребкового WU-AX. Анализировались фракции либо ретентата после прохождения через 30 кДа MMCO ретентата с мембраны 10 кДа (RET10кДа+30кДа), пермеата после прохождения через 30 кДа MMCO ретентата с мембраны 10 кДа (PER10кДа+30кДа), либо пермеата после прохождения через 10 кДа мембрану (PER10кДа). Применялась колонка Shodex SB-802,5 HQ (300×8 мм, Showa, Denko K.K., Tokyo, Japan). В качестве маркеров молекулярной массы применялись стандартные P-82 Shodex пуллуланы с молекулярной массой 11,2×104, 4,73×104, 2,28×104, 1,18×104 и 0,59×104 Да, стандартные ксило-олигосахариды с молекулярной массой 810 (DP6), 678 (DP5), 546 (DP4), 414 (DP3) и 282 Да (DP2) и глюкоза с молекулярной массой 180 Да и их соответствующий элюирующий объем обозначен символом "×" слева направо.
Фиг.9: Влияние добавления к куриному корму AXOS-7-0,34, AXOS-122-0,66 или Xylooligo-95P на микробиоту слепой кишки цыплят. Композиция микробиоты слепой кишки определялась, соответственно, через 1 и 2 недели после начала эксперимента с помощью подсчета колоний enterobacteriaciae и bifidobacteriaceae на чашках. Столбцы показывают средние значения результатов измерения, а столбец ошибки показывает среднеквадратичное отклонение. Для данного момента времени значения, помеченные различными буквами, значительно различаются друг от друга согласно тесту Tukey с p<0,05.
Фиг.10: Влияние добавления к куриному корму AXOS-15-0,27 в концентрации 0,1% или 0,25%, фрукто-олигосахаридов (FOS) в концентрации 0,25% или 1%, или эндоксиланазы на количество бифидобактерий в слепой кишке цыплят через 14 дней. Бактерии рода Bifidobacterium определялись количественной ПЦР. Значения, помеченные различными буквами, значительно отличаются от друг друга согласно тесту наименьшего значимого различия (p<0,05; n=3). Столбцы показывают средние значения результатов измерения, а столбец ошибки показывает среднеквадратичное отклонение.
Фиг.11: Влияние добавления к рациону крыс 0,25% AXOS-8-0,27, AXOS-15-0,27, AXOS-16-0,78 или AXOS-122-0,66 на уровень ацетата (верхняя панель), пропионата (средняя панель) и бутирата (нижняя панель) в фекалиях крыс через 13 дней кормления. Значения, помеченные различными буквами, значительно отличаются друг от друга согласно тесту наименьшего значимого различия (p<0,05; n=4). Столбцы показывают средние значения результатов измерения, а столбец ошибок показывает среднеквадратичное отклонение.
Фиг.12: Влияние добавления к рациону крыс 4% AXOS-15-0,27 или Xylooligo-95P на уровень ацетата в проксимальном отделе толстой кишки (A), ацетата в дистальном отделе толстой кишки (B), пропионата в дистальном отделе толстой кишки (C) и бутирата в дистальном отделе толстой кишки (D) крыс через 14 дней кормления. Столбцы показывают средние значения результатов измерения, а столбец ошибки показывает среднеквадратичное отклонение.
Фиг.13: Влияние добавления к рациону крыс 4% AXOS-15-0,27 или Xylooligo-95P на уровень бифидобактерий в слепой кишке через 14 дней кормления. Бактерии рода Bifidobacterium определялись с помощью количественной ПЦР. Значения, обозначенные различными буквами, значительно отличаются от друг друга согласно тесту наименьшего значимого различия (p<0,05; n=4). Столбцы показывают средние значения результатов измерения, а столбец ошибки показывает среднеквадратичное отклонение.
Фиг.14: Влияние приема внутрь 4,88 г/день AXOS-15-0,27 или 4,81 г/день WPC в течение 14 дней на количество бифидобактерий в фекалиях здоровых людей-добровольцев. Бактерии рода Bifidobacterium определялись с помощью количественной ПЦР. Столбцы показывают средние значения результатов измерения, а столбец ошибки показывает среднеквадратичное отклонение. Столбец со звездочкой показывает значительное отличие от базального уровня согласно тесту Wilcoxon Signed Ranks (p<0,05; n=5).
Фиг.15: Влияние приема внутрь однократной дозы AXOS-15-0,27 (0,24, 0,73, 2,21 или 4,88 г) на экскрецию азота с мочой (A) и фекалиями (B) и на время ороцекального транзита (C). Экскреция азота выражена в процентах от принятого 15N-меченого азота, выведенного с образцами либо мочи, либо фекалий, забранных в течение 0-48 и 0-72 часов после приема внутрь пробного завтрака, соответственно. Время ороцекального транзита выражено в процентах от принятого 3H-меченого PEG, в образцах фекалий, собранных в течение 0-72 часов. Столбцы показывают средние значения результатов измерения, а столбцы ошибки показывают среднеквадратичное отклонение. Столбец с одной звездочкой или двумя звездочками показывает значительное отличие от контрольной терапии согласно тесту Wilcoxon Signed Ranks при p<0,05 (n=9) и p<0,01 (n=9), соответственно.
Фиг.16: Влияние приема внутрь однократной дозы AXOS-15-0,27 (0,24, 0,73, 2,21 или 4,88 г) на экскрецию с мочой p-крезола (A) и фенола (B). Экскреция p-крезола и фенола выражена в виде суммарного количества p-крезола и фенола (мг), выделенного с образцами мочи, забранными через 0-24 часа после приема внутрь пробного завтрака. Столбцы показывают средние значения результатов измерения, а столбцы ошибки показывают среднеквадратичное отклонение. Столбец с одной звездочкой или двумя звездочками показывает значительное отличие от контрольной терапии согласно тесту Wilcoxon Signed Ranks при p<0,05 (n=9) и p<0,01 (n=9), соответственно.
Ранее был описан пребиотический эффект подкрепления корма или пищевых продуктов специфическими препаратами арабиноксилана. Конкретнее, уровень техники предоставляет примеры бифидогенных эффектов с одной стороны ксило-арабино-олигосахаридов, имеющих среднюю степень полимеризации (DP) ниже 4, и с другой стороны препаратов арабиноксилана, включающих длинноцепочечные природные арабиноксиланы. Доступные препараты ксило-арабино-олигосахаридов производятся в условиях сильнодействующей и неконтролируемой деполимеризации, приводящей к наличию относительно высоких уровней ксилозы и коротких ксило-олигосахаридов, которые имеют сладкий вкус. Сладость этих препаратов ограничивает их применение в некоторых пищевых продуктах. Кроме того, молекулы ксило-арабино-олигосахарида с DP ниже 4 имеют содержание метаболической энергии, которое является нежелательным в низкокалорийных пищевых продуктах. Физико-химические характеристики природных арабиноксиланов, такие как высокая вязкость и высокое влагоудержание, делают их не пригодными для широкого спектра пищевых продуктов. Частичная деполимеризация природных арабиноксиланов улучшает их физико-химические характеристики, и были описаны препараты, включающие молекулы арабиноксилана, имеющие среднюю DP приблизительно 58. Однако пребиотическая активность этих частично деполимеризованных арабиноксиланов у людей демонстрировалось только в относительно больших дозах (>6 г в сутки; Grasten et al. 2003).
Настоящее изобретение основано на обнаружении того, что препараты арабиноксилана, включающие арабиноксиланы, имеющие среднюю степень полимеризации (DP) от 5 до 50, являются мощными пребиотическими агентами при назначении людям и подопытным животным, служащим моделью для людей. Кроме того, подобные препараты не имеют ни одного из физико-химических или органолептических недостатков препаратов, включающих либо природные арабиноксиланы, либо короткоцепочечные ксило-арабино-олигосахариды. Также было обнаружено, что как у людей, так и у крыс и цыплят препараты арабиноксилана по изобретению оказывали более сильный бифидогенный эффект, чем препараты, включающие частично деполимеризованные арабиноксиланы, имеющие среднюю DP 58 или более. Кроме того, отмечено, что препараты арабиноксилана по изобретению главным образом проявляют свою пребиотическую активность в дистальной части толстой кишки, тогда как короткоцепочечные ксило-олигосахариды более активны в проксимальной части толстой кишки. Это открытие особенно важно, поскольку, по-видимому, существует зависимость между композицией флоры в дистальном отделе толстой кишки и развитием заболеваний толстой кишки и в частности рака толстой кишки. Кроме пребиотического эффекта в чистом виде, также были отмечены другие благоприятные эффекты применения препаратов арабиноксилана настоящего изобретения, такие как сокращение экскреции азота с мочой и сопутствующее повышение экскреции азота с фекалиями, а также сокращение экскреции крезола и фенола с мочой.
Таким образом, первой задачей настоящего изобретения является создание препаратов арабиноксилана для применения в качестве пищевой добавки или в качестве основы для продукта с питательной добавкой. Препараты арабиноксилана характеризуются тем, что молекулы арабиноксилана, содержащиеся в указанных препаратах, имеют среднюю DP, варьирующую от 5 до 50. В предпочтительном варианте осуществления препарат арабиноксилана включает по меньшей мере 15% указанных молекул арабиноксилана. В более предпочтительном варианте осуществления препараты включают более 30% указанных арабиноксиланов, например, более 60%. В еще более предпочтительном варианте осуществления арабиноксиланы, содержащиеся в препаратах по изобретению, имеют среднюю DP от 7 до 40 DP, еще более предпочтительно от 7 до 20 DP. Предпочтительно, 90% арабиноксиланов, содержащихся в препаратах по изобретению, имеют DP от 2 до 650, определяемую с помощью высокоэффективной эксклюзионной хроматографии (HPSEC), более предпочтительно от 2 до 130.
В предпочтительном варианте осуществления препараты арабиноксилана по изобретению доступны из природных источников, таких как растительный материал, и более предпочтительно из зерновых культур. Они могут быть представлены выбранными фракциями указанных природных арабиноксиланов или могут быть получены с помощью деполимеризации или фрагментации указанных природных арабиноксиланов, или они могут быть структурными аналогами, произведенными с помощью химических, ферментативных и/или физических процессов. В предпочтительном варианте осуществления препараты арабиноксилана получены из боковой фракции процесса разделения глютена и крахмала, такой как WPC (Pfeifer & Langen). В другом предпочтительном варианте осуществления препараты арабиноксилана получены из отрубей зерновых культур.
Пребиотические эффекты препаратов арабиноксилана по изобретению при назначении с пищей наблюдались в дозе 0,25 г на порцию. Таким образом, следующей задачей настоящего изобретения является создание пищевого продукта или напитка, включающего препарат арабиноксилана по изобретению. В предпочтительном варианте осуществления пищевой продукт или напиток содержит от 0,1 до 5 г препарата арабиноксилана по изобретению на порцию. В более предпочтительном варианте осуществления пищевой продукт или напиток содержит от 0,25 до 5 г препарата арабиноксилана по изобретению на порцию. В еще более предпочтительном варианте осуществления пищевой продукт или напиток содержит от 1 до 3 г препарата арабиноксилана по изобретению на порцию. В другом предпочтительном варианте осуществления пищевой продукт или напиток содержит от 0,1 до 5 г арабиноксиланов, имеющих среднюю DP от 5 до 50, на порцию. В более предпочтительном варианте осуществления пищевой продукт или напиток содержит от 0,25 до 5 г арабиноксиланов, имеющих среднюю DP от 5 до 50, на порцию. В еще более предпочтительном варианте осуществления пищевой продукт или напиток содержит от 1 до 3 г арабиноксиланов, имеющих среднюю DP от 5 до 50, на порцию. Как указано выше, препараты арабиноксилана по изобретению особенно подходят в качестве полезной добавки к низкокалорийным пищевым продуктам.
В частном варианте осуществления пищевой продукт является молочным продуктом, таким как йогурт или свежий сыр. Предпочтительно, указанный молочный продукт содержит от 0,25 до 5 г, более предпочтительно от 1 до 3 г арабиноксиланов, имеющих среднюю DP от 5 до 50, в 100 г на порцию 125 г. Опционально указанный молочный продукт содержит живые бактерии рода Bifidobacterium или Lactobacillus, которые способны ферментировать арабиноксиланы. В другом частном варианте осуществления напитки по изобретению являются так называемыми функциональными безалкогольными напитками. Предпочтительно, подобные функциональные безалкогольные напитки содержат от 0,25 до 5 г, более предпочтительно от 1 до 3 г арабиноксиланов, имеющих среднюю DP от 5 до 50, в 100 мл. В альтернативном варианте указанный функциональный безалкогольный напиток содержит желательное количество таких арабиноксиланов в 250 мл. В частном варианте осуществления указанные функциональные безалкогольные напитки содержат живые бактерии рода Bifidobacterium или Lactobacillus, которые способны ферментировать арабиноксиланы.
Обычно, пищевые продукты, содержащие в качестве компонента зерновые культуры или материал, полученный из зерновых культур, содержат арабиноксиланы. Однако арабиноксиланы, содержащиеся в этих пищевых продуктах, являются либо длинноцепочечными природными арабиноксиланами с DP более 6000, либо частично деполимеризованными арабиноксиланами, имеющими DP по крайней мере от 200 до 300. В связи с этим, обогащение указанных пищевых продуктов арабиноксиланами по изобретению также повышает их пищевую ценность. Предпочтительно, подобное обогащение осуществляют посредством добавления указанного количества препарата арабиноксилана по изобретению в качестве компонента во время изготовления пищевых продуктов, содержащих зерновые культуры. Ясно, что подобное обогащение приводит к тому, что содержащий зерновые культуры пищевой продукт, включающий арабиноксиланы, имеющие DP 200 и выше, будет содержать популяцию арабиноксиланов, имеющих DP ниже 200, указанная популяция будет характеризоваться средней DP от 5 до 50. Специалисту ясно, что обогащение содержащих зерновые культуры пищевых продуктов упомянутой популяцией арабиноксиланов, имеющих DP ниже 200, может по меньшей мере частично быть осуществлено при использовании ксиланолитических ферментов в подходящих условиях, во время изготовления этих пищевых продуктов. В частном варианте осуществления указанный пищевой продукт является хлебобулочным изделием, таким как хлеб. Предпочтительно, указанный хлеб обогащен арабиноксиланами, имеющими среднюю DP от 5 до 50, в количестве от 0,25 до 5 г, более предпочтительно от 1 до 3 г на 100 г. В другом варианте осуществления пищевой продукт является кондитерским продуктом, таким как пирог. Предпочтительно, указанный кондитерский продукт обогащен арабиноксиланами, имеющими среднюю DP от 5 до 50, в количестве от 0,25 до 5 г, более предпочтительно от 1 до 3 г на 100 г. В еще одном варианте осуществления пищевой продукт является макаронным продуктом. Предпочтительно, указанный макаронный продукт обогащен арабиноксиланами, имеющими среднюю DP от 5 до 50, в количестве от 0,25 до 5 г, более предпочтительно от 1 до 3 г на 80 г. В еще одном варианте осуществления пищевой продукт является зерновым завтраком. Предпочтительно, указанный зерновой завтрак обогащен арабиноксиланами, имеющими среднюю DP от 5 до 50, в количестве от 0,25 до 5 г, более предпочтительно от 1 до 3 г на 30 г. В еще одном варианте осуществления пищевой продукт является печеньем, например, сухим печеньем для завтрака. Предпочтительно, указанное печенье обогащено арабиноксиланами, имеющими среднюю DP от 5 до 50, в количестве от 0,25 до 5 г, более предпочтительно от 1 до 3 г на 125 г.
К другим пищевым продуктам, которые могут быть полезным образом обогащены препаратами арабиноксилана по изобретению, относятся например, без ограничения, продукты из мясного фарша, шоколадные конфеты, печенья, батончики и десерты, такие как десертные пудинги.
Третьей задачей настоящего изобретения является создание продукта с пищевой добавкой, включающего препарат арабиноксилана по изобретению. В предпочтительном варианте осуществления продукт с пищевой добавкой является капсулой, таблеткой, порошком или т.п. В более предпочтительном варианте осуществления продукт с пищевой добавкой разработан таким образом, что он позволяет ежедневно принимать 0,1 и 5 г арабиноксиланов, имеющих среднюю DP от 5 до 50, более предпочтительно от 0,25 до 5 г, например от 1 до 3 г.
Пятой задачей настоящего изобретения является создание способа изготовления препарата арабиноксилана по изобретению. В первом варианте осуществления способ включает следующие стадии:
i. выделения неэкстрагируемой водой фракции арабиноксилана из богатых арабиноксиланом материалов, таких как отруби, пшеничная мука или пшеничные остатки, путем удаления крахмала и белков из указанного богатого арабиноксиланом материала, предпочтительно, с использованием амилолитических и протеолитических ферментов, соответственно;
ii. деполимеризации неэкстрагируемой водой фракции арабиноксилана с использованием одного или более ксиланолитических ферментов.
Во втором варианте осуществления способ включает следующие стадии:
i. получения частично деполимеризованного экстрагируемого водой содержащего арабиноксилан препарата, такого как препарат, полученный из побочной фракции процесса разделения глютена и крахмала;
ii. если требуется, удаления крахмала и белков из указанного содержащего арабиноксилан препарата, предпочтительно с использованием амилолитических и протеолитических ферментов, соответственно;
iii. деполимеризации арабиноксиланов, содержащихся в указанном препарате, с использованием одного или более ксиланолитических ферментов.
В частном варианте осуществления, после обработки ксиланолитическими ферментами препарат подвергают ультрафильтрации для уменьшения в препарате количества моносахаридов и олигосахаридов, имеющих DP 4 или менее.
Последней задачей настоящего изобретения является создание способа анализа концентрации и средней DP популяции арабиноксиланов с DP менее 200 в пищевом продукте, содержащем зерновые. Указанный способ включает следующие стадии:
i. размалывания образца продукта, содержащего зерновые культуры, предпочтительно после сушки или сублимационной сушки указанного образца;
ii. экстракции размолотого образца в дистиллированной воде;
iii. обработки экстракта амилолитическими ферментами в подходящих условиях для преобразования всего крахмала в глюкозу, например, используя обработку амилазой с последующей обработкой амилоглюкозидазой;
iv. удаления глюкозы из образца, полученного на стадии (iii), например, путем метаболизации глюкозы, используя дрожжи;
v. определения профиля молекулярных масс арабиноксиланов, содержащихся в образце, полученном на стадии (iv), предпочтительно используя высокоэффективную жидкостную хроматографию (HPLC);
vi. вычисления относительного количества и средней DP фракции арабиноксилана, меньше DP 200, например, с помощью анализа поверхности под кривой HPLC.
Изобретение далее поясняется посредством иллюстративных вариантов осуществления, описанных ниже.
Иллюстративный вариант осуществления
Примеры
Пример 1: Препарат XOS/AXOS со средней DP>4
Материалы и методы
Xylooligo-95P. Коммерческий препарат ксило-олигосахарида Xylooligo-95P, состоящий в основном из ксилобиозы, ксилотриозы и ксилотетраозы, был получен от Suntory Ltd (Tokyo, Japan).
Изготовление неэкстрагируемого водой арабиноксилана из пшеничных отрубей. Для изготовления неэкстрагируемого водой арабиноксилана (WU-AX) из отрубей, в качестве исходного материала применялись коммерческие пшеничные отруби (Meneba Meel BV, Rotterdam, The Netherlands). Материал, не содержащий арабиноксилан, был частично удален из отрубей с помощью ферментативной обработки согласно способу, описанному Maes et al. (2004). Сначала, для гидролиза крахмала, суспензия пшеничных отрубей в воде (1:7 вес/объем) обрабатывалась термостабильной α-амилазой (Termamyl 120LS, Novozymes, Bagsvaerd, Denmark; 1 мкл/г пшеничных отрубей) в течение 90 минут при 90°C. После охлаждения до 50°C pH суспензии был установлен на уровне 6,0, используя концентрированную HCI, и суспензия инкубировалась с протеазой (Neutrase 0,8L, Novozymes, Bagsvaerd, Denmark; 150 мкл/г пшеничных отрубей) в течение 24 часов при 50°C для гидролиза остаточных белков. После этого суспензия была прокипячена и отфильтрована, и фильтрат был удален. Остаток, называемый "WU-AX из отрубей", был промыт водой и высушен на воздухе.
Изготовление неэкстрагируемого водой арабиноксилана из крахмала пшеничной муки или скребковой пшеницы. Применяя стандартные методы, пшеничная мука может быть фракционирована на 4 различные фракции (McRitchie, 1985): A-крахмал (крахмал высшего сорта), B-крахмал (скребковый крахмал или остатки), глютен и растворимую в воде фракцию. WU-AX сконцентрирован во фракции скребкового крахмала. Материал, не содержащий арабиноксилан, был частично удален из скребковой фракции с помощью ферментативной обработки. Суспензия скребкового крахмала в воде (1:6 вес/объем) сначала обрабатывалась термостабильной α-амилазой (Termamyl 120LS, Novozymes, Bagsvaerd, Denmark, 30 мкл/г скребкового крахмала) в течение 60 минут при 90°C и амилоглюкозидазой (Megazyme, Bray, Ireland, 20 мкл/г скребкового крахмала) в течение 16 часов при 60°C для гидролиза крахмала. После кипячения в течение 30 минут и центрифугирования, остаток инкубировался с протеазой (Neutrase 0.8L, Novozymes, Bagsvaerd, Denmark, 20 мкл/г скребкового крахмала) в течение 20 часов при 50°C, для гидролиза остаточных белков. После этого суспензия снова кипятилась (30 минут), фильтровалась и фильтрат был удален. Остаток, называемый "WU-AX из муки", был промыт водой, этанолом (95 об.%) и высушен на воздухе. Вместо экстракции WU-AX из пшеничного крахмала, WU-AX может также быть выделен непосредственно из скребкового крахмала пшеницы. В этом случае в качестве исходного материала применялась коммерчески доступная боковая фракция промышленного процесса разделения клейковины и крахмала Meritena 233 (Tate и LyIe, Aalst, Belgium). Суспензия Meritena 233 в воде (1:5 вес/объем) затем обрабатывалась термостабильной α-амилазой (Termamyl 120LS, Novozymes, Bagsvaerd, Denmark; 30 мкл/г Meritena 233) в течение 60 минут при 90°C и амилоглюкозидазой (Megazyme, Bray, Ireland; 20 мкл/г Meritena 233) в течение 16 часов при 60°C для гидролиза крахмала. После кипячения в течение 30 минут и центрифугирования остаток инкубировался с протеазой (Neutrase 0,8 л, Novozymes, Bagsvaerd, Denmark; 20 мкл/г Meritena 233) в течение 20 часов при 50°C для гидролиза остаточных белков. После этого суспензия снова кипятилась (30 минут), фильтровалась и фильтрат был удален. Остаток, называемый "скребковый WU-AX", был промыт водой, этанолом (95 об.%) и высушен на воздухе.
Концентрат пентозана пшеницы (WPC). Концентрат пентозана пшеницы (WPC, Pfeifer & Langen, Dormagen, Germany) получен из пшеничной муки, и его химический состав был подробно описан Courtin и Delcour (1998). WPC богат экстрагируемым водой арабиноксиланом (приблизительно 43%) и белковым материалом (приблизительно 30%). Оставшаяся часть главным образом состоит из арабиногалактанового пептида (приблизительно 14%) и в меньшей степени полимерной глюкозы (6%).
Изготовление AXOS с avDP 122 и коэффициентом A/X 0,66 (AXOS-122-0,66). Исходный материал для изготовления AXOS-122-0,66 был коммерческим продуктом «Концентрат пентозана пшеницы» (WPC, Pfeifer & Langen, Dormagen, Germany). WPC был солюбилизирован в деионизированной воде (1:10 вес/обьем) и в качестве водной суспензии был добавлен кремний (20% вес/объем) до соотношения кремний/белок 7:1. Для получения максимальной адсорбции белков к кремнию pH смеси был установлен на уровне 4,8, применяя 0,1М HCl. После перемешивания в течение 30 минут суспензия была отфильтрована по Büchner. Остаток, включающий кремний/белок, был удален, тогда как фильтрат был подвергнут преципитации этанолом. Этанол (95 об.%) добавлялся при непрерывном перемешивании до конечной концентрации 65% (по объему) и после перемешивания в течение дополнительных 30 минут, осаждения (24 часа, 4°C) и фильтрации полученный остаток был высушен от растворителя (этанол, ацетон и диэтиловый эфир) и высушен на воздухе. Полученный материал был гомогенизирован и просеян через сито 250 мкм.
Изготовление AXOS с avDP 16 и коэффициентом AJX 0,78 (AXOS-16-0,78). AXOS-16-0,78 был изготовлен из исходного коммерческого продукта «Концентрат пентозана пшеницы» (WPC, Pfeifer & Langen, Dormagen, Germany). WPC был обработан кремнием для удаления белков, как описано для препарата AXOS-122-0,66. Полученный фильтрат далее инкубировался при 30°C в течение 24 часов с XAA, эндоксиланазой из Aspergillus aculeatus (Shearzyme 500L, Novozymes, Bagsvaerd, Denmark) в количестве 29 единиц на грамм концентрата пентозана пшеницы. После инактивации фермента с помощью кипячения (30 минут) полученный раствор был охлажден и подвергнут преципитации этанолом. Этанол (95 об.%) добавлялся при непрерывном перемешивании до конечной концентрации 80% (по объему) и после перемешивания в течение дополнительных 30 минут, осаждения (24 часа, 4°C) и фильтрации полученный остаток был растворен в деионизированной воде и снова подвергнут преципитации этанолом. Этанол (95 об.%) добавлялся при непрерывном перемешивании до конечной концентрации 65% (по объему) и после перемешивания в течение дополнительных 30 минут, осаждения (24 часа, 4°C) и фильтрации осажденный материал был удален. Оставшуюся надосадочную жидкость подвергли ротационному испарению для удаления этанола, растворили в деионизированной воде и лиофилизировали. Полученный материал был гомогенизирован и просеян через сито 250 мкм.
Изготовление AXOS с avDP 7 и коэффициентом AJX 0,34 (AXOS-7-0,34). В качестве исходного материала для изготовления AXOS-7-0,34, применялся WU-AX из отрубей, который был выделен, как описано выше. WU-AX из отрубей затем инкубировался при 30°C в течение 24 часов с эндоксиланазой XBS (Grindamyl H640, Danisco, Denmark) в количестве 80 единиц на грамм сухого изолированного WU-AX из отрубей. После фильтрации и инактивации фермента с помощью кипячения (30 минут) фильтрат был лиофилизирован и полученный материал был гомогенизирован и просеян через сито 250 мкм.
Изготовление AXOS с avDP 15 и коэффициентом AJX 0,27 (AXOS-15-0,27). В качестве исходного материала для изготовления AXOS-15-0,27 применялись коммерческие пшеничные отруби (Dossche Mills & Bakery, Deinze, Belgium). Суспензия пшеничных отрубей в воде (1:7 вес/объем) сначала обрабатывалась термостабильной α-амилазой (Termamyl 120LS, Novozymes, Bagsvaerd, Denmark; 1 мкл/г отрубей пшеницы) в течение 90 минут при 90°C для гидролиза крахмала. После охлаждения до 50°C pH суспензии был установлен на уровне 6,0, применяя концентрированную HCl, и суспензия инкубировалась с протеазой (Neutrase 0,8 л, Novozymes, Bagsvaerd, Denmark; 40 мкл/г отрубей пшеницы) в течение 4 часов при 50°C, для гидролиза остаточных белков. После этого суспензия подвергалась кипячению в течение 20 минут, фильтровалась и фильтрат удалялся. Остаток промывался водой и ресуспендировался в деионизированной воде (1:14 вес/объем). Суспензия инкубировалась при непрерывном перемешивании в течение 10 часов при 50°C с эндоксиланазой XBS (Grindamyl H640, Danisco, Дания) в количестве 1,4 единицы на грамм обескрахмаленных и освобожденных от белков пшеничных отрубей, и в течение следующих 10 часов при 50°C после добавления второй дозы эндоксиланазы XBS в количестве 1,1 единиц на грамм обескрахмаленных и освобожденных от белков пшеничных отрубей. После инактивации фермента с помощью кипячения (30 минут) раствор концентрировался в выпарном аппарате с падающей пленкой до концентрации сухого вещества 20% и в конце высушивался в распылительной сушилке.
Изготовление AXOS с avDP 8 и коэффициентом A/X 0,27 (AXOS-8-0,27). AXOS-8-0,27 был изготовлен с помощью инкубирования раствора (1:10 вес/объем) AXOS-15-0,27 при 30°C в течение 1 часа с XAA, эндоксиланазой из Aspergillus aculeatus (Shearzyme 500L, Novozymes, Bagsvaerd, Denmark) в количестве 125 единиц на грамм AXOS-15-0,27. После инактивации фермента с помощью кипячения (30 минут) раствор был лиофилизирован и полученный материал был гомогенизирован и просеян через сито 250 мкм.
Изготовление AXOS с avDP 39 и коэф