Кристаллическая форма бифенильного соединения
Иллюстрации
Показать всеНастоящее изобретение относится к кристаллической соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)
этиламино]метил}-
5-метоксифенилкарбамоил)этил]пиперидин-4-
илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвату. Также изобретение относится к фармацевтической композиции, содержащей такую соль, комбинации, содержащей соль по п.1 и стероидный противовоспалительный агент, способу лечения легочного расстройства, способу получения соли по п.1 и применению соли по п.1 для производства лекарственного средства. Технический результат: получена новая кристаллическая соль указанного выше соединения, обладающая полезными биологическими свойствами. 15 н. и 19 з.п. ф-лы, 6 ил., 4 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым кристаллическим солям 1,2-этандисульфоновой кислоты бифенильного соединения, которые, как предполагается, являются полезными в качестве терапевтических агентов для лечения легочных расстройств. Настоящее изобретение также относится к фармацевтическим композициям, содержащим такие кристаллические соединения или полученным из таких кристаллических соединений, способам и промежуточным соединениям для получения таких кристаллических соединений и способам применения таких кристаллических соединений для лечения легочных расстройств.
Уровень техники
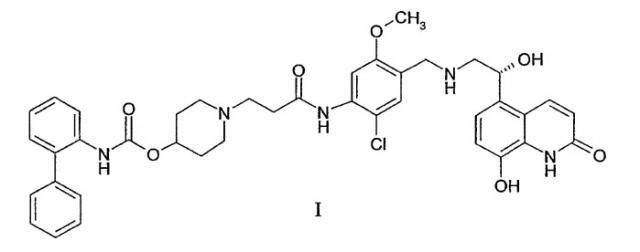
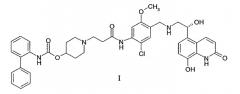
В заявке на патент США №10/779,157, поданной 13 февраля 2004 г., раскрыты новые бифенильные соединения, которые являются полезными в качестве терапевтических агентов для лечения легочных расстройств, таких как хроническое обструктивное заболевание легких (ХОЗЛ) и астма. В частности, соединение 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-иловый эфир бифенил-2-илкарбаминовой кислоты раскрыто в этой заявке, как обладающее как мускариновой антагонистической активностью, так и агонистической активностью к β2-адренергическим рецепторам. Химическая структура 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты представлена в виде формулы I:
Терапевтические агенты, полезные для лечения легочных расстройств, преимущественно вводят непосредственно в дыхательные пути при помощи ингаляции. В этом отношении, некоторые типы фармацевтических ингаляционных устройств разработаны для введения терапевтических агентов посредством ингаляции, включая порошковые ингаляторы (ПИ, DPI), дозирующие ингаляторы (ДАИ, MDI) и ингаляторы-небулайзеры. При изготовлении фармацевтических композиций и лекарственных форм для использования в таких устройствах, очень желательно иметь кристаллическую форму терапевтического агента, которая не является ни гигроскопичной, ни расплывающейся и которая имеет относительно высокую точку плавления (т.e. выше чем примерно 150°C), таким образом, позволяя веществу находиться в микронизированной форме без значимого разложения или потери кристалличности.
Ранее не встречались публикации о кристаллических формах солей соединения формулы I. Следовательно, существует необходимость в стабильной, нерасплывающейся кристаллической форме соли соединения формулы I, которая имеет допустимый уровень гигроскопичности и относительно высокую точку плавления.
Сущность изобретения
Настоящее изобретение предоставляет кристаллические соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольват.
С интересом было обнаружено, что такие кристаллические соли 1,2-этандисульфоновой кислоты соединения формулы I не расплываются даже под воздействием влажности окружающей среды. Кроме того, такие кристаллические соли имеют допустимый уровень гигроскопичности и очень высокую точку плавления, например выше примерно 215°C. В конкретном варианте осуществления кристаллическая соль настоящего изобретения имеет точку плавления выше примерно 230°C.
Среди других применений кристаллическая соль 1,2-этандисульфоновой кислоты соединения формулы I полезна в изготовлении фармацевтических композиций, которые, как ожидается, будут полезными в лечении легочных расстройств. Следовательно, в других аспектах этой композиции настоящее изобретение предоставляет фармацевтическую композицию, содержащую фармакологически приемлемый носитель и соль 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольваты.
В конкретном варианте осуществления фармацевтическая композиция настоящего изобретения дополнительно содержит стероидный противовоспалительный агент, такой как кортикостероид; или ингибитор фосфодиэстеразы-4; или их комбинацию.
В другом конкретном варианте осуществления настоящее изобретение предоставляет фармацевтическую композицию, содержащую водный изотонический солевой раствор, содержащий соль 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты, причем раствор имеет pH в пределах от примерно 4 до примерно 6.
В другом варианте осуществления настоящее изобретение предоставляет комбинацию, содержащую:
(a) кристаллическую соль 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольват; и
(b) стероидный противовоспалительный агент.
Соединение формулы I имеет как мускариновую антагонистическую активность, так и агонистическую активность к β2-адренергическим рецепторам. Следовательно, предполагается, что соль 1,2-этандисульфоновой кислоты настоящего изобретения является полезной в качестве терапевтического агента для лечения легочных расстройств, таких как астма, и хронического обструктивного заболевания легких.
Следовательно, в одном из аспектов указанного способа настоящее изобретение предоставляет способ лечения легочного расстройства, включающий введение пациенту, нуждающемуся в лечении, терапевтически эффективного количества соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвата.
Кроме того, в другом из аспектов указанного способа настоящее изобретение предоставляет способ вызова у пациента бронходилатации, включающий введение пациенту посредством ингаляции такого количества соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвата, которое вызывает бронходилатацию.
Настоящее изобретение также предоставляет способ лечения хронического обструктивного заболевания легких или астмы, включающий введение пациенту, нуждающемуся в лечении, терапевтически эффективного количества 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвата.
Настоящее изобретение также относится к способу получения кристаллической соли 1,2-этандисульфоновой кислоты соединения формулы I. Следовательно, в других аспектах указанного способа настоящее изобретение предоставляет способ получения 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвата, включающий приведение в контакт 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты с 1,2-этандисульфоновой кислотой.
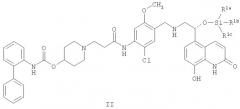
В других аспектах указанного способа настоящее изобретение предоставляет способ получения кристаллической соли 1,2-этандисульфоновой кислоты соединения формулы I, включающий:
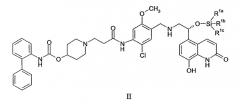
(а) приведение в контакт соединения формулы II:
где R1a, R1b и R1c независимо выбирают из C1-4алкила, фенила, -C1-4алкил-(фенила), или один из R1a, R1b и R1c представляет собой -О-(C1-4алкил); с фторид-ионом; и
(b) приведение в контакт продукта из стадии (b) с 1,2-этандисульфоновой кислотой или ее гидратом; для образования кристаллической соли 1,2-этандисульфоновой кислоты соединения формулы I, причем стадии (a) и (b) выполняют в одном и том же реакционном сосуде без выделения продукта стадии (a).
В других аспектах указанного способа настоящее изобретение предоставляет способ получения кристаллической соли 1,2-этандисульфоновой кислоты соединения формулы I, имеющей точку плавления выше чем примерно 230°C, включающий добавление затравочного кристалла кристаллической соли 1,2-этандисульфоновой кислоты соединения формулы I в раствор, содержащий соль 1,2-этандисульфоновой кислоты соединения формулы I, растворенную в инертном растворителе, в котором затравочный кристалл имеет точку плавления выше чем примерно 230°C.
Этот способ также может быть использован для перекристаллизации кристаллической соли 1,2-этандисульфоновой кислоты соединения формулы I для получения кристаллической формы, имеющей точку плавления выше, чем примерно 230°C. Следовательно, настоящее изобретение дополнительно предоставляет способ получения кристаллической соли 1,2-этандисульфоновой кислоты соединения формулы I, имеющей точку плавления выше чем примерно 230°C, включающий:
(a) растворение кристаллической соли 1,2-этандисульфоновой кислоты соединения формулы I в инертном растворителе при первой температуре;
(b) охлаждение продукта стадии (a) до второй температуры; и
(c) добавление затравочного кристалла соли 1,2-этандисульфоновой кислоты соединения формулы I;
причем затравочный кристалл имеет точку плавления выше чем примерно 230°C, при этом первая температура представляет собой температуру, достаточную для растворения соли 1,2-этандисульфоновой кислоты, а вторая температура ниже температуры, при которой затравочный кристалл полностью растворяется при добавлении продукта стадии (b).
Кроме того, настоящее изобретение относится к способу очистки 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты, включающему образование кристаллической соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты. Настоящее изобретение также относится к продуктам, изготовленным при помощи способов, раскрытых в настоящем описании.
Настоящее изобретение также относится к кристаллической соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвату для применения в терапии или в качестве лекарственного препарата.
Кроме того, настоящее изобретение относится к применению кристаллической соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвата для производства лекарственного средства; особенно для производства лекарственного средства для лечения легочного расстройства.
Настоящее изобретение также относится к применению:
(a) кристаллической соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвата; и
(b) стероидного противовоспалительного агента;
для производства лекарственного средства для лечения легочного расстройства.
Настоящее изобретение также относится к кристаллической соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвату, в микронизированной форме; и фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и кристаллическую соль 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольват, в микронизированной форме.
Краткое описание чертежей
Различные аспекты настоящего изобретения проиллюстрированы со ссылкой на прилагаемые чертежи.
На фиг.1 показан график дифференциальной сканирующей калориметрии (DSC) и график дифференциального термического анализа (TGA), а на фиг.2 показан график DSC образцов кристаллической соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты настоящего изобретения.
На фиг.3 и 4 показаны порошковые рентгенограммы (PXRD) кристаллической соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты настоящего изобретения.
На фиг.5 показан инфракрасный (ИК) спектр поглощения кристаллической соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты настоящего изобретения.
На фиг.6 показан график динамики поглощения влаги (DMS) кристаллической солью 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты настоящего изобретения.
Подробное описание настоящего изобретения
Настоящее изобретение предоставляет кристаллические соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольват. Активный терапевтический агент в этих солях (т.e. соединение формулы I) содержит один хиральный центр, имеющий (R) конфигурацию. Однако специалистам в данной области техники очевидно, что в композициях настоящего изобретения может быть представлено небольшое количество (S) стереоизомера, если явно не указано противное, при условии, что наличие такого изомера в целом не влияет негативно на полезные свойства композиции настоящего изобретения.
Название соединения формулы I было составлено, используя коммерчески доступное программное обеспечение AutoNom (MDL, San Leandro, California). Кроме того, 1,2-этандисульфоновые соли иногда также называют эдизилатами.
Определения
При описании соединений, композиций, способов и процессов настоящего изобретения нижеприведенные термины имеют следующие значения, если явно не указано противное.
Термин "точка плавления", как используется в настоящем описании, означает температуру, при которой наблюдают максимальный эндотермический тепловой поток при помощи дифференциальной сканирующей калориметрии.
Термин "микронизированная форма" означает форму частиц, при которой, по меньшей мере, примерно 90% частиц имеют диаметр, меньший чем примерно 10 мкм.
Термин "сольват" означает комплекс или агрегат, образованный одной или несколькими молекулами растворенного вещества, т.e. соль 1,2-этандисульфоновой кислоты соединения формулы I, и одной или несколькими молекулами растворителя. Такие сольваты обычно имеют по существу молярное отношение растворенного вещества и растворителя. Этот термин также включает клатраты, включая клатраты с водой. Репрезентативные растворители включают, в качестве примера, воду, метанол, этанол, изопропанол, уксусную кислоту и т.п. Когда растворитель представляет собой воду, образованный сольват является гидратом.
Термин "терапевтически эффективное количество" означает количество, достаточное для эффективного лечения при введении нуждающемуся в лечении пациенту.
Термин "лечение" или "терапия", как используется в настоящем описании, означает лечение или терапию заболевания или медицинского состояния (такого как ХОЗЛ) у пациента, например млекопитающего (в частности, человека), которое включает:
(a) предупреждение проявления заболевания или медицинского состояния, т.e. профилактическая терапия пациента;
(b) облегчение заболевания или медицинского состояния, т.e. устранение или ослабление симптомов заболевания или медицинского состояния у пациента;
(c) сдерживание заболевания или медицинского состояния, т.e. замедление или купирование развития заболевания или медицинского состояния у пациента; или
(d) ослабление симптомов заболевания или медицинского состояния у пациента.
Термин "единичная дозированная форма" относится к физически дискретной единице, подходящей для дозировки пациенту, т.e. каждая единица содержит заданное количество соли настоящего изобретения, рассчитанное для получения желательного терапевтического эффекта либо отдельно, либо в комбинации с одной или несколькими дополнительными единицами. Например, такие единичные дозированные формы могут представлять собой капсулы для ингалятора с сухим порошком, отмеренные дозированные формы, отмеренные дозы для ингалятора, капсулы, таблетки, пилюли и т.п.
Соли 1,2-этандисульфоновой кислоты настоящего изобретения
Кристаллическая соль 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты настоящего изобретения может быть получена из 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты и 1,2-этандисульфоновой кислоты или ее гидрата.
Соль 1,2-этандисульфоновой кислоты настоящего изобретения обычно содержит от примерно 0,90 до примерно 1,10 молярных эквивалентов 1,2-этандисульфоновой кислоты на молярный эквивалент соединения формулы I; включая от примерно 0,95 до примерно 1,05 молярных эквивалентов 1,2-этандисульфоновой кислоты на молярный эквивалент соединения формулы I. В конкретном варианте осуществления соль 1,2-этандисульфоновой кислоты настоящего изобретения содержит примерно 1 молярный эквивалент 1,2-этандисульфоновой кислоты на молярный эквивалент соединения формулы I.
Молярное отношение 1,2-этандисульфоновой кислоты к 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты может быть легко определено различными способами, доступными специалистам в данной области техники. Например, такое молярное отношение может быть легко определено 1H ЯМР. В качестве альтернативы, для определения молярного отношения могут быть использованы способы элементного анализа и ВЭЖХ.
1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-иловый эфир бифенил-2-илкарбаминовой кислоты, используемый в настоящем изобретении, может быть легко получен из коммерчески доступных исходных веществ и реагентов при помощи процедур, описанных в нижеприведенных примерах; или при помощи процедур, описанных в опубликованной заявке на патент США в разделе "Уровень техники, к которому относится изобретение".
1,2-этандисульфоновая кислота коммерчески доступна от, например, Alfa Chemicals Ltd., Berkshire, UK. В одном из вариантов осуществления 1,2-этандисульфоновая кислота, используемая для получения солей настоящего изобретения, представляет собой дигидрат. В конкретном варианте осуществления дигидрат 1,2-этандисульфоновой кислоты имеет чистоту, превышающую или равную 97% (как определено ВЭЖХ). При желании дигидрат 1,2-этандисульфоновой кислоты, используемый в настоящем изобретении, до применения может быть перекристаллизован, например, из уксусной кислоты или уксусного ангидрида.
Для получения кристаллической соли настоящего изобретения 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-иловый эфир бифенил-2-илкарбаминовой кислоты обычно приводят в контакт с примерно 0,75-1,3 молярными эквивалентами 1,2-этандисульфоновой кислоты или ее гидрата. Обычно эту реакцию выполняют в инертном разбавителе при температуре, находящейся в пределах от примерно 0°С до примерно 60°C; включая примерно 20°C до примерно 55°C, например, от примерно 25°C до примерно 50°C. Подходящие инертные разбавители для этой реакции включают, без ограничений, метанол, этанол, изопропанол, изобутанол, этилацетат, дихлорметан и т.п., необязательно содержащие воду. В конкретном варианте осуществления раствор дигидрата 1,2-этандисульфоновой кислоты в этаноле добавляли в примерно в пять раз больший объем 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты в смеси изопропанола и дихлорметана (64:1). В конкретном варианте осуществления раствор дигидрата 1,2-этансульфоновой кислоты включает воду или этанол в качестве разбавителя, а раствор 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты включает изопропанол или этанол в качестве разбавителя.
В качестве альтернативы, кристаллическую соль 1,2-этандисульфоновой кислоты соединения формулы I можно получить путем приведения в контакт силил-защищенного производного соединения формулы I (т.e. соединения формулы II) с источником фторид-иона и затем, в том же реакционном сосуде, путем приведения в контакт с 1,2-этандисульфоновой кислотой или ее гидратом. В конкретном варианте осуществления силил-защитная группа представляет собой трет-бутилдиметилсилиловую группу. Другие подходящие силил-защитные группы включают трет-бутилдифенилсилил, дифенилметилсилил, ди-трет-бутилметилсилил, трет-бутоксидифенилсилил и т.п. Источник фторид-иона, используемый в этом способе, может представлять собой любой реагент, включающий или содержащий фторид-ион или фтороводород. В конкретном варианте осуществления источник фторид-иона представляет собой триэтиламина тригидрофторид. Другие подходящие источники фторид-иона включают тетрабутиламмония фторид, фторид калия с 18-краун-6, фтороводород, пиридин гидрофторид и т.п.
В общем случае этот способ выполняют в инертном разбавителе при температуре, находящейся в пределах от примерно 0°C до примерно 50°C; включая от примерно 20°C до примерно 35°C, например, от примерно 25°C до примерно 30°C. Подходящие инертные разбавители для этой реакции включают, без ограничений, дихлорметан, метанол и их смеси. В конкретном варианте осуществления раствор 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты оставляют в контакте с примерно 2,5-3,0 молярными эквивалентами триэтиламина тригидрофторида в дихлорметане при температуре окружающей среды в течение от примерно 12 до примерно 24 часов или до тех пор, пока по существу силильная группа не будет полностью удалена. В полученный раствор без выделения продукта реакции добавляют от примерно 0,9 до примерно 1,1 молярных эквивалентов дигидрата 1,2-этандисульфоновой кислоты в метаноле и эту смесь нагревают при температуре от примерно 25°C до примерно 35°C в течение от примерно 2 до примерно 6 часов. При полном завершении реакции кристаллическую соль 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты выделяют из реакционной смеси обычными средствами, такими как осаждение, концентрация, центрифугирование и т.п.
Необязательно, кристаллическая соль 1,2-этандисульфоновой кислоты настоящего изобретения может быть дополнительно очищена путем перемешивания или смешивания соли с изопропанолом, содержащим от примерно 15% до примерно 25%, включая примерно 20% воды по объему. В конкретном варианте осуществления используют от примерно 10 мл смеси изопропанол/вода на грамм соли 1,2-этандисульфоновой кислоты.
Способ получения кристаллической соли 1,2-этандисульфоновой кислоты настоящего изобретения необязательно может включать использование затравочного кристалла для преимущественного получения конкретной кристаллической соли. Например, путем использования затравочного кристалла кристаллической соли, имеющей более высокую точку плавления (например, выше чем примерно 230°C), может быть получена кристаллическая соль 1,2-этандисульфоновой кислоты соединения формулы I, которая имеет по существу такую же точку плавления, что и у затравочного кристалла. Такие затравочные кристаллы могут быть использованы для первоначального образования кристаллической соли, или они могут быть использованы для перекристаллизации кристаллической или частично кристаллической соли.
Обычно затравочные кристаллы получают в небольших количествах путем медленной кристаллизации без перемешивания и без применения охлаждения. Например, для получения затравочных кристаллов кристаллическую соль обычно растворяют в инертном разбавителе при температуре, достаточной для растворения. Обычно в начальном способе получения затравочных кристаллов используется небольшое количество, обычно меньше чем 10 г, включая меньше чем 5 г, например, меньше чем 1 г, кристаллической соли. В конкретном варианте осуществления метанол, содержащий от примерно 12% до примерно 20% воды, включая от примерно 13% до примерно 15% воды, используется в качестве разбавителя при температуре, находящейся в пределах от примерно 60°C до примерно 70°C, например, от примерно 60°C до примерно 65°C. Раствор охлаждают до комнатной температуры. Спустя примерно 1-3 дня полученные кристаллы выделяют фильтрованием или другим обычным способом. В качестве альтернативы, затравочные кристаллы могут быть получены из предыдущего способа получения кристаллического вещества.
В способе перекристаллизации при помощи затравочных кристаллов кристаллическую соль 1,2-этандисульфоновой кислоты настоящего изобретения растворяют в инертном разбавителе, как в способе получения затравочных кристаллов, обычно в метаноле, содержащем 15% воды, при температуре, находящейся в пределах от примерно 60°C до примерно 65°C. Раствор охлаждают до температуры, при которой затравочные кристаллы не растворяются, например до температуры, находящейся в пределах от примерно 30°C до примерно 40°C, и затем добавляют затравочные кристаллы. Обычно, отношение веса затравочных кристаллов к весу кристаллической соли в растворе находится между примерно 1:5 и примерно 1:35. Раствор охлаждают до температуры, при которой происходит кристаллизация, например до примерно 20°C, и перемешивают в течение от примерно 2 часов до примерно 24 часов. Полученные кристаллы выделяют обычными способами. Для получения достаточного количества затравочных кристаллов для приготовления больших партий вещества способ перекристаллизации может быть успешно выполнен с использованием кристаллов, полученных при помощи первой перекристаллизации, в качестве затравочных кристаллов для следующей стадии перекристаллизации. Очевидно, что определенные температуры, при которых выполняют стадии способа перекристаллизации, выбирают в зависимости от характера разбавителя и концентрации кристаллической соли в растворе. Кроме того, способ перекристаллизации может быть выполнен либо путем испарения, либо при помощи антирастворителя для облегчения кристаллизации, вместо охлаждения.
Помимо других преимуществ, было обнаружено, что образование кристаллической соли 1,2-этандисульфоновой кислоты соединения формулы I полезно для очистки соединения формулы I. Обычно, кристаллическая соль 1,2-этандисульфоновой кислоты настоящего изобретения имеет чистоту, превышающую 95%; и обычно превышающую 98%, как определено при помощи высокоэффективной жидкостной хроматографии.
Кристаллическая соль 1,2-этандисульфоновой кислоты настоящего изобретения характеризуется высокой точкой плавления, что подтверждено графиками дифференциальной сканирующей калориметрии (DSC), которые имеют пик в эндотермическом тепловом потоке в диапазоне от примерно 215°C до примерно 240°C. Обнаружено, что температура точки плавления кристаллической соли зависит от способа, при котором образуется кристаллическая соль. Затравочные кристаллы, образованные медленной кристаллизацией без перемешивания и без применения охлаждения, показывают точки плавления, превышающие примерно 230°C. Кристаллические соли, образованные способом, включающим перекристаллизацию с применением таких затравочных кристаллов, обычно показывают точки плавления в пределах от примерно 230°C до примерно 245°C, как показано, например, на фиг.1. Кристаллические соли, образованные без затравочных кристаллов, имеющих точку плавления, превышающую примерно 230°C, обычно показывают точки плавления в пределах от примерно 215°C до примерно 229°C, как показано, например, на фиг.2. В конкретных вариантах осуществления, следовательно, настоящее изобретение предоставляет кристаллическую соль 1,2-этандисульфоновой кислоты соединения формулы I, имеющую график DSC в диапазоне температур, превышающих примерно 200°C, что по существу соответствует графику, показанному на фиг.1, или графику, показанному на фиг.2.
В другом варианте осуществления кристаллическая соль 1,2-этандисульфоновой кислоты настоящего изобретения характеризуется порошковой рентгенограммой (PXRD), имеющей по существу пики дифракции при 2θ значениях от 5,0 ±0,3 до 15,0 ±0,3. Между положениями пиков в спектре PXRD кристаллической соли, полученной перекристаллизацией из затравочных кристаллов с высокой точкой плавления, как показано на фиг.3, и положениями пиков соли, полученной без использования такого затравочного кристалла, как показано на фиг.4, могут наблюдаться трудноуловимые различия. Соответственно, в отдельных вариантах осуществления кристаллическая соль 1,2-этандисульфоновой кислоты соединения формулы I характеризуется порошковой рентгенограммой, в которой положения пиков по существу соответствуют положениям пиков, показанным на фиг.3, или положениям пиков, показанным на фиг.4.
В другом варианте осуществления кристаллическая соль 1,2-этандисульфоновой кислоты соединения формулы I характеризуется инфракрасным (ИК) спектром поглощения, который показывает значимые полосы поглощения примерно при 704, 748, 768, 841, 900, 1055, 1104, 1166, 1218, 1294, 1408, 1522, 1609, 1655 и 1701 см-1, как показано на фиг.5.
Показано, что кристаллическая соль 1,2-этандисульфоновой кислоты соединения формулы I имеет взаимообратные профили сорбции/десорбции с допустимым со средним уровнем гигроскопичности (т.e. меньше чем примерно 2,5% увеличение веса в диапазоне влажности от 40% относительной влажности до 75% относительной влажности).
Эти свойства солей настоящего изобретения дополнительно проиллюстрированы нижеприведенными примерами.
Фармацевтические композиции и лекарственные формы
Соль 1,2-этандисульфоновой кислоты соединения формулы I обычно вводят пациенту в виде фармацевтической композиции или лекарственной формы. Такие фармацевтические композиции могут быть введены пациенту любым подходящим способом введения, включая, без ограничения, ингаляцию, пероральный, назальный, топический (включая трансдермальный) и парентеральный способы введения. Однако специалистам в данной области техники известно, что после образования кристаллической соли настоящего изобретения она может больше не находиться в кристаллической форме, т.e. соль может быть растворена в подходящем носителе.
Следовательно, в одном из аспектов композиций настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или вспомогательное вещество и соль 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольват. Необязательно, такие фармацевтические композиции могут содержать другие терапевтические агенты и/или агенты для лекарственных форм, если это необходимо.
Фармацевтические композиции настоящего изобретения обычно содержат терапевтически эффективное количество соли 1,2-этандисульфоновой кислоты 1-[2-(2-хлор-4-{[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил}-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты или ее сольвата. Обычно, такие фармацевтические композиции могут содержать от примерно 0,01 до примерно 95% по весу активного агента; включая от примерно 0,01 до примерно 30% по весу; например, от примерно 0,01 до примерно 10% по весу активного агента.
В фармацевтических композициях настоящего изобретения может быть использован любой обычный носитель или вспомогательное вещество. Выбор фармацевтического носителя или вспомогательного вещества или комбинаций носителей или вспомогательных веществ будет зависеть от режима введения, используемого для лечения конкретного пациента, или типа медицинского состояния, или состояния заболевания. В этом отношении изготовление растворимой фармацевтической композиции для конкретного режима введения хорошо известно специалистам в области фармацевтики. Кроме того, ингредиенты для таких композиций коммерчески доступны от, например, Sigma, P.O. Box 14508, St. Louis, MO 63178. В качестве дополнительной иллюстрации обычные техники составления лекарственных форм описаны у Remington: The Science and Practice of Pharmacy, 20-th Edition, Lippincott Williams & White, Baltimore, Maryland (2000); and H.C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7-th Edition, Lippincott Williams & White, Baltimore, Maryland (1999).
Характерные примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, без ограничений, следующие: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлоза; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) вспомогательные вещества, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) растворы фосфатного буфера; (21) сжатые газы-пропелленты, такие как хлорфторуглеводороды и гидрофторуглеводороды; и (22) другие нетоксичные совместимые вещества, используемые в фармацевтических композициях.
Фармацевтические композиции настоящего изобретения обычно получают путем тщательного перемешивания до однородной массы или путем смешивания соли настоящего изобретения с фармацевтически приемлемым носителем и одним или несколькими дополнительными ингредиентами. При необходимости или по желанию полученная смешанная до однородной массы смесь затем может быть формована или введена в таблетки, капсулы, пилюли, контейнеры, картриджи, диспенсеры и т.п., используя обычные процедуры и оборудование.
В одном из вариантов осуществления фармацевтические композиции настоящего изобретения являются подходящими для ингаляционного введения. Подходящие фармацевтические комп