Новые производные 2,4-диаминотиазол-5-она
Иллюстрации
Показать всеИзобретение относится к соединениям формулы I и их фармацевтически приемлемым солям и сложным эфирам. Соединения настоящего изобретения обладают ингибирующей активностью в отношении циклин-зависимых киназ. В формуле I
R1 означает , R3 выбирают из группы, состоящей из Н, CO2R6, C(O)R6, SO2R6 и SO2NR5R6, R5 и R6 каждый независимо выбирают из группы, включающей Н и (низш.)алкил, R2 означает фенил, содержащий один, два или три заместителя, независимо выбранных из группы, включающей галоген или -O-(низш.)алкил. Изобретение также относится к фармацевтической композиции, включающей в качестве активного ингредиента эффективное количество соединения формулы I. 2 н. и 4 з.п. ф-лы, 1 табл.
Реферат
Изобретение относится к новым производным 4-аминотиазола, которые ингибируют циклин-зависимые киназы. Указанные соединения и их фармацевтически приемлемые соли и эфиры обладают антипролиферативной активностью и используются для лечения или подавления развития рака, прежде всего солидных опухолей. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим такие соединения, и к способам лечения или подавления развития рака, наиболее предпочтительно лечения и подавления роста опухолей молочной железы, легких, ободочной кишки и предстательной железы. Наконец, настоящее изобретение относится к новым промежуточным соединениям, которые используются при получении описанных в тексте заявки новых производных 4-аминотиазола.
Неконтролируемая пролиферация клеток является маркером рака. Опухолевые клетки обычно содержат какую-либо форму повреждения генов, которые непосредственно или опосредованно регулируют цикл клеточного деления.
Развитие клеток в различных фазах клеточного цикла регулируется серией мультиферментных комплексов, состоящих из регуляторного белка циклина и киназы. Такие киназы называются циклин-зависимыми киназами (Cdk). Киназы Cdk экспресссируются в ходе клеточного цикла, в то время как уровень циклинов изменяется в зависимости от стадии клеточного цикла.
Четыре главных фазы клеточного цикла называются G1, S, G2 и M. Ключевыми ферментами регуляции клеточного цикла являются циклин D/Cdk4, циклин D/Cdk6, циклин E/Cdk2, циклин A/Cdk2 и циклин B/Cdk1 (известный также, как Cdc2/циклин В). Циклин D/Cdk4, циклин D/Cdk6 и циклин E/Cdk2 контролируют прохождение G1-фазы и переход из G1- в S-фазу за счет фосфорилирования фосфопротеина ретинобластомы pRb. Циклин A/Cdk2 регулирует прохождение S-фазы, а циклин B/Cdk1 контролирует точку контроля G2 и регулирует вступление в М фазу (митоз).
Развитие клеточного цикла регулируется киназами Cdk1 (cdc2) и Cdk2 сразу после G1, когда клетки переходят к цитокинезу. Следовательно, можно предположить, что ингибирование лекарственными средствами указанных киназ Cdk не только блокирует клеточную пролиферацию, но и инициирует гибель клеток за счет апоптоза. После перехода клеток через точку контроля G1 и вступления в S фазу они становятся независимыми от стимуляции ростовым фактором для развития клеточного цикла.
После завершения репликации ДНК клетки переходят в G2 фазу клеточного цикла для подготовки к М фазе и цитокинезу. Установлено, что киназа Cdk1 регулирует прохождение клетками через две последние фазы клеточного цикла в ассоциации с циклинами А и В. Для полной активации Cdk1 необходимо связывание обоих циклинов и специфическое фосфорилирование (Morgan D.O., De Bondt H.L., Curr. Opin. Cell. Biol., 6, 239-246 (1994)). После активации комплексы Cdk1/циклин подготавливают клетку к делению в течение М фазы.
Переход из фазы G1 в фазу S, указанный выше, регулируется комплексом Cdk4 с циклином D и Cdk2 с циклином Е. Указанные комплексы фосфорилируют опухолевый супрессорный белок ретинобластомы (pRb), высвобождая фактор транскрипции E2F и способствуя экспресии генов, необходимых в S фазе (Nevins J.R., Science, 258, 424-429 (1992), Lavia P., BioEssays, 21, 221-230 (1999)). Блокирование активности комплексов Cdk4/циклин D и Cdk2/циклин Е останавливает клеточный цикл в фазе G1. Например, белки семейства INK4, включая белок p16INK4a, который блокирует киназную активность комплекса Cdk4/циклин D, вызывает остановку в фазе G1 (Sherr C.J., Science, 274, 1672-1677 (1996)). Специфичность блока подробно описана в литературе (см. статью Vidal A., Gene, 247, 1-15 (2000)).
Современные данные свидетельствуют о том, что комплекс Cdk4 с циклином D3 также играет определенную роль в развитии клеточного цикла при прохождении фазы G2. Ингибирование этого комплекса белком р16 или с использованием доминантно негативной Cdk4 приводит к остановке в фазе G2 клеток, которые не экспрессируют pRb (Gabrielli B.G. и др., J. Biol. Chem., 274, 13961-13969 (1999)).
Установлено, что многочисленные дефекты в пути pRb наблюдаются при различных видах рака. Например, сверхэкспрессия Cdk4 наблюдается в случаях наследственной меланомы (Webster K.R., Exp. Opin. Invest. Drugs, 7, 865-887 (1998)), циклин D сверхэкспрессирован во многих видах рака человека (Sherr C.J., Science, 274, 1672-1677 (1996)), белок р16 мутирован или отсутствует во многих опухолях (Webster K.R., Exp. Opin. Invest. Drugs, 7, 865-887 (1998)), a функция pRb утрачена из-за мутаций или делеции при многих типах рака человека (Weinberg R.A., Cell, 81, 323-330 (1995)). Установлено, что дефекты в этом пути оказывают влияние на прогноз. Например, потеря белка р16 коррелирует с отрицательным прогнозом при немелкоклеточной карциноме легких (NSCLC) и злокачественной меланоме (Tsihlias J. и др., Annu. Rev. Med., 50, 401-423 (1999)). Дефекты циклина D1 и/или pRb на уровне гена и/или экспрессии присутствуют в более 90% случаев немелкоклеточного рака легких, свидетельствуя о том, что циклин D1 и/или pRb представляют собой важную стадию в процессе онкогенеза легких (Marchetti А. и др., Int. J. Cancer, 75, 573-582 (1998)). В 49 из 50 случаев карциномы поджелудочной железы (98%) путь pRb/pl6 подавляется исключительно за счет инактивации гена белка р16 и связанного с ним циклина D (Schutte M. и др., Cancer Res., 57, 3126-3134 (1998)). Взаимосвязь экспрессии pRb и циклин/циклин-зависимых киназ в ряде тканей описана в статье Teicher В.A., Cancer Chemother. Pharmacol., 46, 293-304 (2000).
В связи с участием пути Cdk4/циклин D/pRb в процессее онкогенеза в организме человека за счет регуляции перехода клеточного цикла из фазы G1 в фазу S, и благодаря эффективному лечебному действию при модулировании этого пути, существует необходимость в разработке агентов, которые ингибируют или стимулируют отдельные стадии этого пути. Например, установлено воздействие на раковые клетки антител, антисмысловых олигонуклеотидов и сверхэкспрессии или при добавлении белков, принимающих участие в этом пути. См., например, Lukas J. и др., Nature, 79, 573-582 (1995), Nevins J.R., Science, 258, 424-429 (1992), Lim I.K. и др., Molecular Carcinogenesis, 23, 25-35 (1998), Tam S.W. и др., Oncogene, 9, 2663-2674 (1994), Driscoll В. и др., Am.J. Physiol., 273 (Lung Cell. Mol. Physiol.), L941-L949 (1997) и Sang J. и др., Chin. Sci. Bull., 44, 541-544 (1999)).
Роль киназ cdk в регуляции клеточной пролиферации является таким образом вполне доказанной. Например, как указано выше, существует множество данных, подтверждающих возможность применения соединений, ингибирующих мишени в путях Cdk4, Cdk2 и Cdk1, в качестве антипролиферативных терапевтических агентов. Таким образом, ингибиторы клеточной пролиферации действуют в качестве обратимых цитостатических агентов, которые применяются при лечении патологических состояний, ассоциированных с аномальным ростом клеток, таких, как различные типы рака и другие нарушения пролиферации клеток, включающие, например, воспалительный процесс (например, доброкачественную гиперплазию предстательной железы, семейный аденоматоз, полипоз, нейрофиброматоз, атеросклероз, фиброз легких, артрит, псориаз, воспалительное заболевание кишечника, инфекции в связи с отторжением трансплантата), вирусные инфекции (включая, без ограничения перечисленным, вирус герпеса, поксвирус, вирус Эпштейна-Барра), аутоиммунное заболевание (например, обыкновенная волчанка, ревматоидный артрит, псориаз, воспалительное заболевание кишечника), нейродегенеративные нарушения (включая, без ограничения перечисленным, болезнь Альцгеймера) и нейродегенеративные заболевания (например, болезнь Паркинсона, боковой амиотрофический склероз, пигментный ретинит, мышечная атрофия и церебральная дегенерация).
В качестве ингибиторов киназ Cdk идентифицировано несколько отдельных классов низкомолекулярных соединений: оломоуцин и другие аналоги пурина, флавопиридол, стауроспорин, UCN-01 и другие индолокарбазолы, 9-гидроксиэллиптицин, индирубин, пауллоны, диарилмочевины, хиназолины, индопиразолы, [2, 3-d]пиридопиримидины, фаскаплизин, аминотиазолы, диаминотиазолы, пара-теридиноны и пиразолы (Carlson и др., Cancer Res., 56, 2973-2978 (1996), De Azevedo и др., Eur. J. Biochem., 243, 518-526 (1997), Bridges A.J., Exp. Opin. Ther. Patents., 5, 1245-1257 (1995), Reinhold и др., J. Biol. Chem., 278, 3803-3807 (1998), Kakeya H. и др., Cancer Res., 58, 704-710 (1998), Harper J.W., Cancer Surveys, 29, 91-107 (1997), Harrington E.A. и др., Proc. Natl. Acad. Sci. USA, 95, 11945-11950 (1998), Meijer L. и др., Eur. J. Biochem., 267, 1-13 (2000), Garrett M.D. и др., Current Opin. Genetics Develop., 9, 104-111 (1999), Mgbonyebi О.Р. и др., Cancer Res., 59, 1903-1910 (1999), Hoessel и др., Nature Cell Biology, 1, 60-67 (1999), Zaherevitz и др., Cancer Res., 59, 2566-2569 (1999), Honma Т. и др., 221st National ACS Meeting., Medi 136 (2001). Sielecki T.M. и др., Bioorg. Med. Chem. Lett., 11, 1157-1160 (2001), Nugiel D.A. и др., J. Med. Chem., 44, 1334-1336 (2001), Fry D.W. и др., J. Biol. Chem., 276, 16617-15523 (2001), Soni R. и др., Biochem. Biophys. Res. Commun., 275, 877 (2000), Ryu C-K. и др., Bioorg. Med. Chem. Lett., 10, 461 (2000), Jeong H-W. и др., Bioorg. Med. Chem. Lett., 10, 1819 (2000), Toogood и др., J. Med. Chem., 43, 4606-4616 (2000), Chong W., Fischer, Curr. Opin. in Drug Discov. and Develop., 4, 623-634 (2001), WO 0009921845, Toogood. P., WO 0119825, Toogood P., WO 0138315, Reich S.H., WO 0179198, Webster K. US 6262096.
Обзор соединений, ингибирующих путь Cdk4/циклин D, приводится в литературе, см. Harris W. и Wilkinson S., Emerging Drugs, 5, 287-297 (2000), Dumas J., Exp. Opin. Ther. Patents., 11, 405-429 (2001), Sielecki Т. и др., J. Med. Chem., 43, 1-18 (2000), WO 99/21845, 6569878 B1, 2003/0220326 A1 и WO 2003011843 A1, причем в каждом указанном документе описаны 4-аминотиазолы общей формулы
.
Установлено, что указанные соединения являются ингибиторами циклин-зависимых киназ.
Настоящее изобретение относится к новым производным 4-аминотиазола формулы
,
где
R1 выбирают из группы, включающей
(a) (низш.)алкил, замещенный арилом,
(b)
, и
(с)
R2 выбирают включающей арил, гетероарил, циклоалкил и гетероцикл, причем каждый из них замещен 1-4 заместителями, назависимо выбранными из группы, включающей (а) (низш.)алкил, (b) галоген, (с) OR5, (d) NH2 и (е) NO2,
R3 выбирают из группы, включающей (а) H, (b) (низш.)алкил, (с) CO2R6,
(d) C(O)R6, (e) SO2R6 и (f) SO2NR5R6,
R4 и R4' каждый независимо выбирают из группы, включающей (а) Н, (b) (низш.)алкил, необязательно замещенный группами оксо, CO2R6, OR6 и/или NH2, (с) S(O)nR7, (d) OR8, (e) NR5R6 и (f) CO2R6,
R5 и R6 каждый независимо выбирают из группы, включающей (а) Н, (b) N, (c) (низш.)алкил, (d) (низш.)алкил, замещенный группами оксо, CO2R9, OR9, и/или NR10R11, (e) арил, необязательно замещенный галогеном, (f) гетероарил, (g) N-арил, где арильная группа необязательно замещена одним или более галогенами, и (h) арил, замещенный галогеном или CF3,
R7 означает (низш.)алкил или арил,
R8 выбирают из группы, включающей (а) Н, (b) (низш.)алкил и (с) (низш.)алкил, замещенный NR5R6,
R9 выбирают из группы, включающей Н и (низш.)алкил,
R10 и R11 каждый независимо выбирают из группы, включающей Н и (низш.)алкил, а
n равно 0, 1 или 2,
или к их фармацевтически приемлемым солям или сложным эфирам.
Указанные соединения ингибируют циклин-зависимые киназы. Указанные соединения и их фармацевтически приемлемые соли и сложные эфиры обладают антипролиферативной активностью и используются при лечении или подавлении развития рака, прежде всего солидных опухолей.
Настоящее изобретение относится также к фармацевтическим композициям, включающим одно или более соединений по изобретению или их фармацевтически приемлемую соль или эфир и фармацевтически приемлемый носитель или эксципиент.
Кроме того, настоящее изобретение относится к применению соединений формулы I для получения лекарственных средств, предназначенных для лечения рака, предпочтительно солидных опухолей и более предпочтительно рака молочной железы, легких, ободочной кишки и предстательной железы.
Кроме того, настоящее изобретение относится к способу лечения или подавления развития рака, прежде всего для лечения или подавления развития солидных опухолей, наиболее предпочтительно для лечения или подавления развития рака молочной железы, легких, ободочной кишки и предстательной железы, причем указанный способ включает введение пациенту, который нуждается в таком лечении, терапевтически эффективного количества соединений формулы I или его фармацевтически приемлемой соли или эфира.
Наконец, настоящее изобретение относится к новым промежуточным соединениям, которые используются для получения соединений формулы I.
Термины, используемые в описании заявки, имеют следующие значения.
«Арил» означает одновалентный моноциклический или бициклический ароматический карбоциклический углеводородный радикал, предпочтительно 6-10-членную ароматическую циклическую систему. Предпочтительные арильные группы включают, без ограничения перечисленным, фенил, нафтил, толил и ксилил.
«Циклоалкил» означает неароматический, частично или полностью насыщенный одновалентный циклический углеводородный радикал, содержащий от 3 до 8 атомов. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил и циклогексил.
«Эффективное количество» означает количество (материала), которое эффективно предотвращает, ослабляет или подавляет симптомы заболевания или продлевает срок жизни субъекта, нуждающегося в лечении.
«Галоген» означает фтор, хлор, бром или иод, предпочтительно фтор или хлор.
«Гетероатом» означает атом, выбранный из N, О и S.
«Гетероарил» означает ароматическую гетероциклическую циклическую систему, содержащую до двух циклов. Предпочтительные гетероарильные группы включают, без ограничения перечисленным, тиенил, фурил, индолил, пирролил, пиридинил, пиридин, пиразинил, оксазолил, тиаксолил, хинолинил, пиримидинил, имидазол, бензофуран и тетразолил.
«Гетероциклил» означает насыщенный или частично ненасыщенный неароматический циклический радикал, содержащий в цикле 3-8 атомов, из которых 1-3 атома являются гетероатомами, выбранными из атомов азота, кислорода, S(O)n (где n равно целому числу от 0 до 2), или из их комбинаций, а остальные атомы в цикле являются атомами углерода. Примерами предпочтительных гетероциклилов являются пиперидин, пиперазин, пирролидин, морфолин, индолин, тетрагидропиранил, тиоморфолино, пентаметиленсульфид и пентаметиленсульфон.
«KI» является мерой термодинамического связывания лиганд/ингибитор (т.е. соединения по изобретению) с белком-мишенью. Ki определяют, как описано ниже в примере 18.
Термин «(низш.)алкил», используемый отдельно или в составе другого термина, например, (низш.)алкилгетероциклил, означает насыщенный алифатический углеводород с прямой или разветвленной цепью, содержащий от 1 до включительно 6, предпочтительно от 1 до 4 атомов углерода. Типичные (низш.)алкильные группы включают метил, этил, пропил, изопропил, бутил, трет-бутил, 2-бутил, пентил, гексил и т.п.
«Оксо» означает группу =O.
«Фармацевтически приемлемый сложный эфир» означает этерифицированное соединение формулы I, содержащее карбоксильную группу, причем сложные эфиры сохраняют биологическую активность и свойства соединений формулы I и расщепляются in vivo (в организме) с образованием соответствующей активной карбоновой кислоты. Примерами сложноэфирных групп, которые расщепляются (в данном случае гидролизуются) in vivo с образованием соответствующих карбоновых кислот (R40C(=O)ОН), являются (низш.)алкиловые эфиры, замещенные группой NR41R42, где R41 и R42 означают (низш.)алкил, или где NR41R42 вместе образуют моноциклический алифатический гетероцикл, такой, как пирролидин, пиперидин, морфолин, N-метилпиперазин и т.п.; ацилоксиалкиловые эфиры формулы R40C(=O)OCHR43OC(=O)R44, где R43 означает водород или метил, а R44 означает (низш.)алкил или циклоалкил; эфиры угольной кислоты (карбонаты) формулы R40C(=O)OCHR43OC(=O)OR45, где R43 означает водород или метил, а R45 означает (низш.)алкил или циклоалкил; или аминокарбонилметиловые эфиры формулы R40C(=O)OCH2C(=O)NR41R42, где R41 и R42 означают водород или (низш.)алкил, или где NR41R42 вместе образуют моноциклический алифатический гетероцикл, такой, как пирролидин, пиперидин, морфолин, N-метилпиперазин и т.п. В описании заявки R40 имеет значения, аналогичные значениям R2, R3, R4 и R4'.
Примерами (низш.)алкиловых эфиров являются метиловый, этиловый и н-пропиловый эфиры и т.п. Примерами (низш.)алкиловых эфиров, замещенных группой NR41R42, являются диэтиламиноэтиловый, 2-(4-морфолинил)этиловый и 2-(4-метилпиперазин-1-ил)этиловый эфиры и т.п. Примеры ацилоксиалкиловых эфиров являются пивалоилоксиметиловый, 1-ацетоксиэтиловый и ацетоксиметиловый эфиры. Примерами эфиров угольной кислоты являются 1-(этоксикарбонилокси)этиловый и 1-(циклогексилоксикарбонилокси)этиловый эфиры. Примерами аминокарбонилметиловых эфиров являются N,N-диметилкарбамоилметиловый и карбамоилметиловый эфиры.
Дополнительная информация относительно примеров и применения эфиров для доставки фармацевтических соединений содержится в монографии Design of Prodrugs, Bundgaard H ed., Elsevier (1985). См. также Н.Ansel и др., Pharmaceutical Dosage Forms and Drug Delivery Systems, 6th Ed., 108-109 (1995), Krogsgaard-Larsen и др., Textbook of Drug Design and Development, 2d Ed., 152-191 (1996).
«Фармацевтически приемлемая соль» означает обычные кислотно-аддитивные соли или основно-аддитивные соли, которые сохраняют биологическую активность и свойства соединений формулы I и образуются из пригодных нетоксических органических или неорганических кислот или органических или неорганических оснований. Примеры кислотно-аддитивынх солей включают соли неорганических кислот, таких, как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и соли органических кислот, таких, как пара-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и т.п. Примеры основно-аддитивных солей включают соли аммония, калия, натрия и гидроксидов четвертичного аммонийного основания, таких например, как гидроксид тетраметиламмония. Химическая модификация фармацевтического соединения (т.е. лекарственного средства) с образованием соли известна фармакологам и используется для повышения физической и химической стабильности, улучшения гигроскопичности, текучести и растворимости соединений. См., например, Н.Ansel и др., Pharmaceutical Dosage Forms and Drug Delivery Systems, 6th Ed., 196, 1456-1457 (1995).
«Фармацевтически приемлемый», такой, как фармацевтически приемлемый носитель, эксципиент и т.п., означает фармакологически приемлемый материал и в основном нетоксичный для субъекта, которому вводится указанное соединение.
«Замещенный», такой, как замещенный алкил, означает, что заместитель находится в одном или более положений, если не указано иное, а заместители в каждом положении независимо выбирают из указанных значений.
«Терапевтически эффективное количество» означает количество по меньшей мере одного соединения формулы I или его фармацевтически приемлемой соли или эфира, которое эффективно ингибирует пролиферацию и/или предотвращает дифференциацию опухолевых клеток человека, включая клеточные линии опухолей человека.
В одном предпочтительном варианте осуществления настоящего изобретения предлагаются соединения формулы I, где
R1 выбирают из группы, включающей (низш.)алкил, замещенный арилом,
и ,
R2 выбирают из группы, включающей арил, гетероарил, циклоалкил и гетероциклил, каждый из которых содержит 1-4 заместителя, независимо выбранных из группы, включающей (низш.)алкил, галоген, OR5, NH2 и NO2,
R3 выбирают из группы, включающей CO2R6 и SO2R6,
R4 и R4' каждый независимо выбирают из группы, включающей Н, (низш.)алкил, необязательно замещенный группами оксо, CO2R6, OR6 и/или NH2; S(O)nR7, OR8, NR5R6 и CO2R6,
R5 и R6 каждый независимо выбирают из группы, включающей Н, N, (низш.)алкил, замещенный группами оксо, CO2R9, OR9 и NR10R11; арил, необязательно замещенный галогеном, гетероарил, N-арил, где арил необязательно замещен (h) одним или более галогенами, и арил, замещенный галогеном или CF3,
R7 означает (низш.)алкил или арил,
R8 выбирают из группы, включающей Н, (низш.)алкил и (низш.)алкил, замещенный группой NR5R6,
R9 выбирают из группы, включающей Н и (низш.)алкил,
R10 и R11 каждый независимо выбирают из группы, включающей Н и (низш.)алкил, а
n равно 0, 1 или 2,
или их фармацевтически приемлемые соли или сложные эфиры.
В предпочтительном варианте соединений формулы I R2 означает фенил, предпочтительно фенил, замещенный галогеном, наиболее предпочтительно F, и OR5, где R5 означает (низш.)алкил. В наиболее предпочтительном варианте R2 означает фенил, замещенный одним иди двумя F и одной группой OR5, где R5 означает (низш.) алкил, предпочтительно метил.
В другом предпочтительном варианте предлагаются соединения формулы I, в которых R2 имеет значения, указанные выше, а R1 означает
где
R3 выбирают из группы, включающей Н, CO2R6, C(O)R6, SO2R6 и SO2NR5R6,
R5 и R6 каждый независимо выбирают из группы, включающей Н и (низш.)алкил,
или их фармацевтически приемлемые соли или эфиры.
Более предпочтительны соединения, указанные выше, в которых R2 означает фенил, содержащий один, два или три заместителя, независимо выбранные из группы, включающей галоген или -O- (низш.) алкил.
В еще одном варианте настоящего изобретения предлагаются соединения формулы I, где
R1 означает
;
R2 означает 3-фторфенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, включающей -F и -O-СН3,
R3 выбирают из группы, включающей Н, CO2R6, C(O)R6, SO2R6 и SO2NR5R6,
R5 и R6 каждый независимо выбирают из группы, включающей Н и (низш.)алкил,
или их фармацевтически приемлемые соли или эфиры.
Примеры соединений формулы I, указанной выше, включают, без ограничения перечисленным,
трет-бутиловый эфир 4-[4-амино-5-(3-фторбензоил)тиазол-2-иламино]пиперидин-1-карбоновой кислоты,
трет-бутиловый эфир 4-[4-амино-5-(3-фтор-4-метоксибензоил)тиазол-2-иламино]пиперидин-1-карбоновой кислоты,
трет-бутиловый эфир 4-[4-амино-5-(2,3-дифтор-6-метоксибензоил)тиазол-2-иламино]пиперидин-1-карбоновой кислоты,
[4-амино-2-(пиперидин-4-иламино)тиазол-5-ил](3-фторфенил)метанон,
[4-амино-2-(пиперидин-4-иламино)тиазол-5-ил](3-фтор-4-метоксифенил)метанон,
[4-амино-2-(пиперидин-4-иламино)тиазол-5-ил](2,3-дифтор-6-метоксифенил)метанон,
1-[4-[4-амино-5-(3-фторбензоил)тиазол-2-иламино]пиперидин-1-ил]этанон,
[4-амино-2-(1-метансульфонилпиперидин-4-иламино)тиазол-5-ил](3-фторфенил)метанон,
1-[4-[4-амино-5-(3-фтор-4-метоксибензоил)тиазол-2-иламино]пиперидин-1-ил]этанон,
[4-амино-2-(1-метансульфонилпиперидин-4-иламино)тиазол-5-ил](3-фтор-4-метоксифенил)метанон,
диметиламид 4-[4-амино-5-(3-фтор-4-метоксибензоил)тиазол-2-иламино]пиперидин-1-сульфоновой кислоты,
[4-амино-2-(1-метансульфонилпиперидин-4-иламино)тиазол-5-ил](2,3-дифтор-6-метоксифенил)метанон и
[4-амино-2-(1-метансульфонилпиперидин-4-иламино)тиазол-5-ил](2,6-дифторфенил)метанон.
В еще одном варианте изобретения R1 означает
где R4 означает S(O)nR7, где R7 означает (низш.)алкил, предпочтительно метил.
Наиболее предпочтительно R4 означает -S(O)2СН3.
Примеры соединений формулы I, указанной выше, включают
[4-амино-2-(4-метансульфонилфениламино)тиазол-5-ил](2,3-дифтор-6-метоксифенил)метанон.
Заявленные соединения формулы I, указанной выше, могут существовать в виде таутомеров или структурных изомеров. Подразумевается, что изобретение включает любые таутомеры или структурные изомеры указанных соединений или смеси указанных изомеров, и не ограничивается любой одной таутомерной или изомерной формой, представленной в вышеуказанной формуле.
В другом варианте изобретения примеры соединений по изобретению включают, без ограничения перечисленным, следующие соединения (см.таблицу).
| A1 | |
| A2 | |
| A3 | |
| A4 | |
| A5 | |
| A6 |
| A7 | |
| A8 | |
| A9 | |
| A10 | |
| A11 | |
| A12 | |
| A13 | |
| A14 | |
| A15 | |
| A16 | |
| A17 | |
| A18 | |
| A19 | |
| A20 | |
| A21 | |
| A22 | |
| A23 | |
| A24 | |
| A25 | |
| A26 | |
| A27 | |
| A28 | |
| A29 | |
| A30 | |
| A31 | |
| A32 | |
| A33 | |
| A34 | |
| A35 | |
| A36 | |
| A37 | |
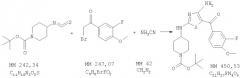
Соединения по настоящему изобретению получают любым известным способом. Пригодные методы синтеза указанных соединений приводятся в примерах. В общем случае соединения формулы I можно получить по одной из указанных ниже схем.
Замыкание цикла
Соединения по изобретению получают алкилироанием и циклизацией ряда производных тиомочевины, как показано на схеме 3, с использованием известных реакций. Производные мочевины, которые используются для этих целей, включают производные нитроамидинотиомочевины (Binu R. и др., Org. Prep. Proced Int., 1998, 30, 93-96 (1998)), 1-[(арилтиокарбамоил)амино]-3,5-диметилпиразолы (Jenardanan G.C. и др., Synth. Commun., 27, 3457-3462 (1997)) и N-(аминоиминометил)-N'-фенилтиомочевину (Rajasekharan K.N. и др., Synthesis, 353-355 (1986)).
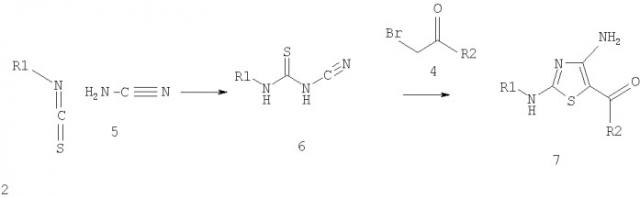
Другим производным тиомочевины, которое используются для получения соединений по изобретению с использованием алкилирования и циклизации, является N-цианотиомочевина (Gewald K. и др., J. Prakt. Chem., 97-104 (1967). Например, как показано ниже на схеме 3, N-цианотиомочевину формулы 6 вводят в реакцию с галогенметилкетоном, таким, как бромметилкетон формулы 4, при температуре от приблизительно комнатной температуры до приблизительно 65°С с образованием соединения формулы 7. Исходные материалы формулы (2) и (4), которые не являются коммерческими препаратами, указаны в конкретных примерах.
Схема 1
Схема 2
Схема 3
В другом варианте соединения по изобретению получают также по реакции иммобилизованного на смоле метилового эфира аминотиооксометилзамещенной карбамидотиокислоты формулы 9 с бромметилкетоном формулы 4, как показано ниже на схеме 4.
Схема 4
Иммобилизованное на смоле производное тиомочевины формулы 9 получают по любой методике, известной специалисту в области органической химии. Например, такое соединение можно получить по реакции иммобилизованной на смоле соли тиоурония формулы 8 с изотиоцианатом формулы 2 в присутствии основания, такого, как третичный амин (например, триэтиламин или диизопропилэтиламин) в инертном растворителе, таком, как полярный апротонный растворитель (например, N,N-диметилформамид). Обычно реакцию проводят приблизительно при комнатной температуре. Затем из иммобилизованного на смоле производного тиомочевины формулы 9 получают соединение формулы 7, например, при взаимодействии с галогенметилкетоном (например, бромметилкетоном формулы 4) в пригодном инертном растворителе, таком, как полярный апротонный растворитель (например, N,N-диметилформамид) при приблизительно комнатной температуре.
Разделение смеси стереоизомеров на оптически чистые стереоизомеры (если соединение формулы I является хиральным соединением)
Необязательное разделение изомеров формулы I проводят известными способами, такими, например, как хиральная жидкостная хроматография высокого давления (известная, как ЖХВР). Методы разделения изомеров известны и подробно описаны в специальной литературе (см., например, Jacques J. и др., Enantiomers, Racemates, and Resolutions», John Wiley and Sons, NY (1981). Методы разделения хиральной ЖХВР также известны и подробно описаны в литературе (см. например, Pirkle W.H. и Finn J., «Separation of Enantiomers by Liquid Chromatographic Methods» в монографии «Asymmetric Synthesis», t.1, c.87-124, Morrison J.D., Ed., Academic Press, Inc., NY (1983)).
Превращение соединения формулы I, содержащего группу азотистого основания, в фармацевтически приемлемую кислотно-аддитивную соль
Необязательное превращение соединения формулы I, содержащего группу азотистого основания, в фармацевтически приемлемую кислотно-аддитивную соль проводят известными способами. Например, соединение обрабатывают неорганической кислотой, такой, например, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, или соответствующей органической кислотой, такой, как уксусная кислота, лимонная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота или т.п.
Превращение соединения формулы I, содержащего карбоксильную группу, в фармацевтически приемлемую соль щелочного металла
Необязательное превращение соединения формулы I, содержащего карбоксильную группу, в фармацевтически приемлемую соль щелочного металла проводят известными способами. Например, соединение обрабатывают неорганическим основанием, таким, как гидроксид лития, гидроксид натрия, гидроксид калия и т.п.
Превращение соединения формулы I, содержащего карбоксильную группу, в фармацевтически приемлемый сложный эфир
Необязательное превращение соединения формулы I, содержащего карбоксильную группу, в фармацевтически приемлемый сложный эфир проводят известными способами. Условия получения сложного эфира зависят от устойчивости других функциональных групп в условиях реакции этерификации. Если другие группы достаточно устойчивы в кислотной среде, этерификацию обычно проводят при нагревании раствора соединения в спирте в присутствии минеральной кислоты (например, серной кислоты). Другие способы получения сложных эфиров, которые обычно используют в том случае, если соединение неустойчиво в кислотной среде, включают взаимодействие соединения со спиртом в присутствии конденсирующего агента и необязательно в присутствии дополнительных агентов, катализирующих реакцию. Специалисту в области органической химии известно множество таких конденсирующих агентов. В качестве примеров можно привести дициклогексилкарбодиимид и трифенилфосфин/диэтилазодикарбоксилат. Если в качестве конденсирующего агента используется дициклогексилкарбодиимид, реакцию обычно проводят при обработке кислоты карбодиимидом в присутствии спирта и необязательно в присутствии каталитического количества (0-10 мол.%) N,N-диметиламинопиридина в инертном расторителе, таком, как галогенированный углеводород (например, дихлорметан) при температуре от приблизительно 0°С до приблизительно комнатной температуры, предпочтительно при приблизительно комнатной температуре. Если в качестве конденсирующего агента используется трифенилфосфин/диэтилазодикарбоксилат, реакцию обычно проводят при обработке кислоты трифенилфосфином и диэтилазодикарбоксилатом в присутствии спирта в инертном растворителе, таком, как простой эфир (например, тетрагидрофуран) или ароматический углеводород (например, бензол) при температуре от приблизительно 0°С до приблизительно комнатной температуры, предпочтительно при приблизительно 0°С.
Композиции/составы
В другом варианте настоящее изобретение включает фармацевтические композиции, содержащие по меньшей мере одно соединение формулы I или его фармацевтически приемлемую соль или эфир и фармацевтически приемлемый эксципиент и/или носитель.
Указанные фармацевтические композиции можно вводить пероральным способом, например, в форме таблеток, таблеток с покрытием, драже, твердых или мягких желатиновых капсул, растворов, эмульсий или суспензий. Композиции можно также вводить ректальным способом, например, в форме суппозиториев, или парентеральным способом, например, в форме инъекционных растворов.
Фармацевтические композиции по настоящему изобретению, включающие соединения формулы I и/или их фармацевтически приемлемые соли или эфиры, получают известным в данной области техники способом, например, с использованием процессов смешивания, инкапсулирования, растворения, гранулирования, эмульгирования, включения в матрицу, дражирования или лиофилизации. Указанные фармацевтические препараты можно перерабатывать в смеси с терапевтически инертными неорганическими или органическими носителями. При получении таблеток, таблеток с покрытием, драже и твердых желатиновых капсул в качестве таких носителей используются лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли. Пригодные носители для мягких желатиновых капсул включают растительные масла, воски и жиры. В зависимости от природы активного соединения в случае мягких желатиновых капсул обычно не требуется никаких носителей. Пригодными носителями при получении растворов и сиропов являются вода, полиолы, сахароза, инвертированный сахар и глюкоза. Пригодными носителями для инъекций являются вода, спирты, полиолы, глицерин, растительные масла, фосфолипиды и ПАВ. Пригодными носителями для суппозиториев являются природные или отвержденные масла, воски,