Способ получения производных (3-оксо-2,3-дигидро-1н-изоиндол-1-ил)-ацетилгуанидина
Иллюстрации
Показать всеИзобретение относится к способу получения соединений формулы I
где R1, R2 независимо друг от друга обозначают Н, F, Cl, OCF3, 2,2,2-трифторэтокси, -CF3, 2,2,2-трифторэтил, С1-С4алкил; R3 означает Alk-R4, -CF3; Alk означает С1-С4 алкил; R4 означает Н, -CF3, С3-С7 циклоалкил; а также их фармацевтически совместимых солей, отличающийся тем, что как определено на схеме 1:
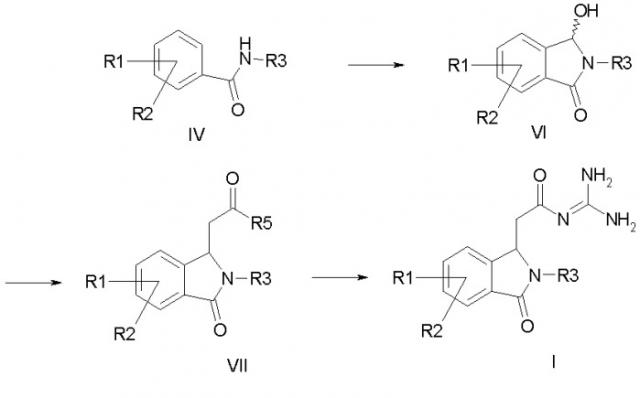
а) формилируют амид формулы IV в орто-положение к амидной группе и затем, без выделения полученного промежуточного соединения, его циклизуют с получением соединения формулы VI, b) соединение формулы VI подвергают превращению с алкоксикарбонилметилентрифенилфосфораном, с 1-алкокси-1-триметилсилоксиэтиленом или с триалкилфосфоноацетатом с получением соединения формулы VII, и с) соединение формулы VII подвергают превращению с гуанидином с получением соединения формулы I, где в соединениях формул IV-VII R1-R3 имеют значения как в формуле I; R5 означает -ОС1-С4алкокси. Описаны промежуточные соединения, способ рацемического разделения. 8 н. и 7 з.п. ф-лы.
Реферат
Данное изобретение касается способа получения производных (3-оксо-2,3-дигидро-1H-изоиндол-1-ил)-ацетилгуанидина через производные 3-гидрокси-2,3-дигидро-1H-изоиндол-1-она или производные сложных эфиров 3-(2-карбамоил-фенил)-акриловой кислоты в качестве промежуточных соединений, способа разделения рацемата, а также промежуточных продуктов способа согласно изобретению.
Производные (3-оксо-2,3-дигидро-1H-изоиндол-1-ил)-ацетилгуанидина формулы I
являются ингибиторами NHE1 и описаны в PCT/EP 03/05279. Однако описанные там синтезы приводят к рацемическим смесям региоизомеров, что требует дорогостоящих способов разделения и уменьшает выход желаемых соединений. До сих пор доступ к энантиомерам был возможен только через дорогостоящее хроматографическое разделение на хиральных носителях. Однако пропускная способность веществ при хроматографическом разделении ограничена.
Поэтому представляло большой интерес разработать региоселективный способ получения производных (3-оксо-2,3-дигидро-1H-изоиндол-1-ил)-ацетилгуанидина, а также способ получения энантиомеров. Улучшенное, региоселективное получение рацемических производных (3-оксо-2,3-дигидро-1H-изоиндол-1-ил)-ацетилгуанидина достигается двумя независимыми путями, представленными на схеме 1 и схеме 3. Разделение рацематов достигается путем кристаллизации в виде солей 2,3-O-ацилированных D- или L-винных кислот, как представлено на схеме 5. Посредством щадящей катализируемой основанием рацемизации нежелательных в данном случае энантиомеров возможно значительное превращение рацемата в желаемый энантиомер. Названные способы делают возможным простое получение энантиомерно обогащенных или энантиомерно чистых производных (3-оксо-2,3-дигидро-1H-изоиндол-1-ил)-ацетилгуанидина. С помощью новых способов в настоящее время возможно простое получение больших количеств соединений формулы I в промышленном масштабе.
Таким образом, данное соединение касается способа получения соединений формулы I,
причем
R1 и R2
независимо друг от друга обозначают водород, F, Cl, трифторметокси, 2,2,2-трифторэтокси, трифторметил, 2,2,2-трифторэтил или алкил с 1, 2, 3 или 4 C-атомами;
R3 обозначает Alk-R4 или трифторметил;
Alk обозначает алкил с 1, 2, 3 или 4 C-атомами;
R4 обозначает водород, трифторметил или циклоалкил с 3, 4, 5, 6 или 7 C-атомами,
а также их солей,
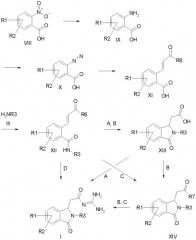
отличающегося тем, что, как представлено на схеме 1
Схема 1
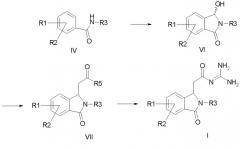
a) формилируют амид формулы IV и затем циклизуют его с получением соединения формулы VI,
b) соединение формулы VI подвергают превращению с алкоксикарбонилметилентрифенилфосфораном, с 1-алкокси-1-триметилсилоксиэтиленом или с триалкилфосфоноацетатом с получением соединения формулы VII, и
c) соединение формулы VII подвергают превращению с гуанидином с получением соединения формулы I,
причем в соединениях формул IV, VI и VII
R1-R3 имеют значения как в формуле I и
R5 обозначает алкокси с 1, 2, 3 или 4 C-атомами;
а также его солей.
Объектом изобретения является также способ получения соединений формулы I,
причем
R1 и R2
независимо друг от друга обозначают водород, F, Cl, трифторметокси, 2,2,2-трифторэтокси, трифторметил, 2,2,2-трифторэтил или алкил с 1, 2, 3 или 4 C-атомами;
R3 обозначает Alk-R4 или трифторметил;
Alk обозначает алкил с 1, 2, 3 или 4 C-атомами;
R4 обозначает водород, трифторметил или циклоалкил с 3, 4, 5, 6 или 7 C-атомами;
а также их солей,
отличающийся тем, что, как представлено на схеме 2
Схема 2
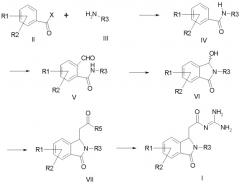
a) соединение формулы II подвергают превращению с амином формулы III с получением амида формулы IV,
b) амид формулы IV формилируют в орто-положение к амидной функции с получением формил-амида формулы V,
c) формил-амид формулы V циклизуют с получением соединения формулы VI,
d) соединение формулы VI подвергают превращению с алкоксикарбонилметилентрифенилфосфораном, с 1-алкокси-1-триметилсилоксиэтиленом или с триалкилфосфоноацетатом с получением соединения формулы VII и
e) соединение формулы VII подвергают превращению с гуанидином с получением соединения формулы I,
причем в соединениях формул II, III, IV, V, VI и VII
R1-R3 имеют значения как в формуле I,
R5 обозначает алкокси с 1, 2, 3 или 4 C-атомами и
X обозначает Cl, Br, OH или алкокси с 1, 2, 3 или 4 C-атомами;
а также его солей.
Соединение формулы II обычным образом подвергают превращению в инертном растворителе, например простом эфире, углеводороде или галогенированном углеводороде, например дихлорметане, при температуре между -30°C и температурой кипения растворителя, предпочтительно при комнатной температуре (КТ), с амином формулы III, в случае необходимости в присутствии активатора, с получением амида формулы IV.
Орто-формилирование можно проводить, например, тем, что используют соединение алкилметалла, например соединение алкиллития, предпочтительно трет.-BuLi, с комплексными лигандами, предпочтительно TMEDA, в инертном растворителе как простой эфир или углеводород, например ТГФ, при температуре между -100°C и 0°C, предпочтительно между -80°C и -50°C. Затем добавляют амид формулы IV и депротонируют в течение интервала времени между 10 минутами и 10 часами, предпочтительно между 10 минутами и 60 минутами, при температуре между -100°C и 0°C, предпочтительно между -80°C и -50°C. Затем добавляют формилирующий реагент, предпочтительно ДМФ, и при температуре между -100°C и 40°C, предпочтительно между -80°C и комнатной температурой, осуществляют реакцию с анионом. Предпочтительно раствор после добавления ДМФ оставляют при КТ в течение периода от 10 минут до 3 часов, например, в течение 30 минут. При этом образующийся промежуточный амид формулы V в целом циклизуется непосредственно с получением изоиндолона формулы VI.
Изоиндолон формулы VI подвергают превращению с (C1-C4)-алкоксикарбонилметилен-трифенилфосфораном в инертном растворителе, таком как простой эфир, углеводород или галогенированный углеводород, например толуол, при температуре между 0°C и температурой кипения растворителя, предпочтительно между 20°C и температурой кипения растворителя, или с три-(C1-C4)-алкилфосфонацетатом в присутствии основания, например гидрида натрия, в инертном растворителе, как простой эфир, углеводород или галогенированный углеводород, например 1,2-диметоксиэтан, при температуре между 0°C и температурой кипения растворителя, предпочтительно между 20°C и температурой кипения растворителя. Альтернативно изоиндолон формулы VI подвергают превращению с 1-(C1-C4)-алкокси-1-триметилсилоксиэтиленом в присутствии кислоты Льюиса, например хлорида титана(IV) или триметилсилилтрифлата, в инертном растворителе, как простой эфир, углеводород или галогенированный углеводород, например дихлорметан, при температуре между -80°C и температурой кипения растворителя, предпочтительно при температуре между -80°C и 20°C (Synth. Commun. 1987, 17, 1).
Сложный эфир формулы VII в целом известными способами может быть превращен с помощью гуанидина до ацилгуанидина формулы I. Превращение осуществляют предпочтительно известными специалистам способами в протонном или апротонном, полярном, но инертном органическом растворителе. При этом при превращении, например, сложного метилового эфира (формула VII; R5=OCH3) с гуанидином пригодны растворители, как метанол, изопропанол или ТГФ при температуре от 20°C вплоть до температуры кипения этого растворителя. При большинстве превращений соединений формулы VII с бессолевым гуанидином используют, например апротонные инертные растворители, например простые эфиры, как ТГФ, диметоксиэтан или диоксан. Но также при необходимости основания, например NaOH, в качестве растворителя при превращении соединений формулы VII с гуанидином может быть использована вода. При превращении соединений формулы VII с солями гуанидина, как, например гидрохлоридом гуанидина, обычно осуществляют превращение в присутствии основания, например калий-трет.-бутоксида, метилата натрия или этилата натрия в инертном растворителе, как диметилформамид, НМП (NMP), 2-пропанол при температуре между 20°C и температурой кипения растворителя.
Помимо эфиров карбоновых кислот формулы VII для превращения с гуанидином могут использоваться также другие активированные производные кислот, например хлорангидриды, тиоэфиры или ангидриды карбоновых кислот. Активирование карбоновых кислот можно осуществлять также, например, с помощью ДЦГКДИ (DCC). Активированные производные кислот могут получаться известным специалисту способом непосредственно из лежащих в основе сложных эфиров карбоновых кислот формулы VII или из соответствующих карбоновых кислот, которые могут быть получены из сложных эфиров посредством типичных методов гидролиза. Ряд пригодных способов получения активированных производных карбоновых кислот имеются в сведениях из литературных источников: J. March, Advanced Organic Chemistry, Third Edition (John Wiley & Sons, 1985, S.350).
Стадии способа, приведенные на схемах 1 и 2, независимо друг от друга могут осуществляться непрерывно или периодически. Обновление реакционной смеси может происходить после каждой стадии способа. Обновление и, при желании, очистка продукта происходит общепринятыми способами, такими как экстракция, pH-разделение, хроматография или кристаллизация и обычная сушка.
Исходные соединения формул II и III являются коммерчески доступными или могут быть получены известными специалисту способами, описанными в литературе или аналогичными им.
Объектом изобретения также является способ получения соединений формулы I
причем
R1 и R2
независимо друг от друга обозначают водород, F, Cl, трифторметокси, 2,2,2-трифторэтокси, трифторметил, 2,2,2-трифторэтил или алкил с 1, 2, 3 или 4 C-атомами;
R3 обозначает Alk-R4 или трифторметил;
Alk обозначает алкил с 1, 2, 3 или 4 C-атомами;
R4 обозначает водород, трифторметил или циклоалкил с 3, 4, 5, 6 или 7 C-атомами,
а также их солей,
отличающийся тем, что, как представлено на схеме 3
Схема 3
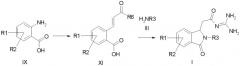
a) амин формулы IX подвергают превращению через соль диазония с алкиловым эфиром акриловой кислоты с получением производного коричной кислоты формулы XI,
b) соединение формулы XI подвергают превращению с амином формулы III и гуанидином с получением ацилгуанидина формулы I,
причем в соединениях формул III, IX и XI
R1-R3 имеют значения как в формуле I, и
R6 обозначает алкокси с 1, 2, 3 или 4 C-атомами;
а также его солей.
Данное соединение касается также способа получения соединений формулы I,
причем
R1 и R2
независимо друг от друга обозначают водород, F, Cl, трифторметокси, 2,2,2-трифторэтокси, трифторметил, 2,2,2-трифторэтил или алкил с 1, 2, 3 или 4 C-атомами;
R3 обозначает Alk-R4 или трифторметил;
Alk обозначает алкил с 1, 2, 3 или 4 C-атомами;
R4 обозначает водород, трифторметил или циклоалкил с 3, 4, 5, 6 или 7 C-атомами,
а также их солей,
отличающегося тем, что, как представлено на схеме 4
Схема 4
a) нитросоединение формулы VIII подвергают превращению с получением амина формулы IX,
b) амин формулы IX подвергают превращению с получением соли диазония формулы X,
c) соль диазония формулы X подвергают превращению с алкиловым эфиром акриловой кислоты с получением производного коричной кислоты формулы XI,
d) соединение формулы XI подвергают превращению с получением амида формулы XII и
e) соединение формулы XII подвергают превращению с получением ацилгуанидина формулы I, или посредством превращения соединения формулы XII в присутствии основания с получением производного изоиндолона формулы XIII и затем посредством превращения с гуанидином при активировании с получением ацилгуанидина формулы I (вариант A), или
после образования производного изоиндолона формулы XIII в присутствии основания из соединения формулы XII посредством превращения соединения формулы XIII в сложный эфир формулы XIV и затем посредством превращения с гуанидином с получением ацилгуанидина формулы I (вариант B), или
посредством превращения соединения формулы XII в присутствии сильного основания с получением сложного эфира формулы XIV и затем посредством превращения с гуанидином с получением ацилгуанидина формулы I (вариант C), или
посредством прямого превращения соединения формулы XII с гуанидином в присутствии основания при одновременно следующем гуанилировании и циклизации с получением изоиндолона формулы I (вариант D),
причем в соединениях формул VIII, IX, X, XI, XII, XIII и XIV
R1-R3 имеют значения как в формуле I и
R6 и R7 независимо друг от друга обозначают алкокси с 1, 2, 3 или 4 C-атомами,
а также касается их солей.
Нитросоединение формулы VIII известными способами (как, например, описано в публикации „Houben-Weyl, Methoden der organischen Chemie“, Band XI/1, Stickstoffverbindungen II, Georg Thieme Verlag Stuttgart, 1957, S.360ff) может быть восстановлено до анилина формулы IX. Предпочтительным является каталитическое гидрирование, например с Pd/C, например с 5% Pd/C или 10% Pd/C, в растворителе, как, например, спирт, предпочтительно этанол, в атмосфере водорода при давлении от 1 бар до 200 бар, предпочтительно при давлении 1 бар - 10 бар.
Последующее диазотирование анилина формулы IX происходит в инертном растворителе, предпочтительно этаноле, в присутствии кислоты, анион которой не сам замещает ион диазония, как, например, HBF4 или HPF6, предпочтительно HBF4, или, например, H2SO4 и в присутствии нитрита, предпочтительно NaNO2, при температуре между -30°C и температурой кипения растворителя, предпочтительно между 0°C до 30°C.
Соль диазония формулы X предпочтительно непосредственно подвергают превращению с (C1-C4)-алкиловым эфиром акриловой кислоты, предпочтительно этиловым эфиром акриловой кислоты, в присутствии палладиевого катализатора, предпочтительно Pd(OAc)2, при температуре между 0°C и температурой кипения растворителя, предпочтительно между 45°C до 55°C, до производного коричной кислоты формулы XI.
Остаток бензойной кислоты соединения формулы XI известными специалисту способами может быть переведен в амид формулы XII, предпочтительно через хлорангидрид или с помощью ДЦГКДИ (DCC). Эта реакция также может быть проведена таким образом, что амид формулы XII в реакционной смеси непосредственно циклизуют до сложного эфира формулы XIV, так что реакцию от соединения формулы XI до сложного эфира формулы XIV проводят в одну стадию. Это может происходить или при основных условиях реакции амидообразования, или циклизации может способствовать добавка основания, например, триэтиламина, основания Хюнига (Hünig-Base) или трет.-бутилат калия. Другая альтернатива состоит в том, что соединение формулы XI непосредственно превращается в соединение формулы I, тем что последовательно друг за другом проводят амидообразование, циклизацию и гуанидирование в том же реакционном сосуде, причем реакция может осуществляться без выделения промежуточных соединений.
Для следующего превращения соединения формулы XII до ацилгуанидина формулы I имеется 4 варианта:
Вариант A: Превращение амида формулы XII происходит предпочтительно с водным раствором щелочи, предпочтительно водным раствором NaOH, в растворителе как спирт, предпочтительно метанол или этанол, при температуре между -30°C и температурой кипения растворителя, предпочтительно при КТ. Имеет место как омыление сложноэфирной группы, так и циклизация с образованием производного изоиндолона формулы XIII. Соединение формулы XIII активируют общеизвестным способом (и как изображено на схеме 1) до ацилирования, например через хлорангидрид или с помощью ДЦГКДИ (DCC), и получают ацилгуанидин формулы I.
Вариант B: Синтез карбоновой кислоты формулы XIII происходит как в альтернативном варианте A. Затем стандартным способом для получения сложного эфира, предпочтительно с SOCl2 в спирте, таком как метанол или этанол, получают, например, сложный метиловый или этиловый эфир формулы XIV. Последующее превращение сложного эфира формулы XIV происходит как показано на схеме 1 с образованием ацилгуанидина формулы I.
Вариант C: Превращение амида формулы XII происходит в растворе сильного основания, предпочтительно метилата или трет.-бутилата в спирте, таком как метанол или этанол, и получают сложный метиловый или этиловый эфир формулы XIV. Превращение сложного эфира формулы XIV до ацилгуанидина формулы I происходит как показано на схеме 1.
Вариант D: Амид формулы XII подвергают превращению при обычных условиях до ацилирования гуанидина. В качестве растворителя используют инертный растворитель, такой как простой эфир, углеводород или галогенированный углеводород, предпочтительно ДМФ. Обычно сначала подвергают превращению соль гуанидиния с сильным основанием, предпочтительно KOtBu, причем высвобождается свободный гуанидин. Смесь добавляют к раствору соединения формулы XII в растворителе, таком как спирт, простой эфир, углеводород или галогенированный углеводород, например ДМФ, НМП (NMP) или 2-пропанол. При этом происходит одновременно гуанилирование и циклизация до изоиндолона формулы I. Вариант состоит в том, что последовательно друг за другом с каталитическим количеством сильного основания, например трет.-бутилата калия или метилата натрия, или этилата натрия в растворителе, например ДМФ, НМП (NMP) или 2-пропаноле, соединение формулы XI циклизуют до соединения формулы XIV и затем in situ подвергают превращению до соединения формулы I.
Предпочтительным является вариант D, при котором проводят превращение производного бензойной кислоты формулы XI темплатным способом (несколько стадий в одном сосуде) вплоть до ацилгуанидина формулы I.
Стадии способа, приведенные на схеме 2, могут осуществляться непрерывно или периодически. Обновление реакционной смеси может происходить после каждой стадии способа. Обновление и, при желании, очистка продукта происходит общепринятыми способами, такими как экстракция, pH-разделение, хроматография или кристаллизация и обычная сушка.
Исходные соединения формул III и VIII являются коммерчески доступными или могут быть получены известными специалисту способами, описанными в литературе или аналогичными им.
Объектом изобретения также являются соединения формулы XII
причем
R1 и R2
независимо друг от друга обозначают водород, F, Cl, трифторметокси, 2,2,2-трифторэтокси, трифторметил, 2,2,2-трифторэтил или алкил с 1, 2, 3 или 4 C-атомами;
R3 обозначает Alk-R4 или трифторметил;
Alk обозначает алкил с 1, 2, 3 или 4 C-атомами;
R4 обозначает водород, трифторметил или циклоалкил с 3, 4, 5, 6 или 7 C-атомами,
R6 обозначает алкокси с 1, 2, 3 или 4 C-атомами,
а также их соли.
Заявлено также применение соединений формулы XII в качестве промежуточных продуктов синтеза.
Соединения формулы I в энантиомерно обогащенной или энантиомерно чистой форме предпочтительно могут быть получены новым способом разделения рацемата, который также является объектом данного изобретения. Для этого рацематы соединений формулы I в виде солей 2,3-O-ацилированной D- или L-винной кислоты используют для кристаллизации, причем энантиомеры обогащаются в кристаллизате или в маточнике. Затем опять высвобождают свободные основания из солей.
Таким образом, данное изобретение касается способа выделения соединений формулы Ia и Ib
причем
R1 и R2
независимо друг от друга обозначают водород, F, Cl, трифторметокси, 2,2,2-трифторэтокси, трифторметил, 2,2,2-трифторэтил или алкил с 1, 2, 3 или 4 C-атомами;
R3 обозначает Alk-R4 или трифторметил;
Alk обозначает алкил с 1, 2, 3 или 4 C-атомами;
R4 обозначает водород, трифторметил или циклоалкил с 3, 4, 5, 6 или 7 C-атомами,
а также их солей,
отличающегося тем, что, как представлено на схеме 5
Схема 5
a) соединение формулы I подвергают превращению с получением солей 2,3-O-ацилированной D- или L-винной кислоты и посредством кристаллизации обе соли формул XVa и XVb получают раздельно,
b) свободные основания формул Ia или Ib высвобождают из обеих солей формул XVa или XVb,
причем в соединениях формул I, XVa и XVb
R1-R3 имеют значения как в формулах Ia и Ib и
R* обозначает
R8 обозначает алкил с 1, 2, 3, 4, 5 или 6 C-атомами или фенил, незамещенный или замещенный 1, 2 или 3 заместителями из группы F, Cl, Br, I, алкил с 1, 2, 3 или 4 C-атомами или алкокси с 1, 2, 3 или 4 C-атомами.
Изобретение также распространяется на вышеописанный способ, при котором нежелательные энантиомеры формулы Ia или Ib вновь рацемизируют.
Рацемат соединения формулы I с производным винной кислоты R*, например, как O,O'-дибензоил-D-винная кислота, O,O'-дибензоил-L-винная кислота, O,O'-ди(4-метилбензоил)-L-винная кислота, O,O'-ди(4-метилбензоил)-D-винная кислота, O,O'-ди(4-метоксибензоил)-L-винная кислота или O,O'-ди(4-метоксибензоил)-D-винная кислота, предпочтительно с O,O'-дибензоил-L-винной кислотой или O,O'-дибензоил-D-винной кислотой, подвергают кристаллизации в пригодном растворителе, например в простом эфире, например диэтиловом эфире, диизопропиловом эфире, диметоксиэтане, тетрагидрофуране или диоксане, в галогенированном углеводороде, например дихлорметане, трихлорметане, тетрахлорметане, 1,2-дихлорэтане или трихлорэтилене, в спирте, например метаноле, этаноле, н-пропаноле, 2-пропаноле, бутаноле, в сложном эфире, например этилацетате или бутилацетате, в воде, или в смеси растворителей, предпочтительно в 2-пропаноле, диметоксиэтане или этилацетате, при температуре между -10°C и температурой кипения растворителя, предпочтительно при 0°C до 40°C. Вариант способа состоит в том, что смеси из двух или нескольких 2,3-O-ацилированных D- или L-винных кислот этих конфигураций, имеющие различные ацильные группы, могут использоваться для разделения.
Образование солей из соединений формулы I и производного винной кислоты R* может происходить при использовании эквивалентных количеств, т.е. могут быть использованы 0,5 моль производного винной кислоты R*, имеющего две карбоксильные группы, на моль соединения формулы I. Соединение формулы I также может подвергаться кристаллизации с менее чем 0,5 мольных эквивалентов 2,3-O-ацилированной D- или L-винной кислоты, например с 0,25 моль до 0,5 моль производного винной кислоты R* на моль соединения формулы I, в особенности с 0,25 моль до 0,3 моль производного винной кислоты R* на моль соединения формулы I. Желаемый энантиомер затем выкристаллизовывается в форме соли формулы XVa или XVb, а нежелательный энантиомер находится в маточнике большей частью в форме энантиомера формулы Ib или Ia и не содержится в форме соли формул XVa или XVb. Чистота энантиомеров солей формул XVa и XVb может быть увеличена посредством повторной кристаллизации или путем перемешивания первичных кристаллов со свежим растворителем при повышенной температуре и последующем охлаждении.
После разделения обеих солей формул XVa и XVb или отделения соли формулы XVa или XVb от нежелательных энантиомеров Ib или Ia, энантиомерно обогащенные соединения формул Ia и Ib затем обычно высвобождают из солей путем добавления вспомогательного основания, например амина, как, например, триэтиламин, неорганического основания, как NaHCO3, Na2CO3 или их водных растворов. При этом обычно используют пригодный растворитель, как, например простой эфир, например, диэтиловый эфир, диизопропиловый эфир, диметоксиэтан, тетрагидрофуран или диоксан, галогенированный углеводород, например, дихлорметан, трихлорметан, тетрахлорметан, 1,2-дихлорэтан или трихлорэтилен, спирт, например метанол, этанол, н-пропанол, 2-пропанол или бутанол, сложный эфир, например этилацетат или бутилацетат, или вода, или смесь растворителей, предпочтительно этилацетат, 2-пропанол, дихлорметан или вода или их смеси, причем реакционная смесь может иметь одну или несколько фаз, при температуре между -10°C и температурой кипения растворителя, предпочтительно при 10°C до 40°C. Это может происходить, например, таким образом, что соль растворяют в водном растворе NaHCO3 и затем с органическим растворителем, например этилацетатом, экстрагируют энантиомер формулы Ia или Ib.
В каждом случае, нежелательный энантиомер Ia или Ib опять может быть переведен в рацемат формулы I посредством способа рацемизации, и таким образом использован для новой стадии разделения рацемата. При этом нежелательные энантиомеры предпочтительно в растворителе, как спирт, например 2-пропанол, при температуре между -10°C и температурой кипения растворителя, предпочтительно при 0°C до 40°C, обрабатывают малым количеством основания, например KOH, нейтрализуют реакционную смесь и после водно-экстракционной обработки отделяют рацемат. Этот способ, путем пригодного выбора количества основания и температуры реакции, может быть проведен так, что практически происходит исключительно образование рацемата, и не наблюдается никаких химических изменений вещества.
Объектом данного изобретения далее являются соединения формул XVa и XVb
причем
R1 и R2
независимо друг от друга обозначают водород, F, Cl, трифторметокси, 2,2,2-трифторэтокси, трифторметил, 2,2,2-трифторэтил или алкил с 1, 2, 3 или 4 C-атомами;
R3 обозначает Alk-R4 или трифторметил;
Alk обозначает алкил с 1, 2, 3 или 4 C-атомами;
R4 обозначает водород, трифторметил или циклоалкил с 3, 4, 5, 6 или 7 C-атомами,
R* обозначает
R8 обозначает алкил с 1, 2, 3, 4, 5 или 6 C-атомами или фенил, незамещенный или замещенный 1, 2 или 3 заместителями из группы F, Cl, Br, I, алкил с 1, 2, 3 или 4 C-атомами или алкокси с 1, 2, 3 или 4 C-атомами.
Если вышеописанные соединения, например соединения формул I, Ia, Ib, VII, XIII, XIV, XVa или XVb, содержат один или несколько центров асимметрии, то независимо друг от друга они могут иметь как S-, так и R-конфигурацию, если не оговорено другое. Соединения могут существовать в виде оптических изомеров, в виде диастереомеров, в виде рацемата или в виде смеси таковых, если это точно не обозначено. У соединений с двойной связью может быть как E- так и Z-конфигурация, если не оговорено другое. Данное изобретение включает таутомерные формы вышеописанных соединений, например соединений формул I, Ia, Ib, XVa и XVb.
Алкильные остатки могут быть неразветвленными или разветвленными. Это также имеет место, если они имеют заместители или выступают в качестве заместителей других остатков, например во фторалкильных остатках или алкоксильных остатках. Примерами алкильных остатков являются метил, этил, н-пропил, изопропил (=1-метилэтил), н-бутил, изобутил (=2-метилпропил), втор.-бутил (=1-метилпропил), трет.-бутил (=1,1-диметилэтил), н-пентил, изопентил, трет.-пентил, неопентил и гексил. Предпочтительными алкильными остатками являются метил, этил, н-пропил и изопропил, особенно предпочтительны метил или этил. В алкильных остатках один или несколько, например, 1, 2, 3, 4 или 5 атомов водорода могут быть замещены атомами фтора. Примерами таких фторалкильных остатков являются трифторметил, 2,2,2-трифторэтил и пентафторэтил, предпочтительно трифторметил или 2,2,2-трифторэтил. Замещенные алкильные остатки могут быть замещены в любых положениях.
Примерами циклоалкильных остатков являются циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Фенильные остатки могут быть незамещенными или однократно, или многократно, например однократно, двукратно или трехкратно замещенными одинаковыми или разными остатками. Если фенильный остаток замещен, предпочтительно он имеет один или два одинаковых или разных заместителя. В монозамещенных фенильных остатках заместитель может находиться в 2-положении, 3-положении или 4-положении. Двукратно замещенный фенил может быть замещен в 2,3-положении, 2,4-положении, 2,5-положении, 2,6-положении, 3,4-положении или 3,5-положении. В трехкратно замещенных фенильных остатках заместители могут находиться в 2,3,4-положении, 2,3,5-положении, 2,4,5-положении, 2,4,6-положении, 2,3,6-положении или 3,4,5-положении.
Вышеописанные соединения, например соединения формул I, Ia и Ib, могут использоваться в способе согласно изобретению в форме их солей и/или в форме солей выделяться. Соли могут быть получены обычными методами, например путем превращения с кислотами или основаниями в растворителе, или посредством анионного или катионного обмена из других солей. В качестве солей кислотного присоединения, например, соединений формул I, Ia и Ib при этом имеют в виду, например, галогениды, в особенности гидрохлориды, гидробромиды, лактаты, сульфаты, цитраты, тартраты, ацетаты, фосфаты, метилсульфонаты, бензолсульфонаты, п-толуолсульфонаты, адипинаты, фумараты, глюконаты, глутаматы, глицеринфосфаты, малеинаты, бензоаты, оксалаты и памоаты, а также трифторацетаты. В случае получения биологически активных веществ предпочтительны физиологически и фармацевтически совместимые соли. В качестве примера можно было бы назвать соли соединений формул I, Ia и Ib с фумаровой кислотой, в особенности соли, содержащие один моль фумаровой кислоты на моль соединения формулы I, Ia или Ib, которые, таким образом, являются гидрогенфумаратами или полуфумаратами. Благодаря полезным свойствам, таким как кристалличность, стабильность, особенно малая гигроскопичность, малая склонность к рацемизации и хорошая растворимость, в особенности отличается, например, (S)-N-{2-[3-оксо-2-(2,2,2-трифторэтил)-6-трифторметил-2,3-дигидро-1H-изоиндол-1-ил]-ацетил}-гуанидин гидрогенфумарат гидрат формулы XVI, который также во всех своих таутомерных формах является объектом данного изобретения.
Если соединения содержат кислотную группу, они могут образовывать соли с основаниями, например соли щелочных металлов, предпочтительно натриевые или калиевые соли или соли аммония, например соли с аммиаком или органическими аминами или аминокислотами. Соединения, содержащие основную группу и кислотную группу, также могут существовать в виде амфотерного иона.
Одна форма выполнения данного изобретения касается соединений, в которых R1 и R2 оба не являются водородом, в особенности соединений, в которых R1 обозначает водород и R2 обозначает фтор, хлор или трифторметил, в особенности трифторметил. В соединениях, в которых R1 обозначает водород, заместитель R2 предпочтительно находится в параположении бензольного кольца относительно C=O-группы в системе изоиндолона.
Группа Alk предпочтительно обозначает алкил с 1, 2 или 3 C-атомами, в особенности с 1 или 2 C-атомами, особенно с 1 C-атомом. R4 предпочтительно обозначает трифторметил или циклоалкил с 3, 5 или 6 C-атомами, в особенности 3 C-атомами, особенно предпочтительно трифторметил. Одна форма выполнения данного изобретения касается соединений, в которых R3 обозначает трифторметил или 2,2,2-трифторэтил, в особенности 2,2,2-трифторэтил.
Специальная форма выполнения данного изобретения касается получения N-{2-[3-оксо-2-(2,2,2-трифторэтил)-6-трифторметил-2,3-дигидро-1H-изоиндол-1-ил]-ацетил}-гуанидина и его энантиомерных форм и их солей.
X предпочтительно обозначает хлор или метокси, в особенности хлор. R5 предпочтительно обозначает метокси или этокси, в особенности этокси. R6 предпочтительно обозначает метокси или этокси, в особенности этокси. R7 предпочтительно обозначает метокси или этокси, в особенности этокси.
В одной форме выполнения данного изобретения R8 обозначает фенил, незамещенный или замещенный 1, 2 или 3 заместителями из группы F, Cl, алкил с 1, 2, 3 или 4 C-атомами или алкокси с 1, 2, 3 или 4 C-атомами, в особенности незамещенный фенил.
Соединения формул I, Ia, Ib, XVa и XVb и их фармацевтически совместимые соли являются замещенными ацилгуанидинами и ингибируют клеточный натрий/протонный обмен (Na+/H+-обменник, NHE), в особенности подтип NHE-1.
На основе свойств ингибирования NHE соединения формул I, Ia, Ib, XVa, XVb и XVI и/или их фармацевтически совместимые соли пригодны для профилактики и лечения заболеваний, вызываемых активацией NHE или активированным NHE, а также вторичных заболеваний, вызываемых повреждениями, обусловленными NHE.
Соединения формул I, Ia, Ib, XVa и XVb также могут использоваться для лечения и профилактики заболеваний, причем NHE ингибируется лишь частично, например, путем использования сниженной дозировки.
Так как ингибиторы NHE преобладающим образом оказывают влияние посредством клеточной регуляции pH, они благоприятным образом могут комбинироваться с другими соединениями, также регулирующими внутриклеточное значение pH, причем имеются в виду ингибиторы ферментных групп карбоангидраз, ингибиторы систем, транспортирующих бикарбонатные ионы, такие как ингибиторы натрий-бикарбонатного котранспортера (NBC) или зависимого от натрия хлорид-бикарбонатного обмена (NCBE), а также с ингибиторами NHE с ингибирующим действием на другие подтипы NHE, в качестве компонентов для комбинации, так как с их помощью могут быть усилены или модулированы существенные фармакологические эффекты, регулирующие pH, описанных здесь ингибиторов NHE.
Применение соединений формул I, Ia, Ib, XVa, XVb или XVI касается профилактики и лечения острых и хронических заболеваний в ветеринарной медицине и медицине человека. Таким образом, ингибиторы NHE согласно изобретению пригодны для лечения заболеваний, вызванных ишемией и реперфузией.
Описанные здесь соединения вследствие своих фармакологических свойств пригодны в качестве антиаритмических лекарственных средств. Благодаря своим кардиозащитным компонентам ингибиторы NHE исключительно пригодны для профилактики инфаркта и лечения инфаркта, а также для лечения стенокардии, причем они также превентивно ингибируют или сильно сокращают патофизиологические процессы при возникновении вызванных ишемией нарушений, в особенности при возникновении вызванных ишемией сердечных аритмий. Благодаря их защитному действию против патологических гипоксических и ишемических ситуаций, соединения формул I, Ia, Ib, XVa, XVb и XVI и/или их фармацевтически совместимые соли, используемые согласно изобретению, вследствие ингибирования клеточного механизма Na+/H+-обмена могут быть использованы в качестве лекарственных средств для лечения всех острых или хронических нарушений, вызванных ишемией, или первичных или вторичных индуцированных ею заболеваний.
Это касается также их применения в качестве лекарственных средств при хирургических вмешательствах. Так, соединения могут быть использованы при трансплантации органов, причем соединения могут быть использованы как для защиты органов донора перед и во время изъятия, для защиты изъятых органов, например, при лечении или их хранении в физиологическом растворе, так и при введении в организм реципиента.
Соединения согласно изобретению также являются ценными лекарственными средствами с защитным действием при проведении ангиопластических операций, например, на сердце, а также на периферических органах и сосудах.
Далее, соединения согласно изобретению могут быть использованы при операциях шунтирования, например при шунтировании коронарных сосудов и при коронарном артериальном шунтировании (Coronary Artery Bypass Graft) (CABG).
В соответствии со своим действием в отношении вызванных ишемией нарушений соединения согласно изобретению формулы I также могут быть использованы для реанимации после остановки сердца.
Соединения согласно изобретению представляют интерес для лекарственных средств против угрожающих жизни аритмий. Они останавливают мерцание желудочков и восстанавливают физиологический синусоидальный ритм сердца.
Так как ингибиторы NHE-1 не только эффективно защищают ткани и органы человека, в особенности сердце, от повреждений, вызываемых ишемией и реперфузией, но и от цитотоксического действия лекарственных средств, в особенности используемых при лечении рака и аутоиммунных заболеваний, пригодно комбинированное применение с ингибиторами NHE, которые могут ингибировать цитотоксическое, в особенности кардиотоксическое побочное действие названных соединений. Путем уменьшения цитотоксического эффекта, в особенности кардиотоксичност