Стабильная, состоящая из частиц фармацевтическая композиция, содержащая солифенацин или его соль
Иллюстрации
Показать всеНастоящее изобретение относится к химико-фармацевтической промышленности и касается стабильной, состоящей из частиц фармацевтической композиции солифенацина или его соли, которую можно получить при использовании связующего вещества с Тпл. ниже 174°С, которая имеет сферическую форму, подходящую для нанесения покрытия, и в которой можно ингибировать разложение с течением времени, при предоставлении фармацевтического препарата солифенацина или его соли для клинического использования. Более конкретно, оно относится к состоящей из частиц фармацевтической композиции, при включении состоящей из частиц фармацевтической композиции солифенацина в состав фармацевтического препарата. Кроме того, при проведении способствующей кристаллизации обработки после получения состоящей из частиц фармацевтической композиции можно получить более стабильную, состоящую из частиц фармацевтическую композицию солифенацина или его соли. 4 н. и 14 з.п. ф-лы, 3 табл., 3 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к стабильной, состоящей из частиц фармацевтической композиции, полученной с использованием солифенацина или его соли, и определенного связующего вещества, способу получения данной композиции, таблетке, распадающейся в щечной полости, которая содержит состоящую из частиц фармацевтическую композицию, и способу стабилизации данной состоящей из частиц фармацевтической композиции.
Предпосылки к созданию изобретения
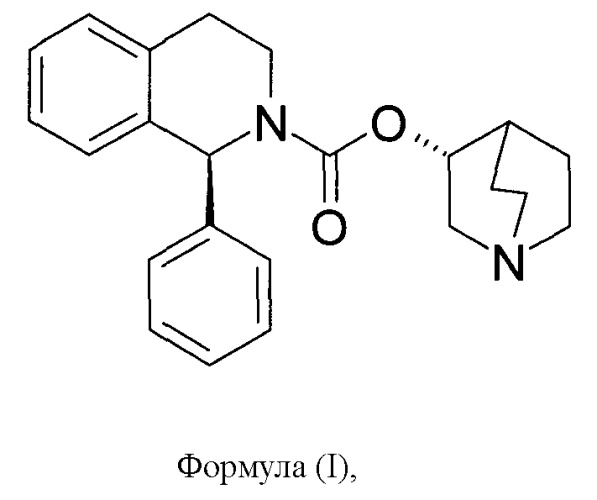
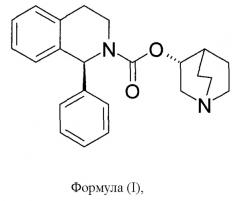
Солифенацин изображается следующей формулой (I):
а его химическое название представляет собой (1R,3'R)-3'-хинуклидинил-1-фенил-1,2,3,4-тетрагидро-2-изохинолинкарбоксилат.
Сообщалось, что ряд производных хинуклидина, включая солифенацин и его соли, обладают высоким селективным антагонизмом по отношению к мускариновому М3 рецептору и применимы в качестве профилактического/терапевтического агента при урологических заболеваниях, таких как нервная поллакиурия, неврогенная дисфункция мочевого пузыря, никтурия, синдром гиперактивного мочевого пузыря, спазмы мочевого пузыря и хронический цистит, или респираторных заболеваниях, таких как хронические обструктивные заболевания легких, хронический бронхит, астма и ринит (смотри патентный документ 1).
В примере 8 патентного документа 1 описан способ получения гидрохлорида солифенацина и сообщается, что кристалл, выросший из смеси растворителей, состоящей из ацетонитрила и диэтилового эфира, имел температуру плавления от 212 до 214°С и проявлял удельное вращение [α]25 D, равное 98,1 (с=1,00, EtOH).
Однако в патентном документе 1 нет описания, или даже указания на аморфную форму солифенацина или его соли, или на то, что при получении фармацевтического препарата из сукцината солифенацина стандартным способом получения препаратов сукцинат солифенацина, являющийся активным ингредиентом, существенно разлагается с течением времени в полученной фармацевтической композиции.
В непатентном документе 1, изданном Министерством здравоохранения, труда и благосостояния в июне 2003 года, приведены стандартные правила для фармацевтических препаратов, то есть описаны концепции разложения продуктов (примесей) в фармацевтических препаратах, допустимые в тесте на стабильность. Согласно данному документу в том случае, когда количество лекарственного вещества, которое нужно вводить в день, составляет менее 10 мг, пороговая величина, для которой необходимо подтверждение безопасности продуктов разложения в фармацевтическом препарате, меньше 1% из расчета на процентную долю продуктов разложения, содержащихся в лекарственном веществе, и 50 мкг из расчета на общий прием продуктов разложения в день. В том случае, когда количество лекарственного вещества, которое нужно вводить в день, составляет 10 мг или более и 100 мг или менее, пороговая величина, для которой необходимо подтверждение безопасности продуктов разложения в фармацевтическом препарате, меньше 0,5% из расчета на процентную долю продуктов разложения, содержащихся в лекарственном веществе, и 200 мкг из расчета на общий прием продуктов разложения в день. Следовательно, в целом стандартная величина количества продуктов разложения, которую можно установить без подтверждения безопасности продуктов разложения, составляет, например, в случае фармацевтической композиции, в которой содержание лекарственного вещества составляет 5 мг, 1%, или менее, из расчета на процентное содержание продуктов разложения, содержащихся в лекарственном веществе, и, например, в случае фармацевтического препарата, в котором содержание лекарственного вещества составляет 10 мг, 0,5% или менее, из расчета на процентное содержание продуктов разложения, содержащихся в лекарственном веществе.
В настоящее время содержащие солифенацин фармацевтические препараты, которые собираются пустить в продажу на основании результатов текущих клинических испытаний, представляют собой таблетку 2,5 мг, таблетку 5 мг и таблетку 10 мг. Для того чтобы подобные фармацевтические препараты обладали стабильностью, описанной в непатентном документе 1, считается, что количество основного продукта разложения сукцината солифенацина (в дальнейшем называемого F1), по отношению к общему количеству сукцината солифенацина и продуктам разложения, должно составлять 0,5%, или менее, и более предпочтительно, необходимо контролировать его на уровне 0,4%, или менее, включая различия и ошибки в ряду большого числа продуктов и во время тестирования.
С другой стороны, известно, что солифенацин и его соль обладают очень высокой растворимостью в различных растворителях и очень сильным горьким и терпким вкусом. Поэтому для разработки фармацевтического препарата с высокой пригодностью, такого как частица, или порошок солифенацина или его соли, содержащиеся в таблетке, которая распадается в щечной полости, требуется скрыть эту горечь и терпкость. Таким образом, необходимо применять способ нанесения пленочного покрытия с использованием полимерного субстрата. Конкретнее, в случае, когда лекарственное вещество покрыто пленкой полимерного субстрата, необходимо равномерно покрыть поверхность лекарственного вещества. Таким образом, данное лекарственное вещество должно представлять собой мелкие частицы сферической формы с одинаковым размером частиц.
[Патентный документ 1] ЕР патент № 801067
[Непатентный документ 1] PFSB/ELD сообщение № 0624001 «Пересмотр правил, касающихся примесей в продуктах медицинского использования с новыми активными ингредиентами»
Раскрытие изобретения
Задачи, которые предстоит решить при помощи данного изобретения
Как описано выше, имелась необходимость в стабильной, состоящей из частиц фармацевтической композиции солифенацина или его соли, которая имеет сферическую форму, подходящую для нанесения пленочного покрытия, и в которой можно замедлить разложение с течением времени при предоставлении фармацевтического препарата солифенацина или его соли для клинического использования.
Способы решения данных задач
При разработке сукцината солифенацина в качестве прекрасного терапевтического агента для лечения учащенного мочеиспускания или недержания мочи авторы настоящего изобретения наносили на лекарственные вещества покрытие из стандартного связующего вещества (поливинилпирролидона, в дальнейшем сокращенно ПВП (PVP)), или гидроксипропилметилцеллюлозы (в дальнейшем сокращенно ГПМЦ (HPMC)), что обычно проводится специалистом в данной области техники при помощи способа гранулирования в псевдоожиженном слое, или тому подобного, и проводили для полученных фармацевтических препаратов предварительный тест на стабильность в течение 2 месяцев в условиях ускоренного тестирования (условия при 40°С, 75%-ной RH (относительной влажности) и в герметически закрытом сосуде), который представляет собой один из стандартных тестов на стабильность. В результате наблюдали снижение остаточного соотношения сукцината солифенацина и было показано, что спустя 6 месяцев после начала хранения, которые являлись временем конечного определения в ускоренном тесте, соотношение количества образовавшегося F1 (окисленной формы сукцината солифенацина) и общего количества сукцината солифенацина и продуктов разложения превысило 0,4% (по поводу подробностей см. таблицу 1 ниже). Было найдено, что при помощи подобного стандартного способа составления препаратов трудно получить фармацевтический препарат, обладающий фармацевтически достаточной стабильностью.
При данном уровне техники авторы настоящего изобретения провели интенсивные исследования, направленные на стабилизацию фармацевтического препарата солифенацина, и в результате ими неожиданно было обнаружено, что основной причиной разложения активного ингредиента с течением времени является солифенацин в аморфной форме, образующийся в процессе производства фармацевтического препарата, и что использование такого стандартного связующего вещества, как ГПМЦ, в значительной степени связано с образованием данной аморфной формы солифенацина.
Для получения гранулированного вещества, в котором горечь и терпкость солифенацина скрыты, автор настоящего изобретения счел эффективным способ, в котором мелкую частицу (состоящую из частиц фармацевтическую композицию) получают путем распыления раствора лекарственного вещества на ядро частицы, состоящей, например, из кристаллической целлюлозы, и покрывают эту мелкую частицу пленкой из соответствующего полимерного вещества. Для получения подобной мелкой частицы необходимо проводить распыление сразу после растворения солифенацина или его соли, однако было найдено, что солифенацин склонен переходить при этом в аморфное состояние и, кроме того, возникает проблема, характерная для солифенацина, которая заключается в том, что при его переходе из аморфной формы в кристаллическую форму образуются продукты разложения. То есть в том случае, когда состоящую из частиц фармацевтическую композицию получают после растворения части, или всего солифенацина в растворителе, было найдено, что крайне сложно гарантировать стабильность солифенацина.
В данных обстоятельствах авторы настоящего изобретения сначала обнаружили, что при использовании в качестве связующего вещества соединения, содержащего этиленоксидную цепочку, такого как полиэтиленгликоль (другое название: макрогол, в дальнейшем иногда сокращенно ПЭГ (PEG)), неожиданно получают фармацевтический препарат, в котором можно замедлить разложение солифенацина с течением времени за счет ингибирования сохранения аморфной формы солифенацина, хотя сам по себе ПЭГ является соединением, которое обычно используют в целях перевода лекарственного вещества в аморфную форму.
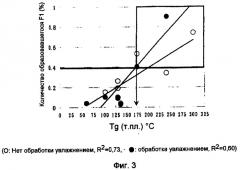
Кроме того, при разработке и получении стабильной, состоящей из частиц фармацевтической композиции солифенацина или его соли, подходящей для нанесения пленочного покрытия, авторы настоящего изобретения пришли к заключению, что, например, в случае, когда растворенный солифенацин распыляют на ядро частицы вместе с полимерным веществом (связующим веществом), таким как ПЭГ, способность солифенацина сохранять или не сохранять аморфную форму после распыления может зависеть от текучести солифенацина в данном полимерном веществе (связующем веществе). Поэтому авторами были проведены интенсивные исследования и обращено внимание на физические величины (температура стеклования (в дальнейшем сокращенно Tg), или температура плавления (в дальнейшем сокращенно т.пл.)), характерные для полимера, которые могут влиять на текучесть лекарственного вещества в том, что касается связующего вещества, предназначенного для использования при распылении на частицы ядра. В результате авторами было обнаружено, что при использовании для состоящей из частиц фармацевтической композиции связующего вещества с высокой Tg, начальное значение для родственного соединения, которое становится индексом разложения, было низким, однако, что касается последующей стабильности, оно было нестабильным. С другой стороны, при использовании для состоящей из частиц фармацевтической композиции определенного связующего вещества с Тg, меньшей, чем заданное значение, авторы неожиданно обнаружили, что и начальное значение для родственного соединения, и значение для родственного соединения, полученное впоследствии, были небольшими и стабильными и, более того, частицы были одинакового размера и сферическими, что подходит для нанесения пленочного покрытия.
Кроме того, в результате интенсивных исследований авторами найдено, что при проведении обработки, способствующей кристаллизации, такой как обработка увлажнением и высушиванием, получается более стабильная, состоящая из частиц фармацевтическая композиция, таким образом, настоящее изобретение было завершено.
То есть настоящее изобретение относится к:
1. Стабильной, состоящей из частиц фармацевтической композиции, содержащей солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль;
2. Фармацевтической композиции в соответствии с изложенным выше в абзаце 1, в которой связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, представляет собой связующее вещество, обладающее способностью ингибировать сохранение аморфной формы солифенацина или его соли;
3. Фармацевтической композиции в соответствии с изложенным выше в абзаце 1 или 2, характеризующейся тем, что связующее вещество представляет собой связующее вещество с температурой стеклования или температурой плавления ниже 174°С;
4. Фармацевтической композиции в соответствии с изложенным выше в абзаце 3, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, этилцеллюлозу, сополимер L метакриловой кислоты, сополимер LD метакриловой кислоты, сополимер S метакриловой кислоты, кукурузный крахиал, сополимер Е аминоалкилметакрилата, сополимер RS аминоалкилметакрилата и мальтозу;
5. Фармацевтической композиции в соответствии с изложенным выше в абзаце 3, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и мальтозу;
6. Фармацевтической композиции в соответствии с изложенным выше в абзаце 3, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена и гидроксипропилцеллюлозу;
7. Стабильной, состоящей из частиц фармацевтической композиции, содержащей солифенацин или его соль, которую можно получить при использовании смеси, в которой солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, растворены и/или суспендированы вместе;
8. Фармацевтической композиции в соответствии с изложенным выше в абзаце 7, в которой связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, представляет собой связующее вещество, обладающее способностью ингибировать сохранение аморфной формы солифенацина или его соли;
9. Фармацевтической композиции в соответствии с изложенным выше в абзаце 7 или 8, характеризующейся тем, что связующее вещество представляет собой связующее вещество с температурой стеклования или температурой плавления ниже 174°С;
10. Фармацевтической композиции в соответствии с изложенным выше в абзаце 9, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, этилцеллюлозу, сополимер L метакриловой кислоты, сополимер LD метакриловой кислоты, сополимер S метакриловой кислоты, кукурузный крахмал, сополимер Е аминоалкилметакрилата, сополимер RS аминоалкилметакрилата и мальтозу;
11. Фармацевтической композиции в соответствии с изложенным выше в абзаце 9, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и мальтозу;
12. Фармацевтической композиции в соответствии с изложенным выше в абзаце 9, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена и гидроксипропилцеллюлозу;
13. Фармацевтической композиции в соответствии с изложенным выше в любом из абзацев 1-12, стабильность которой повышена посредством дополнительного проведения обработки, способствующей кристаллизации; и
14. Таблетке, распадающейся в щечной полости, которая содержит фармацевтическую композицию в соответствии с изложенным выше в любом из абзацев 1-13.
В целом, в качестве индекса текучести во многих случаях используют термодинамические параметры, характерные для вещества, такие как температура стеклования (Tg, единицы: °С), или температура размягчения (единицы: °С), основанные на аморфной области полимера, и температура плавления (т.пл., единицы: °С), основанные на кристаллической области полимера. Данные величины обозначают температуру, показывающую изменение в термодинамическом состоянии вещества, однако, поскольку молекулярное движение подавляется при температуре ниже Tg, вещество находится в состоянии, близком к кристаллическому состоянию, или стеклообразному состоянию, в результате чего пластичность должна снизиться. Однако когда температура вещества составляет Tg или выше, степень активности молекулы возрастает, вследствие чего вещество находится в резиноподобном состоянии и пластичность повышается. Кроме того, состояние, в котором при повышении температуры кристаллическая область полимера разрушается, приводя к появлению пластичности, означает плавление данного полимера. Принимая это во внимание, в случае, когда лекарственное вещество, находящееся в аморфном состоянии, существует в полимере при определенной температуре, то чем выше Tg полимера, тем сложнее самому полимеру проявлять текучесть. Следовательно, оно должно быть в аморфной форме, которая находится в первоначальном состоянии, а с другой стороны, это означает, что чем ниже Tg полимера, тем быстрее выпадет кристалл (Int. J. Pharm. 282 (2004) 151-162). С другой стороны, что касается низкомолекулярного соединения, поскольку структура соединения кристаллическая, то во многих случаях у него нет Tg, поэтому в качестве параметра, показывающего изменение в термической подвижности, для низкомолекулярного соединения в качестве индекса использовали температуру плавления. Что касается полимера, использовали Tg, которая представляет собой температуру, при которой изменение проявляется быстрее.
Кроме того, изобретение относится к:
15. Способу стабилизации солифенацина или его соли, предусматривающему осуществление обработки фармацевтической композиции, содержащей солифенацин или его соль и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, где указанная обработка способствует кристаллизации; и
16. Способу перевода аморфной формы солифенацина или его соли в его кристаллическую форму, предусматривающему осуществление обработки стабильной, состоящей из частиц фармацевтической композиции, содержащей солифенацин или его соль и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, где указанная обработка способствует кристаллизации.
Далее композиция настоящего изобретения будет описана подробно.
Примеры «соли солифенацина», предназначенного для использования в настоящем изобретении, включают в себя гидрохлорид солифенацина, описанный в патентном документе 1, соли присоединения кислоты с минеральными кислотами, такими как бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, или с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфокислота, этансульфоновая кислота и глутаминовая кислота, и четвертичные аммониевые соли. Из их числа предпочтителен сукцинат солифенацина, принимая во внимание то, что он поставляется в виде фармацевтического продукта.
«Солифенацин или его соль», предназначенные для использования в настоящем изобретении, можно легко получить при помощи, или в соответствии с методами, описанными в патентном документе 1, или стандартным способом.
«Кристалл», или «кристаллическая форма» солифенацина или его соли обозначает буквальную интерпретацию соединения солифенацина или его соли, имеющих кристаллографически кристаллическую структуру. Однако в настоящем изобретении это означает вещество, отличающееся от «аморфной формы», в которой проявляется значительная разложимость солифенацина с течением времени при содержании в количестве в пределах интервала, не влияющем на стабильность продукта в фармацевтическом препарате. С другой стороны, «аморфность» или «аморфная форма» солифенацина или его соли в настоящем изобретении означает вещество, имеющее кристаллографически аморфную структуру. Однако в настоящем изобретении это означает вещество, отличающееся от «кристалла», или «кристаллической формы», проявляющее крайне малую разложимость солифенацина с течением времени, которое содержится в количестве в пределах интервала, не влияющем на стабильность продукта в фармацевтическом препарате.
Количество смешения солифенацина или его соли, предназначенное для использования в настоящем изобретении, обычно выбирают подходящим образом, согласно типу лекарственного вещества или его медицинскому использованию (показанию), однако оно особенно не ограничено до тех пор, пока оно представляет собой терапевтически эффективное количество или профилактически эффективное количество. Конкретно, оно составляет от 0,01 мг до 100 мг, предпочтительно, от 0,5 мг до 50 мг, более предпочтительно, от 0,5 мг до 10 мг, и наиболее предпочтительно, от 0,5 мг до 4 мг из расчета на дневное количество солифенацина или его соли.
Кроме того, количество смешанного солифенацина или его соли с распадающейся в щечной полости таблеткой по настоящему изобретению может быть любым в пределах содержания эффективного количества на единицу введения фармацевтического препарата, однако оно предпочтительно составляет от 0,001 масс.% до 97 масс.%, более предпочтительно, от 0,05 масс.% до 50 масс.%, еще более предпочтительно, от 0,05 масс.% до 10 масс.%, и наиболее предпочтительно, от 0,05 масс.% до 4 масс.%.
«Связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль», предназначенное для использования в настоящем изобретении, означает связующее вещество, которое способно замедлять разложение солифенацина или его соли, с течением времени, а конкретно означает связующее вещество, которое способно замедлять разложение солифенацина или его соли, с течением времени за счет ингибирования сохранения аморфной формы. Кроме того, в том случае, когда связующее вещество, не обладающее стабилизирующим действием на солифенацин или его соль, само по себе, например, даже такое связующее вещество, как ГПМЦ, или ПВП, используют вместе со связующим веществом, предназначенным для использования в настоящем изобретении в целях повышения действия в качестве связующего вещества, его можно использовать в количестве, которое находится в пределах интервала, не превышающем стандартные правила стабильности фармацевтического препарата, который является предметом настоящего изобретения.
«Ингибирующее действие в отношении сохранения аморфной формы», как использовано в настоящем изобретении, относится к действию, которое затрудняет существование вещества в аморфном состоянии и/или действие, которое способно облегчить переход вещества из аморфной формы в кристаллическую форму.
Кроме того, связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, или ингибирующее действие на сохранение аморфной формы, предназначенное для использования в настоящем изобретении, представляет собой связующее вещество, способное уменьшить количество F1 в солифенацине до 0,5% или ниже, более предпочтительно, связующее вещество, способное уменьшить количество F1 до 0,4% или ниже. Конкретно, оно представляет собой связующее вещество с Tg или т.пл. ниже 174°С, предпочтительно, связующее вещество с Tg или т.пл., равной 0°С, или выше, и ниже 174°С, более предпочтительно, связующее вещество с Tg или т.пл., равной 0°С или выше, и ниже 156°С, еще более предпочтительно, связующее вещество с Tg или т.пл., равной 0°С, или выше, и ниже 137°С, и наиболее предпочтительно, связующее вещество с Tg или т.пл., равной 10°С или выше, и ниже 137°С. Конкретный тип связующего вещества особенно не ограничен до тех пор, пока оно имеет Tg в пределах указанного выше интервала, однако его предпочтительные примеры включают в себя вещество, содержащее этиленоксидную цепочку, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, этилцеллюлозу, поливиниловый спирт, сополимер метакриловой кислоты, сополимер аминоалкилметакрилата, крахмал и мальтозу. Однако с точки зрения процесса производства в ряду указанных выше связующих веществ поливиниловый спирт, сополимер метакриловой кислоты, сополимер аминоалкилметакрилата и крахмал обладают слабой связующей силой, поэтому считается, что нанесение покрытия на частицы затруднено. Соответственно, более предпочтительно вещество, содержащее этиленоксидную цепочку, такое как ПЭГ, полиэтиленоксид, или блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза или мальтоза, еще более предпочтителен ПЭГ, блоксополимер полиоксиэтилена/полиоксипропилена или гидроксипропилцеллюлоза, особенно предпочтителен ПЭГ или гидроксипропилцеллюлоза, а наиболее предпочтителен ПЭГ. Что касается подобного связующего вещества, тип молекулярной массы, степень полимеризации или тому подобное особенно не ограничены до тех пор, пока при добавлении данного связующего вещества можно достигнуть цели настоящего изобретения, состоящей в ингибировании аморфности солифенацина или его соли. Однако, что касается типа молекулярной массы, средняя молекулярная масса предпочтительно находится в интервале от 400 до 1000000, а более предпочтительно, средняя молекулярная масса находится в интервале от 2000 до 200000. Кроме того, описанные выше связующие вещества можно использовать в виде сочетания двух или более типов.
Вещество, содержащее этиленоксидную цепь, как использовано здесь, особенно не ограничено до тех пор, пока оно содержит этиленоксидную цепь. Тип его молекулярной массы, его степень полимеризации или тому подобное особенно не ограничены до тех пор, пока при добавлении данного связующего вещества можно достигнуть цели настоящего изобретения, состоящей в ингибировании аморфности солифенацина или его соли. Однако, что касается типа молекулярной массы, средняя молекулярная масса предпочтительно находится в интервале от 400 до 1000000, а более предпочтительно, средняя молекулярная масса находится в интервале от 2000 до 200000. Вещества, содержащие этиленоксидную цепь, можно использовать сами по себе или в виде смеси двух или более типов.
В настоящем изобретении конкретные примеры вещества, содержащего этиленоксидную цепь, включают в себя ПЭГ, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена и так далее. Однако в настоящем изобретении из их числа предпочтительны ПЭГ и блоксополимер полиоксиэтилена/полиоксипропилена, а особенно предпочтителен ПЭГ. В качестве ПЭГ предпочтителен ПЭГ, находящийся в твердой форме при нормальной температуре. Конкретные примеры включают в себя макрогол 4000 (Японская Фармакопея, молекулярная масса: от 2600 до 3800, торговая марка: Macrogol 4000/Sanyo Chemical Industries, Ltd., NOF Corporation, Lion Corporation и так далее), макрогол 6000 (Японская Фармакопея, молекулярная масса: от 7300 до 9300, торговая марка: Macrogol 6000/Sanyo Chemical Industries, Ltd., NOF Corporation, Lion Corporation и так далее), макрогол 20000 (Японская Фармакопея, молекулярная масса: от 15000 до 25000, торговая марка: Macrogol 20000/Sanyo Chemical Industries, Ltd., NOF Corporation, Lion Corporation и так далее), полиэтиленгликоль 8000 (USP/NF, молекулярная масса: от 7000 до 9000, торговая марка: Polyethylene glycol 8000/The Dow Chemical Company и так далее) и так далее. Средняя молекулярная масса ПЭГ предпочтительно находится в интервале от 400 до 40000, более предпочтительно, в интервале от 2000 до 25000 и еще более предпочтительно, в интервале от 2000 до 10000.
Блоксополимер полиоксиэтилена/полиоксипропилена в соответствии с настоящим изобретением представляет собой сополимер пропиленоксида и этиленоксида и существуют различные типы в зависимости от его композиционного соотношения, однако он может иметь такое композиционное соотношение, чтобы обладать свойством ингибировать переход солифенацина или его соли в аморфное состояние. Конкретно используют полиоксиэтилен(105)полиоксипропилен(5)гликоль, полиоксиэтилен(160)полиоксипропилен(30)гликоль (другое название: Pluronic F68) или тому подобное.
«Смесь, в которой солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, растворены и/или суспендированы вместе», как использовано в настоящем изобретении, означает смесь, в которой связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, растворено в растворе, полученном при растворении солифенацина или его соли, в растворителе, таком как вода.
Однако не всегда есть необходимость растворять весь солифенацин или его соль в растворителе, и пока частицу, содержащую лекарственное вещество, подходящую для нанесения на нее покрытия, такого как покрытие, скрывающее горечь, которое осуществляют впоследствии, можно получить при использовании полученной смеси, подобную смесь для данной частицы, полученную при использовании смеси в суспендированном состоянии, в которой в растворителе растворена часть солифенацина или его соли также включают в рассмотрение.
Композиция, которую «можно получить при использовании» смеси, в которой солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, растворены вместе, в настоящем изобретении представляет собой частицу, содержащую лекарственное вещество, подходящую для нанесения на нее покрытия, такого как покрытие, скрывающее горечь. Ее примеры включают в себя композицию, полученную при нанесении методом распыления на ядро частицы, такое как кристаллическая целлюлоза, покрытия из лекарственного вещества в форме раствора, композицию, которую можно получить не при нанесении лекарственного вещества в жидком виде, а при соединении смеси, полученной при совместном растворении данных веществ, с нерастворимым ядром частицы, и нанесении лекарственного вещества для получения равномерного распределения лекарственного вещества по нерастворимому ядру частицы, и так далее. Кроме того, примеры продукта, полученного способом, в котором не используют ядро частицы, включают в себя собственно порошок, полученный путем распылительной сушки, или сублимационной сушки раствора лекарственного вещества и связующего вещества, и такой порошок можно использовать для частицы, содержащей лекарственное вещество, предназначенное для использования в целях маскировки горечи, или тому подобного. Однако, с точки зрения эффективности производства, предпочтительна композиция, которую можно получить путем распыления на ядро частицы смеси, в которой вместе растворены солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль.
«Стабильная, состоящая из частиц композиция», как использовано в настоящем изобретении, которую можно получить при использовании солифенацина или его соли, или тому подобное, особенно не ограничена до тех пор, пока она представляет собой стабильную частицу, в которой разложение с течением времени замедлено. Термин «стабильный», использованный здесь, конкретно означает частицу, в которой количество образующегося F1 из солифенацина или его соли составляет 0,5%, или менее, более предпочтительно, 0,4%, или менее. Кроме того, в случае, когда фармацевтическая композиция представляет собой частицу, такую как гранула, размер частиц особенно не ограничен до тех пор, пока самый большой диаметр составляет 2 мм или меньше. Что касается случая, когда она входит в состав таблетки, распадающейся в щечной полости, размер частиц особенно не ограничен до тех пор, пока при ее приеме не возникает неприятного ощущения вроде песка во рту, однако ее предпочтительно изготавливают при среднем размере частиц 350 мкм, или менее. Более предпочтительный средний размер частиц составляет от 1 до 350 мкм, а особенно предпочтительный средний размер частиц составляет от 20 до 350 мкм. С точки зрения распределения частиц по размерам, оно особенно не ограничено до тех пор, пока она представляет собой частицу, подходящую для нанесения на нее покрытия, такого как покрытие для маскировки горечи, однако, предпочтительно, чтобы 80% общей массы было распределено в интервале от 1 до 350 мкм, более предпочтительно, чтобы 80% общей массы было распределено в интервале от 50 до 300 мкм, и особенно предпочтительно, чтобы 80% общей массы было распределено в интервале от 100 до 250 мкм.
Кроме того, форма состоящей из частиц фармацевтической композиции в соответствии с настоящим изобретением особенно не ограничена до тех пор, пока она находится в состоянии, в котором можно осуществить нанесение покрытия, такое как покрытие для маскировки горечи, однако, с точки зрения эффективности нанесения покрытия, она предпочтительно имеет сферическую форму, то есть ее сферичность как можно более близка к 1.
В том случае, когда состоящая из частиц фармацевтическая композиция настоящего изобретения представляет собой гранулу, количество смешанного связующего вещества в состоящей из частиц фармацевтической композиции особенно не ограничено до тех пор, пока оно представляет собой количество, которое дает возможность нанести покрытие солифенацином или его солью, и достигнуть цели настоящего изобретения. Однако оно предпочтительно составляет от 0,01 до 91 массовых %, а более предпочтительно, от 0,5 до 75% от массы всей состоящей из частиц фармацевтической композиции. Наиболее предпочтительно, смешанное количество составляет от 5 до 50 массовых %. Кроме того, рассматривая смешанное количество связующего вещества в случае, когда фармацевтическая композиция настоящего изобретения представляет собой частицу, такую как гранула, относительно 1 массовой части солифенацина или его соли, в кристаллической форме и в аморфной форме, оно предпочтительно составляет долю, находящуюся в интервале от 1 до 1000 массовых %, предпочтительно, в интервале от 5 до 500 массовых %, и еще более предпочтительно, в интервале от 10 до 100 массовых %.
Состоящую из частиц фармацевтическую композицию настоящего изобретения получают из солифенацина или его соли, в состоянии раствора. Однако, в том случае, когда на ядро частицы наносят покрытие раствором солифенацина методом распыления, примеры ядра частицы включают в себя хлорид натрия, микрокристаллическую целлюлозу, карбонат кальция, лактозу, мальтозу и маннит, а ее предпочтительные примеры включают в себя микрокристаллическую целлюлозу, лактозу, маннит и тому подобное. Более предпочтительны микрокристаллическая целлюлоза и лактоза. В настоящем изобретении из группы подобных веществ можно использовать сочетание одного типа или двух или более типов.
Кроме того, обработка, способствующая кристаллизации, особенно не ограничена до тех пор, пока она представляет собой обработку, способствующую кристаллизации, и ее примеры включают в себя обработку увлажнением, обработку микроволновым излучением, обработку ультразвуковым излучением, обработку низкочастотным излучением, обработку термоэлектронным излучением и тому подобное. Кроме того, обработка увлажнением относится к обработке, при которой, например, проводится обработка увлажнением при температуре от 20 до 30°С и при влажности от 60 до 85% RH в течение от 6 до 24 часов, а затем высушивание при температуре от 30 до 40°С и при влажности от 30 до 40% RH в течение от 2 до 6 часов. Обработку микроволновым излучением, как правило, нельзя ограничить, однако, например, можно использовать микроволну с длиной волны от 10 МГц до 25 ГГц. Кроме того, продолжительность обработки зависит от степени кристаллизации на начальной стадии и выбранного основного вещества, одн