Способ получения 1-ацетилизохинолина
Иллюстрации
Показать всеНастоящее изобретение относится к области органического синтеза, в частности к способу получения 1-ацетилизохинолина, который заключается во взаимодействии изохинолина с CCl4 и этанолом в автоклаве под аргоном в присутствии железосодержащего катализатора, выбранного из ряда Fe(C5H5)2, FeBr2, Fе(асас)3, Fe(OAc)2, Fe(C10H7COO)3 при температуре 140-160°С в течение 3-10 ч при мольном соотношении: [Fe(C5H5)2]: [изохинолин]: [этанол]: [CCl4] = [1]:[100]:[500-2000]:[200-1000]. Технический результат: разработан новый одностадийный способ получения 1-ацетилизохинолина, используемого в качестве исходного соединения при синтезе биологически активных соединений. 1 табл.
Реферат
Предлагаемое изобретение относится к области органического синтеза, в частности к способу получения 1-ацетилизохинолина.
Производные 1-ацетилизохинолина (в частности, тиосемикарбазон 1-ацетилизохинолина) используются для получения антималярийных (D.L.Klayman, J.P.Scovill, J.Bruce, J.F.Bartosevich // J. Med. Chem., 1984, 27, 1, 84-87 [1]) и противовирусных препаратов (H.L.Elford, В.Riet / Патент США 6248787, 2001 [2]; C.Shipman, S.Smith, J.Drach, D.Klayman // Antiviral Research, 1986, 6, 4, 197-222 [3]).
Синтез 1-ацетилизохинолина (1) может быть осуществлен по реакции Хека из 1-трифторметилсульфонилоксиизохинолина (2) и этилизопропенилового эфира.
Реакцию проводят в присутствии каталитической системы Pd2(ДБА)3-PPh3 при комнатной температуре в течение 24 ч. Выход 1-ацетилизохинолина составляет 52%.
1-Трифторметилсульфонилоксиизохинолин (2) в свою очередь получают взаимодействием 1-гидроксипроизводного изохинолина с ангидридом трифторметансульфокислоты в присутствии пиридина (J.-Y.Legros et al. // Tetrahedron, 57, 2001, 2507-2514 [4]).
Недостатки метода:
1. Применение в качестве исходного соединения труднодоступного 1-трифторметилсульфонилоксиизохинолина.
2. Высокая стоимость Pd-содержащего катализатора.
1-Ацетилизохинолин (1) можно синтезировать ацилированием изохинолина ацетальдегидом в присутствии радикальных инициаторов. Реакцию проводят по следующей методике.
К 15 ммоль изохинолина добавляют 7 мл 40% H2SO4, охлаждают до 5°С, добавляют 100 ммоль ацетальдегида и при перемешивании добавляют по каплям одновременно 9 мл гидропероксида трет-бутила и раствор 28 г FeSO4·7 Н2О в 70 мл воды. Реакционную смесь оставляют на 2 ч, нейтрализуют содой до pH 6 и экстрагируют эфиром. Эфирный экстракт сушат над MgSO4. После отгона эфира выход 1-ацетилизохинолина (1) составляет 21% (М.Ф.Будыка, М.М.Кантор, М.В.Алфимов // Журнал прикладной химии, 1991, №10, С.1340-1343 [5]).
Недостатки метода:
1. Пожаро- и взрывоопасность процесса из-за использования высокореакционного, склонного к разложению трет-бутил-гидропероксида.
2. Процесс является радикально-каталитическим, что создает большие трудности для масштабирования.
3. Необходимость проведения реакции при низкой температуре.
4. Низкий выход целевого продукта.
В работе (J.Padbury, H.G.Lindwall // J. Amer. Chem. Soc., 1945, 67, p.1268 [6]) 1-ацетилизохинолин (1) синтезирован по методу Кауфмана из 1-цианоизохинолина (3) и иодида метилмагния с выходом 50%.
1-Цианизохинолин (3) является труднодоступным соединением, его получают четырехстадийным синтезом из изохинолина с 53% выходом. При этом наиболее сложной и опасной, из-за использования в качестве реагента ядовитого цианистого натрия, является первая стадия синтеза 1-циано-2-бензоил-1,2-дигидроксиизохинолина(4).
Реакцию проводили по следующей методике: к раствору 294 г (6 моль) NaCN в 2.5 л воды добавляют 258 г (2 моля) изохинолина. К полученной эмульсии при энергичном перемешивании прикапывают хлорангидрид бензойной кислоты (560 г, 4 моля) в течение 3 ч. После обработки реакционной массы выход (4) составил 303 г (58%).
Для получения изохинальдиновой кислоты (5) раствор 1-циано-2-бензоил-1,2-дигидроксиизохинолина (4) (150 г) в 500 мл 10% серной кислоты кипятили 1.5 ч. Бензальдегид удаляли перегонкой с водяным паром. После охлаждения реакционную массу профильтровали и нейтрализовали. Затем раствор нагревали с избытком сульфида меди. После фильтрации и промывки реакционной массы с помощью 1,5 л воды выделено 65 г изохинальдиновой кислоты (выход 65%).
Этиловый эфир изохинальдиновой кислоты (6) был получен при нагревании на паровой бане смеси 75 г изохинальдиновой кислоты (5) и 150 г абс. этилового спирта в присутствии серной кислоты в течение 11 ч. Выход этилового эфира изохинальдиновой кислоты (6) составил 56.6 г (36%).
Для превращения этилового эфира изохинальдиновой кислоты (6) в 1-ацетилизохинолин (1) к суспензии 0,5 моль этилата натрия в 300 мл толуола были последовательно добавлены 66 г (0.75 моль) этилацетата и 50 г (0,25 моль) (6). Смесь нагревали на паровой бане при перемешивании в течение 5 ч. После реакции к охлажденной реакционной массе добавили 400 мл HCl, затем проэкстрагировали. После соответствующей обработки выход целевого продукта 1-ацетилизохинолина (1) составил 36,2 г (85%). Суммарный выход (1), в расчете на взятый в реакцию изохинолин, составляет ~20%.
Недостатки метода:
1. Использование ядовитого цианистого натрия.
2. Многостадийность процесса.
3. Невысокий суммарный выход.
4. Необходимость использования металлического натрия (этилат натрия получают растворением Na в EtOH).
5. Образование большого количества отходов.
В работе (T.Sakamoto, Y.Kondo, M. Shiraiwa, H.Yamanaka // Synthesis, 1984, 245-247 [7]) 1-ацетилизохинолин (1) был синтезирован по следующей методике: смесь 5 ммоль 1-этинилизохинолина (8), 5 ммоль (1.484 г) сульфата ртути (II), 10 ммоль (0,981 г) конц. серной кислоты и 20 мл 70-85% водного раствора ацетона кипятили в течение 2 ч. После нейтрализации реакционной массы и экстрагирования хлороформом был выделен 1-ацетилизохинолин (1), выход которого составил 75%.
Недостатки метода:
1. Использование агрессивного реагента - концентрированной серной кислоты.
2. Применение в качестве исходного реагента труднодоступного 1-этинилизохинолина, синтез которого осуществляется с участием взрывоопасного ацетилена.
С высоким выходом 1-ацетилизохинолин может быть получен реакцией изохинолина с радикалом СН3СО, который генерируется из ацетоуксусной кислоты в водном растворе протонированного гетероциклического основания с помощью редокс-систем на основе серебра или пероксидов (Общая органическая химия. М.: Химия, 1985, т.8, п/р Н.К.Кочеткова [8]).
Недостатки метода:
1. Необходимость использования большого количества соли серебра для разложения ацетоуксусной кислоты.
2. Необходимость применения большого избытка агрессивной серной кислоты и образования неорганических отходов, утилизация которых затруднена.
Авторами предлагается способ получения 1-ацетилизохинолина, не имеющий вышеперечисленных недостатков.
Задачей предлагаемого изобретения является увеличение выхода 1-ацетиллизохинолина, удешевление себестоимости конечного продукта за счет использования доступного исходного соединения и реагентов и упрощение технологии в целом.
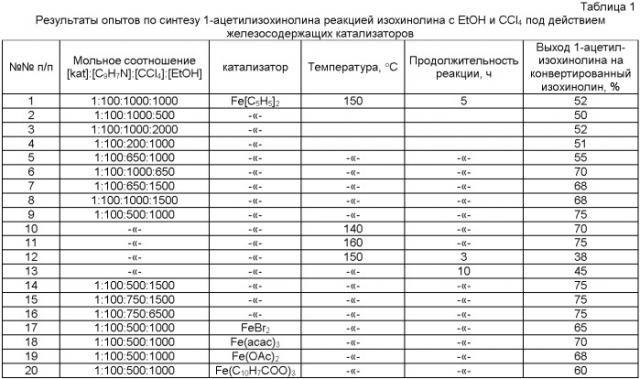
Сущность предлагаемого способа заключается во взаимодействии изохинолина с этиловым спиртом в присутствии четыреххлористого углерода под действием железосодержащего катализатора, выбранного из ряда Fe(C5H5)2, FeBr2, Fe(асас)3, Fe(OAc)2, Fe(С10Н7СОО)3 при температуре 140-160°С в течение 3-10 ч при мольном соотношении: [Fe(C5H5)2]: [изохинолин]: [этанол]: [CCl4] = [1]:[100]:[500-2000]:[200-1000]. При проведении реакции при температуре 150°С в течение 5 ч и использовании следующих мольных соотношений катализатора и реагентов: [Fe(С5Н5)2]: [изохинолин]: [этанол]: [CCl4] = [1]:[100]:[1000]:[500] выход 1-ацетилизохинолина на конвертированный изохинолин составляет 75%.
Увеличение продолжительности реакции до 10 ч нежелательно, так как выход 1-ацетилизохинолина снижается до 45%, что обусловлено образованием более тяжелого продукта - этилового эфира 1-ацетил-4-изохинолинкарбоновой кислоты. При использовании других железосодержащих катализаторов (Fe(асас)3, Fe(OAc)2, FeBr2, Fe(С10Н7СОО)3) выход 1-ацетилизохинолина был меньше и составил 60-70% в расчете на конвертированный изохинолин.
Преимущества предлагаемого метода.
1. Одностадийность процесса.
2. Доступность и низкая стоимость исходных реагентов - изохинолина, этанола и CCl4.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Реакции проводят в стеклянной ампуле (V=20 мл) или в микроавтоклаве из нержавеющей стали (V=17 мл).
В микроавтоклав (ампулу) под аргоном помещают 0.01 ммоль Fe(C5H5)2, 1 ммоль изохинолина, 5 ммоль CCl4 и 15 ммоль C2H5OH, автоклав герметично закрывают (ампулу запаивали) и нагревают при 150°С в течение 5 часов с постоянным перемешиванием. После окончания реакции автоклав (ампулу) охлаждают до 20°С, вскрывают, пропускают через слой Al2O3, нейтрализуют водным раствором Na2CO3. Экстрагируют CHCl3. Органический слой фильтруют через слой силикагеля (2 грамма) (элюент - хлороформ). Продукт реакции элюируется с первой фракцией растворителя, исходный изохинолин в последующей. Выделенный изохинолин после упаривания растворителя может быть возвращен в реакцию. Из первой фракции растворитель отгоняли. Целевой 1-ацетилизохинолин выделен колоночной хроматографией на силикагеле, а аналитически чистый образец (1) выделен препаративной ВЭЖХ.
Конверсия исходного изохинолина составила 43%. Общий выход 1-ацетилизохинолина составляет 32%, а при расчете на конвертированный изохинолин - 75%. Непрореагировавший изохинолин может быть выделен и возвращен в реакцию.
Выделенный 1-ацетилизохинолин имел т.кип. 135-136°С/10 мм рт.ст. (148-148,5°С/11 мм рт.ст.), т.пл. 14-14.5°С (лит. 14-15°С) (J.Padbury, H.G.Lindwall // J. Amer. Chem. Soc., 1945, 67, p.1268 [6]).
Спектр ЯМР 1H, δ, м.д.: 2.91 (3Н, с, COCH 3), 7.75-8.2 м (6Н, Н изохинолина). ЯМР 13С, δ, м.д.: 152.68 (C1), 140.97 (C3), 124.57 (C4), 136.96 (C4a), 126.92 (C5), 129.06 (C6), 130.27 (C7), 126.72 (C8), 123.14 (C8a), 202.52 (COCH3), 28.53 (COCH3).
Масс-спектр, m/z (Ioтн (%)): 171 [M]+ (75), 43(30), 75 (30), 77(20), 101 (40), 102(32), 128(88), 129(100), 143(45), 170(70).
Другие примеры, подтверждающие способ, приведены в таблице 1.
Способ получения 1-ацетилизохинолина формулы отличающийся тем, что изохинолин подвергают взаимодействию с CCl4 и этанолом в автоклаве под аргоном в присутствии железосодержащего катализатора, выбранного из ряда Fe(C5H5)2, FeBr2, Fe(асас)3, Fe(ОАс)2, Fe(C10H7COO)3, при температуре 140-160°С в течение 3-10 ч при мольном соотношении [Fe(C5H5)2]: [изохинолин]: [этанол]: [CCl4] = [1]:[100]:[500-2000]:[200-1000].