Диарилметилпиперазиновые производные, их получение и применение
Иллюстрации
Показать всеОписаны соединение формулы, его фармацевтически приемлемая соль или их смесь, энантиомерно чистый 4-{(R)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамид или его фармацевтически приемлемая соль. Соединения полезны в терапии, в частности для устранения боли, депрессии и тревоги. Описаны также способ терапии тревоги, способ терапии боли и способ терапии депрессии у животного. 5 н.п. ф-лы, 1 табл.
Реферат
Настоящая заявка основана на предварительной заявке на патент США 60/602363, поданной 18 августа 2004 года, которая включена в данное описание путем ссылки, и заявлен приоритет в соответствии с 35 U.S.С. §119(a)-(d) согласно заявке на шведский патент 0401968-3, поданной 2 августа 2004 года.
Область изобретения
Настоящее изобретение относится к новым соединениям, способу их получения, их применению и фармацевтическим композициям, включающим новые соединения. Новые соединения полезны в терапии и, в частности, при лечении боли, тревоги и функциональных желудочно-кишечных расстройств.
Предшествующий уровень техники
Установлено, что дельта ("δ") рецептор играет роль во множестве функций организма, таких как кровеносная и болепроводящая системы. Таким образом, лиганды δ рецептора могут быть потенциально использованы в качестве анальгетиков и/или в качестве антигипертензивных агентов. Также показано, что лиганды δ рецептора обладают иммуномодулирующими активностями.
Идентификация по меньшей мере трех различных популяций опиоидных рецепторов (µ, δ и κ) в настоящее время хорошо доказана, и все три популяции обнаружены в центральной и периферической нервных системах множества видов, включающих человека. Аналгезию наблюдали в различных животных моделях, когда активирован один или более чем один из этих рецепторов.
За несколькими исключениями существующие в настоящее время избирательные лиганды δ-опиоидного рецептора по природе представляют собой пептиды и не подходят для системного введения. Один из примеров непептидного δ-агониста представляет собой SNC80 (Bilsky E.J. et al., Journal of Pharmacology and Experimental Therapeutics, 273 (1), pp.359-366 (1995)).
Множество соединений, представляющих собой δ-агонисты, идентифицированные в предшествующем уровне техники, обладают множеством недостатков, заключающихся в том, что они демонстрируют плохую фармакокинетику и не обладают обезболивающими свойствами при системном введении. Кроме того, отмечено, что множество этих соединений, представляющих собой δ-агонисты, проявляет значительные конвульсивные дейтвия при системном введении.
В публикации РСТ WO 02/094794 описаны некоторые δ-агонисты.
Тем не менее до сих пор существует необходимость в улучшенных δ-агонистах.
Описание изобретения
Авторы изобретения неожиданно обнаружили, что некоторые соединения демонстрируют одно или более чем одно улучшенное свойство, т.е. улучшенную δ-агонистическую активность, активность in vivo, фармакокинетику, биодоступность, стабильность in vitro, стабильность in vivo, проникновение в головной мозг, и/или низкую токсичность.
Если в этом описании не указано иначе, номенклатура, используемая в этом описании, как правило, соответствует примерам и правилам, установленным в Nomenclature of Organic Chemistry, Sections A, B, Q D, E, F, and H, Pergamon Press, Oxford, 1979, включенной здесь путем ссылки на примеры названий химических структур в ней и правила наименования химических структур. Возможно, название соединения может быть создано путем использования программы по образованию химических названий: ACD/ChemSketch, Version 5.09/September 2001, Advanced Chemistry Development, Inc., Toronto, Canada.
"Энантиомерно чистый" относится к соединению, содержащему по меньшей мере 75% названного энантиомера от общего количества двух возможных содержащихся в нем энантиомеров. В конкретном воплощении "энантиомерно чистый" относится к соединению, содержащему по меньшей мере 90% названного энантиомера от общего количества двух возможных содержащихся в нем энантиомеров. В более конкретном воплощении "энантиомерно чистый" относится к соединению, содержащему по меньшей мере 95% названного энантиомера от общего количества двух возможных содержащихся в нем энантиомеров.
"Теплокровное животное" включает человека.
В одном из аспектов в изобретении предложено соединение формулы I, его фармацевтически приемлемые соли, сольваты, пролекарства, диастереоизомеры, один или более чем один энантиомер и их смеси:
В одном из воплощений соединение по изобретению может быть выбрано из:
, , ,
их фармацевтически приемлемых солей, одного или более чем одного выделенного энантиомера и их смесей.
В еще одном воплощении соединение по изобретению может быть выбрано из:
,, ,
и их фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из
и его фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из
и его фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из
и его фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из 4-{(S)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамида; 4-{(R)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамида; 4-[(R)-(3-аминофенил)[4-[(2-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамида; 4-[(R)-(3-аминофенил)[4-[(3-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамида и их фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из энантиомерно чистого 4-{(S)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамида; энантиомерно чистого 4-{(R)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамида; энантиомерно чистого 4-[(R)-(3-аминофенил)[4-[(2-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамида; энантиомерно чистого 4-[(R)-(3-аминофенил)[4-[(3-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамида и их фармацевтически приемлемых солей.
Понятно, что соединения по настоящему изобретению содержат один или более чем один хиральный центр, соединения по изобретению могут существовать в виде энантиомерных или диастереоизомерных форм или в виде рацемической смеси, и могут быть выделены в виде энантиомерных или диастереоизомерных форм или в виде рацемической смеси. Настоящее изобретение включает любые возможные энантиомеры, диастереоизомеры, рацематы соединения формулы I или их смеси. Оптически активные формы соединения по изобретению могут быть получены, например, путем хирального хроматографического разделения рацемата, путем синтеза из оптически активных исходных веществ или путем асимметричного синтеза, основываясь на описанных далее способах.
Также понятно, что некоторые соединения по настоящему изобретению могут существовать в сольватированной, например гидратированной, а также несольватированной формах. Дополнительно понятно, что настоящее изобретение охватывает все такие сольватированные формы соединений формулы I.
В объеме изобретения также находятся соли соединений формулы I. Как правило, фармацевтически приемлемые соли соединений по настоящему изобретению могут быть получены с использованием стандартных способов, хорошо известных в области техники, например путем взаимодействия достаточно основного соединения, например алкиламина, с подходящей кислотой, например, HCl или уксусной кислотой, с получением физиологически приемлемого аниона. Также может быть возможно получение соответствующей соли щелочного (такого как натрий, калий или литий) или щелочно-земельного металла (такого как кальций) путем обработки соединения по настоящему изобретению, имеющего подходящий кислотный протон, такого как карбоновая кислота или фенол, одним эквивалентом гидроксида или алкоксида (такого как этоксид или метоксид) щелочного или щелочно-земельного металла, или подходящим основным органическим амином (таким как холин или меглумин) в водной среде с последующими обычными способами очистки.
В одном из воплощений соединение формулы I выше может быть превращено в его фармацевтически приемлемую соль или сольват, в частности соль присоединения кислоты, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат или пара-толуолсульфонат.
Новые соединения по настоящему изобретению полезны в терапии, в особенности для лечения различных болевых состояний, таких как хроническая боль, невропатическая боль, острая боль, боль при раке, боль, вызванная ревматоидным артритом, мигрень, висцеральная боль и т.д. Тем не менее этот список не следует интерпретировать как исчерпывающий.
Соединения по изобретению полезны в лечении диареи, депрессии, тревоги и/или расстройств, вызванных стрессом, таких как посттравматические стрессовые расстройства, паническое расстройство, генерализированное тревожное расстройство, социофобия, и обсессивно-компульсивное расстройство, недержания мочи, преждевременной эякуляции, различных умственных расстройств, кашля, отека легкого, различных желудочно-кишечных расстройств, например запора, функциональных желудочно-кишечных расстройств, таких как синдром раздраженного кишечника и функциональная диспепсия, болезни Паркинсона и других моторных расстройств, травматического повреждения головного мозга, инсульта, для защиты сердца после инфаркта миокарда, в лечении повреждения спинного мозга и наркозависимости, включая лечение алкогольной, никотиновой, опиоидной и другой лекарственной зависимости, и расстройств симпатической нервной системы, например гипертензии.
Соединения по изобретению полезны в качестве иммуномодуляторов, в особенности при аутоиммунных заболеваниях, таких как артрит, при трансплантации кожи, трансплантации органов и похожих хирургических потребностях, при коллагеновых заболеваниях, различных аллергиях, для применения в качестве противоопухолевых агентов и противовирусных агентов.
Соединения по изобретению полезны при болезненных состояниях, при которых дегенерация или дисфункция опиоидных рецепторов присутствует или вовлечена в эту модель. Может быть включено применение меченных радиоактивными изотопами вариантов соединений по изобретению в диагностических способах и визуализирующих применениях, таких как позитронно-эмиссионная томография (ПЭТ).
Соединения по изобретению полезны в качестве анальгетического агента для применения при общей анестезии и контролируемой анестезии. Комбинации агентов, обладающих различными свойствами, часто используют для достижения баланса эффектов, необходимых для поддержания анестетического состояния (например амнезия, аналгезия, мышечное расслабление и седативное действие). В эту комбинацию включены ингалируемые анестетики, снотворные средства, анксиолитики, нейромышечные блокаторы и опиоиды.
В объеме изобретения находится применение любого из соединений формулы I в соответствии с определенным выше для изготовления лекарственного средства.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для терапии боли, включая острую боль, хроническую боль, невропатическую боль, боль в спине, боль при раке и висцеральную боль, но не ограничиваясь ими.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для терапии тревоги, включая социофобию, генерализированное тревожное расстройство, острое тревожное состояние, но не ограничиваясь ими.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для терапии депрессии.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для терапии болезни Паркинсона.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для лечения любого из обсуждавшихся выше состояний.
Еще один аспект изобретения представляет собой способ лечения субъекта, страдающего любым из обсуждавшихся выше состояний, при котором пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения по настоящему изобретению.
Таким образом, в изобретении предложено соединение формулы I или его фармацевтически приемлемая соль или сольват в соответствии с определенным выше для применения в терапии.
В контексте настоящего описания, если специально не указано иного, термин "терапия" также включает "профилактику". Термины "терапевтический" и "терапевтически" должны быть интерпретированы соответственно. Термин "терапия" в контексте настоящего изобретения дополнительно включает введение эффективного количества соединения по настоящему изобретению для смягчения ранее существующего болезненного состояния, острого или хронического, или рецидивирующего состояния. Это определение также охватывает способы профилактической терапии для предотвращения рецидивирующих состояний и непрерывную терапию для хронических расстройств.
При применении для терапии у теплокровного животного, такого как человек, соединение по изобретению может быть введено в форме обычной фармацевтической композиции при помощи любого из путей, включающих пероральный, внутримышечный, подкожный, местный, интраназальный, внутрибрюшинный, внутригрудинный, внутривенный, эпидуральный, внутриоболочечный, интрацеребровентрикулярный путь и путем инъекции в с суставы.
В одном из воплощений изобретения путь введения может быть пероральным, внутривенным или внутримышечным.
Доза зависит от пути введения, тяжести заболевания, возраста и массы пациента и других факторов, обычно рассматриваемых лечащим врачом при определении наиболее подходящей для конкретного пациента индивидуальной схемы приема лекарственного средства и уровня дозы.
Дополнительно предложена фармацевтическая композиция, содержащая соединение по настоящему изобретению, его сольваты или фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем.
В частности, предложена фармацевтическая композиция, содержащая соединение по настоящему изобретению, его сольваты или фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем, для терапии, более конкретно для терапии боли и тревоги.
Кроме того, предложена фармацевтическая композиция, содержащая соединение по настоящему изобретению, его сольваты или фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем, для применения при любом из обсуждавшихся выше состояний.
Для приготовления фармацевтических композиций из соединений по изобретению инертные фармацевтически приемлемые носители могут быть твердыми и жидкими. Препараты в виде твердой формы включают порошки, таблетки, диспергируемые гранулы, капсулы, саше и суппозитории.
Твердый носитель может представлять собой одно или более чем одно вещество, которое также может действовать в качестве разбавителей, корригентов, солюбилизаторов, смазывающих веществ, суспендирующих агентов, связывающих веществ или разрыхлителей для таблеток; он также может представлять собой инкапсулирующее вещество.
В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным соединением по изобретению, или активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми связывающими свойствами, в подходящих пропорциях, и спрессован в желаемую форму и до желаемого размера.
Для приготовления композиций в виде суппозиториев легкоплавкий воск, такой как смесь глицеридов жирных кислот и масла какао, сначала плавят, и активный ингредиент диспергируют в нем, например путем перемешивания. Расплавленную гомогенную смесь затем выливают в формы с удобным размером и дают возможность охладиться и затвердеть.
Подходящие носители представляют собой карбонат магния, стеарат магния, тальк, лактозу, сахар, пектин, декстрин, крахмал, трагакантовую камедь, метилцеллюлозу, натриевую карбоксиметилцеллюлозу, легкоплавкий воск, масло какао и т.п.
Также предполагают, что термин "композиция" включает приготовление активного компонента с инкапсулирующим материалом в качестве носителя с получением капсулы, в которой активный компонент (с другими носителями или без них) окружен носителем, который, таким образом, ассоциирован с ним. Похожим образом, включены саше.
Таблетки, порошки, саше и капсулы могут быть использованы в качестве твердых лекарственных форм, подходящих для перорального введения.
Жидкие композиции включают растворы, суспензии и эмульсии. Например, стерильные водные или водные пропиленгликолевые растворы активных соединений могут представлять собой жидкие препараты, подходящие для парентерального введения. Жидкие композиции также могут быть приготовлены в виде раствора в водном растворе полиэтиленгликоля.
Водные растворы для перорального введения могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизаторов и загустителей. Водные суспензии для перорального применения могут быть приготовлены путем диспергирования тонкоизмельченного активного компонента в воде вместе с вязким веществом, таким как природные и синтетические камеди, смолы, метилцеллюлоза, натриевая карбоксиметилцеллюлоза и другие суспендирующие агенты, известные в области фармацевтических препаратов.
В зависимости от способа введения фармацевтическая композиция предпочтительно включает от 0,05% до 99 мас.% (процент по массе), предпочтительней от 0,10 до 50 мас.% соединения по изобретению, все проценты по массе основаны на массе всей композиции.
Терапевтически эффективное количество для практического применения настоящего изобретения может быть определено путем применения известных критериев, включающих возраст, массу и реакцию конкретного пациента, и интерпретировано в контексте заболевания, которое лечит или предотвращает специалист в данной области техники.
В еще одном аспекте настоящего изобретения предложен способ получения соединений по настоящему изобретению.
В одном из воплощений в изобретении предложен способ получения соединения формулы I
включающий взаимодействие N,N-диэтил-4-[(3-нитрофенил)(1-пиперазинил)метил]бензамида с R-CH2X или R-CHO с получением нитро-промежуточного соединения;
восстановление указанного промежуточного соединения подходящим восстанавливающим агентом, где
R выбран из 2-фторфенила, 3-фторфенила и 4-фторфенила; и
Х выбран из Cl, I, Br, -OTs (тозил) и -OMs (мезилат).
В одном из воплощений указанный восстанавливающий агент может быть выбран из водорода, цинка и железа.
В еще одном воплощении указанный N,N-диэтил-4-[(3-нитрофенил)(1-пиперазинил)метил]бензамид может быть выбран из N,N-диэтил-4-[(S)-(3-нитрофенил)(1-пиперазинил)метил]бензамида и N,N-диэтил-4-[(R)-(3-нитрофенил)(1-пиперазинил)метил]бензамида.
В еще одном воплощении R может представлять собой 2-фторфенил; и соединение формулы I может представлять собой 4-[(3-аминофенил)[4-[(2-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамид.
В еще одном воплощении R может представлять собой 3-фторфенил; и соединение формулы I может представлять собой 4-[(3-аминофенил)[4-[(3-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамид.
В еще одном воплощении R может представлять собой 4-фторфенил; и соединение формулы I может представлять собой 4-[(3-аминофенил)[4-[(4-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамид.
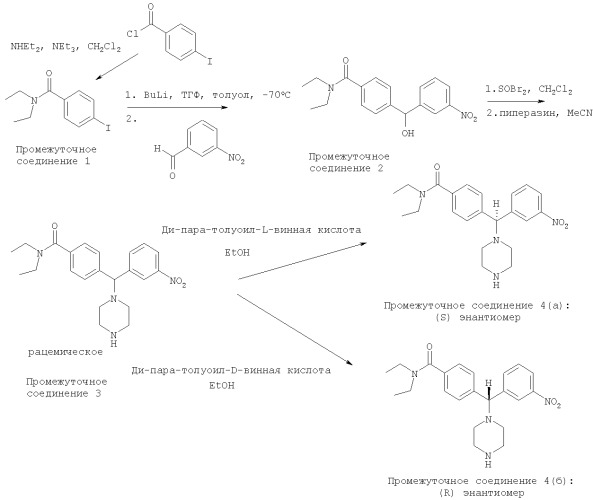
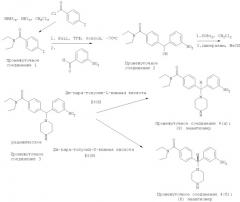
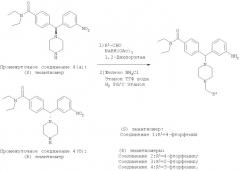
Конкретней, соединения по настоящему изобретению и промежуточные соединения, используемые для их получения, могут быть получены в соответствии с путями синтеза в соответствии с приведенным на схемах 1 и 2.
Схема 1
Схема 2
Биологическая оценка и свойства
Обнаружено, что соединения по изобретению активны в отношении δ рецепторов у теплокровного животного, например человека. В частности, обнаружено, что соединения по изобретению представляют собой эффективные лиганды δ рецептора. Анализы in vitro ниже продемонстрировали эти неожиданные активности, в особенности в отношении агонистической активности и эффективности, как продемонстрировано в функциональном анализе на головном мозге крысы и/или функциональном анализе человеческого δ рецептора (ниже). Это свойство может быть связано с активностью in vivo и может не коррелировать линейно с аффинностью связывания. В этих анализах in vitro тестируют активность соединения в отношении δ рецепторов и получают IC50 для определения избирательной активности для конкретного соединения в отношении δ рецепторов. В контексте настоящего изобретения IC50 в общем относится к концентрации соединения, при которой наблюдают 50%-ное замещение стандартного радиоактивного лиганда δ рецептора.
Активности соединения в отношении κ и µ рецепторов также измеряют в похожем анализе.
Модели in vitro
Культура клеток
Человеческие клетки 293S, экспрессирующие клонированные человеческие κ, δ и µ рецепторы, и резистентные к неомицину, выращивают в суспензии при 37°С и 5% CO2 в колбах шейкера, содержащих бескальциевую среду Игла, модифицированную Дульбекко (DMEM), 10% эмбриональной бычьей сыворотки (FBS), 5% сыворотки теленка (BCS), 0,1% Pluronic F-68 и 600 мкг/мл генетицина.
Образцы головного мозга крыс взвешивают и промывают охлажденным на льду физиологическим раствором, забуференным фосфатом (PBS) (содержащим 2,5 мМ этилендиаминтетрауксусной кислоты (ЭДТА), рН 7,4). Образцы головного мозга гомогенизировают с использованием политрона в течение 30 с (для крыс) в охлажденном на льду лизирующем буфере (50 мМ Tris, рН 7,0, 2,5 мМ ЭДТА, с добавлением фенилметилсульфонилфторида непосредственно перед применением до концентрации 0,5 мМ из концентрированного 0,5 М раствора в смеси ДМСО (диметилсульфоксид):этанол).
Приготовление мембран
Клетки осаждают и ресуспендируют в лизирующем буфере (50 мМ Tris, рН 7,0, 2,5 мМ ЭДТА с добавлением фенилметилсульфонилфторида (ФМСФ) непосредственно перед применением до 0,1 мМ из 0,1 М концентрированного раствора в этаноле), инкубируют на льду в течение 15 мин, затем гомогенизируют с использованием политрона в течение 30 с. Суспензию центрифугируют при 1000 g (макс.) в течение 10 мин при 4°С. Супернатант хранят на льду, и осадки ресуспендируют и центрифугируют как ранее. Супернатанты после обоих центрифугирований объединяют и центрифугируют при 46000 g (макс.) в течение 30 мин. Осадки ресуспендируют в охлажденном буфере Tris (50 мМ Tris/Cl, рН 7,0) и вновь центрифугируют. Окончательно полученные осадки ресуспендируют в буфере для мембран (50 мМ Tris, 0,32 М сахароза, рН 7,0). Аликвоты (1 мл) в полипропиленовых пробирках замораживают в сухом льду/этаноле и хранят при -70°С до применения. Концентрации белка определяют путем модифицированного анализа Лоури с додецилсульфатом натрия.
Анализы связывания
Мембраны оттаивают при 37°С, охлаждают на льду (или хранят на льду, если не используют сразу), трижды пропускают через иглу 25-го калибра и разбавляют в буфере для связывания (50 мМ Tris, 3 мМ MgCl2, 1 мг/мл бычьего сывороточного альбумина (БСА) (Sigma A-7888), рН 7,4, который хранят при 4°С после фильтрования через фильтр 0,22 мм, и к которому сразу добавляют 5 мкг/мл апротинина, 10 мкМ бестатина, 10 мкМ дипротина А, если мембраны приготовлены из ткани (крысы, мыши, обезьяны, при отсутствии дитиотрейтола (ДТТ)). В охлажденные на льду полипропиленовые пробирки размером 12×75 мм, содержащие 100 мкл соответствующего радиолиганда и 100 мкл тестируемого соединения в различных концентрациях, добавляют аликвоты по 100 мкл. Общее связывание (ОС) и неспецифическое связывание (НС) определяют соответственно в отсутствие и в присутствии 10 мкМ налоксона. Пробирки вортексируют и инкубируют при 25°С в течение 60-75 мин, после чего содержимое подвергают быстрой вакуумной фильтрации и промывают приблизительно 12 мл/пробирку охлажденного на льду промывающего буфера (50 мМ Tris, рН 7,0, 3 мМ MgCl2) через фильтры GF/B (Whatman), предварительно промытые в течение по меньшей мере 2 ч в 0,1%-ном полиэтиленимине. Оставшуюся на фильтрах радиоактивность (распады в мин) измеряют при помощи бета-счетчика после выдержки фильтров в течение по меньшей мере 12 ч в минивиалах, содержащих 6-7 мл сцинтилляционной жидкости. Если анализ осуществляют в 96-луночных планшетах с глубокими лунками, фильтрацию осуществляют через монофильтры для 96-луночных планшетов, выдержанные в полиэтиленимине (ПЭИ), которые промывают 3×1 мл промывающего буфера и сушат в печи при 55°С в течение 2 ч. Фильтровальные планшеты подсчитывают в TopCount (Packard) после добавления 50 мкл сцинтилляционной жидкости MS-20/лунку. В случае анализов, проводимых в 96-луночных планшетах с глубокими лунками, IC50 соединений оценивают на основе 10-точечных кривых замещения в случае дельта, и 5-точечных кривых замещения в случае µ и κ. Анализ осуществляют в 300 мкл с соответствующим количеством мембранного белка (2 мкг, 35 мкг и 1 мкг в случае соответственно δ, µ и κ) и 50000-80000 распадов в мин/лунку соответствующего индикатора (125I-Deltorphin II, 125I-FK33824, и 125I-DPDYN соответственно для δ, µ и κ). Общее связывание и неспецифическое связывание определяют в присутствии и отсутствии 10 мкМ налоксона.
Функциональные анализы
Агонистическую активность соединений измеряют путем определения степени, в которой комплекс соединения и рецептора активирует связывание гуанозинтрифосфата (GTP) с G-белками, с которыми сопряжены рецепторы. В анализе связывания GTP комбинируют GTP[γ]35S с тестируемым соединением и мембранами клеток HEK-293S, экспрессирующих клонированные человеческие опиоидные рецепторы, или из гомогенизированных образцов головного мозга крысы или мыши. Агонисты стимулируют связывание GTP[γ]35S в этих мембранах. Значения ЕС50 и Emax соединений определяют из кривых доза-ответ. Сдвиг вправо кривой доза-ответ дельта-агонистом налтриндолом осуществляют для подтверждения того, что агонистическая активность опосредована дельта-рецепторами. Для функциональных анализов человеческих δ-рецепторов EC50 (низкая) измеряют, когда человеческие δ-рецепторы, используемые в анализе, экспрессируются с меньшими уровнями по сравнению с используемыми для определения EC50 (высокая). Значения Emax определяли относительно стандартного δ-агониста SNC80, т.е. величина, большая чем 100%, соответствует соединению, которое обладает лучшей эффективностью по сравнению с SNC80.
Процедура для GTP в головном мозге крысы
Мембраны головного мозга крыс оттаивают при 37°С, трижды пропускают через иглу 25-го калибра с тупым концом и разбавляют в буфере для связывания GTPγS (50 мМ HEPES, 20 мМ NaOH, 100 NaCl, 1 мМ ЭДТА, 5 мМ MgCl2, рН 7,4, добавляют свежеприготовленный: 1 мМ ДТТ, 0,1% БСА). В разведения мембран добавляют конечную концентрацию 120 мкМ гуанозиндифосфата (GDP). EC50 и Emax соединений оценивают по 10-точечным кривым доза-ответ в 300 мкл с соответствующим количеством мембранного белка (20 мкг/лунку) и 100000-130000 распадов в мин GTP[γ]35S на лунку (0,11-0,14 нМ). Базовое и максимальное стимулированное связывание определяют в отсутствие и в присутствии 3 мкМ SNC80. Анализ, осуществляемый на клетках НЕK 293S, стабильно экспрессирующих клонированные дельта рецепторы, проводят в слегка отличающемся буфере (50 мМ Hepes, 20 мМ NaOH, 200 мМ NaCl, 1 мМ ЭДТА, 5 мМ MgCl2, pH 7,4, добавляют свежеприготовленный: 0,5% БСА без ДТТ) и с конечной концентрацией 3 мкМ GDP.
Анализ данных
Специфическое связывание (СС) рассчитывали как ОС-НС, и СС в присутствии различных тестируемых соединений выражают в виде процента от контрольного СС. Значения IC50 и коэффициента Хилла (nH) для замещения лигандами специфически связавшегося радиолиганда рассчитывали по логарифмическим графикам или программам подгонки кривых, таких как Ligand, GraphPad Prism, SigmaPlot, или ReceptorFit. Значения константы ингибирования (Ki) рассчитывали в соответствии с уравнением Ченга-Прусоффа. Средние значения±стандартная ошибка среднего (СОС) для IC50, Ki, и nH приведены для лигандов, тестируемых по меньшей мере с использованием трех кривых замещения.
В Таблице 1 приведены некоторые биологические данные по нескольким соединениям по изобретению, измеренные с использованием вышеописанных анализов.
| Структура | IC50hd | IC50hk | IC50hm | EC50h (низкая) | EC50h (низкая) Emax | EC50h (выс.) | EC50h (выс.) Emax | EC50rb | EC50rb Emax |
| 0,587 | 5524 | 715 | 20,63 | 95,3 | 4,18 | 103,8 | 22,82 | 130,3 | |
| 8,80 | более 10000 | 3316 | Н/O | Н/O | 100,3 | 89,09 | 465,9 | 66,32 |
| 0,717 | 7258 | 2262 | 48,10 | 89,96 | Н/O | Н/O | Н/O | Н/O | |
| 1,08 | 5767 | 2736 | 77,42 | 84,44 | Н/O | Н/O | Н/O | Н/O |
Н/O - не доступно
Эксперименты с насыщением рецептора
Значения Kδ для радиолиганда определяют путем осуществления анализов связывания на клеточных мембранах с соответствующими радиолигандами в концентрациях, находящихся в диапазоне 0,2-5 раз относительно установленного Кδ (до 10 раз, если требуемые количества радиолиганда являются допустимыми). Специфическое связывание радиолиганда выражают в виде пмоль/мг мембранного белка. Значения Кδ и Bmax для индивидуальных экспериментов получают по результатам нелинейных подгонок специфически связанного (В) относительно нМ свободного (F) радиолиганда для индивида в соответствии с одноцентровой моделью.
Определение механической аллодинии с использованием теста фон Фрея
Тестирование проводят в период с 08:00 до 16:00 ч с использованием способа, описанного в Chaplan et al. (1994). Крыс помещают в контейнеры из плексигласа на поверхности из проволочной сетки, дающей возможность для доступа к лапе, и оставляют для привыкания в течение 10-15 мин. Тестируемая область представляет собой середину подошвы левой задней лапы, избегая менее чувствительных подушечек лап. До лапы дотрагиваются серией из 8 волосков фон Фрея с логарифмически возрастающей жесткостью (0,41, 0,69, 1,20, 2,04, 3,63, 5,50, 8,51 и 15,14 грамм; Stoelting, III, USA). Волосок фон Фрея применяют из-под сетчатого пола перпендикулярно поверхности подошвы с достаточной силой для того, чтобы вызвать слабый прогиб лапы и удерживают в течение приблизительно 6-8 секунд. Положительную реакцию регистрируют в том случае, если лапа резко отдергивается. Вздрагивание непосредственно при удалении волоска также рассматривают как положительную реакцию. Передвижение рассматривают как неопределенную реакцию и в таких случаях стимул повторяют.
Протокол теста
Животных в группе, обработанной полным адъювантом Фрейнда (FCA), тестируют на следующий день после операции. 50%-ный порог отдергивания определяют с использованием способа «вверх-вниз» Диксона (Dixon, 1980). Тестирование начинают с волосом 2,04 г в середине серии. Стимулы всегда представляют последовательно по восходящей или по нисходящей. В отсутствии реакции в виде отдергивания лапы на исходно выбранный волосок представляют более сильный стимул; в случае отдергивания лапы следующим выбирают более слабый стимул. Для оптимального расчета порогового уровня с использованием этого способа требуется 6 реакций в непосредственной близости от 50%-ного порогового уровня, и подсчет этих 6 реакций начинается, когда возникает первое изменение в реакции, например впервые пересекается пороговый уровень. В случаях, когда пороговые уровни оказываются за пределами стимулов, соответственно присваивают значения 15, 14 (нормальная чувствительность) или 0,41 (максимальная аллодиния). Получающуюся в результате картину положительных и отрицательных реакций табулируют с использованием правила Х = отсутствие отдергивания; O = отдергивание, и 50%-ный порог отдергивания интерполируют с использованием формулы
50%-ный г пороговый уровень = 10(Xf+κδ)/10000
где Xf = величина последнего используемого волоска фон Фрея (логарифмические единицы); κ = табличное значение (по Chaplan et al. (1994)) для картины положительных/отрицательных реакций; и δ = среднее различие между стимулами (логарифмические единицы). Здесь δ=0,224.
Пороговые величины фон Фрея превращают в процент от максимального возможного эффекта (% МВЭ) в соответствии с Chaplan et al. 1994. Для расчета % МВЭ используют следующее уравнение:
Введение тестируемого вещества
Крысам инъецируют (подкожно, внутрибрюшинно, внутривенно или перорально) тестируемое вещество перед тестом фон Фрея, время между введением тестируемого соединения и тестом фон Фрея варьирует в зависимости от природы тестируемого соединения.
Тест с корчами
Уксусная кислота вызывает абдоминальные сокращения при внутрибрюшинном введении крысам. Это затем приводит к типичному вытягиванию их тела. При введении обезболивающих средств это описанное движение наблюдают с меньшей частотой и лекарственное средство выбирают в качестве потенциального хорошего кандидата.
Полный и типичный рефлекс корчей рассматривают только тогда, когда присутствуют следующие элементы: животное не находится в движении; нижняя часть спины слегка ослаблена; наблюдают за подошвами обеих лап. В этом анализе соединения по настоящему изобретению демонстрируют значительное ингибирование реакций в виде корчей после перорального введения дозы 1-100 мкмоль/кг.
(1) Приготовление растворов
Уксусная кислота (АсОН): 120 мкл уксусной кислоты добавляют к 19,88 мл дистиллированной воды для получения конечного объема 20 мл с конечной концентрацией 0,6% АсОН. Раствор затем перемешивают (вортекс) и готовят для инъекции.
Соединение (лекарственное средство): Каждое соединение готовят и растворяют в наиболее подходящем разбавителе в соответствии со стандартными способами.
(2) Введение растворов
Соединение (лекарственное средство) вводят перорально, внутрибрюшинно (в.б.), подкожно (п.к.) или внутривенно (в.в.) в концентрации 10 мл/кг (из расчета средней массы тела мыши) за 20, 30 или 40 минут (в соответствии с классом соединения и его характеристиками) перед тестированием. Когда соединение вводят центрально: интравентрикулярно (и.в.к.) или внутриоболочечно (в.о.), вводят объем 5 мкл.
АсОН вводят внутрибрюшинно (в.б.) в две области в концентрации 10 мл/кг (из расчета средней массы тела мыши) непосредственно перед тестированием.
(3) Тестирование
За животными (мышами) наблюдают в течение 20 минут и количество событий (рефлекс корчей) фиксируют и накапливают в конце эксперимента. Мышей держат в индивидуальных клетках типа "коробка для обуви" с прикрепленной подстилкой. Обычно одновременно наблюдают за 4 мышами: один контроль и три дозы лекарственного средства.
Для тревоги и подобных тревоге показаний оценивают эффективность в конфликтном тесте Геллера-Зейфтера на крысах.
Для показаний функционального желудочно-кишечного расстройства эффективность может быть оценена на крысах в анализе, описанном Coutinho SV et al., в American Journal of Physiology - Gastrointestinal&Liver Physiology. 282 (2):G307-16, 2002 Feb.
Дополнительные протоколы тестирования in vivo
Объекты и содержание
Не подвергнутых обработке самцов крыс Sprague Dawley (175-200 г) содержат в группах по 5 штук в помещении с контролируемой температурой (22°С, влажность 40-70%, 12-часовой световой/темновой период). Эксперименты проводят во время светлой фазы цикла. Животные получают корм и воду без ограничений и их умерщвляют непосредственно после получения данных.
Образец
Тестируемые в отношении соединения (ле