Способ получения диметилового эфира 2,5-тиофендикарбоновой кислоты из тиофена
Иллюстрации
Показать всеИзобретение относится к способу получения диметилового эфира 2,5-тиофендикарбоновой кислоты, который заключается во взаимодействии тиофена с четыреххлористым углеродом в присутствии метанола под действием катализатора трис(2,4-пентанодионато)железа Fe(асас)3, активированного азотсодержащим лигандом - хинолином или пиридином, при температуре 150°С в течение 6 ч при мольном соотношении 0.04:0.4:4:45:30. Технический результат - разработан способ получения диметилового эфира 2,5-тиофендикарбоновой кислоты, который позволяет получать продукт с более высоким выходом. Диметиловый эфир 2,5-тиофендикарбоновой кислоты применяется в производстве электропроводящих полимеров, электродов, сенсоров, конденсаторов, дисплеев, оптических отбеливателей, гельэлектролитов, ионообменных мембран. 1 табл.
Реферат
Предлагаемое изобретение относится к области органической химии, в частности к способу получения диметилового эфира 2,5-тиофендикарбоновой кислоты.
2,5-тиофендикарбоновая кислота (ТФДК), а также ряд ее производных являются исходными соединениями для синтеза электропроводящих полимеров, электродов, сенсоров, конденсаторов, дисплеев, гельэлектролитов, мембран ([1] Патент Германии №1298133, 18.09.2002) и жидкокристаллических полимеров с сильноразвитой ЖК-фазой ([2] Н-С.Lin, C.-W.Ко, К.Guo, T.-W.Cheng // Liquid Crystals, 26, №4, 613-618, 1999; [3] J.Xu, Y.Wang, T.-S.Chung, S.H.Goh // J.Mater. Res., V.18, №7, p.1509-1521, 2003).
Кроме того, 2,5-тиофендикарбоновая кислота находит широкое применение для получения оптических отбеливателей (ТФДК является исходным соединением для синтеза дихлор-тетрагидротиофен-2,5-дикарбоновой кислоты) ([4] V.А.Doriars, C.-W.Schellhammer, J.Schroeder // Angew. Chem., 87, №19, 1975, 693-707; [5] Патент Швейцарии №437347, 30.11.1967).
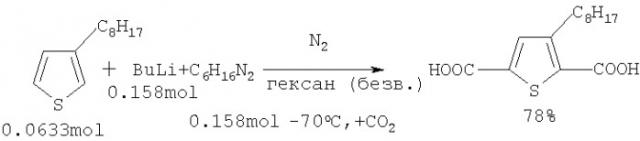
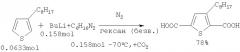
2,5-Тиофендикарбоновую кислоту (имеющую алкильный заместитель в положении 3) получают металлированием 3-алкилтиофена избытком бутиллития в виде комплекса с тетраметилэтилендиамином с последующим карбоксилированием 2,5-дилитий-3-алкилтиофена ([6] H.Meng, W.Huang // J. Org.Chem. 65, 3894, 2000; [7] H.Wynberg, D.J.Zwanenburg // J. Org.Chem. 29, 1919, 1964).
К раствору (18.3 г, 0.158 моль) тетраметилэтилендиамина в безводном гексане (30 мл) и 1,6 М бутиллития в гексане (98 мл, 0,158 моль) добавляют 12,4 г, 0.0633 моль 3-октилтиофена в атмосфере азота при комнатной температуре. После перемешивания при комнатной температуре в течение 1 ч смесь кипятят 30 мин, затем охлаждают до -70°С и медленно приливают под азотом в колбу (V=500 мл), наполовину заполненную сухим накрошенным льдом (CO2). К реакционной смеси приливают 10 М HCl и добавляют лед. После нейтрализации органической фазы 10%-ным раствором NaOH целевой продукт экстрагируют диэтиловым эфиром. Затем эфирный экстракт промывают водой и водным раствором NaCl, высушивают над MgSO4 и растворитель отгоняют. После перекристаллизации из смеси этанол-вода было получено 14 г (выход 78%) 3-октил-2,5-тиофендикарбоновой кислоты ([6] Н. Meng, W. Huang.// J. Org.Chem. 65, 3894, 2000]
Метод имеет ряд существенных недостатков:
1. Использование дорогостоящего металлоорганического реагента бутиллития, который берется в избытке (2,5 раза).
2. Необходимость проведения реакции при пониженной температуре (-70°С).
3. Применение сильной кислоты (НСl), что требует нейтрализации реакционной массы после окончания процесса.
4. Проведение реакции в атмосфере азота.
5. Сложности выделения целевого продукта и образование трудноутилизуемых отходов и сточных вод, содержащих большое количество LiCl и тетраметилэтилендиамина.
Хлорангидрид 2,5-тиофендикарбоновой кислоты можно получить взаимодействием адипиновой кислоты с тионилхлоридом в присутствии пиридина при 140-150°С в течение 5-6 ч, выход хлорангидрида кислоты составляет 63% ([8] S. Nakagawa, J. Ukumura, F. Sakai, H.Toshi, T. Naito // Tetrahedron Lett. №42, 3719, 1970)
Недостатки метода
1. Использование трехкратного избытка тионилхлорида (SOCl2), что требует его нейтрализации после завершения реакции и утилизации отходов и сточных вод, содержащих HCl и H2SO4.
2,5-Тиофендикарбоновая кислота была получена с выходом 45% из метилового эфира 2-тиофенкарбоновой кислоты [9] V.A. Dorlars, C.-W. Schellhammer, J. Schroeder// Angew. Chem., 87, №19, 693-707, 1975]
Недостатки метода:
1. Многостадийность процесса.
2. Низкий общий выход целевого продукта.
В патенте США ([10] Патент США 2900386, 18.08.1959) описан каталитический метод получения 2,5-тиофендикарбоновой кислоты. Смесь 46 г калиевой соли 2-тиофенкарбоновой кислоты и 23 г оксида кадмия (CdO) помещают в автоклав (V=200 мл) и нагревают в течение 1 ч при 340°C с в атмосфере диоксида углерода (CO2) при давлении 50 атм. Затем полученный порошкообразный продукт вымывают 500 мл воды и отфильтровывают. Фильтрат нейтрализуют HCl. Выход 2,5-тиофендикарбоновой кислоты составляет 14,9 г (31%).
Недостатки метода:
1. Низкий выход целевого продукта (31%).
2. Использование большого количества высокотоксичного оксида кадмия.
3. Применение высоких температур и давления (340°С, 50 атм).
4. Нейтрализация реакционной среды с помощью HCl, что приводит к образованию большого количества промывных вод, содержащих CdCl2 и KCl.
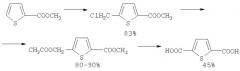
2,5-Тиофендикарбоновая кислота получена окислением из 2,5-бис(гидроксиметил)тиофена ([11] S.Оае, N.Furukawa, Т.Watanade, Y.Otsuji, М.Hamada // Bull. Chem. Soc. Japan, 38, 1247, 1965; [12] J.M.Griffing, L.F.Salisburg/ J.Am.Chem. Soc., 70, 3416, 1948; [13] R.Lukes, М.Janda, К.Kefurt // Coll. Czech. Chem. Commun. 25, 1058, 1960; [14] Y.Matsumoto, T.Sone // Kogyo Kagaku Zasshi, 62, 1559, 1959; [15] S.Gronowitz, A-B.Hornfeldt / Thiophenes (The best methods), Elsivier, 2004, P.961].
Тиофен сначала хлорметилируют параформом в присутствии HCl с образованием 2,5-дихлорметилтиофена, который затем обрабатывают ацетатом калия в среде уксусной кислоты. Далее полученный 2,5-дигидроксиметилтиофен окисляют до соответствующей дикарбоновой кислоты с помощью перманганата калия KMnO4. Общий выход 2,5-тиофендикарбоновой кислоты, считая на 4 стадии, составляет ~52%.
Недостатки метода:
1. Многостадийность (4 стадии).
2. Использование 3-кратного избытка сильного окислителя перманганата калия KMnO4.
3. Образование в качестве отхода MnO2 (3 моля на 1 моль целевого продукта), который надо утилизовать.
4. Применение большого количества кислот: газообразного HCl и ледяной уксусной кислоты, что требует их нейтрализации после завершения реакции и утилизации отходов и сточных вод.
5. Низкий общий выход ~52%.
Эфиры 2,5-тиофендикарбоновой кислоты были получены взаимодействием тиофенов с системой CCl4-ROH-катализатор с общим выходом 3-22%. Реакция проходит при температуре 140-175°C за 6 ч при следующих оптимальных концентрациях катализатора и реагентов: [катализатор]:[тиофен]:[ROH]:[CCl4]=1:100:200÷400:100÷200.
Наилучшими катализаторами указанной реакции являются VO(acac)2, Мо(СО)6, а основными продуктами реакции являются алкиловые эфиры 2-тиофенкарбоновой кислоты (44-92%).
Кроме метилового эфира 2-тиофендикарбоновой кислоты в реакционной массе присутствует небольшое количество (9%) диметилового эфира 2,5-тиофендикарбоновой кислоты ([16] Р.И.Хуснутдинов, Н.А.Щаднева, А.Р.Байгузина, P.P.Мукминов, Ю.Ю.Маякова, А.А.Смирнов, У.М.Джемилев// Нефтехимия, 48(6), 467, 2008].
Прототип имеет следующий недостаток.
Низкий выход целевого продукта - диметилового эфира 2,5-тиофендикарбоновой кислоты составляет 9%.
В связи с этим авторы изобретения поставили перед собой задачу разработать метод получения диметилового эфира 2,5-тиофендикарбоновой кислоты с более высоким выходом.
Сущность способа заключается во взаимодействии тиофена с метанолом в присутствии четыреххлористого углерода под действием катализатора трис(2,4-пентанодионато)железа Fe(асас)3, активированного азотсодержащим лигандом - хинолином или пиридином, при температуре 150°С в течение 6 ч при мольном соотношении [Fe(асас)3]:[лиганд]:[тиофен]:[метанол]:[CCl4]=0.04:0.4:4:45:30. Выход диметилового эфира 2,5-тиофендикарбоновой кислоты составляет 48%. При использовании в качестве лиганда-активатора пиридина выход диметилового эфира 2,5-тиофендикарбоновой кислоты составляет 35%.
При уменьшении продолжительности реакции до 3 ч выход целевого продукта снижается до 18%. При увеличении продолжительности реакции до 10 ч выход диметилового эфира 2,5-тиофендикарбоновой кислоты составляет всего до 6%, что обусловлено образованием более тяжелых продуктов.
В отсутствии лиганда в оптимальных условиях выход целевого продукта не превышает 8%. При использовании следующих молъных соотношений: [Fe(acac)3]:[лиганд]:[тиофен]:[CH3OH]:[CCl4]=0.1:1:6-10:45:30 (в качестве лиганда применяли пиридин, хинолин) выход диметилового эфира 2,5-ТФДК не превысил 10%. При использовании пиридина в качестве лиганда при оптимальном соотношении реагентов и благоприятных условиях выход целевого продукта составил 35%.
Существенные отличия предлагаемого способа от прототипа.
1. Для получения диметилового эфира 2.5-тиофендикарбоновой кислоты из тиофена используется железосодержащий катализатор Fe(acac)3, активированный азотсодержащим лигандом - хинолином.
2. Используется следующее мольное соотношение [Fe(acac)3]:[C9H7N:[тиофен]:[метанол]:[CCl4]=0.04:0.4:4:45:30.
Преимущества предлагаемого метода.
1. Одностадийность процесса.
2. Доступность и дешевизна исходных реагентов.
3. Хороший выход диметилового эфира 2,5-тиофендикарбоновой кислоты 48%.
Предлагаемый способ поясняется примерами.
ПРИМЕР 1. Реакции проводят в стеклянной ампуле (V=20 мл) или в микроавтоклаве из нержавеющей стали (V=17 мл).
В микроавтоклав (ампулу) под аргоном помещают 0.04 ммоль Fe(acac)3, 0.4 ммоль пиридина, 4 ммоль 2-тиофенкарбоновой кислоты, 30 ммоль CCl4 и 45 ммоль CH3OH, автоклав герметично закрывают (ампулу запаивали) и нагревают при 150°С в течение 6 часов с постоянным перемешиванием. После окончания реакции автоклав (ампулу) охлаждают до 20°С, вскрывают, нейтрализуют водным раствором Na2CO3. Экстрагируют CHCl3. Органический слой фильтруют через слой силикагеля (2 грамма) (элюент - хлороформ). Растворитель отгоняют, остаток декантируют гексаном. Гексановую фракцию упаривают, оставляя 1/3, при этом в остатке снова выпадают кристаллы (т.к. продукт частично растворим в гексане). Выпавшие кристаллы снова декантируют гексаном до тех пор, пока не перестанут выпадать кристаллы. Выпавшие кристаллы перекристаллизовывают из диэтилового эфира. Конверсия исходного тиофена составила ~70%. Общий выход диметилового эфира 2.5-тиофендикарбоновой кислоты составляет 48%, а при расчете на конвертированный тиофен - 68.5%, т.пл. 145,5-146°С (лит. 145°С)([17] Словарь органических соединений, Изд-во иностр. лит., 1949, т.3].
Спектр ЯМР 1H δ, м.д.: 7.73 (2Н, с, CH тиофена), 3.91(6Н, с, CH3).
ЯМР 13C (COCl3, д, м.д.): 131.00 (C2,5), 133.71 (C3,4), 162.09 (C6,8), 52.54 (C7,9).
Масс-спектр, т/е (Iотн., %): 200 [M+] (85), 53 (30), 81 (25), 82 (38), 98 (18), 111 (15), 141 (21), 169 (100), 170 (38), 171 (23).
Другие примеры, подтверждающие способ, приведены в таблице 1.
| Таблица 1 | |||||
| Результаты опытов по синтезу диметилового эфира 2,5-тиофендикарбоновой кислоты реакцией тиофена с CH3OH и CCl4 под действием катализатора Fe(acac)3, активированного азотсодержащими лигандами | |||||
| №№ пп | лиганд | Мольное соотношение [Fe(acac)3]:[лиганд]:[тиофен]:[CH3OH]:[CCl4] | Температура, °C | Время реакции, ч | Общий выход диметилового эфира 2,5-тиофендикарбоновой кислоты, % |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1. | в отсутствие лиганда | 0.04:0:4:45:30 | 150 | 6 | 8 |
| 2. | пиридин | 0.04:0.4:4:45:30 | -«- | -«- | 35 |
| 3. | -«- | 0.06:0.6:6:45:30 | -«- | -«- | 7 |
| 4. | хинолин | 0.04:0.4:4:45:30 | -«- | 3 | 18 |
| 5. | -«- | -«- | -«- | 6 | 48 |
| 6. | -«- | -«- | -«- | 8 | 27 |
| 7. | -«- | 0.04:0.12:4:45:30 | -«- | 6 | 15 |
| 8. | -«- | 0.04:0.2:4:45:30 | -«- | 6 | 7 |
Способ получения диметилового эфира 2,5-тиофендикарбоновой кислоты I взаимодействием тиофена с метанолом и CCl4 в присутствии катализатора при T=150°C в течение 6 ч, отличающийся тем, что в качестве катализатора используют трис(2,4-пентанодионато)железа Fе(асас)3, активированного азотсодержащим лигандом - хинолином или пиридином, и мольное соотношение [Fе(асас)3]:[лиганд]:[тиофен]:[метанол]:[ССl] составляет 0.04:0.4:4:45:30.