Метаболиты антагонистов nk-1 против рвоты
Иллюстрации
Показать всеИзобретение относится к соединениям общей формулы (I)
где R представляет собой метил и R1 представляет собой 4-метил-4-окси-пиперазин-1-ил; или R представляет собой СН2ОН и R1 представляет собой 4-метил-пиперазин-1-ил или представляет собой 4-метил-4-окси-пиперазин-1-ил; и к их фармацевтически приемлемым кислотно-аддитивным солям, а также к лекарственному средству на основе этих соединений, обладающему активностью антагониста рецептора NK-1, и применению этих соединений для лечения заболеваний, связанных с рецептором NK-1. Технический результат: получены и описаны новые соединения, которые могуть найти свое применение в медицине. 6 н. и 3 з.п. ф-лы, 3 табл.
Реферат
Изобретение относится к соединениям общей формулы
где
R представляет собой метил и
R1 представляет собой 4-метил-4-окси-пиперазин-1-ил; или
R представляет собой CH2OH и
R1 представляет собой 4-метил-пиперазин-1-ил или представляет собой 4-метил-4-окси-пиперазин-1 -ил;
и к их фармацевтически приемлемым кислотно-аддитивным солям.
Соединения формулы I и их соли отличаются ценными терапевтическими свойствами. Было неожиданно обнаружено, что соединения по настоящему изобретению представляют собой антагонисты рецептора нейрокинина 1 (NK-1, вещества Р). Вещество Р представляет собой природный ундекапептид, относящийся к пептидам семейства тахикининов, последние так названы из-за их быстрого сокращающего действия на внесосудистую гладкомышечную ткань. Рецептор вещества Р является членом надсемейства связанных с G-белком рецепторов.
Нейропептидный рецептор вещества Р (NK-1) широко распределен по всей нервной системе млекопитающих (особенно головном мозге и спинномозговом ганглии), сердечно-сосудистой системе и периферических тканях (особенно двенадцатиперстной кишке и тонкой кишке) и участвует в регулировании ряда разных биологически процессов.
Центральные и периферические действия вещества Р, тахикинина млекопитающих, связаны с многочисленными воспалительными состояниями, включающими мигрень, ревматоидный артрит, астму, и воспалительным заболеванием кишечника, а также с проведением рвотного рефлекса и модуляцией расстройств центральной нервной системы (ЦНС), таких как болезнь Паркинсона (Neurosci. Res., 1996, 7, 187-214), тревога (Can. J. Phys., 1997, 75, 612-621) и депрессия (Science, 1998, 281, 1640-1645).
Доказательство полезности антагонистов тахикининового рецептора при боли, головной боли, особенно мигрени, болезни Альцгеймера, рассеянном склерозе, смягчении отмены морфина, сердечно-сосудистых изменениях, отеке, таком как отек, вызванный термическим ожогом, хронических воспалительных заболеваниях, таких как ревматоидный артрит, астма, бронхиальная гиперреактивность, и других респираторных заболеваниях, включающих аллергический ринит, воспалительных заболеваниях кишечника, включающих язвенный колит и болезнь Крона, повреждении глаз и воспалительных заболеваниях глаз приведено в работе «Tachykinin Receptor and Tachykinin Receptor Antagonists» (Тахикининовый рецептор и антагонисты тахикининового рецептора), J. Auton. Pharmacol., 13, 23-93, 1993.
Кроме того, антагонисты рецептора нейрокинина 1 разрабатывают для лечения ряда физиологических расстройств, связанных с избытком или дисбалансом тахикинина, в частности вещества Р. Примеры состояний, в которые вовлечено вещество Р, включают расстройства центральной нервной системы, такие как тревога, депрессия и психоз (WO 95/16679, WO 95/18124 и WO 95/23798).
Антагонисты рецептора нейрокинина-1, кроме того, полезны при лечении морской болезни и при лечении вызванной этим тошноты.
К тому же в The New England Journal of Medicine, Vol.340, No. 3 190-195, 1999 описано уменьшение вызванной цисплатином рвоты под действием селективного антагониста рецептора нейрокинина-1.
Кроме того, US 5,972,938 описывает способ лечения психоиммунологического или психосоматического расстройства при введении тахикининового рецептора, такого как антагонист рецептора NK-1.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются те, которые включают расстройства центральной нервной системы, например лечение или предотвращение определенных депрессивных расстройств или рвоты при введении антагонистов рецептора NK-1. Главный депрессивный эпизод определен как по меньшей мере двухнедельный период, в течение которого большую часть дня и почти каждый день было или подавленное настроение, или снижение интереса или удовольствия от всех или почти всех видов деятельности.
Предметами настоящего изобретения являются соединения формулы I, которые включают
2-(3,5-бис-трифторметил-фенил)-N-метил-N-[6-(4-метил-4-окси-пиперазин-1-ил)-4-орто-толил-пиридин-3-ил]-изобутирамид (соединение I-1),
2-(3,5-бис-трифторметил-фенил)-N-[4-(2-гидроксиметил-фенил)-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамид (соединение I-2) и
2-(3,5-диметил-фенил)-N-[4-(2-гидроксиметил-фенил)-6-(4-метил-4-окси-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамид (соединение I-3),
и их фармацевтически приемлемые соли, получение вышеуказанных соединений, лекарства, содержащие их, и их изготовление, а также применение вышеуказанных соединений при лечении или предотвращении болезней, особенно болезней и расстройств упомянутого ранее характера, или при изготовлении соответствующих лекарств.
Наиболее предпочтительны соединения формул 1-1 и 1-2. Установлено, что данные соединения обладают улучшенной растворимостью относительно похожих соединений, описанных в ЕР 1035115 А1 или ЕР 1103545 А1.
Данные соединения формулы I и их фармацевтически приемлемые соли можно получить известными из предшествующего уровня техники способами, например, в ходе описанных ниже процессов, при которых
а) соединение формулы
подвергают взаимодействию с OXONE® [(моноперсульфат калия) 2KHSO5·KHSO4·K2SO4]
с получением соединения формулы
и
б)соединение формулы
подвергают взаимодействию с NaBH4
с получением соединения формулы
и
при желании переводят полученное соединение в фармацевтически приемлемую кислотно-аддитивную соль.
Термин «фармацевтически приемлемые кислотно-аддитивные соли» включает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и т.п.
Солеобразование осуществляют при комнатной температуре согласно способам, которые известны по существу и которые знакомы любому квалифицированному специалисту в данной области. Не только соли с неорганическими кислотами, но также соли с органическими кислотами входят в рассмотрение. Примерами таких солей являются гидрохлориды, гидробромиды, сульфаты, нитраты, цитраты, ацетаты, малеаты, сукцинаты, метансульфонаты, пара-толуолсульфонаты и подобные.
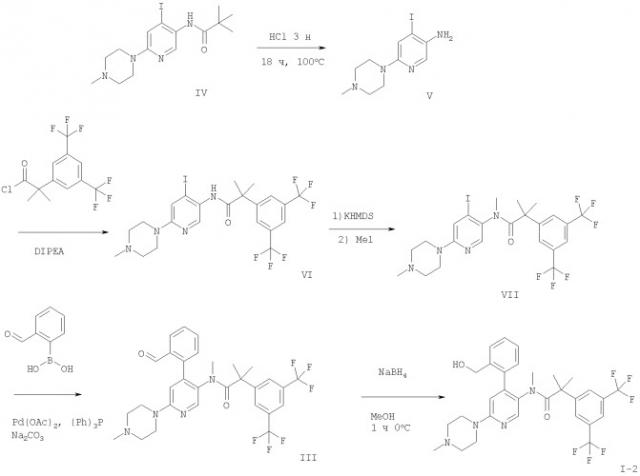
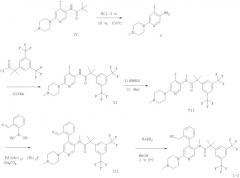
Следующие схемы 1 и 2 описывают способы получения соединений формулы I более подробно. Исходные вещества формул IV и II являются известными соединениями и могут быть получены согласно известным из предшествующего уровня техники способам.
На схемах использованы следующие аббревиатуры:
DIPEA N-этилдиизопропил-амин
KHMDS гексаметилдисилазид калия
Схема 1
Смесь N-[4-йод-6-(4-метил-пиперазин1-ил)-пиридин-3-ил]-2,2-диметил-пропионамида (синтез описан в DE 10008042) в соляной кислоте перемешивают в течение приблизительно 18 часов при 100°С. После охлаждения до 0°С реакционную смесь очищают и высушивают традиционным способом. Затем к суспензии 4-йод-6-(4-метил-пиперазин-1-ил)-пиридин-3-иламина и N,N-диизопропилэтиламина в дихлорметане добавляют 2-(3,5-бис-трифторметил-фенил)-2-метил-пропионилхлорид при 0°С. Реакционную смесь перемешивают в течение приблизительно 2 часов при комнатной температуре и 2 часа при нагревании с обратным холодильником. После охлаждения до комнатной температуры реакционную смесь промывают и высушивают, раствор 2-(3,5-бис-трифторметил-фенил)-N-[4-йод-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-изобутирамида в N,N-диметилформамиде добавляют при 0°С к раствору бис(триметилсилил)амида калия в тетрагидрофуране. После перемешивания при 0°С добавляют йодметан. Смесь перемешивают в течение 2 дней в закрытой колбе. Реакционную смесь концентрируют и очищают.
Смесь полученного 2-(3,5-бис-трифторметил-фенил)-N-[4-йод-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамида, водного раствора карбоната натрия, ацетата палладия (II), трифенилфосфина и 2-формилфенилбороновой кислоты в диметоксиэтане вакуумируют, наполняют аргоном и перемешивают в течение приблизительно 2 часов при 80°С. После охлаждения до комнатной температуры реакционную смесь разбавляют, промывают и высушивают. Затем к смеси боргидрида натрия в метаноле добавляют при 0°С 2-(3,5-бис-трифторметил-фенил)-N-[4-(2-формил-фенил)-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамид. После перемешивания при 0°С в течение 1 часа добавляют при 0°С солевой раствор. Смесь перемешивают в течение приблизительно 30 минут, высушивают и очищают.
Схема 2
К раствору 2-(3,5-бис-трифторметил-фенил)-N-метил-N-[6-(4-метил-пиперазин-1-ил)-4-орто-толил-пиридин-3-ил]-изобутирамида (синтез описан в DE 10008042) и гидрокарбоната натрия в метаноле и воде добавляют тройную соль моноперсульфата калия при комнатной температуре. После перемешивания в течение приблизительно 6 часов реакционную смесь концентрируют и очищают.
Как упоминалось ранее, соединения формулы 1 и их фармацевтически приемлемые соли присоединения обладают ценными фармакологическими свойствами. Установлено, что соединения по настоящему изобретению представляют собой антагонисты рецептора нейрокинина 1 (NK-1, вещество Р).
Соединения исследовали согласно приведенным ниже испытаниям.
Сродство исследуемых соединений к рецептору NK-1 определяли на рецепторах NK-1 человека в клетках яичника китайского хомячка (СНО), инфицированных рецептором NK-1 человека (используя систему экспрессии вируса Semliki) и меченных радиоактивным изотопом [3H]вещества Р (конечная концентрация 0,6 нМ). Анализы связывания проводили в HEPES буфере (50 мМ, рН 7,4), содержащем альбумин бычьей сыворотки (BSA, 0,04%), лейпептин (8 мкг/мл), MnCl2 (3 мМ) и фосфорамидон (2 мкМ). Пробы для связывания состояли из 250 мкл суспензии мембран (1,25×105 клеток/аналитическая пробирка), 0,125 мкл буфера вытесняющего агента и 125 мкл [3H]вещества Р. Кривые вытеснения строили по меньшей мере по семи концентрациям соединения. Аналитические пробирки инкубировали в течение 60 минут при комнатной температуре, после чего содержимое пробирок быстро фильтровали в вакууме через GF/C фильтры, предварительно намоченные в течение 60 минут с полиэтиленимином (PEI, 0,3%) и промытые 2×2 мл HEPES буфером (50 мМ, рН 7,4). Оставшуюся на фильтре радиоактивность измеряли сцинтилляционным методом. Все анализы проводили по меньшей мере в ходе 2 отдельных экспериментов в трех экземплярах.
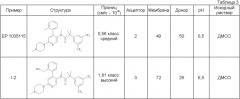
Сродство к рецептору NK-1, выраженное в виде pKi, описано в таблице 1.
Таблица 1
| 2-(3,5-бис-трифторметил-фенил)-N-метил-N-[6-(4-метил-4-окси-пиперазин-1-ил)-4-орто-толил-пиридин-3-ил]-изобутирамид (соединение 1-1) | 9,0 |
| 2-(3,5-бис-трифторметил-фенил)-N-[4-(2-гидроксиметил-фенил)-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамид (соединение 1-2) | 9,1 |
В дополнение к их хорошему сродству к рецептору NK-1 установлено, что соединения формул I-1 и I-2 обладают преимуществами в их фармацевтических свойствах. Например, соединение формулы 1-2 показывает очень хорошую растворимость и проницаемость при сравнении со структурно-родственными соединениями, раскрытыми в предшествующем уровне техники (ЕР 1035115). Следующие результаты могут быть представлены:
Растворимость
Описание метода равновесной растворимости
Значения равновесной растворимости определяли при рН 4,2 (0,15 М цитратный буфер). Известное количество лекарственного вещества, обычно 1-2 мг, добавляли к 250 мкл буфера (стеклянные пробирки) и полученную в результате суспензию перемешивали в течение 2 часов (21°С) после 5 минут сонификации (ультразвуковой вибрации). рН раствора контролировали и корректировали при необходимости (в случае корректирования рН раствор еще раз встряхивали и приводили в равновесие), после 24 часов суспензию фильтровали через 0,65 мкм фильтр. Затем фильтрованный раствор анализировали с помощью ВЭЖХ, чтобы определить концентрацию лекарственного вещества. В тех случаях, когда лекарственное вещество полностью растворялось в буфере, предполагали, что значение равновесной растворимости было выше, чем значение, определенное с помощью ВЭЖХ, и приводили его таким. Исходные растворы (~1 мг/мл) в ДМСО использовали при построении градуировочной кривой в родственном буфере, используя методы анализа ВЭЖХ.
Результаты приведены в табл.2.
Таблица 2
| Соединение | Растворимость (мкг/мл) | pH | Пример |
| 1 | 6,5 буфер: 0,05 М фосфатный | ЕР 1035115 | |
| 8 | 6,7 буфер: 0,05 М фосфатный | Соединение I-2 | |
| 26 | 4,1 буфер: 0,15 М цитратный | ЕР 1035115 | |
| 200 | 4,1 буфер: 0,15 М цитратный | Соединение I-2 |
Растворимость данного соединения I-2 в 8 раз выше, чем соединения сравнения, раскрытого в ЕР 1035115.
Проницаемость
Описание метода:
Проницаемость исследовали в ходе РАМРА PSR4p анализа, который проводили на 96-луночных микропланшетах. Проницаемость измеряют, используя конструкцию типа «сэндвич». Фильтровальный планшет покрывают фосфолипидами (мембрана) и вставляют в планшет донора, содержащий раствор лекарственного вещества / буфера. Под конец фильтровальный планшет заполняют буферным раствором (акцептор). Концентрацию донора измеряют в t-начало (исходная точка) и сравнивают с концентрацией донора и акцептора по истечении определенного времени (t-конец).
Следующая установка используется для РАМРА PSR4p анализа:
Донор: 0,05 М буфер MOPSO (3-(N-морфолино)-2-гидроксипропансульфоновая кислота) с рН 6,5+0,5% (мас./об.) гликохолевая кислота.
Мембрана: 10% (мас./об.) яичный лецитин + 0,5% (мас./об.) холестерин в додекане.
Акцептор: 0,05 М буфер MOPSO с рН 6,5.
Перенос жидкостей осуществляют с пипетирующим устройством TECAN RSP150. Анализ лекарственного вещества основывается на УФ-спектроскопии. Все образцы переносят на 96-луночные УФ-планшеты. УФ-спектрофотометр для прочтения планшетов SpectralMax 190 используется для получения УФ-спектров. Стадии пипетирования можно разделить на четыре части: 1. Разбавление исходных растворов и фильтрование. 2. Приготовление контрольного и РАМРА PSR4p сэндвича. 3. Перенос растворов акцептора на УФ-планшет. 4. Перенос растворов донора на УФ-планшет. РАМРА PSR4p анализ содержит информацию об осаждении образца в буфере донора, УФ-спектры образца, снятые в начале анализа (t-начало: исходная точка) и в конце (t-конец: донор, акцептор), позволяют определить распределение образца в доноре, мембране и акцепторе. Исходя из известного времени проникания (t-конец, t-начало) можно найти константу проницаемости. Единица данной константы составляет 10-6 см/с, показывая, что это является кинетическим значением или другими словами скоростью проникания.
Результаты приведены в табл.3.
Можно сказать, что скорость проникания соединения I-2 в три раза выше по сравнению с соответствующим соединением, раскрытым в ЕР 1035115.
Кроме того, 2-(3,5-бис-трифторметил-фенил)-N-метил-N-[6-(4-метил-пиперазин-1-ил)-4-орто-толил-пиридин-3-ил]-изобутирамид (ЕР 1035115) обладает способностью вызывать фосфолипидоз (токсическое действие). Это объясняется тем фактом, что данное соединение содержит основный атом азота, который может присоединять протон при физиологических условиях. Преимущество настоящего соединения формулы I-1 состоит в том, что N-оксид является нейтральным и, следовательно, не обладает способностью вызывать фосфолипидоз (Halliwell WH, Cationic amphiphilic drug-induced phospholipidosis (Обусловленный катионным амфифильным лекарственным веществом фосфолипидоз), Toxicologic Pathology, 1997, 25(1), 53-60 и Lullmann H et al., Lipidosis induced by amphiphilicationic drugs (Липидоз, вызванный амфифильными катионными лекарственными веществами), Biochem. Pharmacol., 1978, 27, 1103-1108). Также установлено, что N-оксид (соединение формулы I-1) обладает высокой метаболической устойчивостью in vitro в микросомах по сравнению с 2-(3,5-бис-трифторметил-фенил)-N-метил-N-[6-(4-метил-пиперазин-1-ил)-4-орто-толил-пиридин-3-ил]-изобутирамидом.
Соединения формулы I, а также их фармацевтически приемлемые кислотно-аддитивные соли можно применять в качестве лекарств, например в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако эффективным также может быть ректальное введение, например в форме суппозиториев, или парентеральное, например в форме растворов для инъекций.
Соединения формулы I и их фармацевтически приемлемые кислотно-аддитивные соли можно переработать с фармацевтически инертными, неорганическими или органическими эксципиентами для изготовления таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.п. можно использовать в качестве таких эксципиентов, например для таблеток, драже и твердых желатиновых капсул.
Подходящими эксципиентами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.
Подходящими эксципиентами для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.п.
Подходящими эксципиентами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.п.
Подходящими эксципиентами для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подсластители, красители, ароматизаторы, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Также они могут содержать другие терапевтически ценные вещества.
Дозировка может варьировать в широких пределах и, конечно, должна быть подобрана по индивидуальным потребностям в каждом конкретном случае. В общем, в случае перорального введения суточная дозировка приблизительно 10-1000 мг на человека соединения общей формулы I должна быть подходящей, хотя этот верхний предел также можно превысить, когда это необходимо.
Следующие примеры иллюстрируют настоящее изобретение, не ограничивая его. Все температуры приведены в градусах Цельсия.
Пример А
Таблетки следующего состава изготавливают обычным способом:
| мг/таблетка | |
| Активное вещество | 5 |
| Лактоза | 45 |
| Кукурузный крахмал | 15 |
| Микрокристаллическая целлюлоза | 34 |
| Стеарат магния | 1 |
| Вес таблетки | 100 |
Пример Б
Изготавливают капсулы следующего состава:
| мг/капсула | |
| Активное вещество | 10 |
| Лактоза | 155 |
| Кукурузный крахмал | 30 |
| Тальк | 5 |
| Вес содержимого капсулы | 200 |
Активное вещество, лактозу и кукурузный крахмал сначала смешивают в миксере, а затем в измельчителе. Смесь переносят в миксер, добавляют к ней тальк и тщательно перемешивают. Смесью заполняют посредством аппарата твердые желатиновые капсулы.
Пример В
Изготавливают суппозитории следующего состава:
| мг/супп. | |
| Активное вещество | 15 |
| Масса суппозитория | 1285 |
| Всего | 1300 |
Массу суппозитория расплавляют в стеклянном или стальном сосуде, тщательно перемешивают и охлаждают до 45°С. Затем добавляют к ней тонкоизмельченное активное вещество и перемешивают до тех пор, пока оно полностью не распределится. Смесь заливают в формы для суппозиториев подходящего размера, оставляют остывать, затем суппозитории вынимают из форм и по отдельности упаковывают в вощеную бумагу или металлическую фольгу.
Пример 1
2-(3,5-Бис-трифторметил-фенил)-N-метил-N-[6-(4-метил-4-окси-пиперазин-1-ил)-4-орто-толил-пиридин-3-ил]-изобутирамид (соединение I-1)
К раствору 2,00 г (3,46 ммоль) 2-(3,5-бис-трифторметил-фенил)-N-метил-N-[6-(4-метил-пиперазин-1-ил)-4-орто-толил-пиридин-3-ил]-изобутирамида (синтез описан в DE10008042) и 610 мг (7,26 ммоль) гидрокарбоната натрия в 40 мл метанола и 8 мл воды добавляли 1,10 г (1,80 ммоль) тройной соли моноперсульфата калия при комнатной температуре в течение 15 минут. После перемешивания в течение 6 часов при комнатной температуре реакционную смесь концентрировали в вакууме и очищали с помощью флэш-хроматографии, получая 1,65 г (80%) указанного в заголовке соединения в виде белых кристаллов.
MS m/e (%): 595 (M+H+, 100).
Пример 2
2-(3,5-Бис-трифторметил-фенил)-N-[4-(2-гидроксиметил-фенил)-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамид (соединение I-2)
4-Йод-6-(4-метил-пиперазин-1-ил)-пиридин-3-иламин (соединение V)
Смесь 2,20 г (5,47 ммоль) N-[4-йод-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-2,2-диметил-пропионамида (синтез описан в DE10008042) в 50 мл 3 н. соляной кислоте перемешивали в течение 18 часов при 100°С. После охлаждения до 0°С реакционную смесь дважды промывали эфиром (50 мл). Водную фазу обрабатывали 50 мл дихлорметана и повышали основность 1 М раствором карбоната натрия. Органическую фазу отделяли и водную фазу экстрагировали четыре раза 50 мл дихлорметана. Объединенные органические слои высушивали над сульфатом натрия и концентрировали в вакууме, получая 1,60 г (92%) указанного в заголовке соединения в виде грязно-белого твердого вещества.
MS m/e (%): 319 (M+H+, 100).
2-(3,5-Бис-трифторметил-фенил)-N-[4-йод-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-изобутирамид (соединение VI)
К суспензии 1,60 г (5,03 ммоль) 4-йод-6-(4-метил-пиперазин1-ил)-пиридин-3-иламина и 975 мг (7,54 ммоль) N,N-диизопропилэтиламина в 16 мл дихлорметана добавляли по каплям 1,76 г (5,53 ммоль) 2-(3,5-бис-трифторметил-фенил)-2-метил-пропионилхлорида при 0°С. Реакционную смесь перемешивали в течение 2 часов при комнатной температуре и 2 часа при нагревании с обратным холодильником. После охлаждения до комнатной температуры реакционную смесь промывали 20 мл 1 М водного раствора карбоната натрия и 20 мл воды. Объединенные органические слои высушивали над сульфатом натрия и концентрировали в вакууме, получая 3,39 г (100%) неочищенного указанного в заголовке соединения в виде коричневого масла.
MS m/e (%): 601 (М+H+, 100).
2-(3,5-Бис-трифторметил-фенил)-N-[4-йод-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамид (соединение VII)
К раствору 3,09 г (5,15 ммоль) 2-(3,5-бис-трифторметил-фенил)-N-[4-йод-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-изобутирамида в 30 мл N,N-диметилформамида добавляли при 0°С 6,8 мл (6,2 ммоль) 0,91 М раствора бис(триметилсилил)амида калия в тетрагидрофуране. После перемешивания при 0°С в течение 40 минут добавляли 0,352 мл (5,66 ммоль) йодметана. Смесь перемешивали в течение 2 дней в закрытой колбе. Реакционную смесь концентрировали в вакууме и очищали с помощью флэш-хроматографии, получая 980 мг (31%) указанного в заголовке соединения в виде коричневого масла.
MS m/e (%): 615 (M+H+, 100).
2-(3,5-Бис-трифторметил-фенил)-N-[4-(2-формил-фенил)-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамид (соединение III)
Смесь 900 мг (1,47 ммоль) 2-(3,5-бис-трифторметил-фенил)-N-[4-йод-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамида, 2,8 мл 1 М водного раствора карбоната натрия, 33 мг (0,15 ммоль) ацетата палладия (II), 77 мг (0,29 ммоль) трифенилфосфина и 242 мг (1,61 ммоль) 2-формилфенилбороновой кислоты в 5 мл диметоксиэтана вакуумировали, наполняли аргоном и перемешивали в течение 2 часов при 80°С. После охлаждения до комнатной температуры реакционную смесь разбавляли 20 мл этилацетата и промывали 20 мл солевого раствора. Объединенные органические слои высушивали над сульфатом натрия, концентрировали и очищали с помощью флэш-хроматографии, получая 584 мг (67%) указанного в заголовке соединения в виде светло-коричневого твердого вещества.
MS m/e (%): 593 (М+Н+, 100).
2-(3,5-Бис-трифторметил-фенил)-N-[4-(2-гидроксиметил-фенил)-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамид (соединение I-2)
К смеси 15 мг (0,41 ммоль) боргидрида натрия в 2 мл метанола добавляли при 0°С 200 мг (0,338 ммоль) 2-(3,5-бис-трифторметил-фенил)-N-[4-(2-формил-фенил)-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамида. После перемешивания при 0°С в течение 1 часа добавляли 1 мл солевого раствора при 0°С. Смесь перемешивали в течение 30 минут. Метанол отгоняли, остаток разбавляли 20 мл этилацетата и промывали 20 мл солевого раствора. Органический слой высушивали над сульфатом натрия, концентрировали и очищали с помощью флэш-хроматографии, получая 137 мг (68%) указанного в заголовке соединения в виде светло-коричневого твердого вещества.
MS m/e (%): 595 (M+H+, 100).
1. Соединения формулы где R представляет собой метил, иR1 представляет собой 4-метил-4-окси-пиперазин-1-ил; илиR представляет собой СН2ОН, иR1 представляет собой 4-метил-пиперазин-1-ил или представляет собой 4-метил-4-окси-пиперазин-1-ил;и их фармацевтически приемлемые кислотно-аддитивные соли.
2. Соединение по п.1, которое представляет собой2-(3,5-бис-трифторметил-фенил)-N-метил-N-[6-(4-метил-4-окси-пиперазин-1-ил)-4-орто-толил-пиридин-3-ил]-изобутирамид (соединение 1-1) или2-(3,5-бис-трифторметил-фенил)-N-[4-(2-гидроксиметил-фенил)-6-(4-метил-пиперазин-1-ил)-пиридин-3-ил]-N-метил-изобутирамид (соединение 1-2).
3. Лекарственное средство, обладающее активностью антагониста рецептора NK-1, содержащее одно или более соединений по п.1 или 2 и фармацевтически приемлемые эксципиенты.
4. Лекарственное средство по п.3 для лечения заболеваний, относящихся к антагонистам рецептора NK-1.
5. Лекарственное средство по пп.3 и 4 для лечения воспалительных состояний, включающих мигрень, ревматоидный артрит и астму, рвоты, болезни Паркинсона, боли, головной боли, особенно мигрени, болезни Альцгеймера, тревоги, депрессии, рассеянного склероза, смягчения отмены морфина, сердечно-сосудистых изменений, отека, аллергического ринита, болезни Крона, психоза, морской болезни и тошноты.
6. Применение соединения по п.1 или 2 для лечения заболеваний, относящихся к антагонистам рецептора NK-1.
7. Применение соединения по п.1 или 2 для изготовления лекарственного средства для лечения заболеваний, относящихся к антагонистам рецептора NK-1.
8. Применение соединения по п.1 или 2 для изготовления лекарственного средства для лечения воспалительных состояний, включающих мигрень, ревматоидный артрит и астму, рвоты, болезни Паркинсона, боли, головной боли, особенно мигрени, болезни Альцгеймера, тревоги, депрессии, рассеянного склероза, смягчения отмены морфина, сердечно-сосудистых изменений, отека, аллергического ринита, болезни Крона, психоза, морской болезни и тошноты.
9. Применение соединения по п.1 или 2 для изготовления лекарственного средства для лечения рвоты.