1, 5-нафтиридиназолидиноны, обладающие cdk1 антипролиферативной активностью
Иллюстрации
Показать всеНастоящее изобретение относится к соединению формулы I и его фармацевтически приемлемым солям. Соединения настоящего изобретения обладают ингибирующей активностью в отношении CDK1 киназы и могут быть полезны при лечении рака, в частности рака грудной железы, рака легкого, рака толстой кишки и рака простаты. В формуле I
Y обозначает -S- или -NH-; R1 выбран из водорода, -C(O)O-[CH2CH2O]p-R4, -С(O)-R3 и R2-(X)n-; R3 выбран из низшего алкила, циклоалкила, содержащего от 3 до 6 атомов углерода и ; R4 обозначает низший алкил; Х выбран из низшего алкилена и зациклизованного низшего алкилена; R2 обозначает , где выбран из фенила и 5- или 6-членного гетероароматического кольца, содержащего от 1 до 2 гетероатомов, выбранных из группы, состоящей из серы и азота; R5 и R6 независимо выбраны из группы, включающей водород, низший алкил, галоген, перфтор(низший алкил) и низшую алкоксигруппу; n обозначает целое число от 1 до 2 и р обозначает 0. Изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения изобретения. 2 н. и 62 з.п. ф-лы.
Реферат
Данное изобретение относится к производным 1,5-нафтиридиназолидинона, которые обладают CDK1 антипролиферативной активностью и используются в качестве противораковых агентов.
Циклинзависимые киназы (CDKs) являются серинтреонинпротеинкиназами, которые играют решающую роль в регуляции переходов между различными фазами клеточного цикла такого, как переход из находящейся в покое стадии в G1 (гэп между митозом и началом ДНК репликации из-за нового раунда клеточного деления) в S фазу (период активного синтеза ДНК), или перехода от G2 в М фазу, в которой происходит активный митоз и клеточное деление (см., например, статьи, собранные в Science, 274: 1643-1677 (1996), и Ann. Rev. Cell Dev. Biol., 13: 261-291 (1997)). CDK комплексы формируются посредством объединения регуляторных циклиновых субъединиц (например, циклин A, B1, B2, D1, D2, D3 и Е) и субъединицы каталитической киназы (например, CDK1, CDK2, CDK4, CDK5 и CDK6). Это наименование подразумевает, что CDKs проявляют полную зависимость от циклиновых субъединиц, чтобы фосфорилировать субстраты, являющиеся их мишенями, и функция различных киназа/циклиновых пар состоит в регуляции перехода через специфические фазы клеточного цикла.
Как отмечено выше, эти протеинкиназы представляют собой класс белков (ферментов), регулирующих различные клеточные функции. Это сопровождается фосфорилированием специфических аминокислот в белковых субстратах, в результате чего происходит конформационное изменение субстратного белка. Конформационное превращение модулирует активность субстрата или его способность к взаимодействию с другими связывающими партнерами. Ферментная активность протеинкиназы связана со скоростью, с которой киназа присоединяет фосфатные группы к субстрату. Она может быть измерена, например, определением количества субстрата, которое превращается в продукт, в виде функции времени. Фосфорилирование субстрата происходит на активном участке протеинкиназы.
Вследствие того, что CDKs, например CDK1, являются главными активаторами клеточного деления, ингибиторы CDK1 могут быть использованы в качестве антипролиферативных агентов. Эти ингибиторы могут служить для развития терапевтического вмешательства в подавление разрегурированного развития клеточного цикла.
В соответствии с настоящим изобретением было найдено, что соединение формулы:
где Y обозначает -S- или -NH-;
R1 выбирают из водорода, низшего алкила, циклоалкила, низшей алкоксигруппы-низшего алкила, -С(O)O-[СН2СН2О]р-R4, -С(O)-R3 и R2-(X)n-;
R3 выбирают из водорода, низшего алкила, циклоалкила, содержащего от 3 до 6 атомов углерода, и ;
R4 обозначает водород или низший алкил;
Х выбирают из низшего алкилена, гидроксигруппы-низшего алкилена, циклоалкилена и моно- или дигало(низшего алкилена);
R2 обозначает
;
выбирают из арильного кольца,
4-6-членного гетероциклоалкильного кольца, содержащего от 3 до 5 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, и
5- или 6-членного гетероароматического кольца, содержащего от 1 до 2 гетероатомов, выбранных из группы, состоящей из кислорода, серы и азота;
R5 и R6 независимо выбирают из группы, включающей гидроксигруппу, гидроксигруппу-низший алкил, водород, низший алкил, галоген, перфтор(низший алкил) и низшую алкоксигруппу;
n обозначает целое число от 1до 2 и
р обозначает целое число от 0 до 6,
или N-оксиды соединений, где R2 содержит азот в гетероароматическом кольце, сульфоны, где R2 содержит серу в гетероциклоалкильном кольце или гетероароматическом кольце, или его фармацевтически приемлемые соли, ингибируют активность CDKs, в частности, CDK1. Эти агенты по изобретению и фармацевтические композиции, содержащие такие агенты, применяются в лечении различных болезней и болезненных состояний, связанных с неконтролируемой или нежелательной клеточной пролиферацией такой, как рак, аутоиммунными болезнями, вирусными болезнями, грибковыми заболеваниями, нейродегенеративными расстройствами и сердечно-сосудистыми заболеваниями.
Ингибирование или модуляция активности CDKs, в частности CDK1, делает такие соединения формулы I и композиции, содержащие эти соединения, применимыми при лечении болезней, модулируемых киназной активностью, особенно в качестве противоопухолевых агентов при лечении раковых заболеваний, более предпочтительно твердых опухолей таких, как рак грудной железы, рак легкого, рак толстой кишки и рак простаты.
Как отмечено выше, соединения формулы I являются потенциальными антипролиферативными агентами и служат для опосредования и/или ингибирования активности CDKs, в частности CDK1, являясь, таким образом, противоопухолевыми агентами для лечения рака или других болезней, связанных с неконтролируемой или аномальной клеточной пролиферацией.
Предпочтительными соединениями формулы I являются соединения формулы:
где R1' выбирают из водорода, низшего алкила, циклоалкила, низшей алкоксигруппы-низшего алкила, -C(O)O-[CH2CH2O]p-R4, -С(O)-R3 и
R3, R4, Y и р определены выше; или
их фармацевтически приемлемые соли,
и соединения формулы:
где R1'' обозначает R2-(X)n- и
R2, X, Y и n определены выше;
или N-оксиды соединений, где R2 содержит азот в гетероароматическом кольце, сульфоны, где R2 содержит серу в гетерокольце или гетероароматическом кольце, или их фармацевтически приемлемые соли.
В соединениях I и I-Б, где R1 и R1'' содержат арильный фрагмент, предпочтительным арильным фрагментом является замещенный фенил. Используемый в данном описании галоген включает все четыре галогена, такие как хлор, фтор, бром и йод.
Как использовано в описании, термин "низший алкил", самостоятельно или в комбинации, означает моновалентную, прямолинейную или разветвленную насыщенную углеводородную группу, содержащую от 1 до 6 атомов углерода, такую как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, н-гексил и подобные им.
Термин "циклоалкил" означает цикло(низший алкил) заместитель, который означает моновалентное незамещенное 3-6-членное насыщенное углеводородное кольцо. Предпочтительными циклоалкильными заместителями являются циклопропил, циклобутил, циклогексил, и т.п., при этом циклопропил является особенно предпочтительным.
Термин "низшая алкоксигруппа" обозначает линейную или разветвленную -O-низшую алкильную группу, образованную из низшего алкила, содержащего от 1 до 6 атомов углерода, такую как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, трет-бутоксигруппа и подобные им.
Термин "арил" обозначает моновалентное, моно- или бициклическое незамещенное ароматическое углеводородное кольцо, такое как фенил или нафтил, при этом фенил является предпочтительным.
Термин "гетероциклоалкил" относится к 4-6-членному моноциклическому насыщенному кольцу, содержащему от 3 до 5 атомов углерода и 1 или 2 гетероатома, выбранных из группы, включающей кислород, азот или серу. Предпочтительные гетероциклические алкильные группы включают морфолинил, тиопиранил или тетрагидропиранил.
Термин "гетероароматическое кольцо" относится к моновалентному 5 или 6-членному моноциклическому гетероароматическому кольцу, содержащему от 4 до 5 атомов углерода и 1 или 2 гетероатома, выбранных из группы, включающей кислород, азот или серу. Предпочтительные гетероароматические группы включают тиофенил, тиоазол, пиридинил, фуранил и т.п.
Термин "гидроксигруппа" или "гидроксил" означает -ОН.
Термин "гидрокси(низший алкил)" означает низшую алкильную группу по определению выше, которая является замещенной, предпочтительно монозамещена гидроксильной группой.
Термин "низший алкилен" означает дивалентный насыщенный прямолинейный или разветвленный углеводородный заместитель, содержащий от 1 до 6 атомов углерода.
Термин "циклоалкилен" или "цикло(низший алкилен)" означает цикло(низший алкилен) заместитель, который является дивалентным незамещенным 3-6-членным насыщенным углеводородным кольцом. Предпочтительными циклоалкиленовыми заместителями являются циклопропенил или циклобутенил.
Термин "низшая алканоилоксигруппа-низший алкилен" означает низший алкиленовый заместитель, замещенный, предпочтительно монозамещенный, низшей алканоилоксигруппой, при этом "низшая алканоилоксигруппа" означает группу -С(O)O-низший алкил, а "низший алкил" определен выше.
Термин "низшая алкоксигруппа-низший алкилен" означает низший алкиленовый заместитель по описанию выше, замещенный, предпочтительно монозамещенный, низшей алкоксигруппой, где низшая алкоксигруппа определена выше.
Термин " гидроксигруппа(низший алкилен)" означает низший алкиленовый заместитель, замещенный, предпочтительно монозамещенный, гидроксильной группой.
Термин "низшая алкоксигруппа-низший алкил" означает низший алкильный заместитель по определению выше, замещенный, предпочтительно монозамещенный, низшей алкоксигруппой, где низшая алкоксигруппа определена выше.
Термин "перфтор(низший алкил)" означает любую низшую алкильную группу, в которой все атомы водорода низшей алкильной группы замещены или заменены фтором. Предпочтительными перфтор(низший алкил) группами являются трифторметил, пентафторэтил, гептафторпропил, при этом особенно предпочтительной группой является трифторметильная группа.
Термин «фармацевтически приемлемая соль» относится к стандартным кислотно-аддитивным солям или основно-аддитивным солям, которые сохраняют биологическую эффективность и свойства соединений формул I, II, III, IV и V и образуются из соответствующих нетоксичных органических и неорганических кислот или органических или неорганических оснований. Примеры кислотно-аддитивных солей включают соли, полученные из неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и соли, полученные из органических кислот, таких как п-толуолсульфокислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и подобных им. Примеры основно-аддитивных солей включают соли, полученные из гидроксидов аммония, калия, натрия и четвертичного аммониевого основания, такого как, например, гидроксид тетраметиламмония. Технология химической модификации фармацевтических соединений (например, лекарств) в соли для получения соединений с улучшенной физической и химической стабильностью, гигроскопичностью, сыпучестью и растворимостью хорошо известна химикам-фармацевтам. См., например, Н. Ansel et. al., Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Ed. 1995), стр.196 и 1456-1457).
Соединения формулы I включают два фрагмента, например:
где R1 определен выше, и
где R1 определен выше.
Соединения формулы I-B включают два фрагмента:
где R1' определен выше, и
где R1'' определен выше.
Соединения формулы I-Г включают два фрагмента, например:
где R1' определен выше, и
где R1'' определен выше.
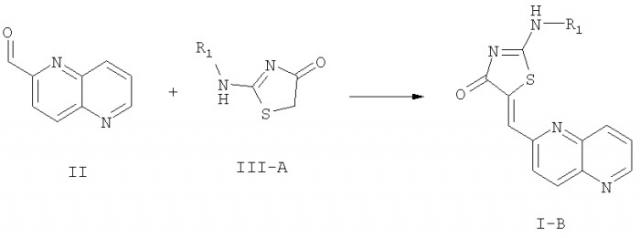
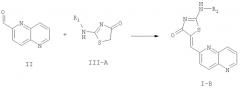
В соответствии с настоящим изобретением соединения формул I-B, I-B1 и I-B2 могут быть получены из соединения формулы:
Соединения формулы II превращают в соединения формулы I-B, которые включают соединения формул I-B1 и I-B2, с использованием следующей реакционной схемы 1, где R1 определен выше.
Схема 1
Реакция соединения формулы III-A с соединением формулы II для получения соединения формулы I-B проводят в высококипящем растворителе, таком как бензол или толуол, при высокой температуре от 100 до 200°С в замкнутой системе. По этой методике реакцию проводят при высоких температурах и давлении. Эта реакция в частности подходит, когда нужно получить соединения формулы I-B, где группа R1 содержит галогены как в цепи X, так и в кольце Р. Соединения формулы III-A могут быть непосредственно получены реакцией роданина с R1-NH2 с использованием следующей реакционной схемы 2, где R1 определен выше:
Схема 2
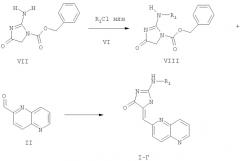
Соединения формулы I-Г, которые включают соединения формул I-Г1 и I-Г2, получают из соединений формулы VII
Используя соединение формулы VII в качестве исходного материала, соединения формулы I-Г получают с использованием следующей реакционной схемы 3, где R1 определен выше:
Схема 3
Соединение формулы VII вводят в реакцию с соединением формулы VI с образованием соединения формулы VIII стандартным методом превращения первичного амина во вторичный амин или амид с помощью реакции алкилгалоида или циклоалкилгалоида или хлорангидрида кислоты с первичным амином. Соединение формулы VIII вводят в реакцию с соединением формулы II с образованием соединения формулы I-Г посредством реакции Кновенагеля, используя методику, описанную прежде в связи с реакцией соединения формулы III-A и II с образованием соединения формулы I-B.
Когда кольцо ℗ является N-оксидом в азотсодержащем кольце, которое образует кольцо ℗, эти N-оксиды могут быть получены из третичного кольцевого атома азота посредством окисления. При этом может быть использован любой стандартный метод окисления третичного атома азота в N-оксид. Предпочтительным окислительным агентом является м-хлорпербензойная кислота (м-ХПБК).
В соединении формулы I, I-A, I-B1 и I-Г1 R или R1 предпочтительно обозначают водород, низший алкил, цикло(низший алкил), в частности циклопропил,
или
где R3 и R4 определены выше и р предпочтительно = 0.
В соединении I, I-B, I-C2 и I-D2, n предпочтительно = 1. В этом случае предпочтительно обозначает фенил или 4-6-членное гетероароматическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота или серы.
В соединениях формулы I-Б, которые включают соединения формулы I-Г2 и I-B2, где R1'' обозначает R2-(X)n, n может быть = 1 или 2. Когда n=0, предпочтительным классом соединений являются такие соединения, где ℗ обозначает фенил. Предпочтительным классом соединений, где n=0, а R2 обозначает фенил, являются такие соединения, где R5 и R6 или оба обозначают водород, или один из R5 и R6 обозначает водород, а другой обозначает галоген, низшую алкоксигруппу или низший алкил, или оба R5 и R6 обозначают галогруппу или перфтор(низший алкил).
Помимо этого, другим предпочтительным классом соединений формулы I-Б являются соединения, где R1'' обозначает R2-(Х)n- и n=1. В класс этих соединений входят такие соединения, где Х обозначает цикло(низший алкилен), предпочтительно циклопропилен. Что касается этого класса соединений, где n=1, а Х обозначает цикло(низший алкилен), он включают такие соединения, где ℗ обозначает фенил, а R5 и R6 оба представляют собой водород или один из R5 и R6 является водородом, а другой низшим алкилом.
Другим классом соединений формулы I-Б, где R2 обозначает фенил, являются такие соединения, где R5 и R6 обозначают водород или галоген, или перфтор(низший алкил), при этом по крайней мере один из R5 и R6 обозначают галоген или перфтор(низший алкил). В соответствии с другим вариантом по изобретению предпочтительными соединениями формулы I-Б являются такие соединения, где n=1, а Х обозначает низший алкилен. Предпочтительными вариантами этого класса соединений являются соединения, где R2 обозначает , а обозначает фенил. В отношении этого варианта по изобретению предпочтительными являются такие соединения, где R5 и R6 оба обозначают водород, или R5 и R6 обозначают водород или низший алкил, перфтор(низший алкил) или галоген, причем по крайней мере один из R5 и R6 не является водородом.
Другим классом соединений формулы I-Б, где n=1, а Х обозначает низший алкилен, являются такие соединения, где ℗ обозначает гетероароматическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из группы, состоящей из кислорода, азота или серы. Предпочтительными соединениями из класса соединений, где обозначает гетероароматическое кольцо, являются соединения с гетероароматическими кольцами, содержащими 1 гетероатом, предпочтительно серу. В этом случае R5 и R6 оба предпочтительно обозначают водород либо один из R5 и R6 может обозначать водород, а другой обозначает галоген, перфтор(низший алкил) или низший алкил.
Фармацевтические композиции по изобретению могут альтернативно или в дополнение к соединению формулы I включать в качестве активного ингредиента фармацевтически приемлемые лекарства, фармацевтически активные метаболиты и фармацевтически приемлемые соли таких соединений и метаболитов. Такие соединения, пролекарства, мультимеры, соли и метаболиты иногда относят к общей группе под названием "активные агенты" или "агенты."
В случае твердых агентов специалистам в данной области техники известно, что представленные в изобретении соединения и соли могут существовать в различных кристаллических или полиморфных формах, все из которых входят в объем данного изобретения и конкретные пункты формулы.
Терапевтически эффективные количества активных агентов по изобретению могут применяться для лечения болезней, опосредованных модуляцией или регуляцией протеинкиназ CDK1. "Эффективное количество" подразумевает такое количество агента, которое существенно ингибирует пролиферацию и/или предупреждает дедифференциацию эукариотической клетки, например клетки млекопитающего, насекомого, растительной или грибной клетки, и является эффективным для указанного применения, например специфического терапевтического лечения.
Количество данного агента, соответствующего эффективному количеству, варьируется в зависимости от таких факторов, как применяемое соединение, болезненное состояние и его тяжесть, идентификация организма (например, масса тела) субъекта или реципиента, нуждающегося в лечении, но может быть, тем не менее, стандартно определено методом, известным из области техники в соответствии с обстоятельствами, связанными с заболеванием, включая, например, специфичность вводимых агентов, метод введения, болезненное состояние, требующее лечения, и субъекта или реципиента, подлежащего лечению. "Лечение" подразумевает по крайней мере облегчение болезненного состояния у субъекта, такого как млекопитающее (например, человек), которое вызывается, по крайней мере частично, активностью CDK1 протеинкиназы, и включает предотвращение заболевания, встречающегося у млекопитающего, особенно, когда, как было найдено, млекопитающее имеет предрасположение к такому заболеванию, но которое еще не диагностировано в качестве имеющегося; модуляцию и/или ингибирование такого болезненного состояния и/или облегчение болезненного состояния.
Далее, настоящее изобретение относится к способам модуляции или ингибирования активности протеинкиназы CDK1, например, в тканях млекопитающих, посредством введения агента по изобретению. Антипролиферативная активность агентов легко определяется известными методами, например, при использовании целых клеточных культур с помощью МТТ анализа. Активность агентов по изобретению в качестве модуляторов CDK1 протеинкиназной активности может быть определена любым из методов, доступных специалистам в области техники, включая анализы в условиях in vivo и/или in vitro. Примеры соответствующих анализов для измерения активности включают примеры, описанные в международной заявке WO 99/21845; Parast et al., Biochemistry, 37, 16788-16801 (1998); Connell-Crowley and Harpes, Cell Cycle: Materials and Methods, (Michele Pagano, ed. Springer, Berlin, Germany) (1995); международных заявках WO 97/34876 и WO 96/14843. Эти свойства могут оцениваться, например, посредством одного или более биологических тестирующих методов, изложенных в приведенных ниже примерах.
Активные агенты по изобретению могут быть введены в фармацевтические композиции, как описано ниже. Фармацевтические композиции по изобретению включают эффективное модулирующее, регулирующее или ингибирующее количество соединения формулы I и инертный фармацевтически приемлемый носитель или разбавитель. В одном из вариантов фармацевтических композиций эффективные уровни агентов по изобретению включают такое количество, чтобы осуществить терапевтическую поддержку, включая антипролиферативное действие. Под "эффективными уровнями" имеются в виду уровни, при которых пролиферация ингибируется или контролируется. Эти композиции изготавливаются в форме единичных доз, соответствующих методу введения, например парентеральному или оральному введению.
Агент по изобретению может быть введен в стандартных дозах, комбинирующих терапевтически эффективное количество агента (например, соединения формулы I) в качестве активного ингредиента с соответствующими фармацевтическими носителями или разбавителями с помощью стандартных методик. Эти методики могут включать смешивание, гранулирование и прессование или растворение ингредиентов в соответствии с изготовлением необходимой формы.
Применяемый фармацевтический носитель может представлять собой твердое вещество или жидкость. Примерами твердых носителей могут служить лактоза, сахароза, тальк, желатин, агар, пектин, камедь, стеарат магния, стеариновая кислота и подобные им. Примерами жидких носителей могут служить сироп, масло земляного ореха, оливковое масло, вода и подобные им. Аналогично носитель или разбавитель может включать материалы, способствующие задержке во времени или реализации во времени, такие как глицерилмоностеарат или глицерилдистеарат, в отдельности или в смеси с воском, этилцеллюлозой, гидроксипропилметилцеллюлозой метилметакрилатом и им подобными.
Может использоваться целый ряд фармацевтических форм. Так, если используется твердый носитель, изготовление может осуществляться посредством таблетирования, в форме порошков или пелет, заполняемых в твердые желатиновые капсулы, в форме таблеток или леденцов. Количество твердого носителя также варьируется. Если используется жидкий носитель, изготовление осуществляется в виде сиропа, эмульсии, мягких желатиновых капсул, стерильных инъекционных растворов или суспензий в ампулах или пузырьках, или неводных жидких суспензий.
Чтобы получить стабильные водорастворимые дозированные формы, фармацевтически приемлемая соль агента по изобретению может быть растворена в водном растворе органической или неорганической кислоты. Если растворимая солевая форма является неприемлемой, агент может быть растворен в соответствующем сорастворителе или комбинациях растворителей.
Если будет признано, что существующие дозированные формы агентов, применяемых в композициях по настоящему изобретению, должны изменяться по отношению к данному комплексу, подлежащему применению, формируется особая композиция, выбирается особое место введения, реципиент и болезнь, подлежащая лечению. Оптимальные дозы для данного набора условий могут быть установлены специалистами в данной области техники с использованием стандартных тестов определения дозы на основе экспериментальных данных для агента.
Композиции по изобретению могут быть получены методами, в основном известными в приготовлении фармацевтических композиций, с использованием стандартных технологий, таких как смешивание, растворение, гранулирование, дражирование, растирание в порошок, эмульгирование, инкапсулирование, включение в полимер или лиофилизация. Фармацевтические композиции могут быть сформированы с использованием одного или более физиологически приемлемых носителей, выбираемых из наполнителей и вспомогательных веществ, которые облегчают функционирование активных соединений в фармацевтических препаратах.
Для орального применения соединения могут быть быстро сформированы посредством комбинации соединений с фармацевтически приемлемыми носителями, известными из уровня техники. Такие носителии способствуют формированию соединений по изобретению в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и им подобных для орального применения пациентом, подлежащим лечению. Фармацевтические препараты для орального применения могут быть получены с использованием твердых наполнителей в смеси с активным ингредиентом (агентом), необязательно с растиранием образующейся смеси, и обработкой смеси гранул после добавления соответствующих вспомогательных веществ, если желательно, для получения таблеток или драже.
Изобретение иллюстрируется далее следующими примерами, которые не ограничивают объем настоящего изобретения. В названных примерах температуры приведены в градусах Цельсия (°С), если не оговорено особо.
Примеры
Пример 1: 2-метил-[1,5]нафтиридин
Суспензию 5-амино-2-пиколина (3,56 г, 33 ммолей), глицерола (12,14 г, 132 моля) и конц. H2SO4 (34,9 г, 356 ммолей) в воде (20 мл) нагревают на масляной бане при 150°С в течение 7 ч. После охлаждения до комнатной температуры реакционную смесь переносят в 200 мл воды и добавляют 100 мл AtOEt. Смесь охлаждают на ледяной бане и доводят до рН 13 с помощью 4,0-нормального раствора NaOH, получая суспензию. Твердое вещество отделяют фильтрованием, промывают этилацетатом. Фильтрат экстрагируют этилацетатом (5 раз по 150 мл) и объединенный органический слой промывают рассолом и высушивают над Na2SO4, получая темно-коричневое масло (5,3 г), которое затем очищают на колонке Biotage, элюируя градиентом 2% CH2Cl2 в МеОН и получая 2-метил[1,5]нафтиридин (выход 2,5 г, 52,6%) в виде коричневого твердого вещества, которое используют на следующей стадии без дальнейшей очистки.
Пример 2: [1,5]нафтиридин-2-карбальдегид
К раствору 2-метил-1,5-нафтиридина (216,0 мг, 1,5 ммоля) в 1,4-диоксане (5 мл) добавляют SeO2 (183,0 мг, 1,65 ммоля) и реакционную смесь нагревают с обратным холодильником в течение 0,5 ч до тех пор, пока по данным ТСХ не остается исходного вещества, затем охлаждают до комнатной температуры и фильтруют через целит. Растворитель удаляют при пониженном давлении, а остаток очищают на Biotage колонке (AcOEt: н-гексан в соотношении 3:1), получая [1,5]нафтиридин-2-карбальдегид в виде белого твердого вещества (выход 142,3 мг, 60,0%). ЛР-ЭС, m/е 159 (МН+).
Пример 3: трет-бутиловый эфир (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидротиазол-2-ил)карбаминовой кислоты
К суспензии N-бок-псевдотиогидантоина (43,3 мг, 0,2 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (34,8 мг, 0,22 ммоля) в толуоле в микроволновой трубке добавляют бензойную кислоту и пиперидин. Реакционную смесь нагревают, получая желтоватый раствор, а затем нагревают до 120°С с помощью микроволнового облучения в течение 10 мин. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, ацетоном и эфиром, получая трет-бутиловый эфир (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидротиазол-2-ил)карбаминовой кислоты в виде слегка желтого твердого вещества (выход 48,6 мг, 68,1%).
ВР-ЭС (+), m/е: вычислено для C17H16N4O3S (М+Н)+ 357,1016, найдено 357,1015.
Пример 4: 2-амино-5-[1,5]нафтиридин-2-илметилентиазол-4-он
Суспензию трет-бутилового эфира (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидротиазол-2-ил)карбаминовой кислоты (20,0 мг, 0,056 ммолей) в смеси ксилолов (1 мл) нагревают в микроволновой трубке, получая желтоватый раствор, а затем нагревают до 170°С с помощью микроволнового облучения в течение 1 ч. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, ацетоном и эфиром, получая 2-амино-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде слегка желтого твердого вещества (выход 5,6 мг, 39,2%).
ВР-ЭС (+), m/е: вычислено для C12H8N4OS (M+H)+ 256,0419, найдено 256,0422.
Пример 5: 5-[1,5]нафтиридин-2-илметилен-2-(2-фенилциклопропиламино)тиазол-4-он
К суспензии 2-(транс)фенилциклопропиламинотиазол-4-она (38,0 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,20 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 150°С с помощью микроволнового облучения в течение 0,5 ч. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием, промывают толуолом, CH2Cl2 и эфиром, получая 5-[1,5]нафтиридин-2-илметилен-2-(2-фенилциклопропиламино)тиазол-4-он в виде коричневого твердого вещества (выход 21,6 мг, 36,2%).
ВР-ЭС (+), m/е: вычислено для C21H16N4OS (M+H)+ 373,1118, найдено 373,1117.
Пример 6: 2-(2-хлорбензиламино)-5-[1,5]нафтиридин-2-илметилентиазолон
К суспензии 2-(2-хлорбензиламино)тиазол-4-она (77,0 мг, 0,32 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (63,2 мг, 0,40 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 150°С с помощью микроволнового облучения в течение 10 мин, а затем охлаждают до комнатной температуры. Твердое вещество отфильтровывают и промывают толуолом, получая коричневое твердое вещество, которое растворяют в 1 мл горячего ДМФ и разбавляют водой. Осадок отделяют и промывают водой, ацетоном и эфиром и высушивают, получая 2-(2-хлорбензиламино)-5-[1,5] нафтиридин-2-илметилентиазол-4-он в виде слегка коричневого твердого вещества (выход 45,6 мг, 37,4%).
ВР-ЭС (+), m/е: вычислено для C19H13ClN4OS (М+Н)+ 381,0572, найдено 381,0572.
Пример 7: 2-[(3-метилтиофен-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он
К суспензии 2-[(3-метилтиофен-2-илметил)амино]тиазол-4-она (36,2 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,20 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 10 мин. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 2-[(3-метилтиофен-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде слегка коричневого твердого вещества (выход 25,7 мг, 43,9%).
ВР-ЭС (+), m/е: вычислено для C18H14N4OS2 (M+H)+ 367,0682, найдено 367,0683.
Пример 8: 2-(3-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он
К суспензии 2-(3-хлор-4-фторбензиламино)тиазол-4-она (41,4 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,20 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 10 мин. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая коричневое твердое вещество (выход 32,6 мг, 51,1%), которое растворяют затем в 0,5 мл горячего ДМФ и разбавляют водой. Осадок отделяют и промывают водой, ацетоном и эфиром и высушивают, получая 2-(3-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде слегка коричневого твердого вещества (выход 18,6 мг, 29,2%).
ВР-ЭС (+), m/е: вычислено для C19H12ClFN4OS (M+H)+ 399,0477, найдено 399.0477.
Пример 9: 5-[1,5]нафтиридин-2-илметилен-2-[(тиофен-2-илметиламино]тиазолон
К суспензии 2-[(тиофен-2-илметил)амино]тиазол-4-она (34,0 мг, 0,16 ммолей) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 120°С с помощью микроволнового облучения в течение 5 мин, затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 5-[1,5]нафтиридин-2-илметилен-2-[(тиофен-2-илметил)амино]тиазол-4-он в виде слегка коричневого твердого вещества (выход 19,7 мг, 34,9%).
ВР-ЭС (+), m/е: вычислено для C17H12N4OS2 (M+H)+ 353,0526, найдено 353,0526.
Пример 10: 2-[2-(3-фторфенил)этиламино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он
К суспензии 2-[2-(3-фторфенил)этиламино]тиазол-4-она (38,1 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 10 мин, затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 2-[2-(3-фторфенил)этиламино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде коричневого твердого вещества (выход 22,3 мг, 36,9%).
ВР-ЭС (+), m/е: вычислено для C20H15FN4OS (М+Н)+ 379,1024, найдено 379,1024.
Пример 11: 2-[(5-метилпиразин-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он
К суспензии 2-[(5-метилпиразин-2-илметил)амино]тиазол-4-она (35,6 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 10 мин, затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 2-[(5-метилпиразин-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде коричневого твердого вещества (выход 10,6 мг, 18,3%).
ВР-ЭС (+), m/е: вычислено для C18H14N6OS (М+Н)+ 363,1023, найдено 363,1022.
Пример 12: 2-(2-хлор-6-метилбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он
К суспензии 2-(2-хлор-6-метилбензиламино)тиазол-4-она (40,8 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 15 мин, затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 2-(2-хлор-6-метилбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде коричневого твердого вещества (выход 32,9 мг, 52,1%).
ВР-ЭС (+), m/е: вычислено для C20H15ClN4OS (M+H)+ 395,0728, найден