Кристаллическая форма малеата азенапина
Иллюстрации
Показать всеНастоящее изобретение относится к новой орторомбической кристаллической форме соединения транс-5-хлор-2,3,3a,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоата (азенапин), к способам получения этой кристаллической формы и к фармацевтическим композициям, содержащим орторомбическую кристаллическую форму азенапина. Такая кристаллическая форма, а также фармацевтические композиции на ее основе являются перспективными для лечения психических заболеваний млекопитающих. 8 н. и 5 з.п. ф-лы, 3 табл., 2 ил.
Реферат
Данное изобретение относится к новой кристаллической форме азенапина, к методам ее получения и фармацевтическим композициям, содержащим указанную кристаллическую форму.
Азенапин является соединением для использования при лечении заболеваний центральной нервной системы, в частности шизофрении. Химическим названием азенапина является транс-5-хлор-2-метил-2,3,3а,12b-тетрагидро-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол, и его получение раскрыто в USP No. 4145434.
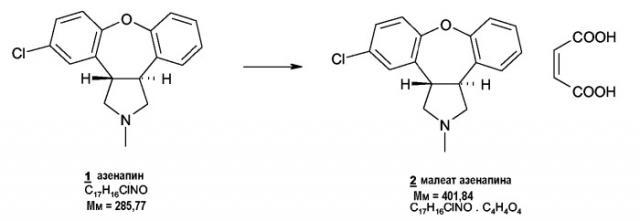
Азенапин разрабатывается в виде его малеатной соли 2 . Эту соль получают добавлением одномолярного эквивалента этанольного раствора малеиновой кислоты к этанольному раствору азенапина 1 в соответствии с примером 1. Для дальнейшей очистки полученный таким образом малеат азенапина 2 можно перекристаллизовать из этанола.
Схема 1. Кристаллизация малеата азенапина.
Фармакологические характеристики транс-5-хлор-2-метил-2,3,3а,12b-тетрагидро-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррола, его кинетика и метаболизм, а также первые исследования его безопасности и эффективности у добровольцев и пациентов с шизофренией были рассмотрены и обобщены De Boer et al. (Drugs of Future, 1993, 18(12), 1117-1123). Было установлено, что азенапин является очень сильным антагонистом допамина и серотонина с антипсихотической активностью.
Funke et al. (Arzneim.-Forsch./Drug Res. 40 (1999), 536-539) описали физико-химические свойства малеата азенапина. Этот известный кристаллический малеат азенапина (форма Н или моноклинная форма) имеет температуру плавления 141-145°C и обычно состоит из кристаллических частиц размером свыше 100 мкм, что наблюдалось на микрофотографиях.
Фармацевтическая композиция, содержащая малеат азенапина, для сублингвального или буккального пути введения описана в WO 95/23600. Для разработки сублингвального препарата желательным является лекарственное вещество с малым размером частиц. Поэтому, чтобы уменьшить размер частиц кристаллов, применяется стадия микронизации. Однако, как описано ниже, трудно получить лекарственное вещество с высокой чистотой полиморфа путем микронизации моноклинной формы азенапина.
Размер частиц лекарственного вещества влияет на биофармацевтические свойства лекарственного продукта. Например, размер частиц лекарственного вещества влияет на производство лекарственного продукта и растворение, и, следовательно, на его биодоступность. Так как азенапин растворяется в слюне, важен размер частиц. Если частицы лекарственного вещества малы, то достижение высоких концентраций занимает лишь короткий период времени. С этой точки зрения предпочтительны тонко измельченные частицы. Кроме того, частицы меньшего размера имеют тенденцию улучшать гомогенность порошковой смеси, что может давать в результате улучшенную однородность содержимого лекарственного продукта. Что касается малеата азенапина, размер частиц в значениях d95 составляет предпочтительно примерно 100 мкм или менее, более предпочтительно примерно 50 мкм или менее и наиболее предпочтительно примерно 30 мкм или менее. В соответствии с описанием термин d95 означает, что 95% частиц (исходя из объема) имеют размер, меньший или равный указанному.
Более тонкие частицы лекарственного вещества могут быть получены путем микронизации. Результат процесса микронизации, однако, весьма непредсказуем, если кристаллы моноклинной формы подвергались такому процессу. Анализы кристаллов после микронизации выявили наличие второго полиморфа (орторомбическая форма L) в дополнение к известной моноклинной форме в исходном веществе. После микронизации, исходя из моноклинной формы, получали либо моноклинную форму, либо орторомбическую форму или смесь полиморфов. Даже если исходный материал брали из той же самой партии моноклинной формы малеата азенапина, микронизация давала в результате продукт, который не был воспроизводимым (см. примеры 9 и 10). Кроме того, при микронизации моноклинной формы малеата азенапина нельзя было получить лекарственное вещество с высокой чистотой полиморфа.
Как правило, желательно получать терапевтические средства однородного и заданного состава. Если смесь полиморфных форм используют в качестве лекарственного средства, то с этим связаны большие недостатки по сравнению с чистой полиморфной формой. Различие кристаллической структуры может приводить к различиям в физико-химических показателях, таких как стабильность, скорость растворения, биодоступность и тому подобное. Поэтому смесь полиморфных форм соединения часто имеет другие физико-химические показатели, чем чистые формы, из которых состоит смесь. Это тем более важно, так как на практике трудно сделать каждую партию смеси полиморфов соединения идентичной в отношении их состава. Вследствие этих различий часто нежелательно включать смесь полиморфов соединения в лекарственные средства, к которым обычно предъявляется требование, чтобы использовался только один из полиморфов.
В данном изобретении представлена орторомбическая форма малеата азенапина, которая посредством применения специальной методики кристаллизации может быть получена в высокочистой форме. Кроме того, не измельченная орторомбическая форма имеет сравнительно меньший размер частиц (на основе d95), чем не измельченная моноклинная форма малеата азенапина. Более того, было обнаружено, что микронизация орторомбической формы малеата азенапина воспроизводимо дает в результате микрокристаллический малеат азенапина орторомбической формы.
Таким образом, в одном из аспектов данного изобретения представлена орторомбическая кристаллическая форма малеата азенапина, которая содержит 10% или менее другой кристаллической формы, 5% или менее другой кристаллической формы или неопределяемое количество другой кристаллической формы соответственно.
В другом аспекте данного изобретения представлена орторомбическая кристаллическая форма малеата азенапина, которая является микрокристаллической. В данном описании термин «микрокристаллическая» означает, что данная форма содержит частицы, имеющие распределение по размеру, характеризующееся d95, равные 30 мкм или менее.
В еще одном аспекте данного изобретения представлен способ получения орторомбической кристаллической формы малеата азенапина. Данный способ включает кристаллизацию малеата азенапина путем охлаждения из смеси этанол/вода, содержащей растворенный малеат азенапина. Смесь предпочтительно представлена отношением этанол/вода 9/1, об./об. Необязательно, если кристаллы орторомбической формы имеются в наличии, то раствор малеата азенапина в смеси этанол/вода может быть затравлен такими кристаллами. Кристаллическое вещество далее может быть дезагрегировано или просеяно для удаления скоплений микрокристаллов.
Кристаллический малеат азенапина, полученный в соответствии с данным изобретением, является особой полиморфной формой, которая имеет температуру плавления в интервале 138-142°C.
Кристалл орторомбической формы согласно данному изобретению можно охарактеризовать и, таким образом, установить отличие от моноклинной формы несколькими аналитическими методами, известными специалистам в данной области, такими как инфракрасная спектроскопия, рамановская спектроскопия, твердофазная ядерная магнитно-резонансная спектроскопия, дифференциальная сканирующая калориметрия, рентгеновские порошковые дифрактограммы (XRPD) и многие другие. Такие методики могут быть применены индивидуально или в сочетании.
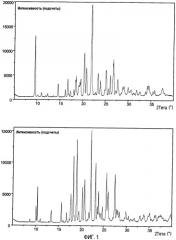
На фиг.1 представлены картины XRPD для моноклинной формы (верхнее изображение) и орторомбической формы (нижнее изображение) малеата азенапина. Каждая из дифрактограмм характеризуется пиками интенсивности при некоторых конкретных значениях угла дифракции 2 тета (θ). Моноклинная форма имеет характерные пики при 2-тета=9,6°, 20,4°, 22,°, 23,4°, 25,2°, 26,1°, 26,7°, 26,8°, 29,1° и 30,0°, с более характерными пиками, находящимися при 9,6°, 20,4°, 22,0°, 23,4°, 25,2° и 26,8°. Наиболее характерные пики находятся при 9,6° и 26,8°.
Орторомбическая форма характеризуется пиками при 2-тета=10,5°, 15,7°, 18,3°, 19,0°, 20,3°, 20,8°, 22,2°, 23,2°, 25,6° и 27,5°, с более характерными пиками, находящимися при 10,5°, 15,7°, 18,3°, 19,0°, 22,2°, 23,2° и 27,5°. Наиболее характерные пики находятся при 10,5° и 15,7°.
Значение 2-тета, которое указано, обычно означает конкретное значение ±0,2.
Орторомбическая форма может быть также охарактеризована кристаллографическими данными. Кристаллографические данные орторомбической и моноклинной формы, полученные при рентгеновской дифракции одного кристалла, сравнивали друг с другом. Установлено, что кристаллическая структура, относящаяся к моноклинной форме, состоит из пространственной группы Р21/n и 4 молекул в элементарной ячейке, тогда как кристаллическая структура, относящаяся к орторомбической форме, состоит из пространственной группы Рса21 и 8 молекул в элементарной ячейке. Данные представлены в таблицах 1А и 1B. Длина по оси в таблице 1А обычно означает это конкретное значение ±0,2Å. Угол в ячейке в таблице 1А обычно означает это значение ±0,2°. Положение атома (х, y, z) в таблице 1B обычно означает эти значения ±0,002.
| Таблица 1AКристаллографические данные, относящиеся к элементарным ячейкам моноклинной формы и орторомбической формы малеата азенапина | ||
| Моноклинная форма | Орторомбическая форма | |
| Пространственная группа | P2 1 /n | Pca2 1 |
| Z | 4 | 8 |
| a(Å) | 17,8 | 11,0 |
| b(Å) | 11,0 | 20,2 |
| c(Å) | 10,3 | 17,3 |
| α(°) | 90 | 90 |
| β(°) | 101,0 | 90 |
| γ(°) | 90 | 90 |
| V(Å3 ) | 1976 | 3824 |
| D (г.см-3) | 1,35 | 1,40 |
Кристаллографические данные из таблиц 1А и 1В можно использовать для расчета рентгеновских порошковых дифрактограмм (XRPD) моноклинной формы и орторомбической формы малеата азенапина. Эти рассчитанные виды XRPD моноклинной формы и орторомбической формы малеата азенапина можно использовать для сравнения с экспериментальными дифрактограммами. Кроме того, данные из таблицы 1А можно использовать для аппроксимации Pawley для сравнения экспериментальных дифрактограмм XRPD с кристаллографическими данными моноклинной и орторомбической формы малеата азенапина. Даже более того, данные таблицы 1B можно использовать для уточнения Rietveld для сравнения картин экспериментальной XRPD с кристаллографическим данными моноклинной и орторомбической формы малеата азенапина.
Кристалл орторомбической формы согласно данному изобретению также можно охарактеризовать и, таким образом, установить отличие от моноклинной формы по их рамановскому спектру.
На фиг.2 представлены рамановские спектры моноклинной формы (верхний спектр) и орторомбической формы (нижний спектр) малеата азенапина.
| Таблица 1BКристаллографические данные, касающиеся относительных положений атомов моноклинной формы и орторомбической формы малеата азенапина | |||||||
| Моноклинная форма | Орторомбическая форма | ||||||
| атом | X | y | z | атом | x | y | z |
| N | 0,7358 | 0,3853 | 0,1998 | N | 0,0882 | 0,1628 | 0,2804 |
| Cl | 0,4562 | 0,1357 | 0,4683 | Cl | 0,2828 | -0,0176 | -0,0076 |
| O | 0,5082 | 0,6250 | 0,2880 | О | -0,1458 | -0,0394 | 0,1668 |
| O | 0,2213 | 0,2168 | 0,4130 | О | 0,6740 | 0,2238 | 0,0820 |
| O | 0,2148 | 0,3418 | 0,5767 | О | 0,8039 | 0,2030 | 0,1658 |
| O | 0,1918 | 0,3674 | 0,0222 | О | 0,6810 | 0,2732 | -0,0309 |
| O | 0,2124 | 0,2255 | 0,1745 | О | 0,8217 | 0,3188 | -0,0987 |
| C | 0,6925 | 0,3634 | 0,3095 | C | -0,0373 | -0,0366 | 0,1285 |
| C | 0,6283 | 0,4583 | 0,2908 | C | -0,0233 | -0,0883 | 0,0727 |
| C | 0,5546 | 0,4192 | 0,3302 | C | 0,08133 | -0,0807 | 0,0326 |
| C | 0,4951 | 0,5053 | 0,3174 | C | 0,1576 | -0,0253 | 0,0457 |
| C | 0,5233 | 0,6628 | 0,1686 | C | 0,1478 | 0,0243 | 0,0979 |
| C | 0,5739 | 0,6068 | 0,1009 | C | 0,0479 | 0,0182 | 0,1397 |
| C | 0,6168 | 0,4892 | 0,1436 | C | 0,0327 | 0,0700 | 0,1998 |
| C | 0,6986 | 0,4912 | 0,1216 | C | 0,1111 | 0,1377 | 0,2085 |
| C | 0,8191 | 0,4003 | 0,2426 | C | 0,0042 | 0,2304 | 0,2844 |
| C | 0,5417 | 0,3050 | 0,3766 | C | 0,0412 | 0,0918 | 0,3158 |
| C | 0,4704 | 0,2787 | 0,4075 | C | 0,0409 | 0,0281 | 0,2624 |
| C | 0,4126 | 0,3625 | 0,3904 | C | -0,0561 | -0,0353 | 0,2780 |
| C | 0,4253 | 0,4761 | 0,3477 | C | -0,0564 | -0,0657 | 0,3412 |
| C | 0,4869 | 0,7719 | 0,1217 | C | -0,1415 | -0,1239 | 0,3604 |
| C | 0,5008 | 0,8240 | 0,0104 | C | -0,2254 | -0,1491 | 0,3134 |
| C | 0,5508 | 0,7718 | -0,0586 | C | -0,2204 | -0,1209 | 0,2504 |
| C | 0,5858 | 0,6647 | -0,0133 | C | -0,1360 | -0,0650 | 0,2325 |
| C | 0,2015 | 0,4272 | 0,3663 | C | 0,7791 | 0,2274 | 0,1077 |
| C | 0,2133 | 0,3209 | 0,4577 | C | 0,8836 | 0,2608 | 0,0697 |
| C | 0,1969 | 0,4327 | 0,2377 | C | 0,8897 | 0,2887 | 0,0086 |
| C | 0,2008 | 0,3373 | 0,1384 | C | 0,7927 | 0,2950 | -0,0432 |
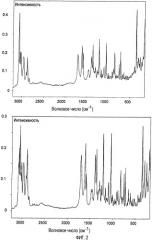
Каждый из спектров характеризуется пиками интенсивности при некоторых конкретных значениях волнового числа (см-1). Моноклинная форма имеет характерные пики при 3070 см-1, 3020 см-1, 2900 см-1, 2871 см-1, 2829 см-1, 1253 см-1, 1238 см-1, 849 см-1, 743 см-1 и 711 см-1, с более характерными пиками, находящимися при 3070 см-1, 3020 см-1, 2871 см-1, 849 см-1 и 711 см-1. Наиболее характерные пики находятся при 2871 см-1 и 849 см-1.
Орторомбическая форма характеризуется пиками при 3072 см-1, 3051 см-1, 3029 см-1, 3011 см-1, 2909 см-1, 2888 см-1, 1245 см-1, 824 см-1, 747 см-1, 717 см-1 и 194 см-1, с более характерными пиками, находящимися при 3051 см-1, 3029 см-1, 3011 см-1, 2888 см-1, 824 см-1 и 717 см-1. Наиболее характерные пики находятся при 2888 см-1 и 824 см-1.
Волновое число, которое указано выше, обычно означает это конкретное значение ±2 см-1.
Вновь обнаруженное, дающее преимущества свойство представлено как дополнительный аспект данного изобретения, использование малеата азенапина в орторомбической форме для получения тонкодисперсных суспензий кристаллов.
В дополнительном аспекте данного изобретения представлены фармацевтические препараты, содержащие орторомбическую кристаллическую форму малеата азенапина в сочетании с одной или несколькими фармацевтически приемлемыми добавками или эксципиентами. Кроме орторомбической кристаллической формы может присутствовать аморфный малеат азенапина.
Такие фармацевтические препараты обычно изготавливают в форме дозированной единицы, такой как таблетка, капсула или суппозиторий, но включены и другие твердые или сухие фармацевтические препараты. Предпочтительный фармацевтический препарат представлен в форме таблетки. Таблетка может содержать некоторые эксципиенты кроме активного компонента, малеата азенапина в кристаллической орторомбической форме, такие как разбавители, связующие, улучшающие скольжение вещества и смазывающие вещества, которые служат для получения удовлетворительных характеристик при переработке и прессовании в таблетки, а также дезинтеграторы и вкусовые средства, которые придают дополнительные желательные физические характеристики конечным таблеткам.
Способы изготовления таких дозированных единиц хорошо известны, например, по стандартным методам, таким как описанные в нормативном источнике Gennaro et al., Remington's Pharmaceutical Sciences, (18th ed., Mack Publishing Company, 1990, в частности, Part 8: Pharmaceutical Preparations and Their Manufacture).
Дозированная единица малеата азенапина, подходящая для лечения психических нарушений, таких как психоз, биполярное расстройство и шизофрения, может содержать от примерно 0,005 до 500 мг активного ингредиента. Предпочтительная дозированная единица может содержать 1-50 мг малеата азенапина в кристаллической орторомбической форме.
Краткое описание чертежей
На фиг.1 представлен вид XRPD моноклинной формы (верхний) и орторомбической формы (нижний) транс-5-хлор-2-метил-2,3,3а,12b-тетрагидро-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоата, определенной при отражении.
На фиг.2 представлены рамановские спектры моноклинной формы (верхний) и орторомбической формы (нижний) транс-5-хлор-2-метил-2,3,3а,12b-тетрагидро-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоата.
Данное изобретение иллюстрируется следующими неограничивающими примерами.
Примеры
Общие методы
Спектры рентгеновской порошковой дифракции (XRPD) были получены на дифрактометре для измерения в отраженном излучении a'Xpert pro Panalytical Reflection в компоновке Bragg-Brantano, излучение СuΚα, настройки 45 кВ и 40 мА вместе с ускорителем (X'celerator) детектора. Используемые щели: противорассеивающая щель 1°, отклоняющая щель 1/2°, щели Соллера 0,02 рад. Условия измерения: интервал сканирования 5-40° 2-тета, размер шага 0,0167° 2-тета. Образцы анализировали на предметном диске из Si, вращающемся со скоростью 15 об/мин. Спектры XRPD кристаллической чистой моноклинной формы и чистой орторомбической формы представлены на фиг.1.
Анализ одиночных кристаллических структур. Анализируемые кристаллы фиксировали с помощью инертной перфторированной смазки на кончике стеклянного капилляра Линдеманна и переносили в потоке холодного азота на нониус Каппа ССD на вращающемся аноде. Структуры определяли прямыми методами (SHELX-86) и уточнения по F2 производили полноматричным методом наименьших квадратов (SHELXL-97-2); во время уточнения не применяли критериев соблюдения. Корректировки факторов рассеивания нейтральных атомов и аномальной дисперсии брали из Международных таблиц по кристаллографии. Геометрические расчеты и иллюстрации выполняли с помощью PLATON. Все расчеты выполняли на Transtec 3.0 GHz Xeon PC согласно Debian Linux.
FT-рамановские спектры регистрировали, используя FT-рамановский спектрометр Bruker RFS 100/S, оборудованный лазером 1064 нм Adias DPY 421 Nd:YAG с максимальной мощностью 1550 мВт и охлаждаемым жидким азотом Gе детектором. Для каждого образца собирали 128 сканограмм, используя фокусированный пучок (лазерное пятно 100 мкм), мощность лазерного излучения 150 мВт и разрешение 2 см-1.
Метод ЛДС. Была получена дисперсионная жидкость, состоящая из (0,7 мг/мл) лецитина (использован в качестве поверхностно-активного вещества) в изооктане, насыщенном малеатом азенапина. Раствор перемешивали в течение ночи. Затем раствор фильтровали через 0,22 мкм фильтр. Образцы получали, отвешивая примерно 30 мг малеата азенапина в центрифужную пробирку и добавляя 2 мл дисперсионной жидкости. Ультразвуковую обработку образцов выполняли в течение 2 минут в ультразвуковой ванне (Transsonic 310). Затем распределение частиц по размеру в образце анализировали, используя лазерную дифракцию (Malvern Mastersizer S, UK). Распределение частиц по размеру рассчитывали, используя алгоритм Fraunhofer.
Метод ДСК. Дифференциальную сканирующую калориметрию (DSC, ДСК) использовали для определения температуры плавления (температура начала в °C) малеата азенапина. Оборудование ДСК содержало ячейку для измерения, имеющую в основе принцип теплового потока, с керамическим сенсором и снабженную термостатом, который можно использовать в интервале температур от 0 до 300°C. Скорость нагревания находилась в интервале, по меньшей мере, 1-20°C/мин. Газом для продувки был азот (N2) с регулируемым расходом 50 мл/мин. Лекарственное средство, малеат азенапина (2,5 мг), аккуратно отвешивали в алюминиевую чашечку для образца. Применяемая скорость нагревания была равна 5°C/мин, и программа температуры была линейной от 0 до 250°C.
Пример 1: синтез малеата азенапина из азенапина и малеиновой кислоты
Соединение ( 1 ) в виде свободного основания, транс-5-хлор-2,3,3а,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол (30 кг), растворяли в 60 л этанола и выпаривали в вакууме при 65°C. К остатку добавляли этанол (90 л) и в раствор при 60°C добавляли 1,8 кг древесного угля. Перемешивание продолжали в течение 30 минут при 60°C и раствор отфильтровывали от порошка через вспомогательный фильтр. Этот вспомогательный фильтр промывали 30 л этанола с температурой 60°C. При 60°C к объединенным фильтратам добавляли раствор 13,5 кг малеиновой кислоты в 90 л этанола и перемешивание продолжали в течение 30 минут. Реакционную смесь охлаждали до 20°C и перемешивали в течение 2 часов. Реакционную смесь затем охлаждали до -10°C (±2°C), перемешивали в течение 2 часов и кристаллы отфильтровывали. Кристаллы промывали 5 л этанола (-10°C) и собирали. Влажные кристаллы непосредственно использовали для перекристаллизации, которая описана в примерах 2-8.
Пример 2: кристаллизация партии С1 (моноклинный полиморф)
Малеат азенапина (10 кг), полученный по методике, описанной в примере 1, растворяли в 24 л этанола при температуре кипения. После охлаждения при 20°C раствор перемешивали в течение 1 часа и охлаждали до -10°C (±2°C). Перемешивание продолжали в течение 2 часов, кристаллы собирали и дважды промывали 3,5 л холодного (-10°C) этанола. Показатели примесей продукта определяли по анализу ГЖХ. Кристаллы сушили в вакууме при 60°C.
Выход: 10 кг=100% (м/м) транс-5-хлор-2,3,3а,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоата (1:1) (малеат азенапина 2 ).
ДСК: 140,6°C.
XRPD: соответствует эталону моноклинного полиморфа.
Чистота полиморфа: 90% моноклинной формы и 10% орторомбической формы.
Размер частиц по ЛДС: d95<199 мкм.
Пример 3: кристаллизация орторомбической формы
Малеат азенапина (260 г), который получен в соответствии с примером 1, растворяли в смеси этанола (480 мл) и воды (50 мл) путем нагревания до 57°C. Затем раствору давали медленно остыть, и начиналась кристаллизация. После перемешивания в течение 72 часов реакционную смесь охлаждали до -10°C и перемешивали в течение еще нескольких часов. Затем кристаллы собирали фильтрованием. Это давало малеат азенапина в орторомбической форме (224 г, 86%).
XRPD: >95% орторомбической формы.
Пример 4: кристаллизация партии С2 (моноклинный полиморф)
Другую партию получали по примеру 2.
Выход: 10 кг=100% (м/м) малеата азенапина.
ДСК: 141,0°C.
XRPD: соответствует эталону моноклинного полиморфа.
Чистота полиморфа: >95% моноклинной формы.
Размер частиц по ЛДС: d95<221 мкм.
Пример 5: кристаллизация партии С3 (орторомбический полиморф)
Малеат азенапина (~30 кг), полученный по методике, описанной в примере 1, растворяли в 57 л этанола и 6,5 л деминерализованной воды при 55°C. Раствор отфильтровывали от порошка и фильтрат медленно охлаждали до 20±5°C. Фильтрат затравливали 30 г Org 5222 (полиморфная орторомбическая форма) и охлаждали в течение 48±6 часов при 20±5°C. Кристаллы собирали и сушили в вакууме при 60°C. Выход: 20,06 кг=69% (м/м) малеата азенапина.
ДСК: 139,1°C.
XRPD: соответствует эталону орторомбического полиморфа >95% чистоты.
Пример 6: кристаллизация партии С4 (орторомбический полиморф)
Методика была такой же, как описано в примере 5, с 28,9 кг свободного основания азенапина.
Выход: 20,88 кг=72% (м/м) малеата азенапина ( 1 , орторомбическая форма).
ДСК: 139,2°C.
XRPD: соответствует эталону орторомбического полиморфа >95% чистоты.
Пример 7: кристаллизация партии С5 (орторомбический полиморф)
Методика была такой же, как описано в примере 4, с 26,9 кг свободного основания азенапина.
Выход: 22,85 кг=85% (м/м) малеата азенапина ( 1 , орторомбическая форма).
ДСК: 139,9°C.
XRPD: соответствует эталону орторомбического полиморфа >95% чистоты.
ЛДС: средний размер частиц - 30 мкм.
Микроскопическая картина: частицы до 100 мкм.
Пример 8: кристаллизация партии С6 (орторомбический полиморф)
Методика была такой же, как описано в примере 5, с 28,9 кг свободного основания азенапина.
Выход: 24,2 кг=84% (м/м) малеата азенапина.
ДСК: 139,2°C.
XRPD: соответствует эталону орторомбического полиморфа >95% чистоты.
Примеры 9-15: микронизация партий С1-С6 с получением М1-М6
Чистые продукты из партий с С1 по С6, которые описаны в примерах 2 и 4-8, микронизировали в мельнице Jet Mill из нержавеющей стали Chrispro MC200, используя азот в качестве газа-носителя и давление для микронизации 7 бар. Результаты показаны в таблице 2.
Было показано, что микронизация кристаллов малеата азенапина орторомбического полиморфа единообразно происходит с сохранением полиморфной формы. Это подтверждается результатами микронизации партий С3-С5, которые давали микронизированные партии М4, М5, М6 и М7 (примеры 12-15). Микронизированные партии М4-М7 все были охарактеризованы как орторомбический полиморф с тонкоизмельченными частицами, т.е. d95<30 мкм, как показано в таблице 2. Кроме того, полиморфная чистота продукта очень высока (>95% орторомбической формы), так как вещество моноклинного полиморфа нельзя было обнаружить с помощью XRPD.
Пример 16: фармацевтическая композиция
Действующее начало
Малеат азенапина орторомбической формы смешивали с желатиновой/маннитной основой и дозировали по весу в предварительно изготовленные ячейки. Основу замораживали в ячейках путем пропускания через замораживающую трубу. Замороженные таблетки затем сушили путем сублимации льда в лиофильной сушилке.
Способ производства
2000 г желатина и 1500 г маннита диспергировали в 45,01 кг очищенной воды при перемешивании и нагревании в вакуумном смесителе. После растворения основу отфильтровывали, добавляли 1406 г транс-5-хлор-2,3,3а,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино-[4,5-с]пиррол-(Z)-2-бутендиоата в орторомбической форме и перемешивали. Смесь дозировали, используя дозировочные насосы, в предварительно сформированные блистерные ячейки (250 мг в каждую ячейку). Заполненные ячейки замораживали путем пропускания через замораживающую трубу, охлаждаемую жидким азотом. Замороженные таблетки сушили в лиофильной сушилке, используя предварительно запрограммированный цикл сушки. Каждая ячейка содержала фармацевтическую стандартную дозируемую форму, включающую в себя 7,03 мг транс-5-хлор-2,3,3а,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоата, 10,0 мг желатина и 7,5 мг маннита.
Пример 17: перекристаллизация с получением орторомбической формы
Неочищенный малеат азенапина в моноклинной форме (20 кг) растворяли в ацетоне (87,6 кг) и нагревали до 55°C. Раствор пропускали через фильтр для удаления нерастворенных веществ. Добавляли гептан (25,5 кг), и температура возвращалась к 55°C. Добавляли затравочные кристаллы малеата азенапина в орторомбической форме (примерно 100 г) и перемешивали в течение 1 часа. Затем добавляли гептан (62,8 кг) с постоянной скоростью за 2 часа. После перемешивания смеси при 57°C в течение 2 часов температуру доводили до 10°C в течение 6 часов. Малеат азенапина выделяли фильтрованием и промывали смесью 1:1 ацетона и гептана (30 кг), охлажденной до 10°C. Это вещество затем сушили. Выход составлял 90-96%. Анализ XRPD показал, что было получено >95% орторомбической формы.
| Таблица 2Микронизация малеата азенапина | ||||||||
| Пример | Образец кристаллизации | D95 (мкм) | ДСК | Полиморф | Образец микронизации | D95 (мкм) | ДСК | Полиморф |
| 9 | C1 | 199 | 140,6 | моноклинный | M1 | <12 | >95% орторомбический | |
| 10 | C2 | 221 | 141 | моноклинный | M2 | <14 | 141 | >95% моноклинный |
| 11 | C2 | 141 | моноклинный | M3 | <16 | 138 | 80% орторомбический, 20% моноклинный | |
| 12 | C3 | 139,1 | орторомбический | M4 | <9 | 138,2 | >95% орторомбический | |
| 13 | C4 | 139,2 | орторомбический | M5 | <6 | 139,2 | >95% орторомбический | |
| 14 | C5 | 30-100 | 139,9 | орторомбический | M6 | <10 | 139,9 | >95% орторомбический |
| 15 | C6 | 139,2 | орторомбический | M7 | <12 | 139,2 | >95% орторомбический |
1. транс-5-Хлор-2,3,3a,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоат в орторомбической кристаллической форме, который характеризуется рентгеновской порошковой дифрактограммой, полученной с помощью излучения СuКα и характеризующейся 2-тета (2θ) 10,5° и 15,7°.
2. Соединение транс-5-хлор-2,3,3a,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоат, отличающееся тем, что данное соединение находится в орторомбической кристаллической форме, характеризующейся рентгеновской порошковой дифрактограммой, полученной с помощью излучения CuKα и характеризующейся 2-тета (2θ) 10,5° и 15,7°, которая содержит 10% или менее другой кристаллической формы, 5% или менее другой кристаллической формы или неопределяемое количество другой кристаллической формы.
3. Соединение по п.1 или 2, которое характеризуется рентгеновской порошковой дифрактограммой, полученной с помощью излучения CuKα и характеризующейся 2-тета (2θ) 10,5°, 15,7°, 18,3°, 19,0°, 22,2°, 23,2° и 27,5°.
4. Соединение по п.1 или 2, которое характеризуется рентгеновской порошковой дифрактограммой, полученной с помощью излучения CuKα и характеризующейся 2-тета (2θ) 10,5°, 15,7°, 18,3°, 19,0°, 20,3°, 20,8°, 22,2°, 23,2°, 25,6° и 27,5°.
5. транс-5-Хлор-2,3,3a,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоат в орторомбической кристаллической форме, который характеризуется рамановским спектром с характеристическими значениями пиков 2888 см-1 и 824 см-1.
6. Соединение транс-5-хлор-2,3,3a,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоат, отличающееся тем, что данное соединение находится в орторомбической кристаллической форме, характеризующейся рамановским спектром с характеристическими значениями пиков 2888 см-1 и 824 см-1, которая содержит 10% или менее другой кристаллической формы, 5% или менее другой кристаллической формы или неопределяемое количество другой кристаллической формы.
7. Соединение по п.5 или 6, которое характеризуется рамановским спектром с характеристическими значениями пиков 3051 см-1, 3029 см-1, 3011 см-1, 2888 см-1, 824 см-1 и 717 см-1.
8. Соединение по п.5 или 6, которое характеризуется рамановским спектром с характеристическими значениями пиков 3072 см-1, 3051 см-1, 3029 см-1, 3011 см-1, 2909 см-1, 2888 см-1, 1245 см-1, 824 см-1, 747 см-1, 717 см-1 и 194 см-1.
9. Способ получения соединения по пп.1-8, отличающийся тем, что транс-5-хлор-2,3,3а,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино-[4,5-с]пиррол-(Z)-2-бутендиоат кристаллизуют из смеси этанол/вода.
10. Способ по п.9, отличающийся тем, что смесь этанол/вода представлена объемным соотношением 9:1.
11. Фармацевтическая композиция для лечения психических заболеваний у млекопитающих, включая человека, содержащая фармацевтически приемлемый эксципиент и транс-5-хлор-2,3,3а,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино-[4,5-с]пиррол-(Z)-2-бутендиоат в орторомбической кристаллической форме по пп.1-8.
12. Применение транс-5-хлор-2,3,3а,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоата по пп.1-8 при получении фармацевтического препарата для лечения психических расстройств у млекопитающих, включая человека.
13. Применение транс-5-хлор-2,3,3а,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол-(Z)-2-бутендиоата по пп.1-8 при получении фармацевтического препарата для лечения шизофрении и биполярного расстройства.