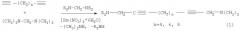Способ получения несимметричных альфа, омега-ди(аминометил)алкадиинов
Иллюстрации
Показать всеИзобретение относится к способу получения несимметричных α,ω-ди(аминометил)алкадиинов общей формулы (I):
где R2N = пиперидил, морфолил, N-метилпиперазил, характеризующемуся тем, что α,ω-диацетилены НС≡СН-(СН2)n-С≡СН, где n=4, 6, 8, подвергают взаимодействию с эквимольным количеством N,N,N1,N1-тетраметилдиаминометана (бисамин) в присутствии катализатора 6-водного азотнокислого самария (Sm(NO3)2*6H2O), взятыми в мольном соотношении α,ω-диацетилен : бисамин : Sm(NO3)2*6H2O=10:10:(0.3-0.7), предпочтительно 10:10:0.5 ммолей, без растворителя при температуре 80°С и атмосферном давлении в течение 3 ч с последующим добавлением к реакционной массе гем-диамина R2NCH2NR2, где R2N такое же, как определено выше, в эквимольном к бисамину количестве и перемешиванием реакционной массы в течение 3-5 ч. Несимметричные α,ω-ди(аминометил)алкадиины могут найти применение в тонком органическом синтезе, в частности, для получения труднодоступных полициклических соединений. Технический результат - новый способ, позволяющий получать несимметричные α,ω-ди(аминометил)алкадиины. 1 табл.
Реферат
Предлагаемое изобретение относится к органической химии, в частности к способу получения несимметричных α,ω-ди(аминометил)алкадиинов общей формулы (1):
где R2N = пиперидил, морфолил, N-метилпиперазил.
Несимметричные α,ω-аминометилированные диацетилены могут найти применение в тонком органическом синтезе, в частности синтезе труднодоступных полициклических соединений (А.Т.Бабаян. Внутримолекулярные перегруппировки солей четырехзамещенного аммония. Ереван: Изд. АН АрмССР, 1976, с.159-348).
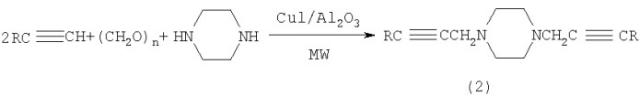
Известен способ (G.W.Kabalka, L.L.Zhou, L.Wang, M.Pagni. A microwave-enhanced, solventless Mannich condensation of terminal alkynes and secondary amines with para - formaldehyde on cuprous iodide doped aluminia. Tetrahedron 62 (2006) 857-867) получения симметричных диаминодиацетиленов, в частности 1,4-ди(2-алкинил)пиперазинов общей формулы (2) взаимодействием терминальных ацетиленов с пиперазином и формальдегидом в присутствии стехиометрических количеств иодида меди и окиси алюминия при ультразвуковом облучении с выходом 49-65% по схеме:
Известным способом не могут быть получены несимметричные α,ω-ди(аминометил)алкадиины общей формулы (1).
Известен способ (G.W.Kabalka, L.L.Zhou, L.Wang, M.Pagni. A microwave-enhanced, solventless Mannich condensation of terminal alkynes and secondary amines with para - formaldehyde on cuprous iodide doped aluminia. Tetrahedron 62 (2006) 857-867) получения симметричных α,ω-ди(аминометил)алкадиинов общей формулы (3) взаимодействием 1 экв. диацетиленового соединения с избытком параформальдегида и 2 экв. вторичного амина в присутствии стехиометрических количеств иодида меди и окиси алюминия при ультразвуковом облучении с выходом 51-56% по схеме:
Известным способом не может быть осуществлен синтез несимметричных α,ω-ди(аминометил)алкадиинов общей формулы (1).
Предлагается новый способ получения несимметричных α,ω-ди(аминометил)алкадиинов общей формулы (1). Сущность способа заключается во взаимодействии α,ω-диацетиленов общей формулы НС≡СН-(СН2)n-С≡СН, где n=4, 6, 8, с эквимольным количеством N,N,N1,N1-тетраметилдиаминометана (бисамин) в присутствии катализатора 6-водного азотнокислого самария (Sm(NO3)2*6H2O), взятыми в соотношении α,ω-диацетилен : бисамин : Sm(NO3)2*6H2O = 10:10:(0.3-0.7), предпочтительно 10:10:0.5 ммолей, без растворителя при температуре 80°С и атмосферном давлении в течение 3 ч, с последующим добавлением к реакционной массе гем-диамина R2NCH2NR2, где R2N = пиперидил, морфолил, N-метилпиперазил, в эквимольном к бисамину количестве и перемешиванием реакционной массы в течение 3-5 ч, предпочтительно 4 ч. Выход несимметричных α,ω-ди(аминометил)алкадиинов (1) составляет 54-68%. Реакция протекает по схеме:
где R2N = пиперидил, морфолил, N-метилпиперазил.
Несимметричные α,ω-ди(аминометил)алкадиины (1) образуются только лишь с участием α,ω-диацетиленов в результате последовательного добавления к нему бисамина, а затем гем-диамина. В присутствии дизамещенных ацетиленов или диаминов другой структуры целевые продукты (1) не образуются.
Проведение указанной реакции в присутствии катализатора Sm(NO3)2*6H2O больше 0.7 ммолей не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Sm(NO3)2*6H2O менее 0.3 ммолей снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 80°С. При более высокой температуре (например, 90°С) увеличиваются энергозатраты, а при меньшей температуре (например, 70°С) снижается скорость реакции.
Изменение соотношения исходного гем-диамина в сторону увеличения его содержания по отношению к исходному α,ω-диацетилену не приводит к существенному повышению выхода целевых продуктов (1).
Существенные отличия предлагаемого способа
В известном способе для аминометилирования α,ω-диацетиленов используются параформальдегид и вторичные амины, реакция идет с участием стехиометрических количеств CuI и Al2O3 при ультразвуковом облучении, при этом в качестве целевых продуктов образуются симметричные α,ω-ди(аминометил)алкадиины.
В предлагаемом способе для аминометилирования α,ω-диацетиленов применяется первоначально N,N,N1,N1-тетраметилдиаминометан (бисамин), а затем гем-диамин R2NCH2NR2, где R2N = пиперидил, морфолил, N-метилпиперазил, реакция идет в присутствии катализатора 6-водного азотнокислого самария (Sm(NO3)2*6H2O), при этом в качестве целевых продуктов образуются несимметричные α,ω-ди(аминометил)алкадиины.
Способ поясняется следующими примерами.
ПРИМЕР 1. В стеклянный реактор, установленный на магнитной мешалке, помещают 10 ммолей 1,7-октадиина, 10 ммолей N,N,N1,N1-тетраметилдиаминометана, 0.5 ммоль катализатора Sm(NO3)2*6H2O, перемешивают 3 часа при температуре 80°С, затем добавляют 10 ммолей (пиперидинометил)пиперидина, перемешивают 4 часа при температуре 80°С. Из реакционной массы выделяют N,N-диметил-10-пиперидино-2,8-декадиин-1-амин с выходом 62%.
Спектральные характеристики N,N-диметил-10-пиперидино-2,8-декадиин-1-амина (1).
Спектр ЯМР 1Н (1), δ, м.д.: уш.с. 1.18 (2Н), м. 1.23 (4Н), с. 1.41 (4Н), уш.с. 2.02 (4Н), с. 2.19 (6Н), уш.с. 2.31 (4Н), с. 3.19 (2Н), с. 3.21 (2Н). Спектр ЯМР 13С (1), δ, м.д.: 17.43, 17.96, 23.40, 25.20, 27.70, 27.92, 43.69, 47.60, 48.40, 52.41, 74.70, 75.12, 84.90, 85.12.
Другие примеры, подтверждающие способ, приведены в таблице.
| №№ п/п | Исходные гам-диамины | Исходные α,ω-диацетилены | Соотношение бисамин : α,ω-диацетилен : гем-диамин : Sm(NO3)2*6H2O, ммоль | Общее время реакции, час | Выход несимметричных α,ω-ди(аминометил)алкадиинов (1), % |
| 1 | 1-(пиперидинометил)-пиперидин | 1,7-октадиин | 10:10:10:0.5 | 7 | N,N-диметил-10-пиперидино-2,8-декадиин-1-амин, 62 |
| 2 | -//- | -//- | 10:10:10:0.7 | 7 | -//-, 68 |
| 3 | -//- | -//- | 10:10:10:0.3 | 7 | -//-, 54 |
| 4 | -//- | -//- | 10:10:10:0.5 | 8 | -//-, 65 |
| 5 | -//- | -//- | 10:10:10:0.5 | 6 | -//-, 55 |
| 6 | -//- | 1,9-декадиин | 10:10:10:0.5 | 7 | N,N-диметил-12-пиперидино-2,10-додекадиин-1-амин, 59 |
| 9 | -//- | 1,11-додекадиин | 10:10:10:0.5 | 7 | N,N-диметил-14-пиперидино-2,12-тетрадекадиин-1-амин, 56 |
| 10 | 4-(морфолинометил)-морфолин | 1,7-октадиин | 10:10:10:0.5 | 7 | N,N-диметил-10-морфолино-2,8-декадиин-1-амин, 64 |
| 11 | 1-метил-4-[(4-метил-пиперазино)метил]-пиперазин | 1,7-октадиин» | 10:10:10:0.5 | 7 | N,N-диметил-10-(4-метилпиперазино)-2,8-декадиин-1-амин, 60 |
Реакции проводили при температуре 80°С без растворителя.
Способ получения несимметричных α,ω-ди(аминометил)алкадиинов общей формулы (I): где R2N = пиперидил, морфолил, N-метилпиперазил, характеризующийся тем, что α,ω-диацетилены НС≡СН-(СН2)n-С≡СН, где n=4, 6, 8, подвергают взаимодействию с эквимольным количеством N,N,N1,N1-тетраметилдиаминометана (бисамин) в присутствии катализатора 6-водного азотнокислого самария (Sm(NO3)2·6H2O), взятыми в мольном соотношении α,ω-диацетилен: бисамин; Sm(NO3)2·6H2O=10:10:(0,3-0,7), предпочтительно 10:10:0.5 ммолей, без растворителя при температуре 80°С и атмосферном давлении в течение 3 ч, с последующим добавлением к реакционной массе гем-диамина R2NCH2NR2, где R2N такое же, как определено выше, в эквимольном к бисамину количестве и перемешиванием реакционной массы в течение 3-5 ч.