Альтернативные способы синтеза ингибиторов ренина и их промежуточных соединений
Иллюстрации
Показать всеНастоящее изобретение относится к способам синтеза соединений формулы (А), где R1 означает галоген, C1-С6галогеналкил, С1-С6алкокси(С1-С6)алкилокси или С1-С6алкокси(С1-С6)алкил; R2 означает галоген, С1-С4алкил или С1-С4алкокси; R3 и R4 независимо означают разветвленный С3-С6алкил; и R5 означает С3-С12циклоалкил, C1-С6алкил, C1-С6гидроксиалкил, С1-С6алкокси(С1-С6)алкил, С1-С6алканоилокси(С1-С6)алкил, С1-С6аминоалкил, С1-С6алкиламино(С1-С6)алкил, С1-С6диалкиламино(С1-С6)алкил, C1-С6алканоиламино(С1-С6)алкил, НО(O)С-(С1-С6)алкил, С1-С6алкил-O-(O)С-(С1-С6)алкил, H2N-С(O)-(С1-С6)алкил, С1-С6алкил-HNC(O)-(С1-С6)алкил или (С1-С6алкил)2N-С(O)-(С1-С6)алкил или их фармацевтически приемлемых солей, которые обладают ингибирующей способностью в отношении ренина, а также к основным промежуточным соединениям, полученным на стадиях синтеза конечных соединений и к способам синтеза указанных промежуточных соединений. 24 н. и 19 з.п. ф-лы.
Реферат
Настоящее изобретение относится к способам получения некоторых производных 2(S),4(S),5(S),7(S)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноиламида или их фармацевтически приемлемых солей. Настоящее изобретение также относится к новым промежуточным соединениям, используемым для получения указанных соединений.
Более подробно производными 2(S),4(S),5(S),7(S)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноиламида, которые получают способами по настоящему изобретению, являются любые указанные производные, обладающие ингибирующей активностью в отношении ренина и, таким образом, их можно использовать в фармацевтике, например производные, описанные в патенте US 5559111.
Неожиданно было обнаружено, что при использовании в качестве исходного соединения пироглютаминовой кислоты, прежде всего L-пироглютаминовой кислоты, образуются производные 2(S),4(S),5(S),7(S)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноиламида, характеризующиеся высокой диастереоизомерной и энантиомерной чистотой.
Прежде всего настоящее изобретение относится к способу получения соединения формулы
где R1 означает галоген, C1-С6галогеналкил, C1-С6алкокси(C1-С6)алкилокси или C1-С6алкокси(C1-С6)алкил, R2 означает галоген, С1-С4алкил или С1-С4алкокси, R3 и R4 независимо означают разветвленный С3-С6алкил, R5 означает циклоалкил, C1-С6алкил, C1-С6гидроксиалкил, C1-С6алкокси(C1-С6)алкил, C1-С6алканоилокси(C1-С6)алкил, C1-С6аминоалкил, C1-С6алкиламино(C1-С6)алкил, C1-С6диалкиламино(C1-С6)алкил, C1-С6алканоиламино(C1-С6)алкил, НО(O)С(C1-С6)алкил, C1-С6алкил-O-(O)-С(C1-С6)алкил, H2N-С(O)(C1-С6)алкил, C1-С6алкил-HNC(O)(C1-С6)алкил или (C1-С6алкил)2N-С(O)(C1-С6)алкил или их фармацевтически приемлемых солей, причем указанный способ включает использование в качестве исходного соединения L-пироглютаминовой кислоты (последовательность реакций показана на схеме 1а).
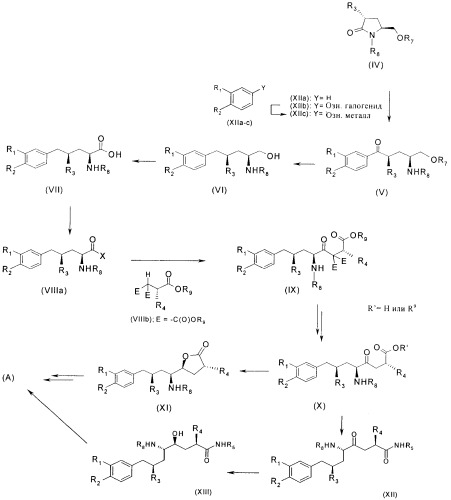
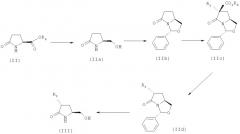
Схема 1а. Способ получения соединения формулы (А) из N- и O-защищенного 5-гидроксиметил-3-замещенного изопропилпирролидинона (IV).
Соединение (IV) получают из L-пироглютаминовой кислоты, с использованием незащищенного 5-гидроксиметил-3-замещенного изопропилпирролидинона (III), как показано в первых стадиях на схемах 1b и 1.
Таким образом, настоящее изобретение также относится к способу получения соединения формулы
где R1 означает галоген, С1-С6галогеналкил, C1-С6алкокси(C1-С6)алкилокси или C1-С6алкокси(C1-С6)алкил, R2 означает галоген, С1-С4алкил или С1-С4алкокси, R3 и R4 независимо означают разветвленный С3-С6алкил, R5 означает циклоалкил, C1-С6алкил, С1-С6гидроксиалкил, C1-С6алкокси(C1-С6)алкил, C1-С6алканоилокси(C1-С6)алкил, C1-С6аминоалкил, C1-С6алкиламино(C1-С6)алкил, C1-С6диалкиламино(C1-С6)алкил, C1-С6алканоиламино(C1-С6)алкил, НО(O)С(C1-С6)алкил, C1-С6алкил-O-(O)С(C1-С6)алкил, H2N-C(O)(C1-С6)алкил, C1-С6алкил-HNC(O)(C1-С6)алкил или (C1-С6алкил)2N-С(O)(C1-С6)алкил или их фармацевтически приемлемых солей, причем указанный способ включает использование в качестве исходного соединения L-пироглютаминовой кислоты (последовательность реакций показана на схеме 1b).
Схема 1b. Способ получения соединения формулы (А) из L-пироглютаминовой кислоты.
Настоящее изобретение также относится к способу получения соединения формулы
где R1 означает галоген, C1-С6галогеналкил, C1-С6алкокси(C1-С6)алкокси или C1-С6алкокси(C1-С6)алкил, R2 означает галоген, С1-С4алкил или С1-С4алкокси, R3 и R4 независимо означают разветвленный С3-С6алкил, R5 означает циклоалкил, C1-С6алкил, C1-С6гидроксиалкил, C1-С6алкокси(C1-С6)алкил, C1-С6алканоилокси(C1-С6)алкил, C1-С6аминоалкил, C1-С6алкиламино(C1-С6)алкил, C1-С6диалкиламино(C1-С6)алкил, C1-С6алканоиламино(C1-С6)алкил, НО(O)С(C1-С6)алкил, C1-С6алкил-O-(O)С(C1-С6)алкил, H2N-C(O)-C1-С6алкил, C1-С6алкил-HNC(O)(C1-С6)алкил или (C1-С6алкил)2N-С(O)(C1-С6)алкил или их фармацевтически приемлемых солей, причем указанный способ включает использование в качестве исходного соединения L-пироглютаминовой кислоты (последовательность реакций показана на схеме 1).
Схема 1. Способ получения соединения формулы (А) из L-пироглютаминовой кислоты.
В каждой схеме заместители имеют одинаковые значения, как описано для соединения формулы (А) или как описано ниже.
Соединения формулы (III), где R3 имеет значение, определенное для формулы (А), являются основными промежуточными соединениями по настоящему изобретению, в которых атомы углерода в положении 5 и 7 в соединении формулы (А) уже имеют требуемую стереохимическую конфигурацию.
Все соединения формулы (III), показанные на схемах 1b и 1, где R3 определен в данном контексте выше, получают с использованием на первой стадии этерификации L-пироглютаминовой кислоты по методикам, описанным в разделе Примеры, или по известным методикам, при этом получают соединения формулы (II), где R6 означает С1-С20алкил, С3-С12циклоалкил, С3-С12циклоалкил(С1-С6)алкил, С6-С10арил или С6-С10арил(С1-С6)алкил, более предпочтительно C1-С6алкил, еще более предпочтительно С1-С4алкил, наиболее предпочтительно метил или этил. Соединения формулы (II) затем превращают в соединения формулы (III) по реакциям, показанным ниже на схеме 2.
Схема 2. Превращение соединения формулы (II) в соединение формулы (III).
a) В соответствии со схемой 2 соединение (II), где R6 определен выше, восстанавливают, при этом получают соответствующий спирт (IIa).
Восстановление обычно проводят в присутствии комплекса боргидридов, таких как LiBH4 или NaBH4, и LiCl в пригодном растворителе, например ТГФ и т.п., смесь ТГФ и спирта, например EtOH, изо-PrOH и т.п., при этом получают соединение (IIa), по известному методу, см. 1a) M. Moloney и др., Tetrahedron, 52, (10), 3719 (1996).
b) Соединение (IIa) подвергают ацетализации в присутствии ароматического альдегида, при этом получают соединение формулы (IIb), где фенильное кольцо в структуре необязательно содержит один или более, например два или три, остатка, например, выбранных из группы, включающей С1-С7алкил, гидрокси, С1-С7алкокси, С2-С8алканоилокси, галоген, нитро, циано и CF3. Ацетализацию соединения формулы (IIa) предпочтительно проводят в присутствии бензальдегида или другого ароматического альдегида, как описано в литературе для соединения (IIb), см. 2а) М.Moloney и др., Tetrahedron, Asymmetry, 6, 337, (1995), 2b) M.Moloney и др., Tetrahedron, 52, (10), 3719 (1996).
c) Соединение (IIb) активируют карбоксилированием, а затем алкилируют с использованием электрофила R3-X, где Х означает уходящую группу, например галоген или сульфонилокси, а группа R3 определена в данном контексте выше, при этом получают соединение формулы (IIc), где фенильное кольцо в структуре необязательно содержит один или более, например два или три, остатка, например, выбранных из группы, включающей С1-С7алкил, гидрокси, С1-С7алкокси, С2-С8алканоилокси, галоген, нитро, циано и CF3. Предпочтительно активацию проводят при карбалкоксилировании, например карбометоксилировании или карбэтоксилировании, которое проводят при предварительной обработке соединения (IIb), например NaH в ТГФ или в смеси ТГФ/ДМФА и при дальнейшей обработке электрофильным агентом, например производным карбоната или фосгена, таким как Cl-СО-OR6. Группа R6 определена в данном контексте выше, и предпочтительно означает C1-С6алкил, более предпочтительно С1-С4алкил, наиболее предпочтительно метил или этил. Полученное промежуточное соединение затем депротонируют и алкилируют в присутствии электрофила, например R3-Х, где группа R3 определена в данном контексте выше, как описано, например, в статье М.Moloney и др., Tetrahedron, 52, (10), 3719 (1996), при этом получают соединение (IIc). Предпочтительным является алкилирование таких карбоалкоксиактивированных промежуточных соединений разветвленными вторичными алкилирующими агентами, такими как R-C-X-R'. Уходящая группа Х означает галоген, сульфонилокси и т.п.
d) В соединении (IIc) омыляют сложноэфирную группу, а затем декарбоксилируют, при этом получают соединение формулы (IId), где фенильное кольцо в структуре необязательно содержит один или более, например два или три, остатка, например, выбранных из группы, включающей С1-С7алкил, гидрокси, С1-С7алкокси, С2-С8алканоилокси, галоген, нитро, циано и CF3, а группа R3 определена в данном контексте. Омыление сложноэфирной группы в соединении формулы (IIc) предпочтительно проводят в водном растворе основания (NaOH), а затем подкисляют и декарбоксилируют, при этом получают соединение (IId), которое в некоторых случаях выделяют, см. статью 2b) выше.
е) Соединения (IId) деацетализируют или трансацетализируют, при этом получают соединение формулы (III), где группа R3 определена в данном контексте. Деацетализацию или трансацетализацию предпочтительно проводят при обработке безводной кислотой, например CF3COOH, HCl в толуоле или диоксане или при трансацетализации в присутствии в качестве катализатора кислоты и в присутствии спирта, при этом получают соединение (III). См. статью 2b) выше.
Соединения формулы (III), где R3 определен в данном контексте выше, превращают в соединения формулы (IV), где R7 означает O-защитную группу, такую как C1-С6алкил, C1-С6алкокси(C1-С6)алкокси, С6-С10арил(C1-С6)алкил, C1-С6алкоксикарбонил, С6-С10арил(C1-С6)алкоксикарбонил или (С1-С8алкил)3силил, a R8 означает N-защитную группу, такую как С6-С10арил(C1-С6)алкил, C1-С6алкилкарбонил, С6-С10арилкарбонил, C1-С6алкоксикарбонил, С6-С10арил(C1-С6)алкоксикарбонил, при этом в зависимости от природы группы R7 и R8 гидроксильные и аминогруппы защищают последовательно или одновременно. Обычно защиту функциональных групп проводят по стандартным методикам, как описано в литературе и в ссылках ниже.
В другом варианте на первой стадии (схема 1) соединение формулы (IV) получают из соединения формулы (I), показанного на схеме 1, по методике, показанной на схеме 1с.
Схема 1с. Способ получения соединения формулы (IV) из L-пироглютаминовой кислоты.
Этерификацию соединения формулы (I) в основном проводят по методике, описанной в данном контексте в разделе Примеры или по известным методикам, при этом получают соединения формулы (II), где R6 определен выше. В соединениях формулы (II) затем защищают атом N, при этом получают соединения формулы (IIe), где R8 означает N-защитную группу, как определено выше. Защиту функциональной группы обычно проводят по стандартным методикам, как описано в литературе ниже.
На следующей стадии соединение (IIe) превращают в соединение (IIf) по методикам, описанным в данном контексте в разделе Примеры, или по хорошо известным методикам. Таким образом, после образования аниона в положении 4 сложноэфирного кольца пироглютаминовой кислоты при обработке соединения IIe сильным основанием, например основанием лития, с последующей остановкой реакции ацетоном в присутствии кислоты Льюиса, получают промежуточный третичный спирт. Затем спиртовую группу превращают в уходящую группу при взаимодействии с пригодным электрофилом. После элиминирования получают требуемое соединение IIf, где R3, R6 и R8 определены выше. Метод описан в статье Hanessian S. и др., J. Org. Chem., 67, 4261 (2002).
Соединение (IIf) затем превращают в соединение (IIg), где R3 и R8 определены выше, при восстановлении сложноэфирного остатка до спирта по методикам, описанным в данном контексте в разделе Примеры или по известным методикам, обычно с использованием гидридов, таких как боргидрид лития.
Затем в соединениях формулы (IIg) защищают атом О, при этом получают соединения формулы (IV), где R7 означает O-защитную группу, как описано выше, а R3 и R8 определены выше, по методикам, описанным в данном контексте в разделе Примеры, или по известным методикам. Обычно функциональные группы защищают по стандартным методикам, как описано в ссылках ниже.
После получения соединений формулы (IV), предпочтительно по одной из вышеописанных методик, их превращают в соединения формулы (V). При взаимодействии с металлоорганическим соединением формулы (XIIc), где R1 и R2 определены при описании формулы (А), а Y означает, например, литий, или (XIIc) означает реактив Гриньяра, затем получают соединения формулы (V), где R1, R2, R3, R7 и R8 определены выше в данном контексте, которые также являются основными промежуточными соединениями для получения соединений формулы (А). Синтез обычно проводят, как описано в данном контексте в разделе Примеры или по известным методикам, см. статью в книге Houben-Weyl: том 4/1, с.370-386, Reduction I. После восстановления бензильной карбонильной группы по стандартным методикам, например, описанным в книге "Organicum, organisch-chemisches Grundpraktikum", 20-е издание, VEB Deutscher Verlag der Wissenschaften, Berlin, (1999), и последующего селективного удаления O-защитной группы получают соединения формулы (VI), где R1, R2, R3 и R8 определены выше в данном контексте. Эти реакции обычно проводят, как описано в данном контексте в разделе Примеры или по известным методикам, см., например, Th.W.Greene & P.G.Wuts, "Protective groups in Organic Synthesis", 2-е издание (1991), см. также Raney-Nickel-benzylic deoxygenation: Applied Catalysis A: General 218, c.281-289 (2001).
Соединения формулы (VI) затем окисляют до карбоновой кислоты формулы (VII), где R1, R2, R3 и R8 определены в данном контексте выше, по методикам, описанным в данном контексте в разделе Примеры, или по известным методикам, например, при обработке гипохлоритом натрия и TEMPO в присутствии межфазного катализатора, такого как Bu4NBr, см. а) статью F.Montanari и др., J.O.C., 54, 2970 (1989) и b) обзор: Н.Van Bekkum и др., Synthesis, 1153 (1996).
Карбоновые кислоты формулы (VII) сначала превращают в активированные производные формулы (VIIIa), где R1, R2, R3 и R8 определены в данном контексте выше, Х означает, например, галоген, такой как фтор или хлор, R10OC(O)O-, где R10 означает С1-С20алкил, С3-С12циклоалкил, С3-С12циклоалкил(C1-С6)алкил, С6-С10арил или С6-С10арил(C1-С6)алкил, Me(MeOH)N- или имидазолил, которые также являются основными промежуточными соединениями для получения соединений формулы (А). Обычно реакции проводят, как описано в данном контексте в разделе Примеры, или по известным методикам, см., например, А) использование хлорангидридов см. статьи a) R.W.Saalfrank и др., Angew. Chem., 102, 292 (1990) и Н.Boehme и др., Chem. Ber., 99, 879 (1996), b) Chem. Pharm. Bull., 13, 1472 (1965) и Synth. Commun., 30, 3439 (2000)
и Bull. Korean Chem. Soc., т.24, 895 (2003), В) использование фторангидридов, см. статью Tetrahedron Lett., 32, 10 1303 (1991), С) использование имидазолида, см. статьи R.V.Hoffman и др., J.O.C., 62, 2292 (1997) или R.V.Hoffman и др., J.O.C., 62, 6240 (1997) или R.V.Hoffman и др., J.O.C., 67, 1045 (2002) или R.V.Hoffman и др., Tetrahedron, 53, 7119 (1997) или см. статью J.Maibaum & D.Rich, J.O.C., 53, 869 (1998).
После конденсации с хиральным производным малоната формулы (VIIIb), где R4 определен при описании формулы (A), a R9 означает С1-С20алкил, С3-С12циклоалкил, С3-С12циклоалкил(C1-С6)алкил, С6-С10арил, С2-С20алкенил или С6-С10арил(C1-С6)алкил, предпочтительно C1-С6алкил или С6-С10арил(С1-С4)алкил, более предпочтительно С1-С4алкил или бензил, наиболее предпочтительно метил, этил, третбутил или бензил, получают соединения формулы (IX), где R1, R2, R3, R4, R5 и R9 определены в данном контексте выше. Эти реакции обычно проводят, как описано в данном контексте в разделе Примеры, или при использовании известных методов, см., например, статью Journ. Med. Chem., 41, 2461 (1998).
После отщепления сложного эфира и декарбоксилирования соединения (IX) получают соединения формулы (X), где R1, R2, R3, R4, R5 и R9 определены в данном контексте выше, которые также являются основными промежуточными соединениями для получения соединений формулы (А). Отщепление сложных эфиров обычно проводят в условиях гидролиза или гидрирования в случае бензилового эфира, по известным методикам. Декарбоксилирование обычно проводят, как описано в данном контексте в разделе Примеры или при использовании известных методик, см., например, J. Med. Chem., 41, 2461 (1998). Сложный эфир, т.е. соединение формулы (X), где R' означает R9, используют без дополнительной очистки на следующей стадии или, если необходимо, перед проведением следующей стадии соединение гидролизуют до соответствующей кислоты, где R' означает Н. Гидролиз проводят по известным методикам.
На следующей стадии в соединении формулы (X) стереоселективно восстанавливают карбонильную группу в положении С-4 и соединение циклизуют при обработке кислотой с образованием соединения формулы (XI), где R1, R2, R3, R4 и R8 определены выше в данном контексте. Стереоселективное восстановление обычно проводят, как описано в данном контексте в разделе Примеры или при использовании известных методик, см., например, статьи R.V.Hoffman и др., JOC, 67, 1045 (2002) и цитированную в данной статье литературу, R.V.Hoffman и др., JOC, 62, 2292 (1997) и Т.Ikariya и др., J.O.C., 69, 7391 (2004) и цитированную в данной статье литературу.
Хиральные производные малоната формулы (VIIIb), где R4 и R9 определены в данном контексте, используемые для превращения соединения (VIIIa), как описано выше, являются важными синтетическими фрагментами для получения ингибиторов ренина. Хиральные производные малоната формулы (VIIIb) получают из различных источников, например D-валина, где R4 означает пропил, как показано ниже на схеме 3. В этом случае R9 предпочтительно означает метил или этил. Данную методику используют для соединений, в которых R4 означает любой разветвленный С3-С6алкил.
Схема 3. Получение соединения (VIII'b), где R4 означает изопропил, с использованием D-валина в качестве исходного соединения.
D-валин превращают в D-2-гидроксиизовалериановую кислоту диазотированием в присутствии нитрита Na в водном растворе серной кислоты. В другом варианте D-2-гидроксиизовалериановую кислоту получают, например, на фирме Fluka или Aldrich. В соответствии с известной методикой (Tetrahedron, 46, 6623 (1990), J. Chem. Soc.; Perk. Trans. 1, 12, 1427 (1996), J. Org. Chem., 52, 4978 (1987)) кислоту этерифицируют в присутствии, например, карбоната калия и R9-X, например, Mel. На следующей стадии гидроксильную группу в сложном эфире D-2-гидроксиизовалериановой кислоты этерифицируют 4-нитробензолсульфонилхлоридом. Реакцию предпочтительно проводят в присутствии триэтиламина и каталитического количества ДМАР (диметиламинопиридина), при этом получают R-энантиомер. Затем сложный эфир сульфоновой кислоты или нозилат алкилируют в присутствии пригодного диэфира, например сложного эфира малоновой кислоты, при этом получают конечный триэфир.
В другом варианте соединения формулы (XI) получают из соединений формулы (VI) или (VII), причем соединения формулы (VI) или (VII) получают по любой из методик, описанных на схемах 1, 1a, 1b, 1с или 2 в отдельности или в комбинации. Этот способ описан ниже на схеме 4. На данной схеме для упрощения описания R4 в качестве примера означает изопропил. Однако на схеме 4 значение R4 не ограничено изопропилом и может означать любой разветвленный С3-С6алкил, как определено в данном контексте. Более того, хотя на схеме 4 для получения на следующей стадии соответствующего альдегида (XIV) приведена только методика с использованием спирта (VI), в другом варианте можно использовать кислоту (VII), при этом после этерификации кислоты и последующего восстановления с использованием DIBAL-H получают соответствующий альдегид (XIV).
Схема 4 Альтернативный вариант получения соединений формулы (XI) из спирта (VI):
Показанные на схеме 4 стадии подробно описаны ниже, а также в разделе Примеры.
Стадия А0. N-Boc-защищенный спирт (VI) селективно окисляют до соответствующего альдегида (XIV), где R1, R2, R3 и R8 определены выше. Обычно реакцию проводят при обработке отбеливателем в присутствии каталитического количества Tempo. Предпочтительно реакцию проводят при интенсивном перемешивании предпочтительно в двухфазной системе растворителей, например вода/толуол или вода/толуол/EtOAc. См. статью a) F.Montanari и др., J.O.C., 54, 2970 (1989) и b) обзор: Н. van Bekkum и др., Synthesis 1153 (1996).
Стадия А. К Вос-защищенному альдегиду (XIV) добавляют пригодный нуклеофил, например литиевую соль пропилового эфира, при этом получают ацетиленоаминоспирт формулы (XV), где R1, R2, R3, R8 и R9 определены в данном контексте. Реакцию обычно проводят в ТГФ при 78°С. Искомый ацетиленоаминоспирт (XV) обычно получают в виде смеси диастереомеров (S,S) и (S,R). Ацетиленовый аминоспирт используют без разделения в виде смеси 2 эпимеров.
Стадия В. Тройную связь в ацетиленоаминоспирте (XV) гидрируют, при этом получают насыщенный γ-гидроксиэфир (XVI), где R1, R2, R3, R8 и R9 определены в данном контексте. Превращение обычно проводят в смеси толуола и уксусной кислоты в присутствии оксида платины. Насыщенный γ-гидрокси эфир (XVI) используют без дальнейшей очистки.
Стадия С. Насыщенный γ-гидроксиэфир (XVI) подвергают лактонизации, при этом получают γ-лактон формулы (XVII), где R1, R2, R3 и R8 определены в данном контексте. Предпочтительно данную стадию проводят при обработке кислотой, например АсОН, предпочтительно в растворителе при повышенной температуре 50-150°С, например в горячем толуоле в течение 2 ч при 95-100°С.
Стадия D. В γ-лактоне формулы (XVII) удаляют N-защитную группу, при этом получают аминолактон формулы (XVIII), где R1, R2 и R3, определены в данном контексте. Данную стадию предпочтительно проводят при обработке безводной кислотой, например газообразным хлористым водородом в этилацетате, предпочтительно при комнатной температуре, при этом получают незащищенный δ-амино-γ-лактон, например, в виде гидрохлорида.
Стадия Е. Аминолактон формулы (XVIII) превращают в соответствующий пиперидинон формулы (XIX), где R1, R2 и R3 определены в данном контексте. Данную стадию предпочтительно проводят при обработке в растворителе, таком как метанол, например, при комнатной температуре, в течение, например, 24 ч в присутствии основания, такого как амин, например триэтиламин. Основание предпочтительно используют в избытке, при этом получают соответствующий пиперидон.
Стадия F. Гидроксильную и амино-группы в пиперидиноне формулы (XIX) защищают пригодной защитной группой, по известным методикам, при этом получают бис-защищенный пиперидинон формулы (XX), где R1, R2, R3, R7 и R8 определены в данном контексте. Предпочтительно пиперидон, полученный на стадии Е, обрабатывают в растворителе, таком как ТГФ, пригодным основанием, например амином, таким как триэтиламин, в присутствии катализатора, например N,N-диметиламинопиридина и карбоната, например дитретбутилдикарбоната, предпочтительно при комнатной температуре, при этом получают, например, бис-Вос-производное.
Стадия G. В пиперидиноновое кольцо бис-защищенного пиперидинона формулы (XX) вводят разветвленный алкил, включающий третичную гидроксильную группу, при этом получают гидроксилалкилзамещенное производное пиперидинона формулы (XXI), где R1, R2, R3, R7 и R8 определены в данном контексте. Обычно бис-Вос производное обрабатывают сильным основанием, таким как LiHDMS, для доставки енолята, например Li-енолята. Реакцию проводят в пригодном растворителе, например в ТГФ, предпочтительно при температуре ниже 0°С, предпочтительно при -78°С. Затем при указанной температуре енолят предпочтительно обрабатывают BF3-диэтиловым эфиром, а затем пригодным кетоном, например ацетоном, при этом после соответствующей обработки и перекристаллизации из гексана получают аддукт в виде кристаллического остатка.
Стадия Н. Гидроксилалкилзамещенное производное пиперидинона формулы (XXI) превращают в производное пиперидинона, содержащее двойную связь вне цикла, формулы (XXII), где R1, R2, R3, R7 и R8 определены в данном контексте выше. Предпочтительно третичный спирт обрабатывают в растворителе, например дихлорметане, основанием, например амином, таким как триэтиламин, а также метансульфонилхлоридом, при этом получают смесь «изопропилидена» и «пропилидена» (продукт XXII) в зависимости от природы группы R4. Реакцию проводят предпочтительно при температуре от -10 до 15°С, более предпочтительно при -5°С.
Стадия I. После изомеризации двойной связи, содержащейся вне цикла, производного пиперидинона формулы (XXII) получают олефин формулы (XIII), где R1, R2, R3, R7 и R8 определены в данном контексте. Предпочтительно раствор соединения пропенилидена (XXII) или подобного соединения в зависимости от природы группы R4 или смесь обоих соединений, полученную на стадии Н, обрабатывают основанием (например, NEt3 или DBU) в этилацетате при комнатной температуре для изомеризации двойной связи, при этом получают требуемое соединение изопропилидена.
Стадия J. Олефин формулы (XXIII) гидрируют, при этом получают алкилзамещенное производное пиперидинона формулы (XXIV), где R1, R2, R3, R7 и R8 определены в данном контексте. Предпочтительно олефин формулы (XXIII) гидрируют в пригодном растворителе, например в этилацетате, в присутствии небольшого количества основания, например амина, такого как триэтиламин, в присутствии Pt-C. Эту реакцию предпочтительно проводят при повышенной температуре и давлении или до полного завершения реакции. Предпочтительными являются температуры 30-70°С, например 50°С, и давление 2-10 бар, например 5 бар.
Стадия К. После раскрытия цикла в производном пиперидинона формулы (XXIV) в качестве промежуточного соединения получают γ-гидроксикислоту, которую лактонизируют, при этом получают соединение формулы (XI), где R1, R2, R3 и R8 определены в данном контексте. Предпочтительно соединение, полученное выше на стадии гидрирования, сначала обрабатывают основанием, например неорганическим основанием, таким как NaOH, при этом получают промежуточную γ-гидроксикислоту. Более предпочтительно используют водный раствор гидроксида натрия, например 2 н. раствор. Необязательно реакцию проводят в присутствии пригодных сорастворителей, например ТГФ. Предпочтительно используют межфазный катализатор (например, ТЕВА-Cl). Реакцию предпочтительно проводят при 20-60°С, более предпочтительно при 40°С. Полученную γ-гидроксикислоту, например, в форме натриевой соли, затем обрабатывают кислотой, например ледяной уксусной кислотой, при этом происходит лактонизация. Обычно используют избыток кислоты.
Наконец, соединения формулы (XI) превращают в соединения формулы (А), где R1, R2, R3, R4 и R5 определены в данном контексте выше, т.е. проводят остальные стадии синтеза, при этом используют условия реакций, описанные в данном контексте в разделе Примеры, или известные методики, см. ЕР-А-0678503. Более подробно после обработки амином H2NR5, где группа R5 определена выше в данном контексте, происходит раскрытие лактонового цикла в соединении формулы (XI), при этом образуется амид формулы (XIII). Реакцию обычно проводят, как описано в данном контексте в разделе Примеры или при использовании известных методик, см., например, ЕР-А-0678503. В конечном итоге соединения формулы (XIII) превращают в соединения формулы (А), где R1, R2, R3, R4 и R5 определены выше в данном контексте, с использованием следующих стадий: удаление N-защитной группы в соединении формулы (XIII), при этом получают свободный амин с использованием стандартных защитных групп и методик, описанных в статьях, указанных ниже, и необязательно образование солей, при этом получают соединения формулы (А), как описано в данном контексте в разделе Примеры. Обычные методы получения солей описаны, например, в патенте US-A-5559111. Конечные стадии показаны на схеме 5.
Схема 5. Конечные стадии получения соединения формулы (А) из соединения формулы (XI).
В другом варианте соединения формулы (X) получают, используя следующие стадии. Карбоксильная группа в соединении (X) взаимодействует с амином H2NR5, где R5 определен в данном контексте выше, в условиях конденсации пептидов, при этом образуется амид формулы (XII) согласно известным методикам, см., например, Houben-Weyl, Methoden der Organische Chemie, 4 издание, Synthese von Peptiden 1.
После соответствующего стереоселективного восстановления С-4 карбонильной группы в соединении формулы (XII) получают соединение формулы (XIII). См. R.V.Hoffman и др. JOC, 67, 1045 (2002) и цитированную литературу, R.V.Hoffman и др., JOC, 62, 2292 (1997), М.Т.Reetz и др., Chem. Commun. 1474 (1989). Наконец, соединения формулы (XIII) превращают в соединения формулы (А), где R1, R2, R3, R4 и R5 определены выше в данном контексте, для этого удаляют N-защитную группу в соединении (XIII) и получают свободный амин, используя стандартные защитные группы и описанные в цитированной в данном контексте литературе методики, и, необязательно, образование соли, при этом получают соединение формулы (А), в условиях реакции, описанных в данном контексте в разделе Примеры. Типичные методики образования солей описаны, например, в патенте US-A-5559111.
Другие объекты, признаки, преимущества и аспекты настоящего изобретения представляются очевидными специалистам в данной области после ознакомления с настоящим описанием, разделом Примеры и формулой изобретения. Следует понимать, однако, что предпочтительные варианты осуществления настоящего изобретения, представленные в описании и формуле изобретения, даны только для иллюстрации настоящего изобретения. Специалисту в данной области представляется очевидным, что возможны различные изменения и модификации настоящего изобретения, не выходя за пределы сущности и объема изобретения.
Ниже приведены определения различных терминов, использованных при описании соединений по настоящему изобретению. Эти определения применимы к терминам, использованным в данном контексте, если не указано иное в конкретных случаях в отношении отдельного термина или в составе группы. Каждое определение заместителя может быть объединено с любым другим определением другого заместителя, включая в обоих случаях предпочтительные значения.
R1 означает галоген, C1-С6галогеналкил, C1-С6алкокси(C1-С6)алкилокси или C1-С6алкокси(C1-С6)алкил. Предпочтительные варианты осуществления изобретения описаны ниже.
R2 означает галоген, С1-С4алкил или С1-С4алкокси.
Предпочтительные варианты осуществления изобретения описаны ниже.
R3 и R4 независимо означают разветвленный С3-С6алкил. Предпочтительные варианты осуществления изобретения описаны ниже.
R5 означает циклоалкил, С1-С6алкил, С1-С6гидроксиалкил, C1-С6алкокси(C1-С6)алкил, C1-С6алканоилокси(C1-С6)алкил, C1-С6аминоалкил, C1-С6алкиламино(C1-С6)алкил, C1-С6диалкиламино(C1-С6)алкил, C1-С6алканоиламино(C1-С6)алкил, НО(O)С(C1-С6)алкил, C1-С6алкил-O-(O)С(C1-С6)алкил, H2N-C(O)(C1-С6)алкил, C1-С6алкил-HNC(O)(C1-С6)алкил или (C1-С6алкил)2N-С(O)(C1-С6)алкил. Предпочтительные варианты осуществления изобретения описаны ниже.
R6 означает С1-С20алкил, С3-С12циклолкил, С3-С12циклолкил(C1-С6)алкил, С6-С10арил или С6-С10арил(C1-С6)алкил. Предпочтительные варианты осуществления изобретения описаны ниже.
R7 означает пригодную O-защитную группу, известную в данной области техники. Примеры таких групп включают С1-С6алкил, C1-С6алкокси(C1-С6)алкилокси, C6-С10арил(C1-С6)алкил, C1-С6алкоксикарбонил, С6-С10арил(C1-С6)алкоксикарбонил или (С1-С8алкил)3силил. Предпочтительные варианты осуществления изобретения описаны ниже.
R8 означает пригодную N-защитную группу, известную в данной области техники, например аминозащитную группу, используемую в химии пептидов (см. «Protective groups in Organic Synthesis», 5 издание, Ed. Т.W.Greene & P.G.M.Wuts), прежде всего для защиты пирролидинов.
Пригодные защитные группы включают, например, (1) С1-С2-алкил, моно-, ди- или тризамещенный фенилом, такой как бензил (или) бензгидрил или тритил, где фенильное кольцо незамещено или содержит в качестве заместителя один или более, например два или три остатка, например, выбранные из группы, включающей С1-С7алкил, гидрокси, С1-С7алкокси, С2-С8алканоилокси, галоген, нитро, циано и CF3, фенил(С1-С2)алкоксикарбонил, аллил или циннамил. Прежде всего предпочтительными являются бензилоксикарбонил (Cbz), 9-флуоренилметилоксикарбонил (Fmoc), бензилоксиметил (ВОМ), пивалоилоксиметил (РОМ), трихлорэтоксикарбонил (Troc), 1-адамантилоксикарбонил (Adoc), а также бензил, кумил, бензгидрил, тритил, аллил, аллок (аллилоксикарбонил). В качестве защитных групп используют также силил, например триалкилсилил, прежде всего триметилсилил, трет-бутилдиметилсилил, триэтилсилил, триизопропилсилил, триметилсилилэтоксиметил (SEM), а также замещеный сульфонил или замещенный сульфенил.
Примеры групп R8 включают С6-С10арил(C1-С6)алкил и С1-С6алкилкарбонил, С6-С10арилкарбонил, C1-С6алкоксикарбонил и С6-С10арил(C1-С6)алкоксикарбонил. Другие предпочтительные варианты осуществления изобретения описаны ниже.
R9 означает C1-С20алкил, С3-С12циклоалкил, С3-С12циклоалкил(C1-С6)алкил, С6-С10арил, С2-С20алкенил или С6-С10арил(С1-С6)алкил. В одном варианте осуществления R9 означает С1-С20алкил, С3-С12циклоалкил, С3-С12циклоалкил(C1-С6)алкил, С6-С10арил или С6-С10арил(C1-С6)алкил. Предпочтительные варианты осуществления изобретения описаны ниже.
Алкильные группы R1 и R2 являются линейными или разветвленными и предпочтительно включают от 1 до 6 атомов углерода, прежде всего от 1 до 4 атомов углерода. Примеры включают метил, этил, н- и изопропил, н-, изо- и третбутил, пентил и гексил.
Галогеналкил R1 является линейным или разветвленным и предпочтительно содержи