Способ получения ингибитора коллагеназы с противоопухолевым действием из гепатопанкреаса камчатского краба
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано при получении высокоочищенных и высокоактивных препаратов ингибиторов ферментов направленного действия, обладающих противоопухолевым действием. Способ предусматривает гомогенизацию сырья в 0,1 М ацетате аммония, содержащем 0,1-1 мМ ацетата кальция при рН 6,4-7,0. Полученный гомогенат центрифугируют с получением супернатанта. К полученному супернатанту добавляют сульфат аммония до 60-70%-ного насыщения. Отделяют осадок через 20 часов центрифугированием. Полученный осадок растворяют в дистиллированной воде с добавлением 0,1-1 мМ ацетата кальция до получения истинного раствора. Полученный раствор очищают и концентрируют на поливолоконной мембране с размером пор 100 кДа и двукратно промывают дистиллированной водой с последующим прогреванием концентрата до 60-100°С в течение 25 мин с получением осадка. Полученный осадок отделяют центрифугированием с получением суммарного препарата ингибитора в 0,05 М трисовом буфере с рН 7,0-8,0. Полученный суммарный препарат ингибитора хроматографируют на колонке с аффинным сорбентом - аргинин силохромом, с последующей элюцией активных ферментов трисовым буфером с добавлением 1 М NaCl и 20% изопропилового спирта. Фракцию, содержащую ингибитор, упаривают на роторном испарителе при 60-80°С в течение 40-60 мин и концентрируют ультрафильтрацией на мембране с размером пор 30-50 кДа с получением концентрата. Полученный концентрат, содержащий целевой продукт, промывают 0,01 М раствором хлористого натрия и лиофильно высушивают с получением целевого продукта. Изобретение позволяет расширить ассортимент препаратов, обладающих противоопухолевым действием. 5 табл., 2 ил.
Реферат
Изобретение относится к биотехнологии, в частности к получению высокоочищенных и высокоактивных препаратов ингибиторов ферментов направленного действия, которые могут быть использованы в медицине, ветеринарии, биохимии, а также для исследовательских целей.
Ингибиторы протеолитических ферментов успешно используются в медицине для лечения пациентов с острыми воспалительными нарушениями типа септического шока и панкреатита. Механизм действия ингибиторов заключается в подавлении избыточной активности протеолитических ферментов, которое обнаруживается при воспалительных процессах, а также при усиленном делении клеток в опухолевом процессе. Известно, что матриксные коллагеназы и цистеиновые протеиназы активно участвуют в процессе канцерогенеза. Наиболее физиологичный способ - применение соответствующих ингибиторов, однако как коллагеназы, так и коллагенолитические ферменты устойчивы к действию известных ингибиторов. Поэтому необходим поиск новых противоопухолевых средств.
Одним из наиболее перспективных в современной медицине является противоопухолевый протеосомный ингибитор бортезомиб. Бортезомиб вызвал каспазозависимый апоптоз в клеточных линиях ретинобластомы при клинически возможных концентрациях. Клинические испытания бортезомиба подтвердили его перспективность при действии на множественную миелому. Однако при исследовании данного препарата на пациентах с метастатическим раком простаты было показано, что применение препарата самостоятельно не дает необходимых результатов, в связи с чем препарат рекомендован к применению с другими противоопухолевыми препаратами. (Morris MJ., Kelly W.K., Slovin S., Ryan C., Eicher C., Heller G., Scher H.I., J. Urol. 2007, 178, 2378-2383).
Более того, противоопухолевый препарат бортезомиб является ингибитором сериновых протеиназ, производных фенил-борной кислоты. Это весьма токсичное соединение, получаемое сложным химическим синтезом с применением взрывоопасного реактива Гриньяра, а заметная токсичность его ограничивает возможность увеличения дозирования при лечении им пациентов.
Известен биопрепарат на основе животной ткани для лечения подкожной фибросаркомы, содержащий кровь акулы и консервант в виде лимоннокислого калия в определенных соотношениях. Указанное средство получают путем извлечения непосредственно из сердца акулы 195-202,5 мл крови, далее добавляют от 47,5 до 55,0 мл лимоннокислого натрия, после чего выдерживают 8-14 месяцев в темноте при температуре от 8-10°С.
Недостатком этого способа является труднодоступное сырье. Как известно, акулы обитают в теплых морях и океанах и в морях России редко встречаются и не являются промысловым видом.
[Патент РФ №2019180, А61К 35/14, опубл. 15.09.1994 г.]
Известен противоопухолевый препарат, выделенный из плавников акулы, состоящий, главным образом, из лиофилизированного осадка или фракции надосадочной жидкости, полученных после центрифугирования водного гомогената целого хряща акулы. Полученный препарат обладает антиангиогенной, непосредственной противоопухолевопролиферирующей, антивоспалительной и антиколлагенолитической активностями. Способ получения его включает:
стадию дробления хряща вместе с соответствующим объемом воды, стадию гомогенизации смеси хрящ/вода с максимальной скоростью при температуре около 4°С, но не выше 10°C, в течение от 10 минут до 24 час в смесителе-дезинтеграторе до размера частиц около 500 мкм, полученный гомогенат центрифугировали при 13600×g в течение 15 мин при 4°С для отделения надосадочной жидкости от осадка. Полученный осадок лиофилизовали в течение 24-48 час для получения твердого экстракта, а надосадочную жидкость фильтровали на фильтре Whatman 24 мкм и подвергали ультрафильтрации при 4°С в фильтрационной колонке с тангенциальным потоком и с пористостью около 500000 дальтон. Полученный пермеат (или жидкий экстракт) с мол. массой от 0 до 500 кДа далее стерилизовали. Лиофилизат и жидкий экстракт имеют предположительный состав, включающий липиды, протеины, натрий, калий, кальций, магний и в следовых количествах - цинк и железо.
Противоопухолевая активность препарата определялась in vitro на гормонально зависимых раковых клеточных линиях. Дозы лиофилизата - 50 и 100 мг/мл четко провоцировали ингибирование роста клеток уже после трех дней обработки.
[Патент РФ №2157695 (WO 96/23512), А61К 35/60, опубл. 20.10.00 г.]
Недостатком указанного способа является труднодоступность сырья, т.к. акулы обитают в теплых морях и океанах, в морях России встречается только один непромысловый вид - катран, сложность получения препарата, очень большие дозы препарата, необходимые для подавления роста клеток и плохая растворимость препарата.
Наиболее близким является способ получения ингибитора коллагеназ из гепатопанкреаса камчатского краба, включающий гомогенизацию сырья, содержащего протеолитические ферменты, способ характеризуется проведением гомогенизации сырья в 0,1 М ацетате аммония, содержащем 0,1-1 мМ ацетата кальция при рН 6,4-7,0, гомогенат затем центрифугируют, к супернатанту добавляют сульфат аммония до 60-70% насыщения, полученный комплекс ферментов отделяют центрифугированием, растворяют последний в дистиллированной воде с добавлением 0,1-1 мМ ацетата кальция до получения истинного раствора с последующей очисткой, концентрированием и обессоливанием ферментов на поливолоконной мембране с размером пор 100 кДа и промывкой концентрата, содержащего ингибитор коллагеназы дистиллированной водой, с последующим прогреванием до 60-100°С, отделением осадка центрифугированием и лиофильным высушиванием. Способ позволяет получить эндогенный ингибитор коллагенолитических ферментов из доступного сырья достаточно экономичным образом, однако получаемый препарат не обладает противоопухолевой активностью.
[Патент РФ №2292393, C12N 9/64, опубл. 10.08.2007.]
Задачей изобретения является расширение ассортимента препаратов, обладающих противоопухолевым действием, полученных из доступного сырья.
Поставленная задача решается тем, что способ получения ингибитора коллагеназы с противоопухолевым действием из гепатопанкреаса камчатского краба характеризуется проведением гомогенизации сырья в 0,1 М ацетате аммония, содержащем 0,1-1 мМ ацетата кальция при рН 6,4-7,0, гомогенат центрифугируют, к супернатанту добавляют сульфат аммония до 60-70%-ного насыщения, полученный комплекс ферментов отделяют центрифугированием, растворяют последний в дистиллированной воде с добавлением 0,1-1 мМ ацетата кальция до получения истинного раствора с последующей очисткой, концентрированием и обессоливанием ферментов на поливолоконной мембране с размером пор 100 кДа и промывкой концентрата, содержащего ингибитор коллагеназы, дистиллированной водой с последующим прогреванием до 60-100°С, отделением осадка центрифугированием, полученный при этом суммарный препарат ингибитора коллагеназы подвергают дополнительному растворению в 0,05 М трисовом буфере с рН 7,0-8,0 и хроматографируют на колонке с аффинным сорбентом - аргинин силохромом, с последующей элюцией активных ферментов трисовым буфером с добавлением 1 М NaCl и 20% изопропилового спирта, фракцию, содержащую ингибитор, упаривают на роторном испарителе при 60-80°С и концентрируют ультрафильтрацией на мембране с размером пор 30-50 кДа, концентрат, содержащий целевой продукт, промывают раствором хлористого натрия и лиофильно высушивают.
Целесообразно фракцию, содержащую ингибитор, упаривать в течение 40-60 мин, а целевой продукт промывать 0,01М раствором хлористого натрия.
Гепатопанкреас крабов, особенно камчатского краба, является источником протеолитических ферментов, в том числе и коллагеназ, способных образовывать комплексы с эндогенным ингибитором, коллагенолитические ферменты гепатопанкреаса краба относятся к особому семейству ферментов - брахиуринам. Это сериновые протеиназы, совмещающие в себе свойства трипсина и химотрипсина, поэтому ингибиторы металлопротеиназ на них не действуют. Гепатопанкреас является доступным, дешевым и нетоксичным сырьем для получения ферментных препаратов.
Сущность предлагаемого способа заключается в следующем. В качестве источника ингибитора коллагеназы используют гепатопанкреас промысловых видов краба, который гомогенизируют и выделяют комплекс коллагеназ и коллагенолитических ферментов с ингибитором в соответствии со способом, заявленным в патенте РФ №2292393. Исследование методом гель-фильтрации на Сефадексе G-100 полученного суммарного препарата показало его неоднородность. Препарат содержит высокомолекулярные и низкомолекулярные ингибиторы коллагеназ.
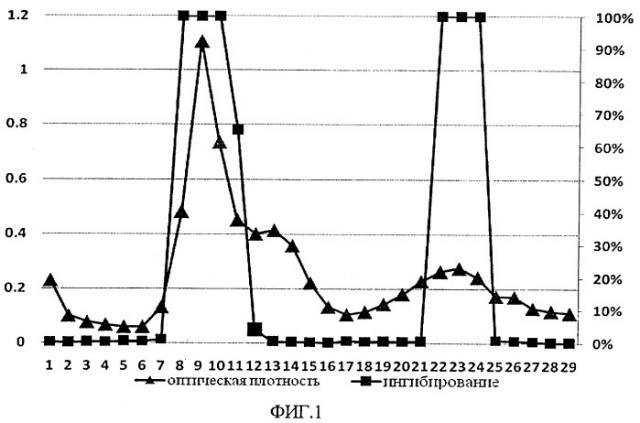
На фиг.1 представлены кривые гель-фильтрации на Сефадексе G-100 суммарного препарата ингибитора коллагеназы. Первый пик содержит высокомолекулярный ингибитор 67 кДа, а второй пик содержит низкомолекулярные ингибиторы 5-25 кДа.
В таблице 1 представлены данные исследования активности высокомолекулярной и низкомолекулярной белковой фракции суммарного ингибитора из гепатопанкреаса краба. Для этого была приготовлена свежетрипсинизированная клеточная взвесь: с поверхности маточного флакона клетки снимали с помощью смеси равных частей 0,25% трипсина и 0,0002% раствора Версена (ЭДТА). Ингибиторы добавляли ех tempora в соответствии с протоколом опыта. Учет роста клеток проводили каждый день в течение 7 суток. При использованной концентрации клеток полный монослой (слой клеток, покрывающий 100% поверхности флакона) должен сформироваться на 3-4 сутки. Использовали концентрацию ингибиторов 10 мг/л.
Как видно из таблицы 1, высокомолекулярный ингибитор препятствует образованию монослоя опухолевых клеток, а низкомолекулярные ингибиторы противоопухолевой активностью не обладают.
Выделение высокомолекулярной белковой фракции, исследование его противоопухолевого действия, токсического действия ингибитора представлены в нижеприведенных примерах и таблицах.
Пример 1.
20 кг гепатопанкреаса гомогенизируют в 0,1 М ацетате аммония рН 6,4, содержащем 0,3 мМ ацетата кальция, затем осадок отделяют центрифугированием при 10000 об/мин, к супернатанту добавляют сульфат аммония 60-70% насыщения и через 20 часов снова центрифугируют. Полученный осадок (сульфат-паста) растворяют в 15 л дистиллированной воды с добавлением 0,1 мМ ацетата кальция воды до получения истинного раствора, объем доводят до 100 л и тщательно перемешивают. Концентрирование раствора проводят на мембранном аппарате для микрофильтрации PELLICON, "Millipore" с размером пор 100 кДа. Концентрат объемом 10 л доводят дистиллированной водой до 50 л и снова концентрируют до 10 л. Эту процедуру проводят еще два раза. Супернатант, содержащий целевой продукт, прогревают при 80°С в течение 25 мин, удаляют образовавшийся осадок центрифугированием (12000 g, 7 мин), а раствор высушивают на сублимационной сушке TG-50, Германия. Выход суммарного препарата ингибитора составляет 56 г.
500 мг суммарного препарата ингибитора растворяют в 0,05 М трисовом буфере с рН 8,0 и наносят на колонку с аффинным сорбентом аргинин силохромом. Колонку промывают тем же буфером, а затем элюирующим раствором, содержащим 1 М Nad на том же буфере и 20% изопропилового спирта. Фракцию 1, содержащую ингибитор, упаривают на роторном испарителе при 60-80°С в течение 40 мин.
Концентрирование раствора проводят ультрафильтрацией на мембране "Millipore" с размером пор 30 кДа. Концентрат, содержащий целевой продукт, промывают 0,01 М NaCl и лиофильно высушивают. Выход препарата - 250 мг.
Ингибитор обладает наибольшей активностью при температуре 15°С и сохраняет 90% активности при 15-22°С в течение 180 мин. При повышении температуры до 50° и выше полностью теряет активность уже через 90 мин. Константа ингибирования гомогенной сериновой коллагенолитической протеиназы гепатопанкреаса камчатского краба составляет 3,1×10-7 М.
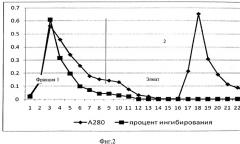
На фиг.2 представлена аффинная хроматограмма исходного суммарного препарата ингибитора на колонке с аминосилохромом. Ингибитор не связывается с сорбентом и обнаруживается во фракции 1 («проскок»). Коллагеназы имеют большое сродство к аргинину и прочно удерживаются сорбентом, элюируются только солевым буфером с добавлением 20% изопропилового спирта (фракция 2).
В таблице 2 приведены данные действия ингибитора на активность различных протеиназ, где % I - процент ингибирования, I/Nf - молярное соотношение ингибитора и фермента в реакционной смеси.
Исследования противоопухолевого действия высокомолекулярного ингибитора проводились в Институте полимиэлита и вирусных энцефалитов им. М.П.Чумакова РАМН на перевиваемой культуре клеток рабдомиосаркомы человека и представлено данными примеров 2, 3 и в таблицах 3, 4.
Пример 2
Клетки выращивались на поверхности пластиковых флаконов площадью 25 см2. Для роста клеток использовалась среда ИГЛА-МЭМ50 мл с добавлением глютамина и антибиотиков, а также эмбриональной телячьей сыворотки. В свежеприготовленную клеточную взвесь добавляли ингибитор в разных концентрациях. Без добавления ингибитора слой клеток полностью покрывает поверхность флакона на 3-4 сутки.
Результаты экспериментов с ингибитором приведены в таблице 3.
Пример 3.
Использовалась свежетрипсинизированная клеточная взвесь. С поверхности маточного флакона клетки снимали с помощью смеси равных частей 0,25% трипсина и 0,0002% раствора Версена (ЭДТА). Ингибиторы добавляли ex tempora в соответствии с протоколом опыта. Учет роста клеток проводили каждый день в течение 7 суток. При использованной концентрации клеток полный монослой (слой клеток, покрывающий 100% поверхности флакона) должен сформироваться на 3-4 сутки. В отличие от опыта 2 ингибитор добавляли не в суспензию клеток, а на сформировавшийся монослой. Кроме культуры RD использовали клетки Нер-2 (Cincinnati), происходящие из эпидермоидной карциномы человека. Результаты эксперимента представлены в таблице 4.
Таким образом, выделенный высокомолекулярный ингибитор в испытанных концентрациях оказывает ингибирующее действие на рост опухолевых клеток, а низкомолекулярные ингибиторы оказались неактивными даже в высоких концентрациях.
Токсикологическое действие ингибитора представлено данными примеров 4, 5 и таблицы 5.
Пример 4.
Для определения токсичности ингибитора использовали культуры нормальных клеток фибробласты линии NIH 3т3. Фибробласты рассажены на двенадцатилуночную плашку в концентрации 50000 клеток/мл. Одновременно с рассадкой добавлены концентрации ингибиторов. Через 24 часа во всех лунках наблюдали монослой клеток. Токсического эффекта не было нигде в течение 4 суток. На 5 сутки клетки сползли с субстрата из-за перероста.
Пример 5
Для определения токсичности ингибитора использовали фибробластоподобные клетки, полученные из подкожного жира человека (мезенхимальные стволовые клетки - МСК). Препараты ингибитора разводили в среде ДМЕМ без добавления сыворотки в концентрации 5 мг/мл и фильтровали через фильтр 0.22 мкм для обеспечения стерильности. Клетки рассевали в 24-луночное плато (50000 клеток/лунку) и затем в лунки добавляли препарат в различных концентрациях.
Для определения жизнеспособности клеток их окрашивали «витальным красителем» и под люминесцентным микроскопом смотрели (если надо, считали) процент погибших клеток. Если в клеточной суспензии процент погибших клеток не превышал 5%, то считали, что нет токсического эффекта.
Таким образом, предлагаемый способ позволяет получить неизвестный ранее эндогенный ингибитор коллагенолитических ферментов с противоопухолевым действием из гепатопанкреаса камчатского краба достаточно экономичным образом. Препарат выделяется из доступного природного сырья. Гепатопанкреас является отходом краболовецкого промысла, и утилизация внутренностей краба способствует улучшению экологии в районе крабоперерабатывающих заводов. Суммарный препарат ингибитора получают как побочный продукт в технологии получения препарата коллагеназы камчатского краба. Проведение ультрафильтрации на мембране с размером пор 30-59 кДа позволяет удалять низкомолекулярные примеси и низкомолекулярные ингибиторы, не обладающие противоопухолевой активностью, полностью сохраняя ингибитор, осуществить концентрирование препарата на том же аппарате, что приводит к получению концентрированных растворов, время высушивания которых значительно сокращается.
Известно, что применяемые в настоящее время, как правило, импортные противоопухолевые средства токсичны и имеют высокую стоимость. Ингибиторы камчатского краба обладают широким спектром действия на протеолитические ферменты различных классов и широким спектром действия на ферментные системы быстрорастущих опухолевых клеток.
Ингибитор не действует на фибробласты здоровых людей, что свидетельствует об отсутствии токсичности препарата.
| Таблица 1 | ||||
| Время опытаКонцентрация ингибиторов | 24 ч | 48 ч | 72 ч | 7 суток |
| Высокомолекулярный ингибитор | Клетки не прикрепились | Клетки не прикрепились | Клетки не прикрепились | Гибель клеток |
| Низкомолекулярные ингибиторы | Рост клеток ~50% поверхности флакона + бакт. рост | Рост клеток ~75% поверхности флакона + бакт. рост | Рост клеток ~75% поверхности флакона + бакт. рост | Бактериальный рост Плесень |
| Контроль культуры клеток без ингибитора | Рост клеток ~50% поверхности флакона | Рост клеток ~75% поверхности флакона | Рост клеток ~100% поверхности флакона | Рост клеток ~100% поверхности флакона |
| Таблица 2 | |||
| Протеиназа | Субстрат | % I | NI/Nf |
| тромбин | Z-Ala-Phe-Arg-pNa | 23,6% | 3 |
| трипсин | Bz-Arg-pNa | 50,7% | 3 |
| 64% | 5 | ||
| химотрипсин | Ac-Phe-pNa | 43,0% | 5 |
| глутамил-эндопептидаза | Z-Glu-pNa | 0 | 5 |
| субтилизин | Z-Ala-Ala-Leu-pNa | 10,0% | 5 |
| 25,8% | 10 | ||
| совиназа | Glp-Ala-Ala-Leu-pNa | 92% | 10 |
| папаин | Glp-Phe-Ala-pNa | 77,3% | 19 |
| морикраза | Glp-Ala-Ala-Leu-pNa | 27% | 52 |
| Таблица 3 | ||||
| Концентрация ингибитора, мг/мл | 24 ч | 48 ч | 72 ч | Седьмой день |
| 100 | Клетки не прикрепились | Сморщенные клетки, напоминают дегенерацию «4+» | Гибель клеток | Гибель клеток |
| 2,5 | 30% клеток прикрепились | Тот же эффект 4+ | Гибель клеток | Гибель клеток |
| 1,0 | 30% клеток прикрепились | Тот же эффект 4= | Сморщенные клетки | Гибель клеток |
| 0,5 | 60% клеток прикрепились | Тот же эффект 4+ | Сморщенные клетки | Гибель клеток |
| 0,25 | 60% клеток прикрепились | Тот же эффект 4+ | Сморщенные клетки | Гибель клеток |
| Контроль без ингибитора | 80% клеток прикрепились | 80% монослой | 100% монослой | 100% живых клеток в монослое |
| Таблица 4 | ||||
| Концентрация ингибитора, мг/мл | 24 ч | 48 ч | 72 ч | 7 дней |
| Высокомолекулярный ингибитор 0,25 мг/мл, RD | Изменений нет | Клетки округляются | Клетки сползли со стенок флакона | Гибель клеток |
| 0,25; Нер-2 | Изменений нет | Изменений нет | Клетки округляются | Клетки сползли |
| Низкомолекулярный ингибитор 2,5 мг/мл, RD | Изменений нет | Изменений нет | Изменений нет | |
| 5,0 мг/мл, НЕР-2 | Изменений нет | Изменений нет | Изменений нет | |
| 5,0 мг/мл, RD | Изменений нет | Изменений нет | Изменений нет | |
| 5,0 мг/мл НЕР-2 | Изменений нет | Изменений нет | Изменений нет |
| Таблица 5 | |||
| Концентрации препаратов | Время инкубации с препаратами | ||
| 24 часа | 48 часов | 72 часа | |
| Контроль | Все клетки распласт. 60% монослой | Клетки распласт. 100% монослой | Клетки распласт. Перерост монослой |
| 0,1 мг/мл | Все клетки распласт. 60% монослой | Клетки распласт. 100% монослой | Клетки распласт. переросший монослой |
| 0,25 мг/мл | Все клетки распласт. 60% монослой | Клетки распласт. 100% монослой | Клетки распласт. переросший монослой |
Способ получения ингибитора коллагеназы с противоопухолевым действием из гепатопанкреаса камчатского краба, предусматривающий гомогенизацию сырья в 0,1 М ацетате аммония, содержащем 0,1-1 мМ ацетата кальция при рН 6,4-7,0, центрифугирование гомогената с получением супернатанта, добавление к супернатанту сульфата аммония до 60-70%-ного насыщения, отделение осадка через 20 ч центрифугированием, растворение осадка в дистиллированной воде с добавлением 0,1-1 мМ ацетата кальция до получения истинного раствора, очистку и концентрирование на поливолоконной мембране с размером пор 100 кДа, двукратную промывку дистиллированной водой с последующим прогреванием супернатанта до 60-100°С в течение 25 мин, отделение осадка центрифугированием, растворение полученного суммарного препарата ингибитора в 0,05 М трисовом буфере с рН 7,0-8,0, хроматографию на колонке с аффинным сорбентом - аргинин силохромом с последующей элюцией активных ферментов трисовым буфером с добавлением 1М NaCl и 20% изопропилового спирта, упаривание фракции, содержащей ингибитор на роторном испарителе при 60-80°С в течение 40- 60 мин, концентрирование ультрафильтрацией на мембране с размером пор 30-50 кДа, промывание концентрата, содержащего целевой продукт, 0,01 М раствором хлористого натрия и лиофильное высушивание с получением целевого продукта.