Оксазолидиноновые производные, способ их получения (варианты) и фармацевтическая композиция на их основе
Иллюстрации
Показать всеНастоящее изобретение относится к оксазолидиноновым производным, охватываемым общей структурной формулой (I) и их фармацевтически приемлемым солям. В формуле (I)
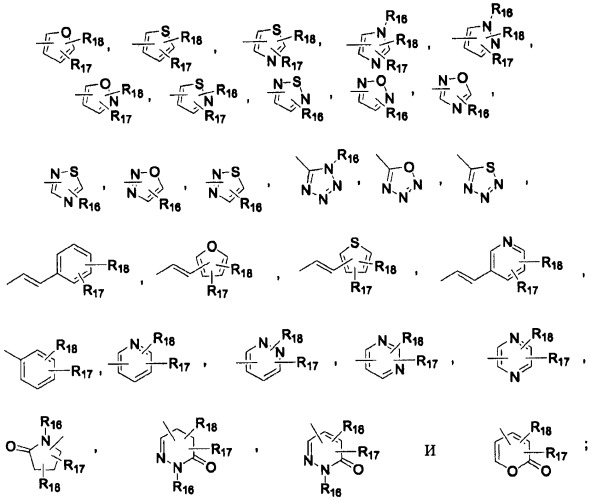
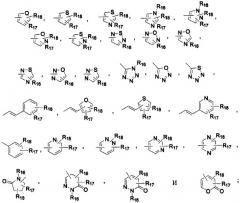
R1, R2, R3 и R4 независимо друг от друга выбраны из группы, включающей -Н и галоген; А выбран из группы, включающей , , , ,
R5 и R6 независимо друг от друга выбраны из группы, включающей -Н, -F, -Cl, -Br, -ОН, алкил(С1-С6), галогеналкил(С1-С6), алкоксигруппу(С1-С6); R7 выбран из группы, включающей -Н, алкил(С1-С6); или R7 и R5 или R6, совместно взятые, образуют цикл из 2 атомов углерода и включают 1 группу, выбранную из О, который, в свою очередь, может быть замещен одним заместителем, выбранным из алкила(С1-С6); R12 выбран из группы, включающей -Н, -COR14, -CSR14, -COOR14; R14 выбран из группы, включающей алкил(С1-С6), циклоалкил(С3-С6), алкенил(С2-С6),
, , , , , , , ,
R16, R17 и R18 представляют собой -Н; R21 выбран из группы, включающей -Н, алкил(С1-С6); Х выбран из группы, включающей О, S, и Y выбран из группы, включающей О, S, SO, SO2, и NR12; и при этом необязательные заместители алкильных(С1-С6) групп могут представлять собой одну или две группы, выбранные из нижеследующих: -OR21, -CN. Изобретение также относится к способам получения соединений изобретения, к применению оксазолидиноновых производных для получения лекарственного средства для лечения бактериальных инфекций и к фармацевтической композиции для лечения бактериальных инфекций, включающей терапевтически эффективное количество соединения изобретения. 7 н. и 29 з.п. ф-лы, 10 табл.
Реферат
Изобретение относится к оксазолидиноновым антимикробным производным соединениям, которые активны в отношении грамположительных и некоторых грамотрицательных бактерий при слабой активности ингибирования моноаминоксидазы (МАО).
Уровень техники
Оксазолидиноны выделяются среди новых антимикробных агентов, направленных на грамположительные организмы, которые в настоящее время становятся доступными. Оксазолидиноны связываются с 50S-субъединицей прокариотической рибосомы, препятствуя формированию комплекса инициации синтеза белка. Это представляет собой новый механизм действия. Другие ингибиторы синтеза белка либо блокируют удлинение полипептида, либо вызывают ошибочное считывание мРНК. Линезолид (N-[[(5S)-3-[3-фтор-4-(4-морфолинил)фенил]-2-оксо-5-оксазолидинил]метил]ацетамид) является первым одобренным антимикробным оксазолидиноном, предназначенным для клинического применения в Соединенных Штатах Америки и за их пределами.
Минимальные ингибирующие концентрации (МИК) линезолида незначительно варьируют в зависимости от способа тестирования, лаборатории и значения, приписываемого некоторым неясностям, связанным с выживаемостью бактерий, но все исследователи обнаруживают, что распределение чувствительности является узким и однородным при значениях МИК от 0,5 до 4 мкг/мл для стрептококков, энтерококков и стафилококков. Полная активность сохраняется в отношении грамположительных кокков, устойчивых к другим антибиотикам, включая метициллинустойчивые стафилококки и ванкомицинустойчивые энтерококки. МИК составляют 2-8 мкг/мл для Moxarella, Pasteurella и Bacteroides spp., но другие грамотрицательные бактерии являются устойчивыми в результате активности эндогенного эффлюкса, а также поглощения, осуществляемого наружной мембраной клетки грамотрицательной бактерии.
Линезолид показан для лечения взрослых пациентов со следующими инфекциями:
внутрибольничная пневмония, вызываемая Staphylococcus aureus (метициллинчувствительные и -устойчивые штаммы) или Streptococcus pneumoniae (включая штаммы с множественной лекарственной устойчивостью [MDRSP]). MDRSP относится к изолятам, устойчивым к двум или более следующих антибиотиков: пенициллинам, цефалоспоринам второго поколения, макролидам, тетрациклинам и триметоприму/сульфаметоксазолу;
осложненные инфекции кожи и кожных структур, включая диабетические инфекции стоп без сопутствующего остеомиелита, вызываемого Staphylococcus aureus (метициллинчувствительные и -устойчивые штаммы), Streptococcus pyogenes или Streptococcus agalactiae;
неосложненные инфекции кожи и кожных структур, вызываемые Staphylococcus aureus (только метициллин-чувствительные) или Streptococcus pyogenes;
ванкомицинустойчивые инфекции Enterococcus faecium, включая случаи с сопутствующей бактериемией, и
внебольничная пневмония, вызываемая Streptococcus pneumoniae (включая штаммы с множественной лекарственной устойчивостью [MDRSP]), также в случаях с сопутствующей бактериемией или вызываемая Staphylococcus aureus (только метициллинчувствительные штаммы).
Оксазолидиноны исходно разрабатывали как ингибиторы МАО для лечения депрессии и болезни Паркинсона. МАО представляет собой один из основных ферментов, чувствительных к катаболизму катехоламинов. У человека МАО существует в двух изоформах, МАО-А и МАО-В. МАО-А преимущественно дезаминирует серотонин (5-НТ) и норэпинефрин; МАО-В преимущественно дезаминирует фенилэтиламин, бензиламин и допамин у мужчин. Обычно ингибиторы МАО-А, такие как моклобемид или транилципромин, использовали как антидепрессанты, тогда как ингибиторы МАО-В, такие как селегилин, использовали предпочтительно в терапии болезни Паркинсона. Патент США 3655687 раскрывает производные 5-гидроксиметил-3-замещенного-2-оксазолидинона с существенной антидепрессивной активностью. Конкретно ссылаются на соединение, раскрытое в данном патенте, толоксатон, 5-(гидроксиметил)-3-(3-метилфенил)-2-оксазолидинон.
Толоксатон представляет собой избирательный обратимый ингибитор МАО-А и введен в клиническую практику. По данной причине особое внимание уделяют вопросу, имеется ли доказательство вредного взаимодействия с лекарственными препаратами, которые, как известно, метаболизируются моноаминоксидазой, у пациентов, которых лечат линезолидом. У пациентов, принимающих ряд адренергическихагентов, в том числе фенилпропаноламин и псевдоэфедрин, наблюдают ответ в виде повышения давления и специально отмечают, что у пациентов, получающих линезолид, дозы данных лекарственных препаратов следует уменьшить. Исследования на животных позволяют предположить, что линезолид умерен но потенцирует эффекты повышения давления эндогенного и пищевого амина, тирамина и других симпатомиметических аминов. Вкладыш в упаковку для линезолида предупреждает в отношении его сочетания с богатыми тирамином пищевыми продуктами и информирует о потенциальном взаимодействии с адренергическими и серотонергическими агентами. Соответственно существует потребность в новых оксазолидиноновых антимикробных соединениях с минимальной активностью ингибирования МАО с целью исключения соответствующих побочных эффектов потенциальных взаимодействий типа лекарственный препарат - лекарственный препарат.
Получение линезолида раскрыто в заявке РСТ WO 9507271.
Заявка РСТ WO 03084534 раскрывает способ лечения диабетической инфекции стоп оксазолидинонами, особенно 3-{4-[1-(2,3-дигидроксипропионил)-1,2,3,6-тетрагидропиридин-4-ил]-3,5-дифторфенил}-5-(изоксазол-3-илоксиметил)-оксазолидин-2-оном; 2,2-дифтор-N-({(5S)-3-[3-фтор-4-(4-гликолоил-пиперазин-1-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил} метил) этантиоамидом и линезолидом.
Заявка РСТ WO 03063862 раскрывает способ лечения нуждающегося в этом пациента оксазолидиноном путем введения эффективного количества оксазолидинона и эффективного количества по меньшей мере одного витамина, выбранный из группы, состоящей из витамина В2, витамина В6, витамина В12 и фолиевой кислоты.
Патентные заявки DE 10105989 и US 2003/0153610 раскрывают получение N-((2-оксо-3-фенил-1,3-оксазолидин-5-ил)-метил)-гетероциклических амидов и их применение для ингибирования свертывания крови in vitro, особенно консервированной крови или биологических образцов, включающих фактор Ха. Гетероциклические амиды, раскрытые в US 2003/0153610, ограничены тиениламидами, тогда как DE 10105989 сосредоточена на N-[[3-[(4-замещенных)-фенил]-2-оксо-5-оксазолидинил]-метил]-амидах с заместителями, включающими либо оксо-, либо N-оксидную группу. Более того, данные документы не описывают ни антибактериальную, ни ингибирующую МАО активность.
WO 04007489 описывает ряд оксазолидиноновых производных, обладающих антибактериальной активностью в отношении грамположительных и грамотрицательных бактерий. В данной патентной заявке указан ряд ограничений, которые появились во время клинического исследования и применения линезолида и потенциальных представителей его класса. Показано, что данный класс соединений имеет потенциальную способность индуцировать миелосупрессию с последующей тромбоцитопенией и что ингибирование моноаминоксидазы оксазолидинонами подсказало клиницистам рекомендовать применение представителей данного класса с осторожностью во время сопутствующего применения адренергических или серотонергических агентов и избирательных ингибиторов повторного всасывания серотонина.
WO 04089944 описывает некоторые замещенные фенилоксазолидиноны, которые представляют собой эффективные антимикробные агенты против ряда человеческих и ветеринарных патогенов, включая грамположительные аэробные бактерии, а также анаэробные организмы. В данном документе отсутствуют упоминания об активности ингибирования моноаминоксидазы.
Таким образом, очевидно, что, несмотря на все предпринятые в прошлом попытки исследований, остается потребность в поиске новых эффективных антибактериальных агентов, имеющих более низкие побочные эффекты, чем известные в области техники.
Раскрытие изобретения
Авторы изобретения обнаружили, что соединения класса, раскрытого в настоящей заявке, представляют собой особенно активные антимикробные агенты, проявляющие слабую активность ингибирования МАО, которая предполагает существенное снижение соответствующих побочных эффектов, обусловленных потенциальными взаимодействиями типа лекарственный препарат - лекарственный препарат. Это является неожиданным, поскольку ингибирование моноаминоксидазы оксазолидинонами, как известно, дает ряд побочных эффектов и, вследствие этого, компетентный специалист не стал бы искать антибактериальные агенты с низкими побочными эффектами или их отсутствием среди оксазолидиноновых производных. Более того, соединения, соответствующие настоящему изобретению, проявляют избирательную активность в отношении бактерий Staphylococcus по сравнению с бактериями Enterococcus, что представляет собой ценное свойство при лечении заболеваний, при которых требуется специальный антибиотик против инфекций Staphylococcus, таких как внебольничный метициллинустойчивый Staphylococcus aureus (CA-MRSA), которые приобретают положение в сообществе и, по-видимому, продвигаются к эпидемическим уровням в США согласно данным последних исследований.
В целом настоящее изобретение представляет факты, свидетельствующие о том, что новые соединения N-[[(3-[4-замещенный фенил]-2-оксо-5-оксазолидинил]метил]-амина обладают специфической активностью в отношении грамположительных человеческих и ветеринарных патогенов со слабой активностью ингибирования моноаминоксидазы.
Настоящее изобретение описывает новый класс оксазолидиноновых производных соединений, охватываемых общей структурной формулой (I):
или их фармацевтически приемлемой соли, где A, R1 R2, R3 и R4, X и Y определены ниже, которые представляют собой антибактериальные агенты, специфически активные в отношении грамположительных и ряда грамотрицательных человеческих и ветеринарных патогенов со слабой активностью ингибирования моноаминоксидазы (МАО).
Другим объектом данного изобретения является разработка синтетических способов получения указанных производных. Другой объект данного изобретения относится к применению соединений формулы (I) или их фармацевтически приемлемых солей для получения лекарственного средства для лечения бактериальных инфекций у млекопитающего, в том числе человека. Последний аспект можно альтернативно сформулировать как способ лечения млекопитающего, в том числе человека, страдающего от бактериальной инфекции, посредством введения терапевтически эффективного количества соединений формулы (I) или их фармацевтически приемлемых солей.
Осуществление изобретения
Настоящее изобретение относится к новым оксазолидиноновым соединениям формулы (I):
где R1 R2, R3 и R4 независимо друг от друга выбраны из -Н и галогена; А выбран из группы, состоящей из
R5 и R6 независимо друг от друга выбраны из группы, состоящей из -Н, -F, -Cl, -Br, -ОН, -NO2, -CN, -CF3, -COR8, -CSR8, -SO2R8, -OCOR8, алкила(С1-С6), галогеналкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(С1-С6), алкокси(С1-С6)алкила(С1-С6), -N-R21R22 и Т; или R5 и R6, совместно взятые, образуют бензо-, пиридо-, фуро-, тиено-, оксазоло-, изоксазоло-, тиазоло-, изотиазоло-, пирроло-, пиразоло- или имидазослитую группу, при этом указанные слитые группы, в свою очередь, могут быть замещены одним, двумя или тремя заместителями, выбранными из группы, состоящей из -F, -Cl, -Br, -ОН, -NO2, -CN, -CF3, -COR8, -CSR8, -SO2R8, -OCOR8, алкила(С1-С6), галогеналкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(С1-С6), алкокси(С1-С6)алкила(С1-С6) и -N-R21R22, или слитого цикла, выбранного из циклопенто-, циклогексо-, циклогепто-, метилендиокси- и этилендиоксигруппы, при этом указанный слитый цикл, в свою очередь, может быть замещен одним, двумя или тремя заместителями, выбранными из группы, включающей алкил(С1-С6), циклоалкил(С3-С6), алкенил(С2-С6) и алкинил(С2-С6);
R7 выбран из группы, состоящей из -Н, необязательно замещенного алкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(C1-С6), -N-R21R22 и Т; или R7 и R5 или R6, совместно взятые, образуют, когда это возможно, цикл из 2-6 атомов углерода и включает 1-3 группы, выбранные из О, N, S, SO и SO2, которые, в свою очередь, могут быть замещены одним, двумя или тремя заместителями, выбранными из группы, состоящей из алкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6) и алкинила(С2-С6);
R8 выбран из группы, состоящей из -Н, алкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(C1-С6), алкокси(С1-С6)алкила(С1-С6), гидроксиалкила(С1-С6), -N-R21R22 и Т;
R9 и R10 независимо друг от друга выбраны из группы, состоящей из -Н, -CN, -NO2, -COR11, -SO2R11, алкила(С1-С6), галогеналкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(С1-С6), алкокси(С1-С6)алкила(С1-С6), -N-R21R22 и Т;
R11 выбран из группы, состоящей из -Н, -ОН, алкила(С1-С6), галогеналкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкокси(С1-С6)алкила(С1-С6) и Т;
R12 и R13 независимо друг от друга выбраны из группы, состоящей из -H, -OH, -CHR14R15, -CN, -COR14, CSR14, -COOR14, -CSOR14, -CONR14R15, -CSNR14R15, -CON(R16)N(R14)R15, -SO2R14, -SO2OR14, -SO2NR14R15, алкила(С1-С6), галогеналкила(С3-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкенила(С2-С6), алкинила(С2-С6), алкокси(С1-С6)алкила(С1-С6) и Т;
R14 и R15 независимо друг от друга выбраны из группы, состоящей из -Н, -ОН, -COR16, -CSR16, -SO2R16, -NR17R18, необязательно замещенного алкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(С1-С6), фенила,
R16 представляет собой -Н, -ОН, алкил(С1-С6), циклоалкил(С3-С6), алкенил(С2-С6), алкинил(С2-С6), алкоксигруппу (С1-С6), алкокси(С1-С6)-алкил(С1-С6), гидроксиалкил(С1-С6) и Т;
R17 и R18 независимо друг от друга выбраны из группы, состоящей из -Н, -ОН, -F, -Cl, -Br, -NO2, -CN, -NR19R20, -COR19, -CONR19R20, -SO2R19, -SO2NR19R20, необязательно замещенного алкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(С1-С6) и Т; или R17 и R18, совместно взятые, образуют бензослитую группу, которая, в свою очередь, может быть замещенной одним, двумя или тремя заместителями, выбранными из группы, состоящей из -F, -Cl, -Br, -ОН, -NO2, -CN, -CF3, -COR8, -CSR8, -SO2R8, -OCOR8, алкила(С1-С6), галогеналкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(C1-С6), алкокси(С1-С6)алкила(С1-С6) и -N-R21R22 или слитый цикл выбран из циклопенто-, циклогексо-, циклогепто-, метилендиокси- и этилендиоксигруппы, причем указанный слитый цикл, в свою очередь, может быть замещен одним, двумя или тремя заместителями, выбранными из группы, состоящей из алкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6) и салкинила(С2-С6);
R19 и R20 независимо друг от друга выбраны из группы, состоящей из -Н, -ОН, необязательно замещенного алкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(С1-С6) и Т;
R21 и R22 независимо друг от друга выбраны из -Н, алкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6) и Т, указанные -N-R21R22 группы могут представлять собой гетероциклическое кольцо, выбранное из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, необязательно N-замещенных алкилом(С1-С6), циклоалкилом(С3-С6), алкенилом(С2-С6) или алкинилом(С2-С6), морфолинилом, тиоморфолинилом, тиоморфолинил-S-оксидом и тиоморфолинил-S-диоксидом;
Т представляет собой фенильную или гетероарильную группу, каждая из которых является необязательно замещенной, при этом гетероарил выбран из группы, состоящей из пиридина, пиридазина, пиримидина, пиразина, фурана, тиофена, оксазола, тиазола, имидазола, пиразола, изоксазола, изотиазола, 1,2,5-тиадиазола, фуразана, 1,2,4-оксадиазола, 1,2,4-тиадиазола, 1,2,3-оксадиазола, 1,2,3-тиадиазола, тетразола, 1,2,3,4-оксатриазола и 1,2,3,4-тиатриазола, причем заместители, необязательно присутствующие на необязательно замещенном фениле или необязательно замещенной гетероарильной группе, могут представлять собой один, два или три заместителя, выбранных из группы, состоящей из -F, -Cl, -Br, -ОН, -NH2, -NO2, -CN, -CF3, -COR8, -CSR8, -SO2R8, -OCOR8, алкила(С1-С6), галогеналкила(С1-С6), циклоалкила(С3-С6), алкенила(С2-С6), алкинила(С2-С6), алкоксигруппы(C1-C6), алкокси(С1-С6)алкила(С1-С6), NH-алкила(C1-C6), NH-циклоалкила(C3-C6), -N-диалкила(C1-C6), -N- (алкил(C1-C6))(циклоалкила(C3-C6)), метилендиоксигруппы, этилендиоксигруппы и гетероциклического кольца, выбранного из группы, состоящей из пирролидинила, пиперидинила, пиперазинила, необязательно N-замещенного алкилом(С1-С6), циклоалкилом(С3-С6), алкенилом(С2-С6) или алкинилом(С2-С6), морфолинилом, тиоморфолинилом, тиоморфолинил S-оксидом и тиоморфолинил S-диоксидом;
X выбран из O, S, NR9 и CR9R10 и
Y выбран из О, S, SO, SO2, NO, NR12 и CR12R13;
при этом необязательные заместители алкильных (С1-С6) групп могут представлять собой одну, две или три группы, выбранные из нижеследующих: -F, -Cl, -NO2, -OR21, -COR21, -N-R21R12, оксогруппа, циклоалкил(С3-С6), алкенил(С2-С6), алкинил(С2-С6), -CN, Т, -COO-R21, -OCOR21, -CON-R21R22, -N(R21)-CO-R22, -OCON-R21R22, и -N(R21)-COO-R22;
или его фармацевтически приемлемую соль.
Предпочтительно, когда настоящее изобретение относится к новым оксазолидинонам формулы (I), где R1 представляет собой -F; каждый из R2, R3 и R4 представляют собой -Н; X означает O, S и N-CN; Y означает O, S, SO, SO2 и NR12; А представляет собой хинолиновую группу, выбранную из
, и
где каждый из R5 и R6 представляет собой - Н; или R5 означает метил и R6 означает метоксигруппу; либо R5 и R6 выбраны из группы, состоящей из -F, -Cl и -Br; и R12 выбран из группы, состоящей из -Н, метила, этила, -CN, -COCH2CN, -СОСН3, -СООСН3, -CONHCH3, -SO2CH3, -SOCH3, -SO2NHCH3,
, ,
, ,
, и
где R13 выбран из группы, состоящей из -Н, метила, этила, изопропила, трет-бутила, -СН2ОН, -CH2NH2, -СООН, - СООСН3, -СООС2Н5, -CH2Cl, -CONH2, -СН2-СН=СН2, -СН2-С≡СН, - СН=СН2, -С≡СН и -CH=CHN(CH3)2.
Термин "фармацевтически приемлемые соли", используемый в данном контексте, охватывает любую соль, образованную из органических и неорганических кислот, таких как бромистоводородная, хлористоводородная, фосфорная, азотная, серная, уксусная, адипиновая, аспарагиновая, бензолсульфоновая, бензойная, лимонная, этансульфоновая, муравьиная, фумаровая, глутаминовая, молочная, малеиновая, яблочная, малоновая, миндальная, метансульфоновая, 1,5-нафталиндисульфоновая, щавелевая, пивалоновая, пропионовая, п-толуолсульфоновая, янтарная, винная кислоты и т.п.
Соединения представляют собой подходящие антимикробные агенты, эффективные в отношении ряда микроорганизмов, поражающих человека и животных. Пример 43 иллюстрирует, что соединения, соответствующие настоящему изобретению, проявляют слабую активность ингибирования МАО, которая указывает на то, что данные соединения обладают способностью минимизировать или исключать потенциальные взаимодействия типа лекарственный препарат - лекарственный препарат, поскольку сильное ингибирование моноаминооксидазы может привести в результате к измененным скоростям клиренса для других соединений, в норме метаболизируемых моноаминоксидазой, в том числе для некоторых фармацевтических препаратов. Кроме того, особенно важно избежать повышенных уровней нейтромедиаторных аминов, таких как допамин, серотонин и норадреналин.
Пример 43 иллюстрирует также, что соединения, соответствующие настоящему изобретению, проявляют избирательную активность в отношении бактерий Staphylococcus по сравнению с бактериями Enterococcus. Данное свойство ясно показано теми соединениями, соответствующими настоящему изобретению, которые включают структуру хинолинового типа, в противоположность тем соединениям, которые включают другие гетероциклы, такие как описаны в WO 04089944. Например, соединение, соответствующее примеру 34 настоящего изобретения, в 100 раз более активно в отношении Staphylococcus, чем Enterococcus. Избирательность является ценным свойством при лечении заболеваний, при которых требуется специфическая антибиотикотерапия Staphylococcus. Среди них инфекции, вызываемые S. aureus, такие как фурункулез, целлюлит, пиемия, пневмония, остеомиелит, эндокардит, нагноение ран и пищевые отравления; инфекции, вызываемые S. epidermidis, такие как маленькие болезненные абсцессы и другие кожные раны, которые имеют место на зараженной паразитами коже и слизистых оболочках человека и других животных; S. hycius, такие как болезнь жирных свиней; S.pyogenes albus и S. pyogenes aureus. Вследствие этого данные соединения представляют собой подходящие антимикробные агенты, эффективные в отношении ряда человеческих и ветеринарных микроорганизмов, обладающие преимуществами относительно известных в уровне техники.
Предпочтительные соединения являются энантиомерами, имеющими S-конфигурацию в положении С-5 оксазолидинонового цикла.
Предпочтительными соединениями, соответствующими настоящему изобретению, являются:
(а) 7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4'-ацетил-4-пиперазинил)-фенил]-2-оксо-5-оксазолидинил]метил]-3-хинолинкарбоксамид, формулы:
(b) 7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4-морфолинил)-фенил]-2-оксо-5-оксазолидинил] метил]-3-хинолинкарбоксамид формулы:
(с) 7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4-тиоморфолинил)-фенил]-2-оксо-5-оксазолидинил]метил]-3-хинолинкарбоксамид формулы:
(d) 7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4'-тиоацетил-4-пиперазинил)-фенил]-2-оксо-5-оксазолидинил]метил]-3-хинолинкарбоситиоамид формулы:
Соединения общей формулы (I) можно получить рядом различных способов в зависимости от природы функциональных групп
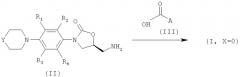
а) Получение амидных соединений (I, X=О):
Формально амиды получают путем реакции аминометильного промежуточного соединения общей формулы (II) с активированной формой соответствующей кислоты формулы (III):
где A, R1, R2, R3, R4 и Y определены выше. Активированная форма кислоты (III) выбрана из группы, состоящей из кислых галогенидов, имидазолидов п-нитрофениловых сложных эфиров кислоты и их 2,4,5-трихлорфениловых сложных эфиров. Другие активированные формы кислоты (III) получают in situ в присутствии реагента, выбранного из группы, включающей трифенилфосфин, бромтрихлорметан, дициклогексилкарбодиимид, катион 2-хлорпиридиния, катион 3-хлоризоксазолия, дифенилфосфорилазид, N-гидроксибензотриазол, 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат, 1-мезитилен-2-сульфонил)-3-нитро-1Н-1,2,4-триазол, бензотриазол-1-ил-окситриспирролидинофосфоний гексафторфосфат, 1-этил-3-(3'-диметиламинопропил)карбодиимид гидрохлорид и 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний тетрафторборат.
b) Получение тиоамидных соединений (I, X=S):
Получение тиоамидных соединений (I, X=S) из соответствующих амидных соединений (I, X=О) можно осуществить с помощью ряда тионирующих реагентов, выбранных из:
,
, ,
, и
Предпочтительным тионирующим реагентом является соединение (IVi), известное как реагент Лоуссона.
Иным образом тиоамидные соединения можно получить конденсацией соответствующего аминометильного производного (II) с алкилдитиоамидом (IIIi):
где А такое, как определено в общей формуле (I) и R представляет собой алкил(С1-С6).
с) Получение сульфоксидных соединений (I, Y=SO):
Получение сульфоксидных соединений (I, Y=SO) можно осуществить
из соответствующих соединений общей формулы (I, Y=S) с помощью ряда окисляющих реагентов, выбранных из группы, состоящей из метаперйодата натрия, гипервалентных йодных реагентов, хромовой кислоты в уксусной кислоте, хромовой кислоты в пиридине, тетраацетата свинца, диоксида марганца, нитрата таллия (III) и озона и т.п., предпочтительно метаперйодата натрия.
d) Получение сульфоновых соединений (I, Y=SO2):
Получение сульфоновых соединений (I, Y=SO2) из соответствующего сульфида (I, Y=S) можно осуществить с помощью ряда окисляющих реагентов, таких как избыток пероксида водорода в уксусной кислоте и каталитический тетраоксид осмия в присутствии N-метилморфолин N-оксида. Избыток пероксида водорода в уксусной кислоте является предпочтительным.
е) Получение цианоамидиновых соединений (I, X=N-CN):
Цианоамидиновые соединения (I, X=N-CN) синтезируют путем
взаимодействия соответствующего аминометильного производного (II) с цианоимидатом общей формулы (V):
где А такое, как определено в общей формуле (I), и R представляет собой алкил(С1-С6).
Ряд аминометильных промежуточных соединений общей формулы (II) известен в области техники и может быть получен согласно способам, описанным в литературе. Так, заявка РСТ WO 9507271 раскрывает получение N-[[(5S)-3-[3-фтор-4-(4-морфолинил)-фенил]-2-оксо-5-оксазолидинил]-метил]амина (II, R1=F, R2=R3=R4=Н, Y=О), заявка РСТ WO 9854161 раскрывает получение N-[[(5S)-3-[3-фтор-4-(4-тиоморфолинил)-фенил]-2-оксо-5-оксазолидинил]метил]амина (II, R1=F, R2=R3=R4=H, Y=S) и заявка PCT WO 0032599 раскрывает получение N-[[(5S)-3-[3-фтор-4-(4'-ацетил-4-пиперазинил)-фенил]-2-оксо-5-оксазолидинил]метил]амина (II, R1=F, R2=R3=R4=Н, Y=CH3-CON). Заявка PCT WO 04/018439 раскрывает получение (S)-N-[3-[3фтор-4-[N-t-бутоксикарбонилпиперазин-1-ил]-фенил]-2-ксооксазолидин-5-илметил]азида и (S)-[3-[3-фтор-4-[N-t-бутоксикарбонилпиперазин-1-ил]фенил]-2-охооксазолидин-5-илметилового]спирта.
Соединения, соответствующие настоящему изобретению, можно, как правило, получить в соответствии со стандартной фармацевтической практикой в виде фармацевтической композиции.
Другой аспект изобретения относится к фармацевтической композиции, включающей терапевтически эффективное количество соединения общей формулы (I), как определено выше, совместно с подходящими количествами фармацевтических наполнителей или носителей.
Фармацевтические композиции, соответствующие настоящему изобретению, можно вводить стандартным способом в соответствии с состоянием болезни, которую требуется лечить, например, путем перорального, парентерального, ингаляционного, ректального, трансдермального или местного введения. Для данных целей соединения, соответствующие данному изобретению, могут быть изготовлены с помощью средств, известных в области техники, в форме, например, таблеток, капсул, сиропов, водных или масляных растворов или суспензий, эмульсий, диспергирующихся порошков, ингаляционных растворов, суппозиториев, мазей, кремов, капель и стерильных водных или масляных растворов или суспензий для инъекций и т.п. Фармацевтические композиции могут включать вкусовые добавки, подсластители и т.п. в подходящих твердых или жидких носителях или разбавителях или в подходящих стерильных средах с образованием суспензий или растворов, пригодных для внутривенной, подкожной или внутримышечной инъекции. Данные композиции, как правило, включают от 1 до 40 мас.%, предпочтительно 1-10 мас.% активного соединения, остальная часть композиции представляет собой фармацевтически приемлемые носители, разбавители, растворители и т.п.
Соединения формулы (I) вводят в количестве 0,1-100 мг/кг массы тела/день, предпочтительно 1-50 мг/кг массы тела/день.
Соединения, соответствующие настоящему изобретению, используют при лечении состояний, таких как внутрибольничная пневмония, внебольничная пневмония, вызываемые метициллинустойчивым Staphylococcus aureus (MRSA), включая сопутствующую бактериемию, пневмонию, вызываемую пенициллинустойчивыми и чувствительными стрептококками, диабетические инфекции стоп и инфекции кожи и кожных структур и все другие инфекции, вызываемые бактериями, чувствительными к соединениям, описанным в изобретении. Соединения, соответствующие настоящему изобретению, эффективны в отношении ряда патогенов человека и животных, клинических изолятов, включая ванкомицинустойчивые организмы и метициллинустойчивые организмы.
Следующие неограничивающие примеры иллюстрируют объем настоящего изобретения.
Примеры:
Некоторые сокращения, используемые в данном контексте, определяют следующим образом: "DCM" означает дихлорметан, "DMAP" означает 4-(диметиламино) пиридин, "ДМСО" означает диметилсульфоксид, "EDCI" означает 3-диметиламинопропил-3-этилкарбодиимид гидрохлорид, "ESI" означает электорспрей ионизация, "HOBt" означает N-гидроксибензотриазол, "ВЭЖХ" означает высокоэффективная жидкостная хроматография, "MS" означат масс-спектроскопия и "ТСХ" означает тонкослойная хроматография.
Пример 1
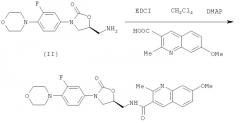
7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4-морфолинил)-фенил]-2-оксо-5-оксазолидинил]метил]-3-хинолинкарбоксамид
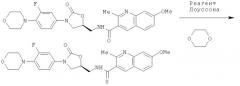
Раствор 110 мг (1,5 экв.) 7-метокси-2-метилхинолин-3-карбоновой кислоты, 21 мг (0,5 экв.) DMAP и 97 мг 1-этил-3-(3'-диметиламинопропил)-карбодиимид гидрохлорида (1,5 экв.) в 5 мл DCM перемешивают при комнатной температуре под аргоном в течение 30 минут. Затем добавляют 100 мг (1 экв.) N-[[(5S)-3-[3-фтор-4-(4-морфолинил)-фенил]-2-оксо-5-оксазолидинил]метил] амина в 5 мл DCM и продолжают перемешивание в течение 12 часов, когда наблюдают полное превращение исходного амина с помощью ТСХ. Неочищенную смесь промывают 5% раствором НОАс, насыщенным NaHCO3 и солевым раствором. Объединенные органические слои сушат (MgSO4) и концентрируют в вакууме, получая 173 мг титульного продукта (Выход = 95%).
Данные 1Н ЯМР-спектроскопии (400 МГц, δ, промиль, CDCl3): 2,75 (3Н, s),3,03 (4Н, m), 3,85 (4Н, m), 3,9 (m, 3Н), 3,94 (3Н, s), 4,13 (1Н, t, J=9,2 Гц), 4,92 (1Н, m), 6,52 (1Н, t, NH), 6,89 (1Н, t, J=8,8 Гц), 7,09 (1Н, dd, J=2,4, 8,4 Гц), 7,17 (1Н, dd, J=2,8, 9,2 Гц), 7,33 (1Н, d, J=2,4 Гц), 7,46 (1Н, dd, J=2,8, 14,4 Гц), 7,61 (1Н, d, J=9,2 Гц), 8,0 (1Н, s).
ВЭЖХ (t, %): 8,9 мин, 99%.
MC (ESI) m/z=495 (М+1)
Пример 2
7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4-тиоморфолинил)-фенил]-2-оксо-5-оксазолидинил]метил]-3-хинолинкарбоксамид
Соединение получают, следуя той же процедуре, что в примере 1, начиная от 370 мг 7-метокси-2-метилхинолин-3-карбоновой кислоты и 350 мг N-[[(5S)-3-[3-фтор-4-(4-тиоморфолинил)-фенил]-2-оксо-5-оксазолидинил]метил]амина. После аналогичной обработки получают 244 мг соединения, соответствующего требуемому 7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4-тиоморфолинил)-фенил]-2-оксо-5-оксазолидинил]-метил]-3-хинолинкарбоксамиду (Выход = 43%).
Данные 1Н ЯМР-спектроскопии (400 МГц, δ, промиль, CDCl3): 2,69 (3Н, s), 2,78 (4Н, m), 2,23 (4Н, m), 3,86 (m, 3Н), 3,90 (3Н, s), 4,05 (1Н, t, J=8,8 Гц), 4,88 (1Н, m), 6,82 (1Н, t, J=8,8 Гц), 6,97 (1Н, т), 7,07 (1Н, dd, J=2,4, 8,8 Гц), 7,31 (1Н, dd, J=3,2, 14 Гц), 7,34 (1Н, d, J=2 Гц), 7,49 (2Н, d, J=8,8 Гц), 8,0 (1Н, s).
ВЭЖХ (t, %): 12,0 мин, 99%.
MC (ESI) m/z=511 (М+1)
Пример 3
7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4'-ацетил-4-пиперазинил)-фенил]-2-оксо-5-оксазолидинил]метил]-3-хинолинкарбоксамид
Соединение получают, следуя той же процедуре, что в примере 1, начиная от 190 мг (1,5 экв.) 7-метокси-2-метилхинолин-3-карбоновой кислоты и 200 мг (1 экв.) N-[[(5S)-3-[3-фтор-4-(4'-ацетил-4-пиперазинил)-фенил]-2-оксо-5-оксазолидинил]метил]амина. После аналогичной обработки получают 120 мг соединения, соответствующего требуемому 7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4'-ацетил-4-пиперазинил)-фенил]-2-оксо-5-оксазолидинил]метил]-3-хинолинкарбоксамиду (Выход = 38%).
Данные 1Н ЯМР-спектроскопии (400 МГц., δ, промиль, CDCl3): 2,69 (3Н, s), 2,91 (2Н, m), 2,98 (2Н, m), 3,57 (2Н, m), 3,70 (2Н, гл), 3,86 (3Н, гл), 3,89 (3Н, s), 4,07 (1Н, t, J=8,8 Гц), 4,88 (1Н, m), 6,79 (1Н, t, J=9,2 Гц), 6,99 (1Н, m), 7,08 (1Н, dd, J=2, 8,8 Гц), 7,36 (2Н, m), 7,50 (1Н, d, J=9,2 Гц), 7,59 (1Н, m), 8,0 (1Н, s).
ВЭЖХ (t, %): 7,9 мин, 98%.
MC (ESI) m/z=511 (М+1).
Пример 4
7-метокси-2-метил-N-[[(5S)-3-[3-фтор-4-(4-морфолинил)-фенил]-2-оксо-5-оксазолидинил]метил]-3-хинолинкарбокситиоамид
Раствор 50 мг N-[[(5S)-3-[3-фтор-4-(4-морфолинил)-фенил]-2-оксо-5-оксазолидинил]метил]-7-метокси-2-метилхинолин-3-ил-амида, 123 мг (3 экв.) реагента Лоуссона в 4 мл 1,4-диоксана нагревают при 65°С в течение 3 часов и при 100°С в течение 1 часа. Растворитель удаляют при пониженном давлении, и сырец очищают колоночной хроматографией (силикагель Merck, этилацетат/гексан 99/1), получая 39 мг титульного про