Способ получения ингибиторов ренина
Иллюстрации
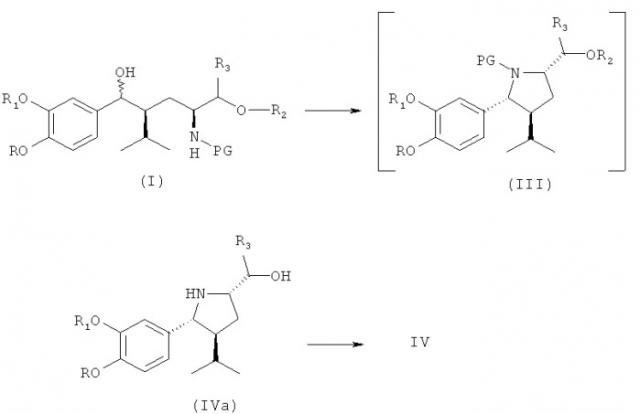
Показать всеНастоящее изобретение относится к новому способу, новым стадиям способа и новым промежуточным соединениям для синтеза фармацевтически активных соединениий, в частности ингибиторов ренина, таких как алискирен. Изобретение, в частности, относится к способу получения соединения формулы III,
,
где R, R1, R2, R3 и PG определены в описании, или его соли, заключающемуся в реакции соединения формулы I
,
с реагентом, выбранным, например, из группы, включающей галоидоводородную кислоту, тионилгалогенид, РХ*3, РОХ*3, РХ*5, РОХ*5, где X* обозначает галоген, комбинацию трифенилфосфина и галогена и активное производное органической сульфоновой кислоты. 52 н. и 11 з.п. ф-лы.
Реферат
Область изобретения
Изобретение относится к новому способу, новым стадиям способа и новым промежуточным соединениям, применяемым в синтезе фармацевтически активных соединений, в частности ингибиторов ренина.
Предпосылки изобретения
Ренин поступает из почек в кровь, где он вызывает расщепление ангиотензиногена, в результате чего образуется декапептид ангиотензин I, который превращается затем в легких, почках и других органах в октапептид ангиотензин II. Октапептид повышает кровяное давление как непосредственно путем сужающего действия на сосуды, так и косвенно путем высвобождения из надпочечников содержащего ионы натрия гормона альдостерона, сопровождающегося увеличением объема внеклеточной жидкости, которое может быть связано с действием ангиотензина II. Ингибиторы ферментной активности ренина вызывают уменьшение образования ангиотензина I и, следовательно, продуцирование меньшего количества ангиотензина II. Уменьшение концентрации этого активного пептидного гормона является непосредственной причиной гипотензивного действия ингибиторов ренина.
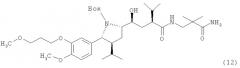
С соединениями, такими как (по МНН) алискирен ((2S,4S,5S,7S)-5-амино-N-(2-карбамоил-2-метилпропил)-4-гидрокси-2-изопропил-7-[4-метокси-3-(3-метоксипропил)бензил]-8-метилнонамид), связана разработка антигипертензивных средств, которые взаимодействуют с ренин-ангиотензивной системой в начальной стадии биосинтеза ангиотензина II.
Поскольку соединение включает 4 хиральных атома углерода, совершенно необходимо решить проблему синтеза энантиомерно чистого соединения. Кроме того, приветствуются современные усовершенствованные пути для более удобного синтеза молекул такого типа.
Для решения этой проблемы настоящее изобретение предлагает новые синтетические пути и новые промежуточные соединения, дающие доступный и эффективный подход к этому классу соединений.
Краткое изложение сущности изобретения
В ходе исследования редуцированного деоксигенирования диастереомерной смеси вторичных бензиловых спиртов формулы I, приведенной ниже, была сделана попытка заменить эту группу на отличную от гидроксильной группы, в частности на отщепляемую группу, такую как галогруппа, например на хлор или йод, или сульфонатную группу органических сульфоновых кислот, например метансульфонатную (мезилат) или толуолсульфонатную (тозилат), чтобы облегчить восстановительный процесс. Однако ожидаемые соединения не были получены. Вместо ожидаемых соединений формулы II
(которые затем согласно первоначальным планам могли были быть восстановлены в соответствующее соединение, где Х обозначает водород), где R, R1, R2, R3 и PG определены, как для соединения I, ниже, и Х обозначает иную, чем гидроксильная, группу, в частности отщепляемую группу, такую как галогруппа, например хлор или йод, или сульфонатная группа органических сульфоновых кислот, например метансульфонатная (мезилат) или толуолсульфонатная (тозилат), пирролидины формулы III, приведенные ниже, получены с высоким выходом в виде энантиомеров со стереохимией, указанной ниже. Эти неожиданные находки были затем использованы в общем новом пути синтеза алискирена и родственных соединений.
Детальное описание изобретения
В первом и очень существенном аспекте изобретение относится к способу получения соединения формулы III
где
R обозначает водород, алкил или алкоксиалкил;
R1 обозначает водород, алкил или алкоксиалкил;
R2 обозначает водород или предпочтительно защитную группу для гидроксила;
R3 обозначает водород или незамещенный или замещенный алкил; и
PG обозначает защитную группу для аминогруппы, в частности удаляемую при гидролизе, например алкоксикарбонильную группу, такую как трет-бутоксикарбонильная группа или бензилоксикарбонильная группа;
или его соли;
заключающемуся в том, что соединение формулы I,
где R, R1, R2, R3 и PG определены, как для соединения формулы III, вводят в реакцию с реагентом, способным превратить (здесь, в частности, бензильную) гидроксигруппу (в частности, группу, связь которой обозначена волнистой линией на схеме в формуле I) в группу Х (которая предположительно присутствует в переходном соединении формулы II, как отмечено выше, в реакционной смеси перед циклизацией), где Х обозначает группу, отличную от гидроксигруппы или водорода, в частности уходящую группу.
Такие соединения формулы (I) используются в качестве исходных соединений. Так, доступен синтез с применением в качестве исходного соединения (S)-пироглутаминовой кислоты. В публикации WO 2006/024501 приведено получение кетоноаминопроизводных таких соединений, которые могут быть превращены в соответствующие аминоспирты посредством гидрирования или восстановления.
Реагентом, способным превратить гидроксигруппу в группу X, предпочтительно, является обычный реагент для замещения гидроксильной группы в бензиловом спирте на другую группу, в частности уходящую группу X, например реагент, где Х обозначает галогруппу, выбранный из группы, включающей (например, водные) галоидводородные кислоты, такие как хлористоводородная кислота, тионилгалогениды, такие как тионилхлорид, РХ*3, РОХ*3, РХ*5 или РОХ*5, где X* обозначает галоген (в частности, хлор или бром), комбинацию трифенилфосфин/галоген, такую как трифенилфосфин/йод, где Х обозначает фрагмент с органической сульфонилоксигруппой в качестве активного производного (образованной в условиях, сравнимых, как показано ниже, с активацией производного карбоновой кислоты формулы XVI, в процессе реакции, в частности в условиях получения ангидрида, например смешанного ангидрида с карбоновой кислотой, такой уксусная кислота, или симметричного ангидрида) или галоидангидрида органической сульфокислоты, такого как метансульфонилхлорид, трифторметансульфонилхлорид или тозилхлорид, в присутствии основания, например третичного азотистого основания, такого как триэтиламин или ему подобного. В случае тионилгалогенида, РХ*3, РОХ*3, РХ*5 или POX*5 реакцию проводят в растворителе типа толуола в присутствии третичного азотистого основания, такого как пиридин, например, при температуре в интервале от 0 до 50°С. В присутствии ангидрида или галоидангидрида органической сульфокислоты реакцию предпочтительно проводят в соответствующем растворителе типа толуола и/или диметиламинопиридина, и основания, например триэтиламина, в температурном интервале от 30 до 50°С. В присутствии трифенилфосфин/галогена реакцию предпочтительно проводят в соответствующем растворителе типа толуола и/или ацетонитрила, в присутствии азотистого основания (предпочтительно циклического незамещенного), такого как имидазол, при температуре в интервале от 0 до 50°С.
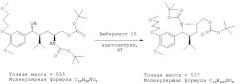
Альтернативно соединение (III) может быть получено из соединения (I) с использованием ионообменной смолы, предпочтительно кислой ионообменной смолы, такой как янтарная ионообменная смола, предпочтительно Amberlyst 15 (фирма Fluka) при удалении воды. Реакцию предпочтительно проводят в соответствующем растворителе типа толуола и/или ацетонитрила, при температурах в интервале от 30 до 50°С, например при комнатной температуре.
Другой важный вариант осуществления изобретения связан с соединением формулы III по определению выше или его солью.
Соединение формулы III может быть использовано, среди прочего, для синтеза фармацевтически активных субстанций, предпочтительно ингибиторов ренина, таких как алискирен, в частности, как описано далее.
В следующем предпочтительном варианте оуществления изобретения этот синтез включает в качестве следующей стадии или индивидуального синтеза (частичное) снятие защиты с соединения формулы III (которое в свободной форме или в виде соли также является предпочтительным вариантом по изобретению), где R2 обозначает защитную группу для гидроксигруппы, в частности группу, удаляемую в других условиях, чем требуется для удаления PG, более предпочтительно путем гидролиза, например трет-С4-С7-алкоксикарбонильную группу, такую как трет-бутоксикарбонильная группа, при этом R, R1, R3 и PG определены, как для соединения формулы I выше, в условиях удаления защитной группы R2 у соединения формулы IV,
где R, R1, R3 и PG определены, как для формулы III выше, или его соли. Соединение формулы IV или его соль также являются предпочтительным вариантом по изобретению.
В случае защитной группы R2, удаляемой посредством гидролиза, например трет-С4-7-алкоксикарбонильной группы, такой как трет-бутоксикарбонильная группа, удаление предпочтительно проводят в присутствии кислоты или, более предпочтительно, в присутствии основания, такого как гидроксид металла, или предпочтительно гидроксида металла, более предпочтительно карбоната щелочноземельного металла, такого как карбонат калия, в присутствии растворителя, такого как спирт, например метанола или этанола, воды или их смеси, при температуре в интервале от 0°С до температуры кипения смеси, например от 30 до 60°С.
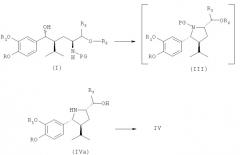
В качестве альтернативы реакционным стадиям, описанным выше, соединение (I) - также сырое (I) - может быть превращено посредством одностадийного синтеза в соединение (IV) в виде свободного основания (IVa), которое может быть очищено путем экстракции без выделения промежуточного соединения (III). Соединение (IVa) затем может быть кристаллизовано в виде соли, такой как малеат или оксалат. При этом предпочтительно провести его дальнейшую очистку. Соединение (IVa) легко превращается в соединение (IV). Введение защитной группы при азоте осуществляется просто, селективно и чисто.
В этой последовательности защитные группы R2 и PG предпочтительно удаляются путем гидролиза и более предпочтительно представляют собой, например, трет-С4-С7-алкоксикарбонильную группу, такую как трет-бутоксикарбонильная группа. Удаление предпочтительно проводят в присутствии основания или более предпочтительно в присутствии кислоты в условиях, известных из уровня техники, например, с использованием неорганической кислоты, предпочтительно в виде ее водного или спиртового раствора, такой как хлористоводородная кислота, трифторуксусная кислота, серная кислота, фосфорная кислота, метансульфоновая кислота и им подобные, в соответствующем растворителе, таком как спирт, например метанол или этанол, сложные эфиры, подобные этилацетату или изопропилацетату, или простые эфиры типа тетрагидрофурана или трибутилметилового эфира, вода или их смеси, при температуре в интервале от 0°С до температуры кипения реакционной смеси, например, от 50 до 100°С.
Если требуется кристаллизация соединения (IVa), она проводится с использованием обычных методов кристаллизации с применением нужной кислоты, такой как малеиновая кислота или щавелевая кислота, предпочтительно малеиновой кислоты.
Защита пирролидиновой аминогруппы осуществляется методами, известными из уровня техники, которые описаны, например, в примерах, приведенных далее, или в работах, процитированных в учебниках.
Предпочтительно к атому азота присоединяют Бок-группу, например ди-трет-дибутилкарбонат в стандартных условиях.
Соединение формулы IV может быть далее использовано во многих методах синтеза ингибиторов ренина, таких как алискирен.
В первом варианте осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, включает окисление соединения формулы IV, в частности, синтезированного на предыдущих стадиях, до оксосоединения формулы V,
где R, R1, R3 и PG определены, как для формулы III выше, или его соли. Эта стадия способа сама по себе, а также соединение формулы V или его соль также являются вариантами по изобретению.
Реакция протекает в обычных условиях, которые применяются при окислении гидроксигруппы в оксигруппу с использованием стандартных окислительных реагентов (окислителей).
В (предпочтительном) случае, где R3 в соединении формулы IV обозначает водород, в этой реакции могут использоваться такие окислители, которые позволяют непосредственно получить из соединения формулы IV соответствующий альдегид формулы V или его соль, или сначала провести окисление до карбоксильного соединения формулы XVI
где R, R1 и PG определены выше, как для соединения формулы III, или его соли, которое может быть восстановлено с помощью восстанавливающих агентов до альдегида формулы V, где R3 обозначает водород, и где R, R1, R3 и PG по определению для формулы III выше, или его соли. Эти стадии способа, как таковые, а также соединение формулы XVI или его соль, и соединение формулы V или его соль также являются вариантами по изобретению. Реакция прямого получения альдегида формулы V может, например, быть проведена в присутствии окислителя, который позволяет провести окисление спирта в альдегид без излишнего образования кислоты формулы XVI, например, в условиях реакции Оппенауэра (используя, например, циклогексанон, коричный альдегид или анисовый альдегид в качестве окислителя в присутствии алкоголята алюминия, такого как трет-бутоксиалкоголят алюминия), предпочтительно с использованием хромовой кислоты, смеси дихромат/серная кислота, пиридиний-хлорхромата, пиридиний-дихромата, азотной кислоты, диоксида марганца или диоксида селена или посредством каталитической дегидрогенизации, или более предпочтительно, используя окислители, позволяющие проводить окисление в мягких условиях, такое как ТЕМРО-окисление (TEMPO = 2,2,6,6-тетраметилпиперидин-нитроксил), с использованием таких окислителей, как, например, хлорит натрия или гипохлорит кальция, предпочтительно в присутствии бромидов, например, бромида калия, в соответствующем растворителе типа метиленхлорида и/или воды, или с использованием диацетоксийодбензола в присутствии соответствующего растворителя, например метиленхлорида, при температурах в интервале от 0 до 50°С; в условиях реакции Шверна, например, с использованием диметилсульфоксида в присутствии оксалилхлорида при пониженных температурах в интервале от -90 до 0°С, предпочтительно в присутствии третичного азотистого основания, такого как триэтиламин или диизопропилэтиламин; в условиях реакции Кори-Кима, например, используя диметилсульфид в присутствии N-хлорсукцинимида; в условиях реакции Моффата-Пфитцнера, например, окисление диметилсульфоксидом в присутствии циклогексилкарбодиимида; окисление в условиях реакции Десса-Мартина в присутствии Десс-Мартин-перйодинана (1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1Н)-он) в соответствующем растворителе типа метиленхлорида, при температурах в интервале от 0 до 50°С; или с использованием SO3/пиридинового комплекса в диметилсульфоксиде в отсутствие или присутствии соответствующего растворителя, такого как метиленхлорид, например, при температурах в интервале от -30 до 30°С; или, с низким преимуществом, использование каталитической дегидрогенизации, например, в присутствии серебра, меди, оксида хрома или оксида цинка. При необходимости стехиометрия окислителей выбирается таким образом, чтобы избежать переокисления.
Окисление соединения формулы IV (а также альдегидного соединения формулы V, полученного, предпочтительно, по описанию выше) до соединения формулы XVI может, например, быть проведено с использованием реагента Джонса (CrO3 в водном растворе серная кислота/ацетон), с диоксидом марганца, с дихроматом пиридиния или, в частности, в условиях окисления по Пиннаку, например окислением с помощью хлорита натрия или гипохлорита кальция в присутствии слабой кислоты, предпочтительно дигидрофосфата щелочноземельного металла, например дигидрофосфата натрия, в соответствующем растворителе, например спирте, таком как трет-бутанол, 2-метил-2-бутанол, и/или в воде, при температуре в интервале от 0 до 50°С. Восстановление кислоты формулы XVI проводится далее с использованием восстанавливающего агента, позволяющего проводить селективное восстановление до альдегида формулы V, где R3 обозначает водород и где R, R1, R3 и PG определены, как для формулы III. Восстанавливающие агенты могут быть выбраны, например, из соответствующих комплексных гидридов, как таковых, и соединение формулы XVI может быть использовано с активированной карбоксильной группой, например, в виде хлорангидрида кислоты, активированного сложного эфира, ангидрида (например, смешанного) или путем активации в процессе реакции, например, с использованием соединения в активной форме или путем активации, как описано ниже при конденсации соединения формулы XVI с соединением формулы VI. Например, в случае хлорангидрида соединения формулы XVI восстановление до альдегида формулы V может быть проведено с помощью LiAlH (трет-бутокси)3 (литий-три(трет-бутокси)алюминий гидрид) в соответствующем растворителе, например 2-метоксиэтиловом эфире (диглим), или с помощью боргидрида натрия или его комплексов. Альтернативно восстановление может быть проведено путем гидрирования в присутствии катализаторов гидрирования, в условиях восстановительной реакции Розенмунда с использованием палладий/барий сульфата и водорода в соответствующем растворителе, таком как вода, спирт, например метанол или этанол, диоксан, этилацетат или смесь одного или более таких растворителей, обычно при температурах в интервале, например, от 0 до 80°С.
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы V при условии, что R3 в нем обозначает водород, в условиях реакции Гриньяра или ей подобных, с реагентом, полученным реакцией соединения формулы VI
где Hal обозначает галоген, предпочтительно хлор, бром или йод, и РТ обозначает защитную группу для гидроксильной группы, с металлом, с получением соединения формулы VII
где R, R1 и PG определены, как для формулы III, и РТ обозначает защитную группу для гидроксильной группы, предпочтительно группу, которая может быть селективно удалена без удаления защитной группы PG, например 1-фенил-С1-С7-алкил, в частности бензил. Эта стадия способа, как таковая, а также соединение формулы VII или его соль также являются вариантами по изобретению. Диастереоселективность этой реакции очень высока, например, выше, чем 99:1, то есть другой возможный диастереомер практически не обнаружен. Это указывает на значительное преимущество использования пирролидиновой кольцевой системы для такой конверсии и, таким образом, для синтеза ингибиторов ренина, таких как алискирен.
Реакция предпочтительно проводится с металлом, взаимодействующим с соединением формулы VI, с образованием соответствующего металлорганического соединения, например с литием, натрием, железом, цинком, оловом, индием, марганцем, алюминием или медью, или с MnX, (алкил)3MnLi-, или -СеХ2, где Х обозначает галоген, такой как Cl, I или Br, более предпочтительно Br; или с реагентом, полученным с помощью комбинаций металлов, таких как Mg/Fe, или, кроме того, с кислотами Льюиса, такими как комплекс BF3 c диэтиловым эфиром, или с MgBr2, или подобными им, с получением реагентов типа Гриньяра для реакций, подобных реакции Гриньяра, или с магнием, дающим соответствующий реактив Гриньяра с магнием (Mg) в качестве металла для реакции Гриньяра, в соответствующем растворителе, например простом эфире, таком как циклический эфир, например тетрагидрофуран, алкиловом эфире, например диэтиловом эфире, трет-бутилметиловом эфире, углеводороде, таком как толуол, или галогенированном углеводороде, например, метиленхлориде, при температуре в интервале от 0 до 70°С. Реагенты Гриньяра или реагенты, подобные реагенту Гриньяра, или органолитиевые соединения являются предпочтительными, при этом реагенты Гриньяра или реагенты, подобные реагенту Гриньяра, особенно предпочтительны.
Соединение формулы (VI) может быть получено методами, хорошо известными из уровня техники, см., например, публикацию в Houben-Weyl, vol.13/2а, page 53-526, которая включена в данное описание посредством ссылок.
В следующем варианте названного первого варианта по изобретению способ синтеза ингибитора ренина, такого как алискирен, включает снятие защитной группы с соединения формулы VII аналогично удалению защитной группы для гидроксила РТ, например в случае защитной группы, которая может быть удалена посредством гидрирования, такой как 1-фенил-С4-7-алкил, в частности бензильной, путем каталитического гидрирования с получением соединения формулы VIII
где R, R1 и PG определены, как для формулы III выше, или его соли. Эта стадия способа, как таковая, а также соединение формулы VIII или его соль, также являются вариантами по изобретению. Снятие защитной группы проводят в стандартных условиях, например, в случае удаления защитной группы посредством гидрирования с помощью водорода в присутствии катализатора, такого как благородный металл, например палладий, который может быть нанесен на носитель, такой как активированный уголь, в присутствии соответствующего растворителя типа спирта, например метанола или этанола, или неспиртового ратворителя, такого как (не ограничиваясь ими) толуол или этилацетат, при соответствующей температуре в интервале, например, от 0 до 50°С.
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в окислении соединения формулы VIII по первичной гидроксильной группе до альдегидного соединения формулы IX
где R, R1 и PG определены, как для формулы III выше, или его соли, которое затем спонтанно циклизуется с образованием лактола формулы X,
который либо в этой же реакционной смеси (in situ) или после выделения на отдельной стадии способа, которая, как таковая, также является вариантом по изобретению, окисляют затем до лактона формулы XI
где в формуле Х и XI R, R1 и PG определены, как для соединения формулы III выше. Эта последовательность реакционных стадий от реакции соединения формулы VIII до соединения формулы XI, как таковая, а также соединение формулы IX или, особенно соединение формулы Х и/или формулы XI или их соли, также являются вариантами по изобретению. Окисление соединения формулы VIII, приводящее к лактолу формулы X, предпочтительно проводят в условиях, отмеченных в качестве предпочтительных при окислении соединения формулы IV до альдегида формулы V, например, с помощью комплекса SO3/пиридин в присутствии диметилсульфоксида в соответствующем растворителе, таком как метиленхлорид, предпочтительно в присутствии третичного азотистого основания, такого как триэтиламин, например, при температуре в интервале от 30 до 50°С. Последующее окисление до соединения формулы XI может быть проведено в тех же реакционных условиях с использованием избытка некоторых реагентов, отмеченных выше, или соединение может быть выделено и окислено отдельно с помощью других реагентов, например, упомянутых выше, более предпочтительно с использованием ТЕМРО/диацетоксийодбензола.
Альтернативно окисление может быть проведено также по первичной гидроксильной группе, не затрагивая вторичной гидроксильной группы, до соединения XI с помощью реагента ТПАР (тетра-N-пропиламмоний рутенат), например, согласно литературному источнику: S. Ley et al. Synthesis, 639 (1994). Этот метод особенно предпочтителен.
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы XI или его соли с амином формулы XII
(где амидный азот при необходимости может быть защищен и защитная группа затем может быть удалена из соответствующего защищенного соединения формулы XIII), или его солью с получением соединения формулы XIII
где R, R1 и PG определены, как для соединения формулы III выше, или его соли. Эта стадия способа, как таковая, а также соединение формулы XIII или его соль, также являются вариантами по изобретению.
Реакция предпочтительно проводится в стандартных условиях, применяемых для получения амида из лактона, например, в соответствующем растворителе или смеси растворителей, например в эфире, таком как трет-бутилметиловый эфир, предпочтительно в присутствии бифункционального катализатора со слабой кислой и слабой основной группой, например 2-гидроксипиридина или пролина, в присутствии соответствующего основания, например третичного азотистого основания, такого как триэтиламин, при соответствующей температуре в интервале, например, от 0°С до температуры кипения реакционной смеси, например в интервале от 0 до 85°С.
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в раскрытии цикла в соединении формулы XIII посредством восстановления или гидрогенолиза кольца с получением соединения формулы XIV
где R, R1 и PG определены, как для соединения формулы III выше, или его соли. Эта реакционная стадия, как таковая, также является вариантом по изобретению.
Раскрытие кольца с помощью восстановления предпочтительно проводится в условиях, использующих соответствующий металл в качестве восстановителя, например в условиях, сравнимых с уловиями проведения восстановления по Берчу с применением щелочных металлов и жидкого аммиака, например натрия или лития в жидком аммиаке (NH3) в присутствии, кроме того, соответствующего растворителя или смеси растворителей, таких как простой эфир, например тетрагидрофуран, и/или спирт, например этанол, при низких температурах, например при температуре в интервале от -90 до -20°С, в частности при температуре около -78°С. Возможны и альтернативные методы восстановления, например восстановление кальцием в трет-бутаноле, другие методы восстановления кальцием, литий-ди-трет-бутилбифенилидом, магнием в антрацене, или подобными методами, которые не требуют применения жидкого аммиака и низких температур (< -20°С).
Альтернативно раскрытие кольца может быть проведено посредством гидрирования. Такие методы хорошо известны из уровня техники и описаны, например, в Houben-Weyl, volume 11/1, Stickstoffverbindungen II, page 968-971 или D.Tourwé, et al., Tetrahedron, 54, 1753 (1998).
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, включает снятие защиты с соединения формулы XIV с получением соответствующего соединения формулы XV,
которое фармацевтически активно, в частности в качестве ингибитора ренина, где R и R1 определены, как для соединения формулы I, или его соли; и при необходимости превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или другую его соль. Например, если PG обозначает (что предпочтительно) C1-7-алкоксикарбонильную группу, такую как трет-бутоксикарбонил, удаление может быть проведено в стандартных условиях, например, в присутствии кислоты, такой как хлористоводородная кислота, в соответствующем растворителе, таком как диоксан, например при температурах в интервале от 0 до 50°С, например, при комнатной температуре.
Особенно важный аспект настоящего изобретения относится к способу получения соединения формулы XV или его соли, заключающемуся в первоначальном раскрытии кольца в соединении формулы XIII, описанном выше, посредством его селективного восстановления в соединение формулы XIV, описанное выше, или его соли, с последующим снятием защиты с соединения формулы XIV с получением соответствующего соединения формулы XV или его соли, и при необходимости превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или другую его соль.
В следующем втором варианте осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы XVI (которое может быть получено описанным выше методом или посредством первоначального окисления соединения формулы IV, где R3 обозначает водород, при этом в реакции могут использоваться такие окислители, которые приводят к соответствующему альдегиду формулы V или его соли, и последующего окисления альдегида формулы V до карбоновой кислоты формулы XVI или ее соли, например, посредством описанной выше реакции), описанного выше, или его соли (полученных предпочтительно, как описано выше, где синтез соединения формулы XVI описан первый раз), где R, R1 и PG определены, как для соединения формулы III, или его соли, с реагентом, способным активировать карбоксильную группу, в частности превращать ее в галоидангидрид, смешанный ангидрид, карбонилимидазолид или «Weinreb амид», и затем введение его в реакцию с металлоорганическим производным соединения формулы VI по описанию выше, в частности с производным цинка, лития или магния, с получением соединения формулы XVII,
где R, R1 и PG определены, как для соединения формулы III выше, и РТ по определению, как для соединения формулы VI, или его соли. Эта стадия способа, как таковая, а также соединение формулы XVII или его соль также являются вариантами по изобретению.
Активацию карбоксильной группы в соединении формулы XVI, приводящую к ее реакционным производным, предпочтительно проводят в стандартных условиях реакции конденсации, где среди возможных реакционных производных кислоты формулы XVI реакционные сложные эфиры (например, гидроксибензотриазол (ГОБТ), пентафторфенил, 4-нитрофенил или N-гидроксисукцинимид эфир), имидазолид, «Weinreb амид», галоидангидриды (такие как хлор или бромангидрид) или реакционные ангидриды (такие как смешанные ангидриды низших алкановых кислот или симметричные ангидриды) являются предпочтительными. Реакционные производные карбоновой кислоты могут также образоваться в процессе реакции. Реакцию проводят посредством растворения соединений формулы XVI в соответствующем растворителе, например галогенированном углеводороде, таком как метиленхлорид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон или смесь одного или более таких растворителей, и добавления соответствующего основания, например триэтиламина, диизопропилэтиламина (ДИЭА) или N-метилморфолина, если реакционное производное кислоты формулы II образуется в процессе реакции, добавления соответствующего конденсирующего агента, который способствует образованию предпочтительного реакционного производного карбоновой кислоты формулы XVI в процессе реакции, например дициклогексилкарбодиимид/1-гидробензотриазола (ДЦК/ГОБТ); хлорида бис-(2-оксо-3-оксазолидинил)фосфина (БОФ-С1); тетрафторбората O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N',N'-тетраметилурония (ТПТУ); тетрафторбората (O-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (ТБТУ); (бензотриазол-1-илокси)пирролидинофосфоний-гексафторфосфата (РуБОФ), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида/гидроксибензотриазола или/1-гидрокси-7-азабензотриазола (EDC/ГОБТ или EDC/ГОАТ) или одного ГОАТ, или с (1-хлор-2-метилпропенил)диметиламином. Реакционная смесь предпочтительно перемешивается при температурах в интервале приблизительно от -20 до 50°С, в частности в интервале от 0°С до 30°С, например при комнатной температуре. Реакция предпочтительно проводится в атмосфере инертного газа, например азота или аргона.
Последующую реакцию металлоорганического производного соединения формулы VI, в частности цинкового, литиевого или магниевого производного, или, кроме того, производного магния, алюминия или меди, затем предпочтительно проводят в обычных условиях, например, аналогично условиям реакции Гриньяра или подобным реакции Гриньяра, отмеченным выше для соединения формулы VI, с альдегидом формулы V.
В следующем варианте названного второго варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в восстановлении соединения формулы XVII в стереоселективных условиях и снятии защиты с полученного соединения путем удаления защитной для гидроксила группы РТ с получением соединения формулы VIII, как описано выше, или его соли.
Восстановление в стереоселективных условиях предпочтительно проводится в присутствии стереоселективного восстановителя, такого как LiAlH(O-трет-бутил)3, LiBH(втор-бутил)3 (Selectride®), калий селектрид или борогидрид/оксаазаборлидин («CBS-катализаторы» на основе новой работы Corey, Bakshi и Shibata, получаемые in situ из аминоспирта и борана), или посредством стереоселективного гидрирования, например, в присутствии таких катализаторов, как [Ru2Cl4((S- или R-)BINAP)]NEt3. Реакция протекает в стандартных условиях, например, в соответствующем растворителе, таком как тетрагидрофуран, метанол, этанол или смесь двух или более таких растворителей, например, при температуре в интервале от -80 до 50°С (см., например, Reger et al., Tetrahedron Letters, 2000, , 10085).
Снятие защитной группы проводят в стандартных условиях, например, если РТ является группой, удаляемой гидрированием, такой как 1-фенил-С1-7-алкильная, например бензильная, ее удаляют с помощью каталитического гидрирования, например, в условиях, аналогичных описанным выше для снятия защиты с соединения формулы VII.
Соединение формулы VIII может быть далее введено в реакцию с соединением формулы X, или его солью, как описано выше, с получением после прохождения реакционных стадий, описанных выше, соединения формулы XV или его соли.
Альтернативно соединение формулы VIII по определению выше или его соль, предпочтительно получаемое согласно либо первому, либо второму варианту по изобретению, может быть далее введено в реакцию с соединением формулы XVIII
где R, R1 и PG определены, как для соединения формулы III, или его солью, с раскрытием пирролидинового кольца посредством восстановления или гидрогенолиза. Эта стадия способа, как таковая, а также соединение формулы XVIII, или его соль, также являются вариантами по изобретению. Раскрытие кольца посредством восстановления или гидрогенолиза предпочтительно проводят в условиях, упомянутых выше, для раскрытия кольца в соединении формулы XIV.
Альтернативно соединение формулы VII по определению выше, или его соль, предпочтительно получаемое согласно либо первому, либо второму варианту осуществления изобретения, может быть далее введено в реакцию с соединением формулы XVIII непосредственно, минуя стадию снятия защиты,
где R, R1 и PG определены, как для соединения формулы III, или его солью, с раскрытием пирролидинового кольца посредством восстановления или гидрогенолиза. Эта стадия способа, как таковая, а также соединение формулы XVIII или их соли, также являются вариантами по изобретению. Раскрытие кольца посредством восстановления или гидрогенолиза предпочтительно проводят в условиях, упомянутых выше, для раскрытия кольца в соединении формулы XIV. Этот метод особенно предпочтителен в случае, когда РТ является защитной группой, удаляемой в условиях восстановительного раскрытия кольца, в частности, если РТ является фенилС1-С7-алкилом, таким как бензил.
Соединение формулы XVIII может быть затем окислено в следующем варианте н