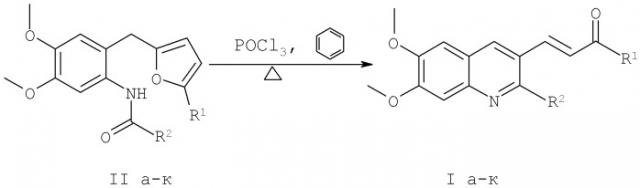
Способ получения производных (e)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она
Иллюстрации
Показать всеНастоящее изобретение относится способу получения производных (Е)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она общей формулы I, где Iа: R1 и R2 - СН3; Iб: R1 - СН3, R2 - С6Н5; Iв: R1 - СН3, R2 - о-NO2С6Н4; Iг: R1 - t-Bu, R2 - С6Н5; Iд: R1 - t-Bu, R2 - р-ОСН3С6Н4; Ie: R1 - р-ВrC6H4, R2 - Ph; Iж: R1 -СН3, R2 - тиофен; Iз: R1 - t-Bu, R2 - CH2СН2Рh; Iи: R1 - t-Bu, R2 - СН2CH2Сl; Iк: R1 - р-ВrС6Н4,
R2 - CH2CH2NPht, характеризующийся тем, что производные ортоаминоацилбензилфуранов формулы II кипятят в бензоле в присутствии хлорокиси фосфора с обратным холодильником в течение 1,5-3,5 часов в зависимости от заместителей R1 и R2. Технический результат: разработан новый способ получения производных (Е)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она, аналогов питавастатина, обеспечивающий введение требуемого заместителя в целевое соединение при одновременном формировании хинолинового ядра. 2 табл.
Реферат
Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она, которые могут быть использованы в синтезе новых препаратов фармацевтического назначения.
Изобретение относится к разработке способа получения производных (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она общей формулы I, представляющих интерес как вещества, обладающие потенциальной биологической активностью, - аналогов питавастатина [Acemoglu M., Brodbeck A., Helvetica Chimica Acta, 2007, 90, 1069].
| Индекс | R1 | R2 |
| Ia | CH3 | CH3 |
| Iб | CH3 | C6H5 |
| Iв | CH3 | o-NO2C6H4 |
| Iг | t-Bu | C6H5 |
| Iд | t-Bu | p-ОСН3С6Н4 |
| Ie | p-BrC6H4 | Ph |
| Iж | CH3 | |
| Iз | t-Bu | CH2CH2Ph |
| Iи | t-Bu | CH2CH2Cl |
| Ik | p-BrC6H4 | CH2CH2NPht |
В литературе описаны различные подходы к синтезу непредельных производных хинолинов, в которых исходные соединения уже содержат готовый хинолиновый фрагмент. Так, производные хинолил-3-бутен-2-она могут быть получены альдольной конденсацией 2-хлорохинолил-3-карбоксальдегида и ацетона в присутствии пиперидина и уксусной кислоты [Cziaky Z., Szabo Z., J. Heterocyclic Chem., 1995, 32, 755]. Также в качестве катализатора в данной реакции может быть использован водный раствор гидроксида натрия [Paul S., Gupta M., Synthetic Communications, 2005, 35, 213-222].
Другим способом получения производных хинолил-3-бутен-2-она является реакция Хорнера-Вэдсворфа-Эммонса при взаимодействии хинолил-2-аля и β-кетофосфоната в хлористом метилене в присутствии хлорида лития и 1,5-диазабицикло [5.4.0]ундец-5-ена (DBU).
Недостатками данного способа синтеза являются низкие выходы продуктов, необходимость проведения реакции в атмосфере азота при температуре -10°C [Sliskovic D.R., Picard J.A., J. Med. Chem., 1991, 34, 367].
Еще одной модификацией данного метода синтеза является получение производных хинолил-3-бутен-2-она взаимодействием хинолил-2-аля и β-кетофосфоната в этиловом спирте и в присутствии K2CO3 [Acemoglu М., Brodbeck A., Helvetica ChimicaActa, 2007, 90, 1069].
Также хинолил-3-бутен-2-он может быть синтезирован из бромхинолина и пент-1-ен-3-она под действием [Pd(C3H5)Cl]2 и 1,2,3,4-тетракисдифенилфосфинометилциклопентана [Lemhadri М., Doucet Н., Santelli М., Synlett, 2006, 18, 2935].
Недостатками данного способа являются высокая стоимость используемого катализатора, длительность реакции (около 20 часов), а также необходимость проведения синтеза в атмосфере азота.
Задача изобретения - разработка способа получения производных (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она I, позволяющего расширить номенклатуру потенциально биологически активных веществ и представляющих собой удобные исходные соединения для синтеза аналогов алкалоида питавастатина.
Техническим результатом является обеспечение введения требуемого заместителя в целевой продукт при одновременном формировании хинолинового ядра.
Технический результат достигается тем, что в способе получения производных (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она ортоаминоацилбензилфураны II кипятят в бензоле в присутствии хлорокиси фосфора с обратным холодильником от 1,5 до 3,5 часов в зависимости от заместителей R1, R2.
| Индекс | R1 | R2 |
| Ia | CH3 | CH3 |
| Iб | CH3 | C6H5 |
| Iв | CH3 | o-NO2C6H4 |
| Iг | t-Bu | C6H5 |
| Iд | t-Bu | p-OCH3C6H4 |
| Iе | p-BrC6H4 | Ph |
| Iж | CH3 | |
| Iз | t-Bu | CH2CH2Ph |
| Iи | t-Bu | CH2CH2Cl |
| Iк | p-BrC6H4 | CH2CH2NPht |
В основе заявляемого способа лежит внутримолекулярная реакция раскрытия фуранового цикла под действием электрофильного атома углерода, приводящая к образованию (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-онов.
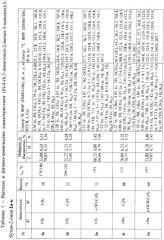
Температуры плавления, данные элементного анализа и спектральные характеристики (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-онов Iа-к приведены в таблице 1.
Полученный технический результат позволяет расширить ряд производных (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она Ia-к, а тем самым и номенклатуру потенциально биологически активных соединений.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она
Пример 1.
Смесь 0.5 г (1.4 ммоль) 2-[5-(трет-бутил)-2-фурилметил]-4,5-диметокси-1-фенилкарбоксамидобензола IIа, 5 мл хлорокиси фосфора и 25 мл бензола кипятят с обратным холодильником в течение 1,5 часов. Затем реакционную смесь выливают в 800 мл воды и нейтрализуют раствором гидроксида натрия (50 г) в 200 мл воды, экстрагируют хлористым метиленом (3×150 мл). Объединенные органические фракции сушат сульфатом натрия, отфильтровывают и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен. Перекристаллизовывают из смеси хлористый метилен/ петролейный эфир. Выход 33% (0.16 г).
Тпл.=115°C.
Найдено для C24H25NO3, %: C, 76.84; H 6.73; N 3.72.
Вычислено: C, 76.77; H 6.71; N 3.73.
Спектр 1H ЯМР (CDCl3), (δ, м. д. и KCCB, J, Гц): 1.21 (с, 9Н, t-Bu), 4.05 (с, 3H, OCH3), 4.06 (с, 3H, OCH3), 7.07 (д, J=15.6 Hz, 1Н, =CH), 7.14 (с, 1Н, HAr), 7.45-7.53 (м, 3H, HAr), 7.56-7.60 (м, 3H, HAr), 7.83 (д, J=15.6 Hz, 1H, =СН), 8.35 (с, 1H, HPy).
Спектр 13С ЯМР (CDCl3), (δ, м. д.): 26.4 (3C), 43.2, 56.1, 56.3, 104.8, 108.0, 122.4, 122.5, 125.6, 128.5 (2С), 128.6, 129.6 (2С), 133.2, 139.5, 140.9, 145.4, 150.2,153.6, 157.6,203.7.
Пример 2.
Смесь 0.5 г (1.4 ммоль) 2-[5-(трет-бутил)-2-фурилметил]-4,5-диметокси-1-фенилкарбоксамидобензол IIа, 7.5 мл хлорокиси фосфора и 25 мл бензола кипятят с обратным холодильником в течение 1,5 часов. Затем реакционную смесь выливают в 800 мл воды и нейтрализуют раствором гидроксида натрия (50 г) в 200 мл воды, экстрагируют хлористым метиленом (3×150 мл). Объединенные органические фракции сушат сульфатом натрия, отфильтровывают и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен. Перекристаллизовывают из смеси хлористый метилен/ петролейный эфир. Выход 88% (0.42 г).
Пример 3.
Смесь 0.5 г (1.4 ммоль) 2-[5-(трет-бутил)-2-фурилметил]-4,5-диметокси-1-фенилкарбоксамидобензол IIа, 5 мл хлорокиси фосфора и 25 мл бензола кипятят с обратным холодильником в течение 3 часов. Затем реакционную смесь выливают в 800 мл воды и нейтрализуют раствором гидроксида натрия (50 г) в 200 мл воды, экстрагируют хлористым метиленом (3×150 мл). Объединенные органические фракции сушат сульфатом натрия, отфильтровывают и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен. Перекристаллизовывают из смеси хлористый метилен/ петролейный эфир. Выход 45% (0.22 г).
Пример 4.
Смесь 0.5 г (1.4 ммоль) 2-[5-(трет-бутил)-2-фурилметил]-4,5-диметокси-1-фенилкарбоксамидобензол IIа, 7.5 мл хлорокиси фосфора и 25 мл бензола кипятят с обратным холодильником в течение 3 часов. Затем реакционную смесь выливают в 800 мл воды и нейтрализуют раствором гидроксида натрия (50 г) в 200 мл воды, экстрагируют хлористым метиленом (3×150 мл). Объединенные органические фракции сушат сульфатом натрия, отфильтровывают и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен. Перекристаллизовывают из смеси хлористый метилен/ петролейный эфир. Выход 82% (0.39 г).
Пример 5.
Смесь 0.5 г (1.4 ммоль) 2-[5-(трет-бутил)-2-фурилметил]-4,5-диметокси-1-фенилкарбоксамидобензол IIа, 5 мл хлорокиси фосфора и 25 мл бензола кипятят с обратным холодильником в течение 4,5 часов. Затем реакционную смесь выливают в 800 мл воды и нейтрализуют раствором гидроксида натрия (50 г) в 200 мл воды, экстрагируют хлористым метиленом (3×150 мл). Объединенные органические фракции сушат сульфатом натрия, отфильтровывают и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен. Перекристаллизовывают из смеси хлористый метилен/ петролейный эфир. Выход 69% (0.33 г).
Пример 6.
Смесь 0.5 г (1.4 ммоль) 2-[5-(трет-бутил)-2-фурилметил]-4,5-диметокси-1-фенилкарбоксамидобензола IIа, 7.5 мл хлорокиси фосфора и 25 мл бензола кипятят с обратным холодильником в течение 4,5 часов. Затем реакционную смесь выливают в 800 мл воды и нейтрализуют раствором гидроксида натрия (50 г) в 200 мл воды, экстрагируют хлористым метиленом (3×150 мл). Объединенные органические фракции сушат сульфатом натрия, отфильтровывают и упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен. Перекристаллизовывают из смеси хлористый метилен/ петролейный эфир. Выход 64% (0.31 г).
В таблице 2 приведены данные о влиянии времени реакции и концентрации хлорокиси фосфора на выход (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-он (примеры 1-6).
Как видно из таблицы 2, оптимальным условием синтеза целевого продукта (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-он I является кипячение 2-[5-(трет-бутил)-2-фурилметил]-4,5-диметокси-1-фенилкарбоксамидобензола IIа в присутствии хлорокиси фосфора в течение 1,5 часов при соотношении соединение Ia: хлорокись фосфора=1 моль:7.5 мл. Более продолжительное время реакции сопровождается сильным осмолением и, как следствие, снижением выхода целевого продукта. Проведение реакции при более высокой концентрации хлорокиси фосфора также приводит к осмолению реакционной смеси.
| Таблица 2 | ||||
| Влияние реакционных условий на выход (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-он IIа | ||||
| Пример | Соотношение | Время реакции, час | Выход, % | |
| соединение Iа, моль | POCl3, мл | |||
| 1 | 1 | 5 | 1,5 | 33 |
| 4 | 1 | 7.5 | 88 | |
| 2 | 1 | 5 | 3 | 45 |
| 5 | 1 | 7.5 | 82 | |
| 3 | 1 | 5 | 4,5 | 69 |
| 6 | 1 | 7.5 | 64 |
Кипячение исходного 2-[5-(трет-бутил)-2-фурилметил]-4,5-диметокси-1-фенилкарбоксамидобензола в присутствии 5 мл хлорокиси фосфора в течение 1,5 часов не позволяет провести полную конверсию исходных соединений и выход (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она составляет 33%. При кипячении бензилфурана в данных условиях в течение 4,5 часов приводит к полной его конверсии, но выход целевого продукта не превышает 69%.
Заявляемым способом получен ряд производных (E)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она Iа-к.
Способ получения производных (Е)-4-(6,7-диметокси-2-метил-3-хинолил)-3-бутен-2-она общей формулы I характеризующийся тем, что производные ортоаминоацилбензилфуранов II кипятят в бензоле в присутствии хлорокиси фосфора с обратным холодильником в течение 1,5-3,5 ч в зависимости от заместителей R1 и R2.