Аминоиндановое производное или его соль
Иллюстрации
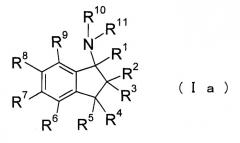
Показать всеИзобретение относится к новым производным аминоиндана формулы (Iа) или их фармацевтически приемлемым солям, которые обладают эффектом антагониста NMDA рецептора и могут использоваться для получения лекарственного средства для лечения деменции. В формуле (Iа):
R1 представляет собой низший алкил, С5-С6циклоалкил, фенил, который может быть замещенным ОН, низшим алкилом, атомом галогена, O-алкилом; С5-С6гетероарил, содержащий в качестве гетероатома атом S, или низший алкил, замещенный одним или несколькими атомами галогена, R2 и R3 являются одинаковыми или различными, каждый представляет собой низший алкил или фенил, R4 и R5 являются одинаковыми или различными, каждый представляет собой атом водорода, низший алкил, -O-низший алкил, -низший алкилен-ОН или -низший алкилен-O-низший алкил, R6-R9 являются одинаковыми или различными, каждый представляет собой атом водорода, низший алкил, -O-низший алкил, атом галогена, низший алкил, замещенный одним или несколькими атомами галогена, ОН, CN, низший алкенил или азотсодержащую C5-С6гетероциклическую группу, R10 и R11 являются одинаковыми или различными, каждый представляет собой атом водорода или низший алкил. Изобретение также относится к фармацевтической композиции, содержащей указанные соединения. 2 н. и 4 з.п. ф-лы, 15 табл.
Реферат
Настоящее изобретение относится к производному аминоиндана или его соли, которое полезно в качестве лекарственного средства, в частности в качестве антагониста NMDA рецептора, и к антагонисту NMDA рецептора, содержащему данное соединение в качестве активного ингредиента. Производное аминоиндана или его соль и антагонист NMDA рецептора, содержащий данное соединение в качестве активного ингредиента, по настоящему изобретению полезны для лечения или профилактики болезни Альцгеймера, цереброваскулярной деменции, болезни Паркинсона, ишемической апоплексии, боли и т.п.
Глутаминовая кислота действует в качестве нейромедиатора в центральной нервной системе млекопитающих и контролирует активность нейронов или высвобождение нейромедиаторов через глутаматный рецептор, находящийся в синапсах. В настоящее время глутаматный рецептор подразделяется на «ионотропный глутаматный рецептор» и «метаботропный глутаматный рецептор», по данным многих фармакологических и биологических исследований (Hollmann M. and Heinemann S., Annu. Rev. Neurosci., 17 (1994) 31-108). NMDA (N-метил-D-аспартат) рецептор является связанным с ионным каналом глутаматным рецептором, особенно чувствительным к агонистам NMDA (Moriyoshi K. et al., Nature, 354 (1991) 31-37; Meguro H. et al., Nature, 357 (1992) 70-74), и обладает высокой проницаемостью для Ca2+ (Iino M. et al., J. Physiol., 424 (1990) 151-165). NMDA рецептор экспрессирован специфическим образом в центральной нервной системе (Ozawa S. et al., Prog. Neurobiol., 54 (1998) 581-618).
По данным многих фармакологических и биологических исследований считается, что NMDA рецептор может участвовать в высокоорганизованных неврологических функциях, таких как память и обучение (Morris RG., et al., Nature, 319 (1986) 774-776; Tsien JZ. et al., Cell, 87 (1996) 1327-1338). С другой стороны предполагается, что острая и хроническая гиперактивность или гипоактивность NMDA рецептора может принимать участие при различных заболеваниях нервной системы, например, ишемической апоплексии, геморрагическом повреждении мозга, черепно-мозговой травме, нейродегенеративных расстройствах (например, болезнь Альцгеймера, цереброваскулярная деменция, болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз), глаукоме, СПИД-ассоциированной энцефалопатии, зависимости, шизофрении, депрессии, мании, связанных со стрессом заболеваний, эпилепсии и боли (Beal MF., FASEB J., 6 (1992) 3338-3344; Heresco-Levy U. and Javitt DC., Euro. Neuropsychopharmacol., 8 (1998) 141-152; Hewitt DJ., Clin. J. Pain, 16 (2000) S73-79). Соответственно, лекарственные средства, способные контролировать активность NMDA рецептора, будут исключительно полезны в клинической практике.
В качестве лекарственных средств, способных контролировать активность NMDA рецепторов, называют большое число неконкурентных антагонистов NMDA рецепторов, но многие из них не использовались в клинической практике из-за побочных эффектов, основанных на их антагонистическом действии в отношении NMDA рецептора, например психическом расстройстве, таком как галлюцинация или спутанность сознания, и головокружение. Некоторые из уже существующих антагонистов NMDA рецепторов, например кетамин и декстрометорфан, были апробированы в качестве обезболивающих средств в клинической практике (Fisher K. et al., J. Pain Symptom Manage., 20 (2000) 358-373), но при лечении этими препаратами диапазон безопасности узок и их клиническое применение ограничено (Eide PK., et al., Pain, 58 (1994) 347-354). Мемантин известен в качестве неконкурентного антагониста NMDA рецептора, который имеет относительно немного побочных эффектов (Parsons CG., et al., Neuropharmacol., 38 (1999) 735-767); и в последнее время сообщается, что он может быть эффективен при болезни Альцгеймера (Reisberg B., et al., N. Engl. J. Med., 348 (2003) 1333-1341). Тем не менее, диапазон безопасности мемантина в качестве лекарственного средства все еще неудовлетворительный, и требуется антагонист NMDA рецептора, обладающий более широким диапазоном безопасности (Ditzler K., Arzneimittelforschung, 41 (1991) 773-780; Maier C., et al., Pain, 103 (2003) 277-283; Riederer P., et al., Lancet, 338 (1991) 1022-1023). Ожидается, что создание такого антагониста NMDA рецептора, обладающего более широким диапазоном безопасности, может привести к новому клиническому применению антагониста NMDA рецептора.
В патентном документе 1 раскрывается фармацевтическая композиция для профилактики и лечения церебральной ишемии, которая содержит адамантановое производное, представленное следующей общей формулой, или его фармацевтически приемлемую кислотно-аддитивную соль:
[Химическая структура 1]
(где R1 и R2 являются одинаковыми или различными, и каждый представляет собой водород, линейную или разветвленную алкильную группу, имеющую 1-6 атомов углерода, или подобную; R3 и R4 являются одинаковыми или различными и каждый представляет собой водород, алкильную группу, имеющую 1-6 атомов углерода, или подобную; и R5 представляет собой водород или линейную или разветвленную алкильную группу, имеющую 1-6 атомов углерода, см. официальное издание для обозначения других радикалов в формуле).
В патентном документе 1, приведенном выше, мемантин описан как контрольное соединение № 1 (мемантин представляет собой соединение формулы, где R1, R2 и R3 представляют собой атомы водорода и R4 и R5 представляют собой метил).
Кроме того, в патентном документе 2 раскрывается 1-аминоалкилциклогексан, представленный следующей общей формулой, в качестве антагониста NMDA рецептора:
[Химическая структура 2]
(где R* представляет собой -(CH2)n-(CR6R7)m-NR8R9; n+m равно 0, 1 или 2; R1-R9, каждый независимо выбран из группы, состоящей из атома водорода и низшего C1-6алкила; и по меньшей мере R1, R4 и R5 представляют собой низший алкил, см. официальное издание для обозначения других радикалов в формуле).
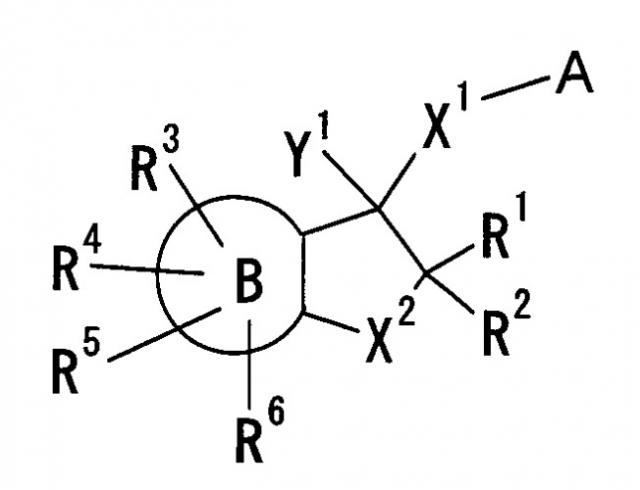
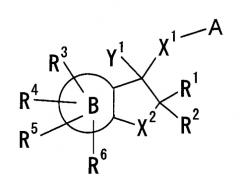
Кроме того, авторы настоящего изобретения сообщают в патентном документе 3 о циклическом аминном производном, представленным в качестве антагониста NMDA рецептора следующей общей формулы:
[Химическая структура 3]
(где A представляет собой 5-8-членный циклический амин, необязательно имеющий двойную связь, необязательно имеющий в структуре мостик и необязательно имеющий заместители R7-R11 в кольце, -NH2, -NH(низший алкил) или -N(низший алкил)2; кольцо B представляет собой бензол, тиофен, фуран, пиррол, 5-7-членный циклоалкан или 5-7-членный циклоалкен; X1 представляет собой связь, низший алкилен или -L3-D-L4-; и Y1 представляет собой -OH, -O-низший алкил, -NH2 или -N3, см. официальное издание для обозначения других радикалов в формуле).
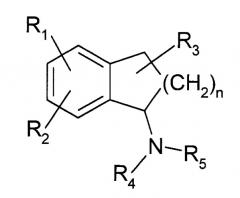
Кроме того, в патентном документе 4 раскрывается 1-аминоиндан, представленный следующей общей формулой, в качестве терапевтического агента для лечения болезни Паркинсона и подобных:
(где R1 и R2 независимо представляют собой водород, гидрокси, алкил, алкокси или подобные; R3 представляет собой водород, алкил, гидрокси, алкокси и подобные, R4 и R5 независимо представляют собой водород, алкил, арил или подобные; и n равен 0, 1 или 2).
Патентный документ 1: JP-A-2821233
Патентный документ 2: международная патентная публикация WO 99/01416
Патентный документ 3: международная патентная публикация WO 2006/033318
Патентный документ 4: международная патентная публикация WO 95/18617
В настоящее время повышается степень распространения у взрослого населения болезни Альцгеймера, цереброваскулярной деменции, ишемической апоплексии и подобных, и, таким образом, настоятельно требуется создание в области медицины антагониста NMDA рецептора, обладающего более широким диапазоном безопасности, который является эффективным для лечения или профилактики таких заболеваний, как болезнь Паркинсона, боль и подобных. Объектом настоящего изобретения является обеспечение нового аминоинданового производного или его соли, обладающего отличной активностью антагониста NMDA рецептора и имеющего широкий диапазон безопасности, и еще одним объектом является лекарственное средство, содержащее такое соединение.
Было обнаружено, что новое аминоиндановое производное, представленное следующей общей формулой (I) или (Iа), или его соль, которое отличается тем, что оно имеет аминогруппу и R1 (низший алкил, циклоалкил, -низший алкиленарил, арил, который может быть замещенным, и подобные) на атомах углерода инданового, циклопента[b]тиофенового, циклопента[b]фуранового, циклопента[b]пиридинового или циклопента[c]пиридинового кольца или 2,3-дигидро-1-бензофуранового, 2,3-дигидро-1-бензотиофенового, индолинового кольца или подобных, и имеет R2 и R3 (одинаковые или различные, каждый представляет собой низший алкил или арил) на атомах углерода, помимо них, обладает отличной активностью антагониста NMDA рецептора и широким диапазоном безопасности и, таким образом, определяет настоящее изобретение. В особенности, настоящее изобретение относится к аминоиндановому производному, представленному следующей общей формулой (I) или (Iа), или его соли (в дальнейшем называемое как "соединение формулы (I) по настоящему изобретению" или "соединение формулы (Iа) по настоящему изобретению"). Кроме того, настоящее изобретение также относится к антагонисту NMDA рецептора, в частности к терапевтическому агенту или агенту профилактики болезни Альцгеймера, цереброваскулярной деменции, ишемической апоплексии, боли и т.д., который содержит соединение формулы (I) или формулы (Iа) или его соль по настоящему изобретению в качестве активного компонента. Кроме того, термин “аминоиндановое производное”, как используют в настоящем изобретении, охватывает широкий интервал “аминоиндановых аналогов”, имеющих кольца, иные, чем индановое кольцо, например, циклопента[b]тиофеновые, циклопента[b]фурановые, циклопента[b]пиридиновые и циклопента[c]пиридиновые кольца, как описано выше, но без ограничения.
Соединение формулы (I) или формулы (Iа) по настоящему изобретению отличается от соединений, описанных в патентных документах 3 и 4, тем, что оно имеет аминогруппу, а также R1 (низший алкил, циклоалкил, -низший алкиленарил, арил, который может быть замещенным, и подобные), иной, чем атом водорода на индановом кольце и подобные, и имеет R2 и R3 (которые могут быть одинаковыми или различными и каждый представляет собой низший алкил или арил), иные, чем атомы водорода в их α положениях.
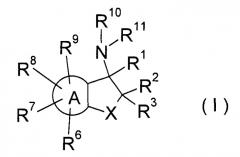
[1] Соединение, представленное следующей общей формулой (I) или его соль:
[Химическая структура 5]
(где радикалы в формуле (I) имеют следующие значения в указанном порядке:
кольцо A представляет собой 5-6-членное гетероциклическое кольцо или бензольное кольцо,
X представляет собой C(R4)(R5), O, S или N(R12),
R1 представляет собой низший алкил, циклоалкил, -низший алкиленарил, арил, который может быть замещенным, гетероарил, который может быть замещенным, или низший алкил, замещенный одним или несколькими атомами галогена,
R2 и R3 являются одинаковыми или различными, каждый представляет собой низший алкил или арил,
R4 и R5 являются одинаковыми или различными, каждый представляет собой атом водорода, низший алкил, -O-низший алкил, -OH, -низший алкилен-OH или -низший алкилен-O-низший алкил,
R6-R9 являются одинаковыми или различными, каждый представляет собой атом водорода, низший алкил, -O-низший алкил, атом галогена, низший алкил, замещенный одним или несколькими атомами галогена, OH, CN, низший алкенил или азотсодержащую гетероциклическую группу,
R10 и R11 являются одинаковыми или различными, каждый представляет собой атом водорода или низший алкил, и
R12 представляет собой атом водорода или низший алкил,
при условии, что R2 и R3 могут быть взяты вместе со смежным атомом углерода, с образованием циклоалкила).
[2] Соединение, представленное следующей общей формулой (Iа) или его соль:
[Химическая структура 6]
(где радикалы в формуле (Iа), представленной выше, имеют следующие значения в указанном порядке:
R1 представляет собой низший алкил, циклоалкил, -низший алкиленарил, арил, который может быть замещенным, гетероарил, который может быть замещенным, или низший алкил, замещенный одним или несколькими атомами галогена,
R2 и R3 являются одинаковыми или различными, каждый представляет собой низший алкил или арил,
R4 и R5 являются одинаковыми или различными, каждый представляет собой атом водорода, низший алкил, -O-низший алкил, -OH, -низший алкилен-OH или -низший алкилен-O-низший алкил,
R6-R9 являются одинаковыми или различными, каждый представляет собой атом водорода, низший алкил, -O-низший алкил, атом галогена, низший алкил, замещенный одним или несколькими атомами галогена, OH, CN, низший алкенил или азотсодержащую гетероциклическую группу,
R10 и R11 являются одинаковыми или различными, каждый представляет собой атом водорода или низший алкил,
при условии, что R2 и R3 могут быть взяты вместе со смежным атомом углерода, с образованием циклоалкила).
[3] Соединение или его соль, как описано в [2], где каждый R4, R5, R10 и R11 в формуле (Ia), указанной выше, представляет собой атом водорода.
[4] Соединение или его соль, как описано в [3], где R2 и R3 в формуле (Iа), указанной выше, являются одинаковыми или различными, и каждый представляет собой низший алкил или циклоалкил, образованный в комбинации с соседним атомом углерода.
[5] Соединение или его соль, как описано в [1], которое выбирают из 2,2-диметил-1-фенилиндан-1-амина, 1-(4-фторфенил)-2,2-диметилиндан-1-амина, 1-(2-метоксифенил)-2,2-диметилиндан-1-амина, 1-(3-метоксифенил)-2,2-диметилиндан-1-амина, 1,2,2-триметилиндан-1-амина, 1,2,2,5-тетраметилиндан-1-амина, 1,2,2,6-тетраметилиндан-1-амина, 4-фтор-1,2,2-триметилиндан-1-амина, 5-фтор-1,2,2-триметилиндан-1-амина, 7-фтор-1,2,2-триметилиндан-1-амина, 5-метокси-1,2,2-триметилиндан-1-амина, 6-метокси-1,2,2-триметилиндан-1-амина, 6-изопропокси-1,2,2-триметилиндан-1-амина, 1-этил-2,2-диметилиндан-1-амина, 1-изопропил-2,2-диметилиндан-1-амина, 1'-метил-1',3'-дигидроспиро[циклопропан-1,2'-индин]-1'-амина, 2,4,5,5-тетраметил-5,5-дигидро-4H-циклопента[b]тиофен-4-амина.
[6] Фармацевтическая композиция, содержащая соединение или его соль, как описано в [1] или [2].
[7] Фармацевтическая композиция, как описано в [6], которая представляет собой антагонист NMDA рецептора.
[8] Фармацевтическая композиция, как описано в [6], которая представляет собой терапевтический агент для лечения деменции.
[9] Применение соединения или его соли, как описано в [1] или [2], для получения антагониста NMDA рецептора или терапевтического агента для лечения деменции.
[10] Способ лечения деменции, включающий введение терапевтически эффективного количества соединения или его соли, как описано в [1] или [2], пациенту.
Соединение по настоящему изобретению обладает активностью антагониста NMDA рецептора и, таким образом, является полезным для лечения или профилактики болезни Альцгеймера, цереброваскулярной деменции, болезни Паркинсона, ишемической апоплексии, боли и подобных.
Ниже в настоящем описании настоящее изобретение описано подробно.
Если не указано иное, термин "низший", как используют в определении общей формулы в настоящем описании, означает линейную или разветвленную углеродную цепь, имеющую 1-6 атомов углерода. Таким образом, термин "низший алкил" предпочтительно представляет собой линейный или разветвленный C1-6алкил, и его примеры включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил и изогексил. Среди них предпочтительными являются алкилы, имеющие 1-4 атома углерода; и особенно предпочтительными являются метил и этил.
Примеры "низшего алкилена" включают метилен, этилен, пропилен, бутилен, а также другой разветвленный низший алкилен. Предпочтительным является низший алкилен, имеющий 1-3 атома углерода; более предпочтительным является метилен и этилен; и особенно предпочтительным является метилен.
Примеры "атома галогена" включают атом фтора, атом хлора, атом брома и атом йода. Среди них предпочтительными являются атом фтора, атом хлора и атом брома.
Термин "низший алкил, замещенный одним или несколькими атомами галогена" означает, что любой из атомов водорода "низшего алкила", как описано выше, заменен одним или несколькими "атомами галогена". Особенно предпочтительным является CF3.
Термин "циклоалкил" означает циклоалкил, имеющий 3-8 атомов углерода.
Термин "R2 и R3, взятые вместе со смежным атомом углерода, с образованием циклоалкила", в частности, означает, что циклопропил, циклобутил, циклопентил или циклогексил образованы как таковые. Предпочтительным является циклопропил.
Примеры "низшего алкенила" включают винил, 1- или 2-пропенил, изопропенил, 2-метил-1-пропенил, 2-метил-2-пропенил, 1-метил-1-пропенил и 1-метил-2-пропенил. Предпочтительным является винил.
Примеры "низшего алкинила" предпочтительно включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил и 1-метил-2-пропинил.
Термин "арил" означает моно-трициклическую ароматическую углеводородную кольцевую группу, имеющую 6-14 атомов углерода. Предпочтительно, его примеры включают фенил, нафтил, антрил и фенантрил и особенно предпочтительным является фенил.
Термин "гетероарил" означает 5- или 6-членную ароматическую гетероциклическую группу, имеющую 1-4 гетероатома, выбранных из атома азота, атома кислорода и атома серы. Предпочтительно, его примеры включают тиенил, фурил, пирролил, тиазолил, пиридил и пиримидил и особенно предпочтительным является тиенил.
В качестве "-низшего алкиленарила" особенно предпочтительными являются бензил и фенетил.
Примеры "заместителя" "арила, который может быть замещенным" или "гетероарила, который может быть замещенным" включают низший алкил, -O-низший алкил, атом галогена, OH, CN, CF3, -NH2, -NH(низший алкил) и -N(низший алкил)2, но не ограничиваясь ими.
Термин "азотсодержащая гетероциклическая группа" означает 3-7-членную моноциклическую азотсодержащую гетероциклическую группу, включающую 1-3 атома азота. Предпочтительным является 4-6-членная моноциклическая насыщенная гетероциклическая группа и более предпочтительными являются азетидил, пирролидил и пиперидил.
Термин "5-6-членное гетероциклическое кольцо" означает тиофеновое, фурановое, пиридиновое кольца и подобные. Таким образом, в настоящем изобретении взятое вместе со смежным циклопентановым кольцом образует 5,6-дигидро-5H-циклопента[b]тиофеновое, 5,6-дигидро-5H-циклопента[b]фурановое, 6,7-дигидро-5H-циклопента[b]пиридиновое, 6,7-дигидро-5H-циклопента[c]пиридиновое кольца и подобные.
Кроме того, "X" означает в настоящем описании гетероатомы, например, такие как O и S или NR12, а также C(R4)(R5). В настоящем описании C(R4)(R5) означает, что атомы углерода имеют заместители R4 и R5.
Кроме того, соединения по настоящему изобретению включают смеси различных изомеров, например таутомеры и оптические изомеры, а также индивидуальные изомеры, выделенные из них.
Соединения по настоящему изобретению могут образовывать кислотно-аддитивные соли. В зависимости от типа заместителя такие соединения могут образовывать соли с основаниями. В частности, соли включают кислотно-аддитивные соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота и этансульфоновая кислота; или кислыми аминокислотами, такими как аспарагиновая кислота и глутаминовая кислота, а также соли с неорганическим основанием, таким как натрий, калий, магний, кальций, алюминий; органическим основанием, таким как метиламин, этиламин и этаноламин; или основной аминокислотой, такой как лизин, орнитин; и аммонийные соли.
Кроме того, соединения по настоящему изобретению включают гидраты, различные фармацевтически приемлемые сольваты и кристаллические полиморфные соединения.
Кроме того, естественно, соединения по настоящему изобретению не ограничены теми, которые описаны в примерах, как приведено ниже, и включают все соединения указанной выше общей формулы (I) или (Iа) и их фармацевтически приемлемые соли.
В дополнение, соединения по настоящему изобретению включают пролекарства, которые метаболизируются в живых организмах, обеспечивая соединения указанной выше формулы (I) или (Iа) или соединения, которые должны преобразовываться в их соли. Примеры групп, для образования пролекарств соединений по настоящему изобретению, включают группы, как описано в Prog. Med., 5:2157-2161 (1985), и группы, как описано в Pharmaceutical Research, Drug Design, Hirokawa Publishing Company (1990), Vol. 7, Molecular Planning, p. 163-198.
[Способы получения]
Принимая во внимание особенности, основанные на основной структуре или типе их заместителя, соединения по настоящему изобретению могут быть получены в соответствии с различными известными способами получения. В зависимости от типа функциональной группы, функциональная группа в исходных соединениях или промежуточных соединениях может быть модифицирована в подходящую защитную группу или группу, которая может быть легко преобразована в функциональную группу, которая может быть технологически эффективной при получении соединений. После завершения процесса, при необходимости, защитная группа может быть необязательно удалена, и обозначенное соединение может быть, таким образом, получено. Примеры функциональной группы включают гидроксильную группу и карбоксильную группу. Примеры их защитных групп включают защитные группы, описанные у Greene & Wuts' “Protective Groups in Organic Synthesis”, 2nd Ed. В зависимости от условий реакции они могут быть соответствующим образом использованы.
Обычные способы получения соединений формулы (I) по настоящему изобретению описаны ниже, но само собой разумеется, что соединения формулы (Iа) по настоящему изобретению могут быть также получены с помощью соответствующих методик.
(Способы получения)
Соединение формулы (Ib) по настоящему изобретению может быть получено с помощью способа, представленного на схеме 1. Инданoн (1) и реагент Гриньяра или органический литиевый реагент (2) могут быть подвергнуты взаимодействию в инертном растворителе, таком как тетрагидрофуран (в дальнейшем называемый "ТГФ"), диэтиловый эфир и дихлорметан, в условиях от охлаждения до комнатной температуры и, если требуется, при нагревании, что дает спирт (3). Затем спирт (3) может быть в дальнейшем подвергнут взаимодействию с агентом азидирования, например азидом натрия и триметилсилилазидом, в растворителе, таком как хлороформ, 1,2-дихлорэтан и толуол, в присутствии кислоты, такой как трифторуксусная кислота, серная кислота и метансульфоновая кислота, в условиях от охлаждения до комнатной температуры и, если требуется, при нагревании, что дает азид (4). Затем азид (4) может быть подвергнут каталитическому восстановлению водородом в атмосфере водорода в условиях от нормального давления до повышенного в инертном растворителе, таком как этанол, этилацетат, ТГФ и уксусная кислота, используя катализатор, такой как палладий на углероде, никель Ренея и оксид палладия, в условиях от комнатной температуры до нагревания или подвергнут гидридному восстановлению в растворителе, таком как ТГФ и диэтиловый эфир, в условиях от охлаждения до нагревания, используя агент восстановления, например литийалюминийгидрид, и азид (4) может быть в дальнейшем подвергнут взаимодействию с фосфиновым реагентом, например трифенилфосфином и трибутилфосфином, в растворителе, таком как ТГФ, метанол, толуол, вода или их смешанный растворитель, в условиях от комнатной температуры до нагревания с получением соединения формулы (Ib), где в соединении формулы (I) по настоящему изобретению R10 и R11 оба представляют собой атомы водорода. Кроме того, соединение формулы (Ib) может быть подвергнуто взаимодействию с альдегидом в присутствии катализатора палладия на углероде, родия на углероде или подобных в растворителе, таком как этанол и ТГФ, в атмосфере водорода в условиях от комнатной температуры до нагревания с получением соединения формулы (Ic), где в соединении формулы (I) по настоящему изобретению по меньшей мере один из R10 и R11 представляет собой низшую алкильную группу. Кроме того, соединение формулы (I) по настоящему изобретению представлено следующей общей формулой (Ib) или (Ic):
[Химическая структура 7]
(где A, X, R1-R3 и R6-R9 каждый является таким, как определено выше. Кроме того, R12 представляет собой водород или низшую алкильную группу, R13 представляет собой ―CH2-R12 или атом водорода, и M представляет собой щелочные металлы, например галогениды лития и магния).
Соединения формулы (I) по настоящему изобретению могут быть подвергнуты реакции для модификации группы, известной специалисту в данной области, что дает соединение, имеющее желаемый заместитель. Конкретные реакции для этого описаны ниже.
Среди соединений формулы (I) по настоящему изобретению соединение, где любой один из R6-R9 представляет собой цианогруппу, может быть получено путем обработки соответствующего соединения, где R6-R9 представляют собой группы брома, с Zn(CN)2 в присутствии катализатора, такого как Pd(PPh3)4, в растворителе, таком как ДМФА и N-метилпиперидон, при нагревании.
Среди соединений формулы (1) по настоящему изобретению, в случае когда X представляет собой C(R4)(R5), соединение, где любой один из R3-R6 представляет собой арильную группу, которая может быть замещенной, низшую алкенильную группу или низшую алкинильную группу, может быть получено путем взаимодействия соответствующего соединения, где любой один из R3-R6 представляет собой группу брома или йода с арилбороновой кислотой, алкенилбороновой кислотой, алкинилбороновой кислотой или их боронатным эфиром в присутствии катализатора, такого как Pd(PPh3)4, PdCl2(dppf) или Pd2(dbа)3, в присутствии основания, например, K2CO2, Na2CO2, KOH, CsF и NaOEt, в растворителе, таком как ДМФА, N-метилпиперидон, DME и толуол или их смешанный растворитель с водой, при нагревании (реакция Сузуки).
Кроме того, снятие защиты может быть осуществлено в подходящем растворителе в присутствии подходящего основания. Конкретные примеры основания включают NaOH, KOH, NaOMe и NaOEt. Конкретные примеры растворителя включают простые эфиры, например ТГФ, диоксан и диглим; спирты, например, MeOH, EtOH и изо-PrOH; MeCN, воду; или смешанный растворитель. В зависимости от типа реакционной смеси и условий реакции, растворитель может быть выбран соответствующим образом. Температура реакции может изменяться в зависимости от типа исходного соединения и условий реакции, как правило, включая условия от охлаждения до кипячения с обратным холодильником, предпочтительно приблизительно от 0°C дo приблизительно 100°C.
Кроме того, снятие защиты может также быть осуществлено в присутствии металлического катализатора, такого как Pd-C, Pd(OH)2 и PtO2, в подходящем растворителе в атмосфере водорода, но может быть осуществлено в присутствии подходящей кислоты Льюиса в подходящем растворителе. Примерами кислоты Льюиса являются BCl3, BBr3 и AlCl3, и примерами растворителя являются простые эфиры, такие как ТГФ, диоксан; сложные эфиры, например, этилацетат; спирты, такие как MeOH, EtOH; MeCN; и их смесь. В зависимости от типа реакционной смеси и условий реакции, растворитель может быть выбран соответствующим образом. Температура реакции может изменяться в зависимости от типа исходного соединения и условий реакции, как правило, включая условия от охлаждения до кипячения с обратным холодильником, предпочтительно приблизительно от -80°C дo приблизительно 30°C.
Полученные таким образом соединения формулы (I) по настоящему изобретению могут быть выделены в виде свободных соединений или в виде фармацевтически приемлемых солей. Соль соединений формулы (I) по настоящему изобретению может быть получена путем обработки соединений формулы (I) по настоящему изобретению, находящихся в виде свободных оснований, путем обычных реакций солеобразования.
Соединение формулы (I) по настоящему изобретению или его фармацевтически приемлемая соль может быть выделена и очищена в виде гидратов, сольватов или кристаллических полиморфных форм. Выделение и очистка могут быть осуществлены через обычную химическую обработку экстрагированием, концентрированием, упариванием, кристаллизацией, фильтрованием, перекристаллизацией и различными типами хроматографии.
Различные изомеры могут быть выделены путем подбора подходящих исходных соединений или путем разделения, которое основывается на отличии между изомерами по их физическим или химическим особенностям. Например, оптические изомеры могут быть переведены в их стереохимически чистые изомеры путем подбора подходящих исходных соединений или путем рацемического разделения рацемических соединений (например, путем перевода их в диастереомерные соли с помощью обычной оптически активной кислоты для оптического разделения).
Соединения по настоящему изобретению или их соль, выбранные из 2,2-диметил-1-фенилиндан-1-амина, 1-(4-фторфенил)-2,2-диметилиндан-1-амина, 1-(2-метоксифенил)-2,2-диметилиндан-1-амина, 1-(3-метоксифенил)-2,2-диметилиндан-1-амина, 1,2,2-триметилиндан-1-амина, 1,2,2,5-тетраметилиндан-1-амина, 1,2,2,6-тетраметилиндан-1-амина, 4-фтор-1,2,2-триметилиндан-1-амина, 5-фтор-1,2,2-триметилиндан-1-амина, 7-фтор-1,2,2-триметилиндан-1-амина, 5-метокси-1,2,2-триметилиндан-1-амина, 6-метокси-1,2,2-триметилиндан-1-амина, 6-изопропокси-1,2,2-триметилиндан-1-амина, 1-этил-2,2-диметилиндан-1-амина, 1-изопропил-2,2-диметилиндан-1-амина, 1'-метил-1',3'-дигидроспиро[циклопропан-1,2'-инден]-1'-амина, 2,4,5,5-тетраметил-5,5-дигидро-4H-циклопента[b]тиофен-4-амина, могут быть подвергнуты оптическому разделению на (R)-изомеры и (S)-изомеры с помощью описанного выше способа.
Антагонистическая активность NMDA рецепторов соединений настоящего изобретения была подтверждена следующими способами тестирования.
1. Тест на связывание MK-801
1) Приготовление препаратов мозговых оболочек крыс
Цельный головной мозг извлекают у 30 10-недельных крыс SD (Nippon SLC), из них извлекают мозжечок. Раствор сахарозы 0,32М добавляют к части, содержащей головной мозг, измельчают миксером и гомогенизируют в гомогенизаторе TeflonTM (торговая марка). Полученный материал гомогенизируют при 2800 об/мин и 4°C в течение 15 минут и полученный супернатант снова центрифугируют при 15000 g и 4°C в течение 20 минут. Осадки суспендируют в 50 мМ Tris-HCl (pH 7,5), содержащем 0,08% Triton X-100, и выдерживают в покое на льду в течение 30 минут, затем центрифугируют при 15000 g и 4°C в течение 20 минут. Осадки суспендируют в добавленном 50 мМ Tris-HCl (pH 7,5) и центрифугируют при 15000 g и 4°C в течение 20 минут. 50 мМ Tris-HCl (pH 7,5) вновь добавляют к осадкам и центрифугируют таким же образом, как описано выше. Полученный осадок суспендируют в 20 мл добавленного 50 мМ Tris-HCl (pH 7,5) и гомогенизируют с помощью гомогенизатора TeflonTM (торговая марка). Препарат мембран разделяют по небольшим пробиркам и хранят в аппарате глубокого замораживания (-80°C). Перед использованием полученный материал промывают дважды 5 мМ Tris-HCl (pH 7,5) в пять раз большим количеством, чем препарат мембран. Концентрацию контролируют на уровне 1 мг белка/мл при помощи добавления 5 мМ Tris-HCl (pH 7,5) и используют для исследования.
2) Исследование связывания [3H]
50 мкл препарата мембран крыс (1 мг белка/мл) добавляют к раствору тестируемого соединения, растворенного в 1 мкл ДМСО. Затем добавляют 50 мкл раствора лиганда (600 нМ глутамата, 600 нМ глицина, 8 нМ [3H] MK-801 (Perkin-Elmer)), тщательно размешивают и реакцию проводят при комнатной температуре в течение 45 минут. Используя пластину Uni Filter Plate GF/B 96 (Perkin-Elmer), предварительно покрытую 0,2% полиэтиленимином, собирают мембранный препарат и затем данный фильтр тщательно промывают 5 мМ Tris-HCl (pH 7,5). 30 мкл Microscinti 20 (Perkin-Elmer) добавляют к фильтру и радиоактивность, уловленную фильтром, определяют с помощью микропланшетного сцинтилляционного счетчика (TopCountTM от Beckman). На основании ингибирования MK-801 (конечная концентрация 1 мкМ) подсчитывают концентрацию соединения для 50% ингибирования, IC50, принимая за 100% контроль, когда используется только ДМСО. Аффинность связывания [3H]MK-801 для крысиного мембранного препарата получали таким образом, чтобы по анализу Scatchard Kd=1,6 нМ. Значение Ki соединения подсчитывают в соответствии с расчетом уравнения: Ki=IC50/(1+концентрация радиолиганда (4 нМ) в исследовании)/значение Kd (1,6 нМ).
В результате, соединения настоящего изобретения продемонстрировали выраженную аффинность в отношении NMDA рецептора. Значения Ki аффинности в отношении NMDA рецепторов некоторых конкретных соединений настоящего изобретения показаны в приведенной ниже таблице 1.
| Таблица 1 | |||
| Соединение настоящего изобретения | Ki (мкM) | Соединение настоящего изобретения | Ki (мкM) |
| Пример 2 | 0,4 | Пример 38 | 0,3 |
| Пример 10 | 0,4 | Пример 41 | 0,8 |
| Пример 17 | 0,8 | Пример 42 | 0,3 |
| Пример 18 | 0,3 | Пример 43 | 0,3 |
| Пример 21 | 0,1 | Пример 44 | 0,6 |
| Пример 23 | 0,9 | Пример 48 | 0,6 |
| Пример 36 | 0,4 | Пример 59 | 0,9 |
| Пример 37 | 0,1 | Пример 61 | 0,5 |
2. Тест определения внутриклеточной концентрации кальция посредством FLIPR (Fluorometric Imaging Plate Reader)
1) Приготовление нервных клеток крыс первого поколения
Анестезированных эфиром крыс Wistar (Nippon SLC), беременных в течение 19 дней, умерщвляют посредством выпускания крови из грудного разреза. Живот вскрывают, извлекают матку, из нее достают плод. Цельный мозг извлекают, затем полушарие изолируют в среде Neurobasal (Glu, без Asp) (Gibco) и удаляют мозговую оболочку. Полушарие измельчают посредством центрифугирования и суспендируют в диспергирующем клетки растворе (0,36 мг/мл папаина, 150 Ед/мл ДНКазы 1, 0,02% моногидрохлорида моногидрата L-цистеина, 0,02% бычий сывороточный альбумин, 0,5% глюкоза, PBS без Ca2+, Mg2+) и проводят реакцию при 37°C в течение 15 минут. Материал центрифугируют при 400 g в течение 15 минут и супернатант удаляют путем аспирации. Полученный материал суспендируют в нейронной культуральной среде (Sumitomo Bakelite) и клеточные массы удаляют фильтрованием. Число живых клеток подсчитывают и 100000 клеток/лунка инкубируют на 96-луночном планшете (Biocoat PDL96W black/clear, by Nippon Becton Dickinson) (при 37°C в 5% CO2).
2) Определение внутриклеточной концентрации кальция посредством FLIPR
Культуру нервных клеток крысы первого поколения (DIV7-9) удаляют посредством аспирации и клетки промывают однократно 100 мкл буфера исследования (Hank's Balanced Salt Solution (без Ca2+, Mg 2+), 20 мМ Hepes-NaOH (pH 7,4), 1 мМ CaCl2). 100 мкл буфера исследования, содержащего Fluo3 (Dojin Chemical), добавляют и инкубируют в течение 1 часа (37°C, 5% CO2). Клетки промывают трижды 100 мкл буфера исследования и затем раствор соединения в 1 мкл ДМСО и 100 мкл буфера исследования, содержащего 2,5 мкМ (конечная концентрация) тетродотоксина, добавляют к смеси и инкубируют в течение 30 минут (37°C, 5% CO2). Интенсивность флуоресценции измеряют через интервалы 2 секунды. Через десять секунд после начала измерений добавляют 50 мкл раствора лиганда (Hank's Balanced Salt Solution (без Ca 2+, Mg 2+), 20 мМ Hepes-NaOH (pH 7,4), 1 мМ CaCl2, 9 мкМ NMDA, 30 мкМ глицина), содержащего раствор тестируемого соединения, растворенного в 0,5 мкл ДМСО, и интенсивность флуоресценции системы измеряют в течение 120 секунд от начала измерения. Данные, полученные в течение 120 секунд (в общем 60 измерений), усредняют. Основываясь на ингибировании 10 мкМ MK-801 с контролем только ДМСО 100%, подсчитывают концентраци