Лекарственная форма и способ для доставки вызывающих зависимость лекарственных веществ
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается лекарственной формы и способа для доставки лекарственных веществ, в частности вызывающих зависимость лекарственных веществ, характеризующихся устойчивостью к экстракции растворителем, сдавлению, дроблению или измельчению, и обеспечивающих первоначальное быстрое высвобождение лекарственного вещества с последующим длительным периодом контролируемого высвобождения лекарственного вещества. 5 н. и 37 з.п. ф-лы, 34 табл., 33 ил.
Реферат
Техническая область изобретения
Настоящее изобретение относится к композициям для перорального введения. Настоящее изобретение предпочтительно относится по меньшей мере к одной обеспечивающей устойчивость к зависимости композиции для доставки лекарственного вещества, имеющего способность вызывать зависимость, к связанным с ней способам получения таких лекарственных форм и способам лечения пациента, нуждающегося в этом, включающим введение пациенту композиций по этому изобретению.
Предпосылки изобретения
Зависимость от назначаемых лекарственных веществ стала проблемой общественного здравоохранения во многих сообществах. Одним распространенным классом лекарственных веществ, которые вызывают зависимость, является класс опиоидов. Опиоиды представляют собой основной класс анальгетиков, применяемых для управления болью от умеренной до тяжелой степени в США, вследствие их эффективности, простоты титрования и благоприятного соотношения риска и пользы.
Одним из эффектов введения опиоидов является способность таких лекарственных веществ у некоторых индивидов изменять настроение и ощущения таким образом, чтобы появлялось желательное чувство "благополучия", разобщенное с терапевтическими эффектами смягчения. Этот эффект изменения настроения некоторые индивиды считают очень приятным, и это может быть связано с тем фактом, что некоторые потребители имеют высокий риск применения незаконных лекарственных веществ и привыкания к применению опиоидов.
В США было выявлено три основных модели опиоидной зависимости. Одна модель вовлекает индивидов, применение которыми лекарственного вещества начинается в условиях медицинского лечения и которые первоначально получают лекарственное вещество через медицинские инстанции. Другая модель вовлекает лиц, применение которыми лекарственного вещества начинается с экспериментального или "рекреационного" применения лекарственного вещества и переходит в более интенсивное применение лекарственного вещества. Наконец, существуют потребители, которые начинают применять лекарственные вещества, полученные из медицинских инстанций или через пути рекреационных лекарственных веществ, однако позднее переключаются на пероральные опиоиды, получаемые через организованные программы лечения зависимости.
Зависимость от опиоидов, вводимых пероральным путем, является значительной. Однако оказывается, что другой значительной проблемой для опиоидной зависимости является опиоидная зависимость от лекарственных веществ, вводимых посредством парентерального введения, в частности посредством инъекции. Известно, что быстрая инъекция опиоидных агонистов приводит к вызывающему потепление приливу крови к коже и возбуждению. Состояние, альтернативно известное как "наслаждение", "удовлетворение" или "возбуждение", как правило, длится в течение только 45 секунд, однако наркоманы считают его очень приятным. Зависимые индивиды экстрагируют твердые лекарственные формы опиоидов, а затем инъецируют их для достижения такого состояния. Также известно, что опиоиды вызывают зависимость посредством назального введения, где потенциальное вызывающее зависимость лекарственное вещество дробят и измельчают и вдыхают через нос.
Некоторые предложенные в настоящее время фармакологические способы для предотвращения экстракции пероральных опиоидов включают один или несколько опиодных антагонистов, смешанных опиоидных агонистов-антагонистов и других оказывающих отрицательное действие лекарственных веществ с терапевтическим опиоидным агонистом. В большинстве предложенных систем доза опиоидного антагониста не является перорально активной, однако она будет блокировать желательные для зависимых лиц эффекты лекарственного вещества-агониста или смешанного лекарственного вещества агониста-антагониста, когда лекарственное вещество растворяют для получения агониста (или смешанного лекарственного вещества агониста-антагониста), а затем вводят опиоид парентерально. Однако в этих случаях врачи могут опасаться, что ненадлежащее высвобождение вызывающих отрицательное действие лекарственных веществ может быть вредным, и некоторые из них не согласны назначать опиоиды, изготовленные совместно с вызывающими отрицательное действие лекарственными веществами.
Например, недостаток подходов с включением опиоидных антагонистов в препарат опиоида для предотвращения зависимости состоит в том, что опиоидные антагонисты сами по себе имеют побочные эффекты, которые могут быть неблагоприятными. Например, налорфин вызывает неприятные реакции, такие как тревога, иррациональные ощущения, галлюцинации, угнетение дыхания и миоз. В случае налоксона описаны обмороки, хотя и нечасто, и у пациентов после хирургической операции при высоких дозах выявляли отек легких и фибрилляцию желудочков. Описано, что налтрексон способен вызвать печеночно-клеточное повреждение при введении в дозах, уже в пять раз или менее превышающих терапевтические дозы. Описано, что налмефен, хотя он обычно хорошо переносится, у некоторых индивидов вызывает тошноту, рвоту и тахикардию. Небольшие дозы любого из этих опиоидных антагонистов также могут форсировать абстинентный синдром у зависимых от опиоидов индивидов, даже в низких дозах, эффект, который может быть чрезвычайно опасен, в зависимости от того, где зависимый индивид принимает лекарственное вещество.
Аналогично опиоидам, многие другие классы лекарственных веществ также вызывают зависимость, хотя характер и эффекты зависимости в некоторой степени отличаются.
В WO 2005/079760 (Euroceltique) описаны экструдированные плавлением композиции с контролируемым высвобождением из множества частиц, содержащие нейтральный сополимер поли(этилакрилат, метилметакрилат) и активный ингредиент. Указано, что композиции обладают каучукоподобными свойствами, так что они проявляют повышенную устойчивость к сдавлению.
US 2003/0118641 (Boehringer Ingelheim) относится к способу снижения потенциала в отношении зависимости пероральной лекарственной формы опиоида, экстрагируемого обычно доступными бытовыми растворителями, при этом указанный способ включает комбинирование терапевтически эффективного количества опиоидного соединения, матриксного полимера и ионообменной смолы. Предпочтительными являются ионообменные смолы, которые проявляют свойства сильных кислот.
WO 00/041481 (Knoll) относится к формам лекарственных веществ, содержащим активные вещества с высокой растворимостью в воде в матриксе на основе акрилатных полимеров.
Публикация патентной заявки США No. 2006/0002860 (Bartholomaus et al.) относится к устойчивым к сдавлению композициям лекарственного вещества, пригодным в случае вызывающих зависимость лекарственных веществ.
Несмотря на то что существует множество композиций, составов и способов, направленных против зависимости от лекарственных веществ, все композиции, составы и способы обладают ограничениями в большей или меньшей степени. Таким образом, существует необходимость в предоставлении новых и/или улучшенных составов, композиций и способов предотвращения зависимости от лекарственных веществ, обладающих способностью вызывать зависимость.
Эта информация об уровне техники предоставлена для передачи некоторой информации, которая, как полагает заявитель, возможно, имеет отношение к настоящему изобретению. Не подразумевается допущений, и не следует истолковывать, что любая из предшествующей информации составляет предшествующий уровень техники для настоящего изобретения.
Сущность изобретения
Определенные предпочтительные варианты осуществления настоящего изобретения относятся к лекарственным формам и способам доставки лекарственных веществ, в частности вызывающих зависимость лекарственных веществ, характеризующихся устойчивостью к экстракции растворителем, сдавлению, дроблению или измельчению, и обеспечивающим первоначальный выброс лекарственного вещества с последующим длительным периодом контролируемого высвобождения лекарственного вещества.
Один иллюстративный вариант осуществления настоящего изобретения относится к предотвращающей зависимость композиции лекарственного вещества, содержащей подвергнутую плавлению смесь: a) по меньшей мере одного вызывающего зависимость лекарственного вещества, b) по меньшей мере одного простого эфира целлюлозы или сложного эфира целлюлозы и c) по меньшей мере одного алкилалкакрилатного полимера, алкакрилатного полимера или их комбинации. В этом варианте осуществления количество лекарственного вещества, которое экстрагируется из композиции 40% водным раствором этанола в течение одного часа при 37°C, является меньшим или равным двойному количеству лекарственного вещества, которое экстрагируется 0,01 Н хлористоводородной кислотой в течение одного часа при 37°C, и композиция лекарственного вещества адаптирована таким образом, чтобы она была пригодна для перорального введения человеку 3, 2 или 1 раз в сутки.
Другой иллюстративный вариант осуществления настоящего изобретения относится к монолитной пероральной лекарственной композиции с замедленным высвобождением, содержащей подвергнутую плавлению смесь: a) эффективного для анальгезии количества по меньшей мере одного вызывающего зависимость лекарственного вещества, b) по меньшей мере одного простого эфира целлюлозы или сложного эфира целлюлозы и c) по меньшей мере одного алкилалкакрилатного полимера, алкакрилатного полимера или их комбинации. В этом варианте осуществления количество лекарственного вещества, которое экстрагируется из композиции 40% водным раствором этанола в течение одного часа при 37°C, является меньшим или равным двойному количеству лекарственного вещества, которое экстрагируется 0,01 Н хлористоводородной кислотой в течение одного часа при 37°C; и композиция лекарственного вещества адаптирована для замедленного высвобождения, чтобы она была пригодна для перорального введения человеку 3, 2 или 1 раз в сутки.
Другой иллюстративный вариант осуществления настоящего изобретения относится к пероральной лекарственной композиции с замедленным высвобождением лекарственного вещества, характеризующейся по меньшей мере двумя из следующих признаков: a) количество лекарственного вещества, которое экстрагируется из композиции 40% водным раствором этанола в течение одного часа при 37°C, является меньшим или равным двойному количеству лекарственного вещества, которое экстрагируется 0,01 Н хлористоводородной кислотой в течение одного часа при 37°C, b) композиция не разрушается под действием силы 150 ньютон, предпочтительно 300 ньютон, более предпочтительно 450 ньютон, еще более предпочтительно 500 ньютон, как определяют с помощью измерителя твердости "Pharma Test PTB 501", и c) композиция высвобождает по меньшей мере 15% одного лекарственного вещества и не более 45% одного лекарственного вещества в течение первого часа тестирования растворения in vitro и предпочтительно также in vivo.
Другой иллюстративный вариант осуществления настоящего изобретения относится к неизмельченной экструдированной плавлением композиции лекарственного вещества, содержащей лекарственное вещество со способностью вызывать лекарственную зависимость.
Иллюстративный вариант осуществления настоящего изобретения также относится к монолитной, неизмельченной, не состоящей из множества частиц, экструдированной плавлением композиции лекарственного вещества, содержащей лекарственное вещество со способностью вызывать лекарственную зависимость, имеющей диаметр от приблизительно по меньшей мере 5,1 мм до приблизительно 10 мм и длину от приблизительно 5,1 мм до приблизительно 30 мм.
Другой иллюстративный вариант осуществления настоящего изобретения относится к способу получения устойчивой к зависимости дозированной композиции лекарственного вещества, включающему экструдирование плавлением композиции, содержащей по меньшей мере одно терапевтическое вещество, дополнительно включающему прямое придание формы экструдату лекарственной формы без (промежуточной) стадии измельчения или стадии образования множества частиц.
Другой иллюстративный вариант осуществления настоящего изобретения относится к монолитной, неизмельченной, экструдированной плавлением композиции лекарственного вещества, содержащей лекарственное вещество со способностью вызывать лекарственную зависимость, где монолитная композиция обладает по существу профилем высвобождения лекарственного вещества, сходным с дробленой формой монолитного композиции, где монолитную композицию дробят при от приблизительно 20000 об/мин до приблизительно 50000 об/мин в машине для измельчения кофе в течение приблизительно 60 секунд c устройством для дробления, имеющим лезвия из нержавеющей стали, мотор приблизительно на 150 ватт и емкость приблизительно для 90 миллилитров (т.е. приблизительно 3 унций) кофейных зерен.
Другой иллюстративный вариант осуществления настоящего изобретения относится к предотвращающей зависимость композиции лекарственного вещества, содержащей подвергнутую плавлению смесь: a) по меньшей мере одного вызывающего зависимость лекарственного средства, b) по меньшей мере одного изменяющего скорость фармацевтически приемлемого полимера, сополимера или их комбинации. В этом варианте осуществления количество лекарственного вещества, которое экстрагируется из композиции 40% водным раствором этанола в течение одного часа при 37°C, является меньшим или равным двойному количеству лекарственного вещества, которое экстрагируется 0,01 Н хлористоводородной кислотой в течение одного часа при 37°C; и композиция лекарственного вещества адаптирована, чтобы она была пригодна для перорального введения человеку 3, 2 или 1 раз в сутки.
Другой иллюстративный вариант осуществления настоящего изобретения относится к предотвращающей зависимость композиции лекарственного вещества, содержащей подвергнутую плавлению смесь: a) по меньшей мере одного вызывающего зависимость лекарственного вещества, где указанное лекарственное вещество представляет собой гидрокодон (или фармацевтически приемлемую соль, например, такую как гидрокодона битартрата пентагемигидрат), b) по меньшей мере одного простого эфира целлюлозы или сложного эфира целлюлозы и c) меньшей мере одного акрилового полимера, метакрилового полимера или их комбинации. В этом варианте осуществления композиция лекарственного вещества адаптирована, чтобы она была пригодна для перорального введения человеку 3, 2 или 1 раз в сутки; и приблизительно девяносто процентов гидрокодона высвобождается in vitro в течение приблизительно 4-6 часов, когда он адаптирован для введения 3 раза в сутки, в течение приблизительно 6-10 часов, когда он адаптирован для введения 2 раза в сутки, и в течение приблизительно 16-22 часов, когда он адаптирован для введения 1 раз в сутки.
Другой иллюстративный вариант осуществления настоящего изобретения также относится к предотвращающей зависимость композиции лекарственного вещества, содержащей подвергнутую плавлению смесь: a) по меньшей мере одного опиоида и b) по меньшей мере одного изменяющего скорость фармацевтически приемлемого полимера, сополимера или их комбинации. В этом варианте осуществления количество лекарственного вещества, которое экстрагируется из композиции 40% водным раствором этанола в течение одного часа при 37°C, составляет приблизительно от 70% до 110% от количества лекарственного вещества, которое экстрагируется 0,01 Н хлористоводородной кислотой в течение одного часа при 37°C; и композиция лекарственного вещества адаптирована, чтобы она была пригодна для перорального введения человеку 3, 2 или 1 раз в сутки. Этот и другие варианты осуществления обладают требуемыми фармакокинетическими профилями.
В другом иллюстративном варианте осуществления настоящее изобретение относится к способу лечения боли у пациента-человека, включающему пероральное введение пациенту-человеку композиции по одному из указанных выше вариантов осуществления.
Эти и другие цели, преимущества и признаки этого изобретения станут очевидны специалистам в данной области при прочтении подробного описания способов по этому изобретению и композиций, используемых в них, как более подробно описано ниже.
Краткое описание чертежей
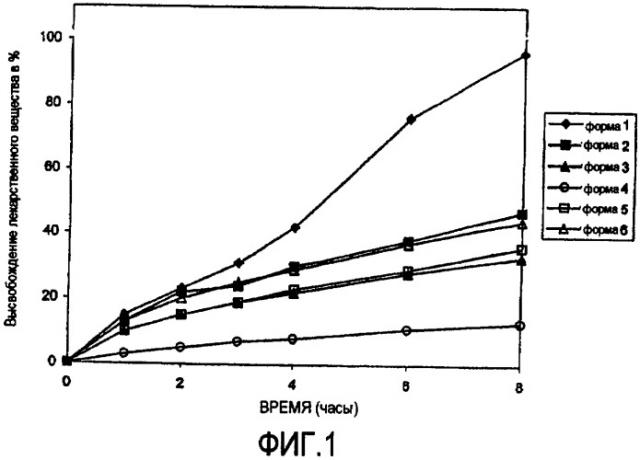
На фигуре 1 представлена скорость растворения различных лекарственных форм лекарственного вещества 1-6 в 0,01 Н хлористоводородной кислоте.
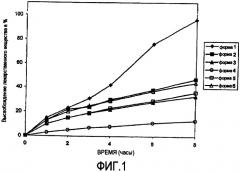
На фигуре 2 представлена скорость растворения различных лекарственных форм лекарственного вещества 1-6 в 20% водном растворе этанола.
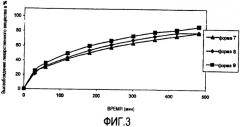
На фигуре 3 представлена скорость растворения различных лекарственных форм лекарственного вещества 7-9 гидрокодона в 0,01 Н хлористоводородной кислоте.
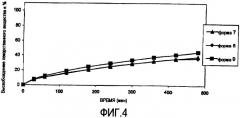
На фигуре 4 представлена скорость растворения различных лекарственных форм лекарственного вещества 7-9 ацетаминофена (APAP; также известный как парацетамол) в 0,01 Н хлористоводородной кислоте.
На фигуре 5 представлена скорость растворения различных лекарственных форм лекарственного вещества 7-9 гидрокодона в 40% водном растворе этанола.
На фигуре 6 представлена скорость растворения различных лекарственных форм лекарственного вещества 7-9 ацетаминофена (APAP) в 40% водном растворе этанола.
На фигуре 7 представлен силовой измерительный преобразователь и иллюстративный держатель с таблеткой, имеющий таблетку, используемые для измерения прочности таблеток.
На фигуре 8 представлен цилиндр с клиновидным наконечником, имеющим определенные иллюстративные размеры, пригодные для проведения "Pharma Test PTB 501" для измерения твердости таблетки.
На фигуре 9 (A) представлена химическая структура ацетаминофена (APAP), на (B) представлено время полужизни, Cmax, Tmax и AUC для некоторых вариантов осуществления композиции по этому изобретению (30) после введения пероральной дозы этой композиции (30) у самцов карликовых свиней (Goettingen), на (C) представлено среднее значение (±SEM) концентраций ацетаминофена в плазме после введения пероральной дозы варианта осуществления композиции по этому изобретению (30) у самцов карликовых свиней (Goettingen).
На фигуре 10 (A) представлено время полужизни, Cmax, Tmax и AUC для некоторых вариантов осуществления композиции по этому изобретению (формы 26, 27, 28, 29, 30), контроля 1 и контроля 2 у самцов карликовых свиней (Goettingen) и контроля 1 у человека, на (B) представлено среднее значение (±SEM) концентраций ацетаминофена в плазме после введения пероральной дозы определенных вариантов осуществления композиции по этому изобретению (формы 26, 27, 28, 29, 30), контроля 1 и контроля 2 у самцов карликовых свиней (Goettingen) и композиции контроля 1 у человека.
На фигуре 11 представлены средние значения (±SEM) концентраций ацетаминофена в плазме после введения пероральной дозы некоторых вариантов осуществления композиции по этому изобретению (формы 26, 27, 28, 29 и 30), контроля 1 и контроля 2 у самцов карликовых свиней (Goettingen) и композиции контроля 1 у человека.
На фигуре 12 (A) представлено время полужизни, Cmax, Tmax и AUC для некоторых вариантов осуществления композиции по этому изобретению (формы 26, 27, 28 и 29), контроля 1 и контроля 2 у самцов карликовых свиней (Goettingen) и композиции контроля 1; на (B) представлено среднее значение (±SEM) концентраций ацетаминофена в плазме после введения пероральной дозы некоторых вариантов осуществления композиции по этому изобретению (формы 26, 27, 28 и 29), контроля 1 и контроля 2 у самцов карликовых свиней (Goettingen) и композиции контроля 1.
На фигуре 13 (A) представлена химическая структура гидрокодона; на (B) представлено время полужизни, Cmax, Tmax и AUC после введения пероральной дозы некоторых вариантов осуществления композиции по этому изобретению (формы 26, 27, 28 и 29), контроля 1 и контроля 2 у самцов карликовых свиней (Goettingen) и композиции контроля 1; на (C) представлено среднее значение (±SEM) концентраций гидрокодона в плазме после введения пероральной дозы некоторых вариантов осуществления композиции по этому изобретению (формы 26, 27, 28 и 29), контроля 1 и контроля 2 у самцов карликовых свиней (Goettingen) и композиции контроля 1.
На фигуре 14 представлена скорость растворения различных лекарственных форм лекарственного вещества 32-37 относительно гидрокодона в 20% водном растворе этанола.
На фигуре 15 представлена скорость растворения различных лекарственных форм лекарственного вещества 32-37 относительно гидрокодона в 0,01 Н хлористоводородной кислоте.
На фигуре 16 представлена скорость растворения лекарственной формы лекарственного вещества 31 относительно гидрокодона в 0,01 Н хлористоводородной кислоте сразу после изготовления и после хранения в течение 1 месяца при 25°C/относительной влажности 60%, при 40°C/относительной влажности 75% и при 60°C в сухих условиях соответственно.
На фигуре 17 представлена скорость растворения лекарственной формы лекарственного вещества 31 относительно ацетаминофена (APAP) в 0,01 Н хлористоводородной кислоте сразу после изготовления и после хранения в течение 1 месяца при 25°C/относительной влажности 60%, при 40°C/относительной влажности 75% и при 60°C в сухих условиях соответственно.
На фигуре 18 представлена скорость растворения различных лекарственных форм лекарственного вещества 32, 34 и 36 относительно ацетаминофена (APAP) в 0,01 Н хлористоводородной кислоте + 5% NaCl.
На фигуре 19 представлена скорость растворения различных лекарственных форм лекарственного вещества 32, 34 и 36 относительно ацетаминофена (APAP) в 0,05 M фосфатном буфере pH 6,78.
На фигуре 20 представлена скорость растворения различных лекарственных форм лекарственного вещества 32, 34 и 36 относительно ацетаминофена (APAP) в 0,01 Н HCl и 0,09% NaCl.
На фигуре 21 представлена скорость растворения различных лекарственных форм лекарственного вещества 32, 34 и 36 относительно ацетаминофена (APAP) в 0,01 Н HCl.
На фиг.22 представлена скорость растворения различных лекарственных форм лекарственного вещества 38-40 относительно гидрокодона в 0,01 Н HCl.
На фиг.23 представлена скорость растворения различных лекарственных форм лекарственного вещества 38-40 относительно ацетаминофена (APAP) в 0,01 Н HCl.
На фиг.24 представлена скорость растворения различных лекарственных форм лекарственного вещества 38-40 относительно гидрокодона в 40% водном растворе этанола.
На фиг.25 представлена скорость растворения различных лекарственных форм лекарственного вещества 38-40 относительно ацетаминофена (APAP) в 40% водном растворе этанола.
На фиг.27 представлены профили средняя концентрация ацетаминофена-время для формы 45 и контроля 1.
На фиг.28 A и B представлен профиль концентрация гидрокодона-время отдельного субъекта для формы 45 и контроля 1 соответственно.
На фиг.29 A и B представлен профиль концентрация ацетаминофена-время отдельного субъекта для формы 45 и контроля 1 соответственно.
На фиг. 30 A и B представлен профиль средняя концентрация гидрокодона-время в течение периода 1 и 2 соответственно для формы 45 и контроля 1.
На фиг. 31 A и B представлен профиль средняя концентрация ацетаминофена-время через периоды 1 и 2 соответственно для формы 45 и контроля 1.
На фиг. 32 A и B представлены средние концентрации гидрокодона и ацетаминофена для формы 45 in vitro, контроля in vitro 1, концентрации контроля 1 in vivo и in vitro-in vivo предсказанные концентрация для формы 45.
На фиг. 33 A и B представлены профили средних значений растворения гидрокодона и ацетаминофена in vitro для формы 45 и контроля 1.
Подробное описание изобретения
Это изобретение не ограничивается конкретными способами, протоколами, исследованиями на животных и описанными реагентами, которые могут варьировать. Также следует понимать, что используемая в настоящем документе терминология предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который может ограничиваться только прилагаемой формулой изобретения.
Необходимо отметить, что, как используют в настоящем документе и в прилагаемой формуле изобретения, форма единственного числа включает указание на множественное число, если контекст явно не указывает иное. Таким образом, например, указание на "соединение" включает множество таких соединений и их эквивалентов, известных специалистам в данной области, и т.д. Также форма единственного числа, термины "один или несколько" и "по меньшей мере один" могут использоваться в настоящем документе взаимозаменяемо. Также следует отметить, что термины "содержащий", "включающий" и "имеющий" могут использоваться взаимозаменяемо.
Если не определено по-другому, все технические и научные термины, используемые в настоящем документе, имеют те же значения, что и обычно понимают специалисты в области, к которой относится это изобретение. Хотя можно использовать любые способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящем документе, при осуществлении на практике или тестировании настоящего изобретения, предпочтительные способы и материалы описаны в настоящем документе. Все публикации, упомянутые в настоящем документе, включены в настоящий документ в качестве ссылок для целей описания и изложения химических веществ, животных, инструментов, статистического анализа и способов, которые описаны в публикациях, которые могут использоваться применительно к этому изобретению. Ничто в настоящем документе не следует истолковывать как допущение того, что настоящее изобретение не дает право датировать такую публикацию более ранним числом на основании предшествующего изобретения.
Торговые названия используют в этом описании в качестве удобного сокращения для хорошо известных материалов. Как поймет специалист в данной области, следующие названия торговых марок указывают на указанные вещества:
EUDRAGIT®: Полимеры, образованные из сложных эфиров акриловой и метакриловой кислоты
METHOCEL®: Метил- или метоксилцеллюлоза
KOLLICOAT®: Привитые сополимеры поливиниловый спирт-полиэтиленгликоль
PLASDONE®: Полимер или сополимер поливинилпирролидона
LAUROGLYCOL®: Сложный эфир лаурата пропиленгликоля
SPAN®: Сложные эфиры сорбитана и жирных кислот
CREMOPHOR®: Полиэтоксилированное касторовое масло
POLOXAMER®: Блоксополимеры полиоксиэтилена и полиоксипропилена или полиоксиэтилена и полипропиленгликоля
TWEEN®: Сложные эфиры полиэтоксилированного сорбитана
KLUCEL®: Гидроксипропилцеллюлоза
KOLLIDON®: Гомо- и сополимеры поливинилпирролидона
XYLITOL®: (2,3,4,5)Тетрагидроксипентанол
ISOMALT®: Эквимолярная композиция 6-0-α-D-глюкопиранозидо-D-сорбит (1,6-GPS) и 1-0-α-D-глюкопиранозидо-D-маннит-дигидрат (1,1-GPM-дигидрат)
POLYOX®: Растворимые в воде смолы на основе полиэтиленоксида
XYLIT®: (2,3,4,5)Тетрагидроксипентанол
PLUROL OLEIQUE®: Олеиновые сложные эфиры полиглицерина
LUTROL®: Блок-сополимеры полиоксиэтилена и полиоксипропилена или полиоксиэтилена и полипропиленгликоля
ETHOCEL®: Этилцеллюлоза
PRIMOJEL®: Натрия крахмала гликолят
Настоящее изобретение относится к улучшенному твердому веществу или твердому раствору, пероральной дозированной композиции, которая обеспечивает замедленное высвобождение in vivo фармацевтически активных соединений ("лекарственных веществ"), которые обладают свойствами, обеспечивающими возможность вызывать зависимость, или для которых было показано, что они часто вызывают зависимость, а также их солей, сложных эфиров, пролекарств и других их фармацевтически приемлемых эквивалентов.
Термин "AUC" относится к площади по кривой зависимости концентрации от времени, вычисленной с использованием правила трапеции и Clast/k, где Clast представляет собой последнюю наблюдаемую концентрацию и k представляет собой вычисленную константу скорости выведения.
Термин "AUCt" относится к площади под кривой зависимости концентрации от времени для последней наблюдаемой концентрации, вычисленной с использованием правила трапеции.
Термин "Cmax" относится к концентрации в плазме указанного вызывающего зависимость лекарственного вещества в Tmax, выраженной в нг/мл и мкг/мл соответственно, к которой приводит пероральный прием композиции по этому изобретению. Если конкретно не указано иное, Cmax относится к общей максимальной наблюдаемой концентрации.
Термин "Cmin" относится к минимальной наблюдаемой концентрации в определенном интервале дозирования, например в интервале дозирования двенадцать часов для композиции, маркированной в качестве пригодной для дозирования каждые 12 часов или при необходимости, лекарственной формы по этому изобретению, вводимой в течение непрерывных интервалов дозирования из 5 доз.
Термин "нг·ч/мл/мг" относится к количеству вещества, измеряемому в количестве нанограмм, умноженном на количество часов на миллилитр крови, деленных на количество миллиграмм вызывающего зависимость лекарственного вещества, вводимого животному или человеку.
Как используют в настоящем документе, выражение "возрастающая скорость высвобождения" относится к скорости растворения, которая, главным образом, повышается с течением времени, так что лекарственное вещество растворяется в жидкости в применяемой среде со скоростью, которая, главным образом, возрастает со временем, а не остается постоянной или не снижается, до истощения приблизительно 80% лекарственного вещества лекарственной формы.
В одном предпочтительном варианте осуществления это изобретение относится к лекарственным формам, которые ингибируют экстракцию из композиции лекарственного вещества обычными растворителями, например, но не ограничиваясь этим, дистиллированным водным этанолом. Композиция предотвращает зависимость вследствие ограничения способности лиц экстрагировать опиоид из композиции (либо преднамеренно, либо непреднамеренно), так что опиоид нельзя легко концентрировать для парентерального введения. Также эти обеспечивающие устойчивость к зависимости композиции нельзя легко раздробить на более мелкие частицы или в форму порошка, которые легко вызывают зависимость при вдыхании через нос. Такая обеспечивающая устойчивость к зависимости композиция не требует включения опиоидного антагониста (хотя опиоидный антагонист можно добавлять к препарату для дополнительного предотвращения зависимости). Без связи с какой-либо конкретной теорией, полагают, что включение алкилцеллюлоз, таких как (но не ограничиваясь ими) гидроксиметилцеллюлозы и предпочтительно гидроксипропилметилцеллюлозы, приводит к устойчивости композиции к экстракции в спирте, в частности в 20% или 40% водном растворе этанола. Алкилцеллюлоза предпочтительно обладает по меньшей мере 12% замещением алкильным заместителем, более предпочтительно по меньшей мере 16% замещением алкильным заместителем и наиболее предпочтительно по меньшей мере 19% замещением алкильным заместителем. Алкильное замещение целлюлозы менее приблизительно 40% и более предпочтительно менее приблизительно 30% является предпочтительным в контексте этого изобретения. Кроме того, предпочтительно алкильный заместитель представляет собой C1-C6, более предпочтительно C1, C2 или C4 и наиболее предпочтительно C3, и он может быть прямым или разветвленным, когда алкильный заместитель содержит 3 или более атома углерода.
В другом предпочтительном варианте осуществления лекарственные формы необязательно являются устойчивыми к разрезанию, измельчению, пульверизации и т.п. Удобным показателем этого аспекта этого изобретения является "прочность", как определяют посредством устройства для тестирования твердости "Pharma Test PTB 501". Композиция по этому изобретению предпочтительно обладает прочностью по меньшей мере 150 ньютон (150 Н). Более предпочтительно композиция по этому изобретению обладает прочностью по меньшей мере 300 Н, более предпочтительно по меньшей мере 450 Н и более предпочтительно по меньшей мере 600 Н.
Прочность в соответствии с настоящим изобретением можно определять с помощью таблетки диаметром 10 мм и толщиной 5 мм в соответствии со способом определения прочности таблеток, опубликованным в European Pharmacopoeia 1997, page 143, 144, method no. 2.9.8. Предпочтительное устройство, используемое для измерения прочности, представляет собой устройство для тестирования материалов "Zwick Z 2.5", Fmax = 2,5 кН, максимальное перемещение 1150 мм с установкой, содержащей колонку и измерительный наконечник, клиренсом менее 100 мм и скоростью тестирования 0,1800 мм/мин. Измерение можно проводить с использованием нагнетательного поршня с вворачиваемой вставкой и цилиндра (диаметром 10 мм), силового измерительного преобразователя (Fmax = 1 кН, диаметр = 8 мм, класс 0,5 от 10 Н, класс 1 от 2 Н для ISO 7500-1, суммарная сила Zwick Fmax = 1,45 кН). Устройство необязательно может быть получено из Zwick GmbH & Co. KG, Ulm, Germany.
Для получения композиции по этому изобретению можно использовать любой пригодный способ. В предпочтительном варианте осуществления композицию предпочтительно подвергают плавлению и более предпочтительно экструдированию плавлением, а затем в любом случае сразу придают форму без дробления или измельчения композиции. Несмотря на указанное выше, подразумевают, что таблетки композиции, которым сразу придали форму, можно необязательно покрывать добавкой для облегчения проглатывания, такой как, но не ограничиваясь этим, желатиновое покрытие. Без связи с какой-либо конкретной теорией, полагают, что прямое придание формы для предотвращения образования нежелательных сильно выступающих элементов на композиции без промежуточной стадии измельчения приводит к наиболее высокой прочности композиции. Кроме того, варианты осуществления композиции по этому изобретению необязательно обеспечивают дополнительную прочность с помощью по меньшей мере двух подвергнутых плавлению полимеров. Без связи с конкретной теорией, полагают, что второй подвергнутый плавлению полимер предпочтительно взаимодействует с первым подвергнутым плавлению полимером, так чтобы преимущественно доводить до температуры перехода стекла композиции в целом в ходе образования таблетки.
В одном варианте осуществления в композиции можно использовать полимер, или сополимер, или их комбинации для создания подвергнутой плавлению и более предпочтительно экструдированной плавлением, прямо сформованной композиции. Также можно использовать полимеры, которые являются фармакологически неактивными и обеспечивают растворимое в кишечнике покрытие или профиль замедленного освобождения композиции. В одном варианте осуществления пригодные полимеры/сополимеры включают поли(мет)акрилат, например такой как Eudragit L- или S-типа, которые являются фармакологически неактивными.
EUDRAGIT® представляет собой торговое название некоторых предпочтительных полимеров, которые пригодны для применения в этом изобретение и которые образованы из сложных эфиров акриловой и метакриловой кислоты. Свойства полимеров EUDRAGIT, главным образом, определяются функциональными группами, включенными в мономеры полимеров EUDRAGIT. Отдельные классы EUDRAGIT® отличаются по их соотношению нейтральных, щелочных и кислых групп и, таким образом, по их физико-химическим свойствам. Можно использовать аммоний-алкильные метакрилатные сополимеры или метакрилатные сополимеры, имеющие следующую формулу:
В соответствии с 2007 US Pharmacopoeia Eudragit определяют согласно с USP 30 / NF 25
Сополимер метакриловой кислоты, тип A NF = Eudragit L-100
Сополимер метакриловой кислоты, тип B NF = Eudragit S-100
Сополимер метакриловой кислоты, тип C NF = Eudragit L-100-55 (содержит небольшое количество детергента)
Аммоний-метакрилатный сополимер, тип A NF = Eudragit RL-100 (гранулы)
Аммоний-метакрилатный сополимер, тип A NF = Eudragit RL-PO (порошок)
Аммоний-метакрилатный сополимер, тип B NF = Eudragit RS-100 (гранулы)
Аммоний-метакрилатный сополимер, тип B NF = Eudragit RS-PO (порошок)
Полиакрилатная дисперсия, 30 процентная Ph. Eur. = Eudragit NE30D (= 30% водная дисперсия)
Основной бутилированный метакрилатный сополимер Ph. Eur. = Eudragit E-100
где функциональная группа обладает группой четвертичного аммония (триметиламмонийэтилметакрилат), или R = COOCH2CH2N+(CH3)SCr [коммерчески доступный в качестве EUDRAGIT® (RL или RS)], или функциональная группа предст