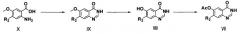Новое амидное производное для ингибирования роста раковых клеток
Иллюстрации
Показать всеНастоящее изобретение относится к новым амидным производным формулы (I), его изомерам и фармацевтически приемлемой соли, которые обладают свойствами селективного ингибитора роста раковых клеток, вызванного тирозинкиназной сверхэкспрессией рецептора эпидермального роста (EGFR), выбранную из EGFR, или вызванного мутацией EGFR. В формуле (I):
или
А представляет группу (а) или (b), R4, R5, R6 и R7, каждый независимо, представляет водород, галоген, N-C1-6алкил или N-гидроксиамидо или обратный C-C1-6алкиламидо (-NHCOC1-6алкил), гидроксикарбонил (-СООН), C1-6алкилоксикарбонил (-COOC1-6), C1-6алкил или C1-6алкил, замещенный гидроксигруппой, C1-6диалкиламином или насыщенной 5-6-членной гетероциклической группой с 1-2 гетероатомами, выбранными из атомов азота и кислорода; R1 представляет фенильную или 6-членную гетероарильную группу с атомом азота в качестве гетероатома, каждая из которых замещена одним-тремя X, или C1-6алкил, замещенный фенилом, который может быть замещен атомами галогена; R2 представляет водород, гидрокси, C1-6алкокси или C1-6алкокси, замещенный C1-6алкокси или 5-6-членной насыщенной гетероциклической группой; R3 представляет водород, -СООН, C1-6алкилоксикарбонил или амидо, N-незамещенный или N-замещенный Y; na и nb, каждый, является целым числом от 1 до 3; где: Х представляет водород, галоген, гидрокси, циано, нитро, (моно-, ди- или тригалоген)метил, меркапто, C1-6алкилтио, акриламидо, C1-6алкил, С2-6алкенил, С2-6алкинил, С1-6алкокси, фенилокси, C1-6диалкиламино или C1-6алкил или С1-6алкокси, замещенный Z, при условии, что когда количество заместителей Х равно двум или более, группы Х могут быть конденсированы друг с другом с образованием 5-членной циклической структуры, возможно содержащей в цикле 2 атома азота в качестве гетероатомов; Y представляет гидрокси, C1-6алкил или C1-6алкил, замещенный Z, C1-6алкил имеет один-четыре фрагмента, выбранных из группы, состоящей из N, О, S, SO и SO2; и Z представляет C1-6алкил, фенил или 6-членную гетероциклическую группу, включающую один или более гетероатомов, выбранных из N или О, причем указанный фенил или гетероциклическая группа является незамещенной или замещена галогеном. 2 н. и 2 з.п. ф-лы, 7 табл.
Реферат
Область техники
Настоящее изобретение относится к новому амидному производному и его фармацевтически приемлемой соли, которое селективно и эффективно ингибирует рост раковых клеток, вызванный сверхэкспрессией рецептора эпидермального фактора роста (EGFR), и также предотвращает развитие лекарственной устойчивости, вызванной мутацией EGFR тирозин киназы, и к фармацевтической композиции, включающей его в качестве активного ингредиента.
Предпосылки изобретения
В клетках существует множество систем передачи сигнала, которые функционально взаимосвязаны для управления пролиферацией, ростом, метастазированием и апоптозом клеток (Nature Reviews Cancer 5, 689, 2005). Отказ межклеточной системы управления вследствие генетических факторов или факторов окружающей среды вызывает аномальное усиление или разрушение системы передачи сигнала, приводящее к появлению раковых клеток (Cell 100, 57, 2000).
Протеин тирозин киназы играют важную роль в таком клеточном регулировании (Nature Reviews Drug Discovery 3, 993, 2004), и их аномальная экспрессия или мутация наблюдается в раковых клетках. Протеин тирозин киназы является ферментом, который катализирует транспорт фосфатных групп от АТФ к тирозинам, находящимся в белковых субстратах. Множество рецепторых белков факторов роста функционируют как тирозин киназы, чтобы передавать клеточные сигналы. Взаимодействие между факторами роста и их рецепторами в норме управляет ростом клеток, но аномальная передача сигнала, вызванная мутацией или сверхэкспрессией любого из рецепоров, часто индуцирует опухолевые клетки и различные виды рака.
Протеин тирозин киназы был классифицирован на множество семейств в соответствии с их факторами роста, в частности была подробно изучена тирозин киназа (EGFR), относящаяся к рецептору фактора роста эпителиальных клеток (EGF) (Nature Reviews Cancer 5, 341, 2005). EGFR тирозин киназа состоит из рецептора и тирозин киназы и доставляет внеклеточные сигналы в ядро клетки через клеточную мембрану. Различные EGFR тирозин киназы классифицированы на основе их структурных различий на EGFR (Erb-B1), Erb-B2, Erb-B3 и Erb-B4, каждая из которых может образовывать гомодимерный или гетеродимерный комплекс доставки сигнала. Также сверхэкспрессия более чем одного из таких гетеродимеров часто наблюдается в злокачественных клетках. В дополнение, известно, что как EGFR, так и Erb-B2 вносят значительный вклад в образование гетеродимерного комплекса доставки сигнала.
Были разработаны некоторые лекарственные средства, такие как малые молекулы, для ингибирования EGFR тирозин киназ, такие как гефитиниб, эрлотиниб, лапатиниб и другие. Гефитиниб или эрлотиниб селективно и обратимо ингибируют EGFR, а лапатиниб обратимо ингибирует как EGFR, так и Erb-B2, таким образом задерживая рост опухолей и в значительной степени продлевая срок жизни пациента или предоставляя терапевтические преимущества.
Ингибиторы передачи сигнала с малыми молекулами, включая EGFR тирозин киназы, имеют в качестве общего структурного признака хиназолиновый фрагмент, и ингибиторы тирозин киназы, имеющие хиназолиновый фрагмент, раскрыты в международных публикациях № WO 99/006396, WO 99/006378, WO 97/038983, WO 2000/031048, WO 98/050038, WO 99/024037, WO 2000/006555, WO 2001/098277, WO 2003/045939, WO 2003/049740 и WO 2005/012290, патентах США №7019012 и 6225318 и патентах ЕР №0787722, 0387063 и 1292591.
В то же время хорошо известно, что развитие устойчивости к конкретным используемым лекарственным средствам вызывает снижение активности лекарственного средства. Например, сообщалось, что гефитиниб или эрлотиниб порождают мутант EGFR T790M, вторичную мутацию, а также, что у половины пациентов, которым вводили гефитиниб или эрлотиниб, развивается устойчивость к гефитинибу или эрлотинибу, и что такие лекарственные средства не обеспечивают существенного клинического эффекта у пациентов с вариацией EGFR T790M (Public Library of Science Medicine, 2(3), 225, 2005, Cancer Res, 67(24), 11924, 2007).
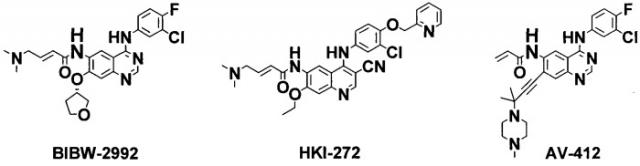
В этой связи недавно было обнаружено, что необратимые ингибиторы мишени EGFR более перспективны для преодоления проблемы развития устойчивости по сравнению с общепринятыми необратимыми ингибиторами, такими как гефитиниб или эрлотиниб (Cancer Cell 12, 81, 2007, Bioorganic & Medicinal Chemistry 16, 3482, 2008). Например, необратимые ингибиторы, такие как BIBW-2992 (British Journal of Cancer 98, 80, 2008), HKI-272 (Cancer Research 64, 3958, 2004) и AV-412 (Cancer Sci. 98(12), 1977, 2007), разработаны и в настоящее время находятся на клинической стадии. Структуры необратимых ингибиторов показаны ниже:
Соединения, показанные выше, имеют общий структурный признак - акриламидную функциональную группу в положении С-6 хиназолинового или цианохинолинового остатка, которая образует ковалентную связь с цистеином773 (Cys773), расположенным в домене АТФ EGFR, таким образом необратимо блокируя аутофосфорилирование EGFR и эффективно ингибируя передачу сигнала раковых клеток (Proc. Natl. Acad. Sci. U.S.A. 95, 12022, 1998). Они проявляют более высокие ингибирующие активности in vitro и in vivo по сравнению с общепринятыми обратимыми ингибиторами (J. Med. Chem. 42, 1803, 1999).
Международная патентная заявка WO 2008/032039, поданная авторами вышеуказанной литературы, раскрывает новое противораковое соединение, имеющее другой акриламидный заместитель в положении С-6 хиназолина, которое показывает улучшенную ингибирующую активность против EGFR тирозин киназ.
Соответственно, существует постоянная потребность в разработке нового лекарственного средства, которое имеет улучшенную ингибирующую активность против мутантов EGFR тирозин киназ, которое может эффективно ингибировать развитие лекарственной устойчивости, вызванной мутантами EGFR тирозин киназ, и одновременно не вызывающее нежелательных побочных эффектов.
Краткое описание изобретения
Соответственно, целью настоящего изобретения является обеспечение нового амидного производного или его фармацевтически приемлемой соли, которое селективно и эффективно ингибирует рост раковых клеток, вызванный сверхэкспрессией рецептора эпидермального фактора роста (EGFR) и также предотвращает развитие лекарственной устойчивости, вызванной мутацией EGFR тирозин киназы, и к фармацевтической композиции, включающей его в качестве активного ингредиента.
Другой целью настоящего изобретения является обеспечение фармацевтической композиции для ингибирования роста раковых клеток, включающей указанное амидное производное в качестве активного ингредиента.
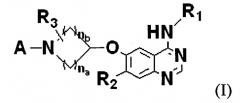
В соответствии с одним аспектом настоящего изобретения обеспечивается амидное производное формулы (I) или его фармацевтически приемлемая соль:
где А представляет
,
R4, R5, R6 и R7, каждый независимо, представляет водород, галоген, N-С1-6 алкил или N-гидроксиамидо или обратный С-С1-6 алкиламидо (-NHCOC1-6), гидроксикарбонил (-СООН), С1-6 алкоксикарбонил (-СООС1-6), С1-6 алкил или С1-6 алкил, замещенный гидроксигруппой, С1-6 диалкиламином или гетероциклической группой;
R1 представляет арильную или гетероциклическую группу, замещенную одним-пятью Х, или С1-6 алкил, замещенный арилом;
R2 представляет водород, гидрокси, С1-6 алкокси или С1-6 алкокси, замещенный С1-6 алкокси или гетероциклической группой;
R3 представляет водород, -СООН, С1-6 алкилоксикарбонил или амидо, N-незамещенный или N-замещенный Y;
na и nb, каждый, является целым числом от 0 до 6; где:
Х представляет водород, галоген, гидрокси, циано, нитро, (моно-, ди- или тригалоген)метил, меркапто, С1-6 алкилтио, акриламидо, С1-6 алкил, С1-6 алкенил, С1-6 алкинил, С1-6 алкокси, арилокси, С1-6 диалкиламино или С1-6 алкил или С1-6 алкокси, замещенный Z, при условии, что когда количество заместителей Х равно двум или более, группы Х могут быть конденсированы друг с другом с образованием циклической структуры;
Y представляет гидрокси, С1-6 алкил или С1-6 алкил, замещенный Z, С1-6 алкил имеет один-четыре фрагмента, выбранных из группы, состоящей из N, O, S, SO и SO2; и
Z представляет С1-6 алкил, арильную или гетероциклическую группу, указанный арил является С5-12 моноциклической или бициклической ароматической группой, указанная гетероциклическая группа является С5-12 моноциклической или бициклической ароматической или неароматической группой, содержащей один-четыре фрагмента, выбранных из группы, состоящей из N, O, S, SO и SO2, и указанная арильная или гетероциклическая группа является незамещенной или замещена заместителями, выбранными из группы, состоящей из галогена, гидроксила, амино, нитро, циано, С1-6 алкила, С1-6 алкенила, С1-6 алкинила, С1-6 алкокси, С1-6 моноалкиламино и С1-6 диалкиламино.
Подробное описание изобретения
В предпочтительном воплощении настоящего изобретения R1 представляет 3-хлор-4-фторфенил, 3-хлор-2-фторфенил, 3-хлор-2,4-дифторфенил, 3,4-дихлор-2-фторфенил, 4-бром-3-хлор-2-фторфенил, 4-бром-2-фторфенил, (R)-1-фенилэтил, 3-хлор-4-(3-фторбензилокси)фенил, 3-хлор-4-(пиридин-2-илметокси)фенил, l-(3-фторбензил)-1H-5-индазол, 3-этинилфенил, 4-хлор-2,5-диметоксифенил, 4-бром-3-метилфенил, 4-изопропилфенил, 3-метилфенил, 3-бромфенил, 3-хлорфенил, 3,4-дихлорфенил, 2,3,4-трифторфенил, 4-фтор-3-метилфенил, 3,4-диметилфенил, 4-фенилоксифенил, 2,3-дигидро-1H-инденил, 4-гидрокси-3,5-дихлорфенил, 3-гидрокси-4-хлорфенил, 4-гидрокси-2-хлорфенил, 2-гидрокси-4-хлорфенил, 3-цианофенил, 3-трифторметилфенил, 3-хлор-2-метоксифенил, 4-хлор-3-метилфенил, 4-бром-3-хлорфенил, 4-бром-3-фторфенил, 3-хлор-2-метилфенил, 3-диметиламинофенил, 2-фтор-3-трифторметилфенил, 3-циано-4-фторфенил, 3-циано-4-хлорфенил, 3-метилтиофенил, 2-хлорфенил, 4-хлорфенил, 3-хлорфенилметил, 3-винилфенил, 3-нитрофенил, 3-акриламидофенил, 3-меркаптофенил, 3-хлорметилфенил, 4-гидрокси-3-хлорфенил или 4-гидрокси-3-фторфенил; R2 представляет водород, гидрокси, метокси, этокси, 3-морфолинопропилокси или метоксиэтокси; R3 представляет водород, метилоксикарбонил, карбоксил, амидо, N-метиламидо, N-этиламидо, N-пропиламидо, N-изопропиламидо, N-гидроксиамидо, N-2-гидроксиэтиламидо, N-3-гидроксипропиламидо, N-2-метоксиэтиламидо, N-2-метилтиоэтиламидо, N-2-метилсульфонилэтиламидо, N-2-N,N'-диэтиламиноэтиламидо, или N-2-морфолиноэтиламидо; R4, R5, R6 и R7 каждый независимо представляет водород, метил, 4-метилпиперазинилметил, 4-метилпиперазинилэтил, N,N'-диметиламинометил, N,N'-диэтиламинометил, морфолинометил, пирролидин-1-илметил, пиперидин-1-илметил, гидроксиметил, N-метилкарбоксамидо, ацетамидо, N-гидроксиамидо, метиловый сложный эфир, хлор или карбоксил; и na и nb, каждый независимо, представляет целое число от 0 до 2, в аминопроизводном формулы (I).
В настоящем изобретении термин «галоген» относится к фтору, хлору, брому или йоду, если иное не указано.
В настоящем изобретении термин «алкил» относится к насыщенным моновалентным углеводородным радикалам, имеющим нормальную, циклическую или разветвленную цепь, если иное не указано.
Примерами более предпочтительных соединений формулы (I) в соответствии с настоящим изобретением являются
1) 1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
2) (E)-1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)бут-2-ен-1-он;
3) 1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)бут-2-ин-1-он;
4) 1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)-5-(4-метилпиперазин-1-ил)пент-2-ин-1-он;
5) 1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)-4-(диметиламино)бут-2-ин-1-он;
6) 1-((3S)-3-(4-(3-хлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
7) 1-((3S)-3-(4-(4-бром-3-хлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
8) 1-((3S)-3-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
9) 1-((3S)-3-(4-(4-бром-2-фторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
10) 1-((3S)-3-(4-(3-хлор-4-(пиридин-2-илметокси)фениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
11) 1-((3S)-3-(7-метокси-4-((1R)-1-фенилэтиламин)хиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
12) 1-((3S)-3-(4-(1-(3-фторбензил)-1H-индазол-5-иламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
13) 1-((3S)-3-(4-(3-хлор-4-фторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
14) 1-((3R)-3-(4-(3-хлор-4-фторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
15) 1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)хиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
16) 1-((3S)-3-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
17) 1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
18) 1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
19) 1-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
20) 1-((3R)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-он;
21) N-(2-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)этил)акриламид;
22) 1-(3-(7-метокси-4-((1R)-1-фенилэтиламино)хиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
23) 1-(3-(4-(3-хлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
24) 1-(3-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
25) 1-(3-(4-(3-хлор-4-фторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
26) 1-(3-(4-(3-хлорфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
27) 3-(6-(1-акрилоилазетидин-3-илокси)-7-метоксихиназолин-4-иламино)бензонитрил;
28) (E)-4-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-N-метил-4-оксобут-2-енамид;
29) 1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-2-метилпроп-2-ен-1-он;
30) (Z)-метил-4-(3-(4-(3-хлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-4-оксобут-2-еноат;
31) N-(3-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-3-оксопроп-1-ен-2-ил)ацетамид;
32) (Z)-3-хлор-1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
33) (E)-3-хлор-1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
34) 1-(4-(4-(3-хлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
35) 1-(4-(7-метокси-4-((1R)-1-фенилэтиламино)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
36) 1-(4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
37) 1-(4-(4-(3-этинилфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
38) 1-(4-(4-(4-хлор-2,5-диметоксифениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
39) 1-(4-(4-(4-бром-3-метилфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
40) 1-(4-(4-(4-изопропилфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
41) 1-(4-(4-(м-толуидино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
42) 1-(4-(4-(3-бромфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
43) 1-(4-(4-(3-хлорфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
44) 1-(4-(4-(3,4-дихлорфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
45) 1-(4-(7-метокси-4-(2,3,4-трифторфениламино)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
46) 1-(4-(4-(4-фтор-3-метилфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
47) 1-(4-(4-(3,4-диметилфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
48) 1-(4-(7-метокси-4-(4-феноксифениламино)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
49) 1-(4-(4-(2,3-дигидро-1H-инден-5-иламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
50) 1-(4-(4-(3,5-дихлор-4-гидроксифениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
51) 1-(4-(4-(4-хлор-3-гидроксифениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
52) 1-(4-(4-(2-хлор-4-гидроксифениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
53) 1-(4-(4-(4-хлор-2-гидроксифениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
54) 1-(4-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
55) 1-(4-(4-(3-хлор-4-(пиридин-2-илметокси)фениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
56) 3-(6-(1-акрилоилпиперидин-4-илокси)-7-метоксихиназолин-4-иламино)бензонитрил;
57) 1-(4-(4-(3-хлор-4-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
58) 1-(4-(7-метокси-4-3-(трифторметил)фениламино)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
59) 1-(4-(4-(3-хлор-2-метоксифениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
60) 1-(4-(4-(4-хлор-3-метилфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
61) 1-(4-(4-(4-бром-3-хлорфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
62) 1-(4-(4-(4-бром-3-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
63) 1-(4-(4-(3-хлор-2-метилфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
64) 1-(4-(4-(3-(диметиламино)фениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
65) 1-(4-(4-(2-фтор-3-(трифторметил)фениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
66) 5-(6-(1-акрилоилпиперидин-4-илокси)-7-метоксихиназолин-4-иламино)-2-фторбензонитрил;
67) 5-(6-(1-акрилоилпиперидин-4-илокси)-7-метоксихиназолин-4-иламино)-2-хлорбензонитрил;
68) 1-(4-(7-метокси-4-(3-(метилтио)фениламино)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
69) 1-(4-(4-(2-хлорфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
70) 1-(4-(4-(4-хлорфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
71) 1-(4-(4-(3-хлор-2,4-дифторфениламино)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
72) 1-(4-(4-(3-хлорбензиламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
73) 1-(4-(7-метокси-4-(3-винилфениламино)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
74) 1-(4-(7-метокси-4-(3-нитрофениламино)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
75) N-(3-(6-(1-акрилоилпиперидин-4-илокси)-7-хиназолин-4-иламино)фенил)акриламид;
76) 1-(4-(4-(3-меркаптофениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
77) 1-(4-(4-(3-хлорметил)фениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
78) 1-(4-(4-(3-хлор-4-гидроксифениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
79) 1-(4-(4-(3-фтор-4-гидроксифениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
80) 1-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)бут-2-ин-1-он;
81) 1-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-3-метилбут-2-ен-1-он;
82) (E)-4-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-N-метил-4-оксобут-2-енамид;
83) (Z)-метил-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-4-оксобут-2-еноат;
84) (Z)-метил-(4-(4-(3,4-дихлор-2-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-4-оксобут-2-еноат;
85) (Z)-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-4-оксобут-2-еновая кислота;
86) (Z)-4-(4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-4-оксобут-2-еновая кислота;
87) (E)-4-(4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-4-оксобут-2-еновая кислота;
88) (E)-4-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-N-гидрокси-4-оксобут-2-енамид;
89) (Z)-3-хлор-1-(4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
90) (E)-3-хлор-1-(4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
91) N-(3-(4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-3-оксопроп-1-ен-2-ил)ацетамид;
92) (E)-1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
93) (E)-1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
94) (E)-1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)-4-морфолинобут-2-ен-1-он;
95) (E)-1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)-4-(пирролидин-1-ил)бут-2-ен-1-он;
96) (E)-1-((3S)-3-(4-(3-хлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
97) (E)-1-((3S)-3-(4-(3-хлор-2,4-фторфениламино)хиназолин-6-илокси)пирролидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
98) (E)-1-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
99) (E)-1-(4-(4-(3,4-дихлор-2-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
100) (E)-1-(4-(4-(3-хлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
101) (E)-1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
102) (E)-1-(3-(4-(3-хлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
103) (E)-N-(2-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)этил)-4-(диметиламино)бут-2-енамид;
104) 1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-2-((диметиламино)метил)проп-2-ен-1-он;
105) 1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-2-((морфолинометил)проп-2-ен-1-он;
106) 1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-2-((4-метилпиперазин-1-ил)метил)проп-2-ен-1-он;
107) 1-(3-(4-(3-хлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-2-(пиперидин-1-илметил)проп-2-ен-1-он;
108) 1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-2-(пиперидин-1-илметил)проп-2-ен-1-он;
109) 1-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-2-((диметиламино)метил)проп-2-ен-1-он;
110) 1-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-2-(морфолинометил)проп-2-ен-1-он;
111) 1-(4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-2-((диметиламино)метил)проп-2-ен-1-он;
112) (Z)-1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)азетидин-1-ил)-4-(диметиламино)бут-2-ен-1-он;
113) (Z)-1-(4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-2-(диметиламино)бут-2-ен-1-он;
114) 1-(4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-1-ил)-2-(гидроксиметил)проп-2-ен-1-он;
115) 1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-гидроксихиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
116) 1-(3-(4-(3-хлор-2,4-дифторфениламино)-7-(2-метоксиэтокси)хиназолин-6-илокси)азетидин-1-ил)проп-2-ен-1-он;
117) 1-(4-(4-(3-хлор-2,4-дифторфениламино)-7-(2-метоксиэтокси)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
118) 1-(4-(4-(3-хлор-2,4-дифторфениламино)-7-(3-морфолинопропокси)хиназолин-6-илокси)пиперидин-1-ил)проп-2-ен-1-он;
119) (2S,4S)-метил-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-2-карбоксилат;
120) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-2-карбоксамид;
121) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-метилпиперидин-2-карбоксамид;
122) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-этилпиперидин-2-карбоксамид;
123) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-пропилпиперидин-2-карбоксамид;
124) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-изопропилпиперидин-2-карбоксамид;
125) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-гидроксипиперидин-2-карбоксамид;
126) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-(2-гидроксиэтил)пиперидин-2-карбоксамид;
127) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-(2-метоксиэтил)пиперидин-2-карбоксамид;
128) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-(2-(метилтио)этил)пиперидин-2-карбоксамид;
129) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-(2-метилсульфонил)этил)пиперидин-2-карбоксамид;
130) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-(2-(диметиламино)этил)пиперидин-2-карбоксамид;
131) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-(3-гидроксипропил)пиперидин-2-карбоксамид;
132) (2S,4S)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-(2-морфолиноэтил)пиперидин-2-карбоксамид;
133) (2R,4R)-метил-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-2-карбоксамид;
134) (2R,4R)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-2-карбоновая кислота;
135) (2R,4R)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-2-карбоксамид;
136) (2R,4R)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-метилпиперидин-2-карбоксамид;
137) (2R,4R)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-гидроксипиперидин-2-карбоксамид;
138) (2R,4R)-1-акрилоил-4-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)-N-(2-метилсульфонил)этил)пиперидин-2-карбоксамид;
139) (2R,4R)-1-акрилоил-4-(4-(3,4-дихлор-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-2-карбоксамид; и
140) (2R,4R)-1-акрилоил-4-(4-(4-бром-2-фторфениламино)-7-метоксихиназолин-6-илокси)пиперидин-2-карбоксамид.
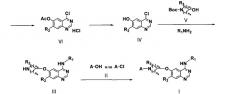
Соединение формулы (I) настоящего изобретения может быть получено, например, по методике, представленной схемой реакции (I) (см., [Bioorg. Med. Chem. Lett, 2001; 11: 1911] и международную патентную публикацию WO 2003/082831):
Схема реакции (I)
где
А, R1, R2, R3, na и nb имеют те же значения, что и определенные выше.
В схеме реакций (I) соединение формулы (Х) подвергают реакции конденсации с гидрохлоридом формамидина при высокой температуре (например, 210°С) с образованием соединения формулы (IX) с последующей реакцией с L-метионином в среде органической кислоты (например, метансульфоновой кислоты), включая удаление метила из положения С-6 соединения формулы (IX), с образованием соединения формулы (VIII).
Затем соединение формулы (VIII) подвергают реакции введения защитной группы в среде основания (например, пиридина) и безводной уксусной кислоты с образованием соединения формулы (VII) с последующей реакцией с неорганической кислотой (например, тионилхлоридом или оксихлоридом фосфора) в присутствии каталитического количества диметилформамида в условиях кипячения с обратным холодильником с образованием соединения формулы (VI) в форме гидрохлората.
Соединение формулы (VI) добавляют к спиртовому раствору, содержащему аммиак (например, 7н. метанольному раствору, содержащему аммиак), который перемешивают, включая удаление из него ацетила с образованием соединения формулы (IV). Соединение формулы (IV) затем подвергают реакции Мицунобу с соединением формулы (V) и реакции замещения с R1NH2 в органическом растворителе (например, 2-пропанол или ацетонитрил) для введения в него R1. Полученное соединение подвергают реакции с органической или неорганической кислотой (например, трифторуксусной кислотой или концентрированной хлористоводородной кислотой) в органическом растворителе (например, метиленхлориде), включая удаление трет-бутоксикарбонила, с образованием соединения формулы (II). В реакции Мицунобу можно использовать диизопропилазодикарбоксилат, диэтилазодикарбоксилат, ди-трет-бутилазодикарбоксилат или трифенилфосфин.
Затем соединение формулы (I) настоящего изобретения получают, подвергая соединение формулы (II) реакции конденсации с соединением формулы (III) A-C1 в смеси органического растворителя (например, тетрагидрофурана и воды, или метиленхлорида) в присутствии неорганического или органического основания (например, бикарбоната натрия, пиридина или триэтиламина), или подвергая соединение формулы (II) реакции конденсации с соединением формулы (III) А-ОН в органическом растворителе (например, тетрагидрофуране или метиленхлориде) в присутствии агента сочетания (например, 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) или гексафторфосфата метанаминия 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметил европия (HATU)).
Соединение формулы (I) настоящего изобретения также может применяться в форме фармацевтически приемлемой соли, образованной неорганической или органической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, азотная кислота, уксусная кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, глутаровая кислота, фумаровая кислота, яблочная кислота, миндальная кислота, винная кислота, лимонная кислота, аскорбиновая кислота, пальмитиновая кислота, малеиновая кислота, гидроксималеиновая кислота, бензойная кислота, гидроксибензойная кислота, фенилуксусная кислота, коричная кислота, салициловая кислота, метансульфоновая кислота, бензолсульфоновая кислота и толуолсульфоновая кислота.
Соединение изобретения или его фармацевтически приемлемая соль селективно и эффективно ингибирует рост раковых клеток, вызванный эпидермальным фактором роста и его мутантами, и оказывает улучшенное противораковое действие в комбинации с другим противораковым агентом. Конкретно, соединение изобретения или его фармацевтически приемлемая соль полезны для улучшения действия противоракового агента, выбранного из группы, состоящей из ингибиторов передачи клеточного сигнала, ингибиторов митоза, алкилирующих агентов, антиметаболитов, антибиотиков, ингибиторов фактора роста, ингибиторов клеточного цикла, ингибиторов топоизомеразы, модификаторов биологичеких реакций, антигормональных агентов и антиандрогенов.
Поэтому настоящее изобретение обеспечивает фармацевтическую композицию для ингибирования роста раковых клеток, включающую в качестве активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль.
Соединение изобретения или его фармацевтически приемлемая соль в качестве активного ингредиента может быть введено перорально или парентерально в эффективном количестве, изменяющемся от примерно 0,01 до 100 мг/кг, предпочтительно - от 0,2 до 50 мг/кг массы тела в день в случае млекопитающего, включая человека, в виде разовой дозы или разделенных доз. Дозировка активного ингредиента может быть установлена с учетом различных релевантных факторов, таких как состояние пациента, подвергаемого лечению, тип и серьезность заболевания, скорость введения и мнение врача. В некоторых случаях может быть подходящим количество, меньшее вышеуказанной дозировки. Количество, большее вышеуказанной дозировки, может применяться, если оно не вызывает вредных побочных эффектов, и такое количество может быть введено в виде разделенных дневных доз.
Фармацевтическая композиция изобретения может быть составлена в соответствии с любыми общепринятыми способами в форме таблетки, гранулы, порошка, капсулы, сиропа, эмульсии или микроэмульсии для перорального введения или для парентерального введения, включая внутримышечный, внутривенный и подкожный пути.
Фармацевтическая композиция изобретения для перорального введения может быть приготовлена смешением активного ингредиента с носителем, таким как целлюлоза, силикат кальция, кукурузный крахмал, лактоза, сахароза, декстроза, фосфат кальция, стеариновая кислота, стеарат магния, стеарат кальция, желатин, тальк, поверхностно-активное вещество, суспендирующий агент, эмульгатор и разбавитель. Примерами носителя, применяемого в композиции для инъекций настоящего изобретения, являются вода, раствор соли, раствор глюкозы, раствор аналога глюкозы, спирт, простой эфир гликоля (например, полиэтиленгликоль 400), масло, жирная кислота, сложный эфир жирной кислоты, глицерид, поверхностно-активное вещество, суспендирующий агент и эмульгатор.
Следующие примеры предназначены дял дальнейшей иллюстрации настоящего изобретения без ограничения его объема.
Пример 1: Получение 1-((3S)-3-(4-(3-хлор-2,4-дифторфениламино)-7-метоксихиназолин-6-илокси)пирролидин-1-ил)проп-2-ен-1-она
(1-1) 6,7-Диметоксихиназолин-4(3H)-он
36,9 г 4,5-диметоксиантраниловой кислоты смешивают с 25,0 г гидрохлорида формамидина и смесь 30 минут перемешивают при 210°С. После завершения реакции полученное таким образом твердое вещество охлаждают до комнатной температуры, перемешивают с 200 мл (0,33 М) водного раствора гидроксида натрия и отфильтровывают при пониженном давлении. Полученное таким образом твердое вещество промывают водой и сушат на воздухе, получают указанное в заголовке соединение (24,6 г, 64%).
1H-ЯМР (300 МГц, ДМСО-d6) δ 7,99 (с, 1H), 7,44 (с, 1H), 7,13 (с, 1H), 3,90 (с, 3H), 3,87 (с, 3H).
(1-2) 6-Гидрокси-7-метоксихиназолин-4(3H)-он
3,06 г соединения, полученного в (1-1), разбавляют 20 мл метанмульфоновой кислоты. К полученному раствору добавляют 2,66 г L-метионина и перемешивают 22 часа при 100°С. К реакционной смеси прибавляют лед и нейтрализуют 40% водным раствором гидроксида натрия, вызывая кристаллизацию продукта. Твердое вещество отфильтровывают при пониженном давлении, промывают водой и сушат на воздухе, получают указанное в заголовке соединение (2,67 г, 94%).
1H-ЯМР (300 МГц, ДМСО-d6) δ 11,94 (с, 1H), 9,81 (с, 1H), 7,92 (с, 1H), 7,39 (с, 1H), 7,11 (с, 1H), 3,91 (с, 3H).
(1-3) 7-Метокси-4-оксо-3,4-дигидрохиназолин-6-илацетат
6,08 г соединения, полученного в (1-2), растворяют в смеси 550 мл уксусной кислоты и 7 мл пиридина, и полученный раствор перемешивают 3 часа при 100°С. Реакционный раствор охлаждают до комнатной температуры и добавляют в него лед, вызывая кристаллизацию продукта. Твердое вещество отфильтровывают при пониженном давлении, промывают водой и сушат на воздухе, получают указанное в заголовке соединение (4,87 г, 65%).
1H-ЯМР (300 МГц, ДМСО-d6) δ 12,21 (с, 1H), 8,09 (с, 1H), 7,76 (с, 1H), 7,28 (с, 1H), 3,91 (с, 3H), 2,30 (с, 3H).
(1-4) Гидрохлорид 4-хлор-7-метоксихиназолин-6-илацетата
4,87 г соединения, полученного в (1-3), растворяют в смеси 33 мл тионилхлорида и 6 мл оксихлорида фосфора. К полученному раствору добавляют две капли диметилформамида и перемешивают 7 часов при 120°С. Реакционный раствор охлаждают до комнатной температуры и из него при пониженном давлении удаляют растворитель с образованием остатка. К остатку добавляют толуол и полученный раствор концентрируют при пониженном давлении с удалением растворителя, и эту процедуру повторяют еще 2 раза. Полученное таким образом твердое вещество сушат при пониженном давлении, получают указанное в заголовке соединение (5,16 г).
1H-ЯМР (300 МГц, ДМСО-d6) δ 9,01 (с, 1H), 8,02 (с, 1H), 7,64 (с, 1H), 4,02 (с, 3H), 2,35 (с, 3H).
(1-5) 4-Хлор-7-метоксихиназолин-6-ол
2 г соединения, полученного в (1-4), добавляют к 25 мл 7н. раствора аммиака в метаноле. Смесь перемешивают при комнатной температуре 1 час, образовавшееся в реакционной смеси твердое вещество отфильтровывают, промывают диэтиловым эфиром и сушат, получают указанное в заголовке соединение (1,43 г, 98%).
1H-ЯМР (300 МГц, ДМСО-d6) δ 8,78 (с, 1H), 7,41 (с, 1H), 7,37 (с, 1H), 4,00 (с, 3H).
(1-6) N-(3-хлор-2,4-дифторфенил)-7-метокси-6-((3S)-пирролидин-3-илокси)хиназолин-4-амин
1,43 г соединения, полученного в (1-5), 1,91 г (R)-N-Boc-3-пирролидинола и 1,96 г трифенилфосфина добавляют к 20 мл метиленхлорида и по каплям прибавляют туда 2,01 мл диизопропилазодикарбоксилата. Полученную смесь перемешивают при комнатной температуре 1 час, перегоняют при пониженном давлении и остаток предварительно очищают колоночной хроматографией (этилацетат:метиленхлорид:метанол = 20:20:1). Частично очищенный остаток растворяют затем в 60 мл 2-пропанола, добавляют туда 1,17 г 3-хлор-2,4-дифторанилина и смесь перемешивают 3 часа при 100°С. Полученную смесь перегоняют при пониженном давлении для удаления растворителя и остаток растворяют в 60 мл метиленхлорида. Добавляют туда 60 мл трифторуксусной кислоты и смесь перемешивают 1 час при комнатной температуре. Полученную смесь перегоняют при пониженном давлении для удаления растворителя. К полученному остатку добавляют раствор бикарбоната натрия до основной реакции с последующей экстракцией хлороформом. Органический слой осушают над безводным сульфатом натрия, фильтруют и перегоняют при пониженном давлении. Полученный остаток подвергают колоночной хроматографии (хлороформ:метанол = 1:2), получают указанное в