Способ получения производных 2-арил(гетарил)-1н-индолов
Иллюстрации
Показать всеИзобретение относится к способу получения производных 2-арил(гетарил)-1Н-индолов общей формулы I:
1 R2 Ia Cl Iб ОСН3 Iв H Iг H Iд Н Ie Cl Iж Cl
характеризующемуся тем, что производные 4-(1Н-индол-3-ил)-бут-3-ен-2-онов II и фенилгидразин солянокислый кипятят в диметилформамиде в течение 2 мин. Способ обеспечивает получение целевых продуктов с выходом до 83%. Соединения могут быть использованы для синтеза новых препаратов фармацевтического назначения. 2 табл.
Реферат
Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных 2-арил(гетарил)-1H-индолов, которые могут быть использованы для синтеза новых препаратов фармацевтического назначения.
Изобретение относится к разработке способа получения производных 2-арил(гетарил)-1H-индолов общей формулы I, которые могут быть использованы в синтезе противораковых препаратов - аналогов алкалоидов фуростифолина и фуроклаузина [Tsuchimoto Т., Nagase Y., Miyamura Т., Matsubayashi H., Kaneko M., Shirakawa E., Journal of the American Chemical Society, 2008, 47, 15823].
| Индекс | R1 | R2 |
| Ia | Cl | |
| Iб | ОСН3 | |
| Iв | H | |
| Iг | H | |
| Iд | Н | |
| Ie | Cl | |
| Iж | Cl |
В литературе описаны различные подходы к синтезу 2-арил-1H-индолов. Так 2-арил-1H-индолы получают палладий катализируемой реакцией арилирования индола незамещенного по 2 положению [Wang X., Gribkov D.V., Sames D., J. Org. Chem. 2007, 72, 1476].
Также эти соединения получают внутримолекулярной катализируемой InBr3 реакцией циклизацией 2-фенилэтиниланилина [Sakai N., Annaka К., Konakahara Т., Organic letters, 2004, 6, 1527].
Другими способом получения является модифицированная реакция Бишлера - микроволновое облучение смеси N-фенациланилина и гидробромида анилина [Liu F., Ma D., Synlett. 2006, 91].
Итальянскими авторами был описан способ получения 2-арил-1H-индолов, основанный на присоединении о-йоданилина к 1-алкинам и последующей циклизации в толуоле, с использованием комплексного медного катализатора [Cacchi S., Fabrizi G., Parisi L.M., Organic letters, 2003, 5, 3843].
Синтез 2-гетарил-1H-индолов в литературе описан мало. Так 2-гетарил-1H-индолы получают термолизом азидов [Rozhkov V.V., Kuvshinov A.M., Shevelev S.A. Synthetic Communications, 2002, 32, 1465].
Другим методом синтеза является восстановительная палладий катализируемая циклизация производных о-нитростирола [Kuethe J.Т., Davies I.W. Tetrahedron 2006, 62, 11381].
Также эти соединения можно получить взаимодействием анилинов и карбонильных соединений в суперосновных средах [Caubere С., Caubere P., Ianelli S., Nardelli M., Jamart-Gregoiret В. Tetrahedron, 1994, 50, 11903; Moskalev N., Barbasiewicz M., Makosza M. Tetrahedron, 2004, 60, 347].
Другим методом получения 2-гетарил-1H-индолов является реакция смешанного медно-цинкового бензильного металлорганического производного с хлорангидридами карбоновых кислот [Chen H.G., Hoechstetter С., Knochel P. Tetrahedron Lett., 1989, 36, 4795].
Недостатками перечисленных методов являются многостадийность, низкие выходы, либо применение дорогостоящих катализаторов.
Задача изобретения - разработка способа получения производных 2-арил(гетарил)-1H-индолов I, позволяющего расширить номенклатуру потенциально биологически активных веществ и представляющих собой удобные исходные соединения для синтеза аналогов алкалоидов фуростифолина и фуроклаузина.
Техническим результатом является обеспечение введения требуемого заместителя в целевой индольный каркас и увеличение выходов продуктов реакции.
Технический результат достигается тем, что в способе получения производных 2-арил(гетарил)-1H-индолов доступные 4-(1H-индол-3-ил)-бут-3-ен-2-оны II [Butin A.V., Uchuskin M.G., Pilipenko A.S., Tsiunchik F.A., Cheshkov D.A., Trushkov I.V., Eur. J. Org. Chem., 2010, 920] и фенилгидразин солянокислый кипятят в диметилформамиде в течение 2 мин.
| Индекс | R1 | R2 |
| Ia | Cl | |
| Iб | ОСН3 | |
| Iв | H | |
| Iг | H | |
| Iд | Н | |
| Ie | Cl | |
| Iж | Cl |
В основе заявляемого способа лежит взаимодействие 4-(1H-индол-3-ил)-бут-3-ен-2-онов с фенилгидразинами с образованием производных дигидропиразола описанная в [Bioorganic and Medicinal Chemistry, 2008, 7, 3907], в предложенном нами методе происходит отщепление дигидропиразолового остатка от молекулы индола.
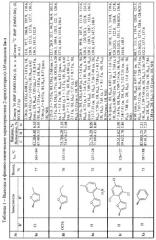
Температуры плавления, данные элементного анализа и спектральные характеристики 2-арил(гетарил)-1H-индолов Ia-з приведены в таблице 1.
Полученный технический результат позволяет расширить ряд производных 2-арил(гетарил)-1H-индолов Ia-з и тем самым номенклатуру потенциально биологически активных соединений.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения 6-хлоро-2-(5-метил-фуран-2-ил)-1H-индола
Пример 1.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл. диметилформамида кипятят в течение 2 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl2 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир.
Выход 77% (0.89 г).
Tпл.=164°C.
Найдено для C17H14ClNO2, %: С, 68.12; Н 4.71; N 4.67.
Вычислено: С, 68.30; Н 4.70; N 4.53.
Спектр 1Н ЯМР (CDCl3), (δ, м.д. и КССВ, J, Гц): 2.38 (с, 3Н, Me), 6.08 (д, J=3.0 Hz 1H, HFur), 6.52 (д, J=3.0 Hz 1H, HFur), 6.62 (уш.с, 1Н, HPyr), 7.05 (дд, J=1.8, 8.4 Hz, 1H, HAr), 7.33 (д, J=1.8 Hz, 1H, HAr), 7.46 (д, J=8.4 Hz, 1H, HAr), 8.37 (уш.с, 1H, NH).
Спектр 13С ЯМР (CDCl3), (δ, м. д.): 13.6,97.7, 106.8, 107.9, 110.6, 120.9, 121.2, 127.6, 127.7, 130.3, 136.3, 145.5, 152.0.
Пример 2.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл. диметилформамида кипятят в течение 5 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl2 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир.
Выход 65% (0.75 г).
Пример 3.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл. диметилацетамида кипятят в течение 2 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl2 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 70% (0.81 г).
Пример 4.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл. диметилацетамида кипятят в течение 5 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl2 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 63% (0.73 г).
Пример 5.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл. нитробензола кипятят в течение 2 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl2 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 55% (0.64 г).
Пример 6.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл. нитробензола кипятят в течение 5 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl3 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 40% (0.46 г).
Пример 7.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл. диметилсульфоксида кипятят в течение 2 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl2 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 50% (0.58 г).
Пример 8.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл диметилсульфоксида кипятят в течение 5 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl2 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 37% (0.43 г).
Пример 9.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл 1,4-диоксана кипятят в течение 2 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl2 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 41% (0.47 г).
Пример 10.
Смесь 1.50 г (0.5 ммоль) 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1H-индол-3-ил]-бут-3-ен-2-она, 0.87 г (0.6 ммоль) гидрохлорида фенилгидразина и 15 мл 1,4-диоксана кипятят в течение 5 минут. Затем реакционную смесь выливают в 200 мл воды, экстрагируют CH2Cl2 (3×75 мл), объединенные органические фракции сушат над Na2SO4, упаривают при пониженном давлении. Остаток разделяют на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - хлористый метилен: гексан 1:6. Перекристаллизовывают из смеси хлористый метилен/петролейный эфир. Выход 28% (0.32 г).
В таблице 2 приведены данные о влиянии реакционных условий на выход 6-хлоро-2-(5-метил-фуран-2-ил)-1H-индола (примеры 1-10).
Как видно из таблицы 2, оптимальным условием получения целевого продукта 6-хлоро-2-(5-метил-фуран-2-ил)-1H-индола Ia является кипячение смеси 4-[6-хлоро-2-(5-метил-фуран-2-ил)-1Н-индол-3-ил]-бут-3-ен-2-она IIа и гидрохлорида фенилгидразина в диметилформамида в течение 2 минут. Более продолжительное время реакции сопровождается осмолением и, как следствие, снижением выхода целевого продукта. Проведение реакции в других растворителях сопровождается сильным осмолением реакционной среды.
| Таблица 2 | |||
| Влияние реакционных условий на выход 6-хлоро-2-(5-метил-фуран-2-ил)-1H-индола Ia | |||
| Пример | Растворитель | Время реакции, мин | Выход, % |
| 1 | Диметилформамид | 2 | 77 |
| 2 | Диметилформамид | 5 | 65 |
| 3 | Диметилацетамид | 2 | 70 |
| 4 | Диметилацетамид | 5 | 63 |
| 5 | Нитробензол | 2 | 55 |
| 6 | Нитробензол | 5 | 40 |
| 7 | Диметилсульфоксид | 2 | 50 |
| 8 | Диметилсульфоксид | 5 | 37 |
| 9 | 1,4-диоксан | 2 | 41 |
| 10 | 1,4-диоксан | 5 | 28 |
Заявляемым способом получен ряд производных 2-арил(гетарил)-1H-индолов 1а-к.
Способ получения производных 2-арил(гетарил)-1Н-индолов общей формулы I характеризующийся тем, что производные 4-(1Н-индол-3-ил)-бут-3-ен-2-онов II и фенилгидразин солянокислый кипятят в диметилформамиде в течение 2 мин.