Способ направленного изменения активности ферментных белков
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложен способ направленного изменения активности ферментных белков. Способ заключается во введении модифицирующей добавки в раствор, содержащий ферментный белок. В качестве модифицирующей добавки вводят соединения, представленные ацил- или алкилфенолами, имеющими от 1 до 3 углеродных циклов, причем алкильные радикалы имеют длину углеродной цепи C1-C2 или С6. Заданное направление изменения активности в сторону стимулирования или ингибирования осуществляют путем обеспечения оптимальной концентрации выбранной модифицирующей добавки в растворе ферментного белка. Изобретение позволяет как повышать, так и снижать скорость катализа и глубину каталитического превращения, а также способствует расширению спектра используемых ферментами субстратов. 10 з.п. ф-лы, 14 табл.
Реферат
Изобретение относится к области биотехнологии и может быть использовано для повышения эффективности ферментных процессов в производствах получения пищевых продуктов и добавок, кормовых смесей, моющих средств или, напротив, для целей консервации за счет ингибирования активности ферментов.
Ферменты - биологические катализаторы, широко используются в различных областях хозяйственной деятельности человека. Активность ферментных белков зависит от внутримолекулярной динамики, которая может быть повышена или понижена, что приведет к стимуляции или ингибированию каталитической активности, соответственно.
Модифицировать пространственную структуру белковой молекулы можно разными способами:
1) использованием добавок, изменяющих конформацию белка;
2) химической модификацией молекулы;
3) приемами белковой инженерии через сайт-направленный мутагенез.
Добавление веществ, модифицирующих конформацию белка, является наиболее простым и во многих случаях наиболее эффективным и дешевым способом изменения активности ферментов.
Известен способ повышения активности ферментов при повышенных температурах с помощью внесения в их водные растворы веществ с функциями шаперонов, таких, например, как сахариды (трегалоза 20%) и глицерин (20%) (ЕР 0821058, 2002).
Однако активность повышается только при высоких температурах. Известен способ активации оксидоредуктазы, основанный на добавлении веществ формулы:
со многими вариантами заместителей R1, R2 и R3 (US 6169065, 2001).
Недостатком является повышение активности только в отношении оксидоредуктазы. Другим недостатком данного способа является сложность синтеза модификаторов, включая их очистку, что неизбежно приведет к удорожанию способа.
Известен способ стабилизации и активации ферментов, в частности РНКазы и химотрипсина, с помощью С7-алкилоксибензола, который осуществляют путем внесения в раствор фермента, предварительно растворенного в этаноле С7-алкилоксибензола, и последующего инкубирования полученной смеси в течение 10-60 мин ("Микробиология", 2000, том 69, №2, 224-230).
Ближайшим аналогом настоящего изобретения является способ активации водных растворов амилосубтилина и ксиланазы, основанный на добавлении 5-метилрезорцина в концентрации 0.05-1.0 мг/мл, что приводит к повышению ферментативной активности на 38-51%, RU 2238318 (2003).
Недостатками как прототипа, так и вышеописанных аналогов является то, что эффект изменения активности ферментов проявляется только в сторону повышения активности, причем при оптимальных или супраоптимальных температурах, хотя во многих реальных производствах, например при силосовании, требуется активировать процесс при субоптимальных температурах.
Задачей настоящего изобретения является разработка способа направленного изменения активности как моно-, так и полисубъединичных ферментов в водных разбавленных и концентрированных растворах и в составе растений, приводящего к повышению или понижению скорости катализа и глубины каталитического превращения как при оптимальных, так и при неоптимальных условиях, а также возможность расширения спектра используемых субстратов.
Поставленная задача решается описываемым способом направленного изменения активности ферментных белков, который включает введение раствора модифицирующей добавки в раствор, содержащий ферментный белок, причем в качестве модифицирующей добавки используют соединения с одним или несколькими шестиатомными углеродными циклами с различными радикалами, среди которых не менее чем один радикал представлен гидроксилом или оксигруппой, а алкильные радикалы имеют длину углеродной цепи С1-С2 или C6, при этом заданное направление изменения активности в сторону стимулирования или ингибирования осуществляют путем обеспечения оптимальной концентрации выбранной модифицирующей добавки в растворе, содержащем ферментный белок.
Введение модифицирующей добавки можно осуществить в реакционную смесь, содержащую ферментный белок и субстрат, или в раствор ферментного препарата до его внесения в реакционную смесь.
Согласно способу, для стимулирования активности моносубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы C1-C2, находится в диапазоне 0.014-1.7 г/л. Для каждого конкретного фермента оптимальное количество добавки уточняется индивидуально.
Согласно способу, для стимулирования активности полисубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы C1-C2, составляет 0.01-0.2 г/л. Для каждого конкретного фермента оптимальное количество добавки уточняется индивидуально.
Согласно способу, для ингибирования активности полисубъединичных ферментов концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы C1-C2, превышает 0.2 г/л.
Согласно способу, для стимулирования активности моносубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С6, находится в диапазоне 0.002-0.04 г/л. Для каждого конкретного фермента оптимальное количество добавки уточняется индивидуально.
Согласно способу, для стимулирования активности полисубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С6, находится в диапазоне 0.018-0.18 г/л. Для каждого конкретного фермента оптимальное количество добавки уточняется индивидуально.
Согласно способу, для ингибирования активности моносубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С6, превышает 0.04 г/л.
Согласно способу, для ингибирования активности полисубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С6, превышает 0.2 г/л.
Согласно способу, для изменения субстратной специфичности полисубъединичных белков оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы C1-С2 и С6, находится в диапазоне 0.03-0.08 г/л. Добавки больше влияют на скорость реакции полисубъединичных ферментов с неспецифическими субстратами, чем со специфичными.
Предлагаемое изобретение соответствует изобретательскому уровню, так как из уровня техники не известны модифицирующие добавки для ферментных белков, обладающие структурой, охарактеризованной в независимом пункте формулы. Не известно также использование модифицирующих добавок подобной структуры для направленного изменения активности ферментов (повышения или понижения в зависимости от задачи обработки) за счет введения одной и той же модифицирующей добавки, но в разном количестве. Не известно также использование модифицирующих добавок для расширения спектра используемых ферментами субстратов.
Технический результат настоящего изобретения основан на внесении в растворы ферментных белков амфифильных веществ, способных модифицировать структуру белка путем образования нового комплекса за счет межмолекулярных водородных связей, гидрофобных и ионных взаимодействий. Используемые в способе модификаторы ферментных белков, по существу, являются химическими производными аналогов микробных метаболитов, имеющих функции адаптогенов, относящихся к природным ацил- или алкилфенолам.
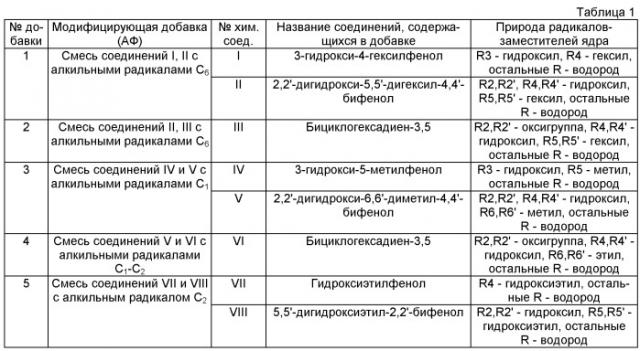
В таблице 1 представлены испытанные нами модифицирующие добавки (далее условное обозначение - АФ), содержащие смесь из химических соединений, относящихся к группе заявленных в п.1 соединений, где радикалы R1-R5 относятся к первому кольцу, радикалы R'1-R'5 - ко второму, R"1-R"5 - к третьему.
Используемые модифицирующие добавки 1-5 могут быть получены, например, путем смешения компонентов I-VIII, входящих в их состав, приобретенных коммерчески (например, http://www.reaxys.com; http://mntc.ru/synthesis.html и http://chemexpress.fatal.ru/Navigator/Deliver.html). Активность модифицирующих композиций проявляется при наличии указанных выше АФ I-VIII в количествах от 1% до 99% от суммарного содержания АФ при любом их соотношении.
Ферменты обрабатывают с помощью модифицирующих добавок двумя способами: смешивая растворы ферментов и АФ или внося растворы АФ в реакционную смесь одновременно с растворами фермента и субстрата.
Модификация пространственной структуры при образовании комплекса «белок-АФ» проявляется в (1) изменении каталитической активности ферментов в широком температурном и рН-диапазонах катализа и (2) в том, что сопровождается расширением спектра используемых субстратов.
Направление изменения каталитической активности модифицированных ферментов - стимуляция или ингибирование, зависит от типа выбранного модификатора из ряда заявленных и подбора необходимой для заданной цели концентрации модификатора.
Решение поставленной задачи подтверждено представленными ниже примерами.
Конкретные примеры осуществления изобретения
Пример 1. Влияние введения в раствор модифицирующих добавок (АФ №1-5) на протеолитическую активность ферментных препаратов (ФП) протеаз (Biobake-BPN и Biobake-BSC, Qwest, Нидерланды)
Протеолитическую активность определяют модифицированным методом Ансона. Для проведения гидролиза готовят 2% раствор субстрата (казеин по Гамерстену); раствор ФП на фосфатном буфере рН 7.2 (KH2PO4 - 9.08 г/л, Na2HPO4×12H2O - 23.89 г/л). Реакционная смесь содержит 2 мл ФП, 1 мл раствора модификатора так, чтобы конечная концентрация составляла 0.03-1.4 г/л, 2 мл субстрата. Через 20 мин реакцию останавливают добавлением 4 мл 5% трихлоруксусной кислоты (ТХУ). Протеолитическую активность определяют по нарастанию концентрации низкомолекулярных белковых фракций, не осаждаемых 5% ТХУ, при измерении экстинкции (λ=280 нм) супернатантов, полученных после фильтрования реакционной смеси. Калибровочную кривую строят по тирозину. Активность в контроле принимают за 100%. Результаты представлены в таблицах 2 и 3.
| Таблица 2 | |||
| Активность модифицированных АФ протеаз (№3 - ФП Biobake-BPN; №4 и 5 - ФП Biobake-BSC) | |||
| Концентрация АФ, г/л | Протеолитическая активность, % от контроля | ||
| № препарата согласно табл.1 | |||
| №3 | №4 | №5 | |
| 0 | 100 | 100 | 100 |
| 0.03 | 117 | 87 | - |
| 0.05 | 107 | 83 | - |
| 0.1 | 100 | 87 | 123 |
| 0.2 | 117 | 80 | 156 |
| 0.4 | 200 | 110 | 167 |
| 0.6 | 133 | 167 | 175 |
| 0.8 | 160 | 210 | - |
| 1.0 | 267 | 343 | - |
| 1.2 | 160 | 313 | 287 |
| 1.4 | 100 | 298 | 269 |
| Таблица 3 | ||
| Активность модифицированных протеаз ФП Biobake-BPN и Biobake-BSC с АФ №1 и №2 соответственно | ||
| Концентрация АФ, г/л | Протеолитическая активность, % от контроля | |
| Biobake-BPN (АФ №1) | Biobake-BSC (АФ №2) | |
| 0 | 100 | 100 |
| 0.002 | 120 | 130 |
| 0.004 | 119 | 129 |
| 0.006 | 120 | 129 |
| 0.008 | 118 | 128 |
| 0.01 | 115 | 128 |
| 0.02 | 112 | 124 |
| 0.04 | 100 | 94 |
| 0.06 | 37 | 69 |
| 0.08 | 35 | 43 |
| 0.1 | 42 | 34 |
Используемые добавки №3, 4, 5 в диапазоне концентраций 0.03-1.4 г/л стимулируют активность ФП до 117-298% от контроля. Препараты №1, 2 в области низких концентраций 0,002-0,02 г/л увеличивают активность протеиназ до 120-130% от контроля. Дальнейшее повышение содержания АФ №1 и 2 в реакционной смеси приводит к ингибированию активности ФП.
Пример показывает, что модификация ферментных белков препаратами АФ приводит к изменению их каталитической активности - стимуляции или ингибированию, в зависимости от выбранной добавки с соответствующим алкильным заместителем и ее концентрации.
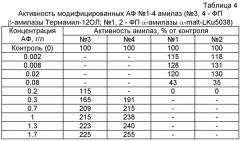
Пример 2. Влияние введения модифицирующих добавок - АФ №№1, 2, 3, 4 на активность амилаз (№3, 4 - β-амилазы ФП Термамил-12ОЛ, Novozyme, Дания; №1, 2 - α-амилазы ФП α-malt-LKu5038, Германия (табл.4))
Амилолитическую активность определяют по количеству образующихся при гидролизе крахмала редуцирующих веществ колориметрическим методом с 3,5-динитросалициловой кислотой. Для проведения гидролиза готовят: для β-амилазы - 0.2% раствор крахмала на фосфатно-цитратном буфере рН 4.8; для α-амилазы - в буфере рН 6.9. В реакционную смесь вносят 0.5 мл раствора фермента с активностью 0.05 ед/мл, 2 мл субстрата, 0.5 мл раствора АФ, так чтобы его конечная концентрация составляла от 0.002 до 1.7 г/л. Ферментный гидролиз проводят в течение 10 мин при 25°С. В контрольные варианты вместо раствора модификатора добавляют 0.5 мл воды. Для определения образовавшихся редуцирующих веществ из каждой пробы отбирают 0.5 мл реакционной смеси и добавляют 2 мл 3,5-динитросалициловой кислоты. Затем смесь выдерживают 10-15 мин в кипящей водяной бане. После охлаждения раствора определяют его экстинкцию при λ=510 нм. За 100% принимают активность необработанного АФ препарата β-амилазы.
Результаты примера 2 представлены в табл.4, из которой видно, что активность β-амилазы и α-амилазы возрастает при всех концентрациях АФ №3 и 4, для АФ №1 и 2 при концентрациях АФ 0.002-0.02 г/л, а при более высоких снижается до полного ингибирования.
Пример подтверждает зависимость стимулирующего его ингибирующего действия АФ от их структуры и концентрации для различных ферментов.
Пример 3. Влияние введения модифицирующих добавок АФ №3 и 4 на активность жидких концентрированных ФП α-амилазы (ФП α-malt-LKu5038, Германия) и глюкоамилазы (Сан-УльтраЛ, Novozyme, Дания).
Ферментативную активность амилаз определяют по количеству редуцирующих веществ (3,5-динитросалициловой кислотой), образующихся при гидролизе крахмала. Реакционная смесь включает 2.5 мл раствора фермента, 1.5 мл раствора АФ заданной концентрации, 5 мл 1% раствора крахмала. Гидролиз проводят в течение 10 мин при температуре 30°С, рН 6.0. Реакцию останавливают добавлением равного объема 0.2 н. HCl. Для стабилизации фермента из исходного концентрата ФП готовят растворы, разведенные в 1; 100; 1000; 5000; 40000 раз. К 1 мл полученных растворов добавляют 1 мл раствора АФ с концентрацией 40 г/л. Растворы модифицированных ферментов разводят до концентрации 0.05 ед./мл и используют для гидролиза.
Полученные результаты представлены в таблице 5.
Величина стимуляции активности α-амилазы зависит от соотношения ФП/АФ. Наилучшие результаты (170% от контроля) получены при стабилизации жидких ФП, разведенных в 1000-100 раз (2 и 20 ед./мл), и концентрациях АФ 1.0-0.1 г/л, соответственно.
Модификацию глюкоамилазы проводят, используя разведения концентрированного ФП в 1; 100; 500; 1000; 25000 раз. Стабилизированный фермент разводят для реакции гидролиза до активности 0.1 ед./мл.
Полученные результаты представлены в таблице 6.
Величина стимуляции активности глюкоамилазы зависит от соотношения ФП/АФ. Наилучшие результаты (150-310% от контроля) получены при стабилизации жидких ФП, разведенных в 100-1000 раз, при концентрациях АФМ 0.16-1.6 г/л.
| Таблица 5 | |||
| Активность модифицированного жидкого ФП α-амилазы α-malt-LKu5038 с АФ №3 | |||
| Разведение ФП, раз | Количество фермента в рабочем растворе, ед./мл | Концентрация АФ №3 в реакционной смеси, г/л | Активность, % от контроля |
| 40000 | 0.05 | 0 (контроль) | 100 |
| 5000 | 0.4 | 5.0 | 100 |
| 1000 | 2.0 | 1.0 | 175 |
| 100 | 20.0 | 0.1 | 168 |
| 1 | 2000 | 0.001 | 100 |
| Таблица 6 | |||
| Активность модифицированного жидкого ФП глюкоамилазы Сан-УльтраЛ с АФ №4 | |||
| Разведение ФП, раз | Количество фермента в рабочем растворе, ед./мл | Концентрация АФ №4 в реакционной смеси, г/л | Активность, % от контроля |
| 25000 | 0.1 | 0 (контроль) | 100 |
| 1000 | 2.5 | 1.6 | 311 |
| 500 | 5.0 | 0.8 | 265 |
| 100 | 25.0 | 0.16 | 155 |
| 1 | 2500 | 0.0016 | 100 |
Данный пример показывает эффективность применения заявленных модификаторов для повышения активности жидких концентрированных ферментных препаратов. Величина стимуляции активности ферментов зависит от соотношения ФП (ед.)/АФ. Расход АФ при модификации концентрированных препаратов существенно меньше, чем при модификации ферментов в катализируемой реакции, как в примерах 1, 2.
Пример 4. Влияние введения модифицирующих добавок АФ №3 и №4 на активность ФП «Целлюлаза» (завод «Энзим», г.Ладыжино, Украина) (табл.7).
Активность целлюлаз определяют по количеству редуцирующих веществ, образующихся при гидролизе целлюлозы, колориметрическим методом с 3,5-динитросалициловым реагентом. Калибровочную кривую строят по глюкозе. Реакционная смесь включает 2 мл 0.15% раствора фермента, 2 мл 0.75% раствора субстрата (натриевая соль карбоксиметилцеллюлозы), 1 мл раствора АФ заданной концентрации. Гидролиз проводят в течение 2 часов при оптимальных параметрах. Результаты опытов представлены в таблице 7, из которой видно, что активность модифицированного фермента возрастает по мере увеличения концентрации АФ в реакционной среде в 30 и 32 раза, соответственно, достигая максимальных значений при концентрациях АФ 0.8-1.0 г/л.
| Таблица 7 | ||
| Активность модифицированного АФ №3 и 4 ФП «Целлюлаза» (завод «Энзим», г.Ладыжино, Украина) | ||
| Концентрация АФ, г/л | Активность целлюлазы, мг глюк./см3·мин | |
| АФ №3 | АФ №4 | |
| 0 | 0.0018 | 0.0018 |
| 0.2 | 0.028 | 0.035 |
| 0.4 | 0.035 | 0.037 |
| 0.6 | 0.040 | 0.044 |
| 0.8 | 0.047 | 0.05 |
| 1.0 | 0.054 | 0.057 |
Пример 5. Влияние введения модифицирующих добавок АФ №1, 3, 5 на активность и субстратную специфичность метилпирокатехин-1,2-диоксигеназы (МПК-1,2-ДО) (фермент с широкой субстратной специфичностью)
Активность МПК-1,2-ДО определяют модифицированным методом Хаяиси с соавторами. Реакционная смесь содержит в 50 мМ буфере Tris-HCl (рН 7.2) 0.25 mM пирокатехин или замещенный пирокатехин, 1.3 мМ ЭДТА и фермент. Реакцию начинают добавлением фермента. Активность фермента рассчитывают по скорости образования продукта (цис, цис-муконовой кислоты или замещенных муконатов) спектрофотометрически при 260 нм. При расчете активностей используют коэффициенты молярной экстинкции, определенные Дорном и Кнакмуссом: 16800 М-1·см-1 для пирокатехина; 17100 М-1·см-1 для 3-хлорпирокатехина; 12400 М-1·см-1 для 4-хлорпирокатехина; 12000 М-1·см-1 для 3,5-хлорпирокатехина; 18000 М-1·см-1 для 3-метилпирокатехина; 13900 М-1·см-1 для 4-метилпирокатехина. Единицу активности определяют как количество фермента, катализирующее превращение 1 мкмоля субстрата или образование 1 мкмоля продукта в минуту.
В экспериментах используют концентрации добавок, которые максимально увеличивают скорость протекания реакции полисубъединичного фермента МПК-1,2-ДО с пирокатехином: АФ №1 - 0.036 г/л, АФ №3 - 0.042 г/л, АФ №5 - 0.08 г/л. Смесь АФ + фермент в буферном растворе выдерживают 10 мин при 25°С в контрольных вариантах, реакцию начинают добавлением пирокатехина, в опытах реакцию начинают добавлением различных субстратов. Результаты см. в таблице 8.
| Таблица 8 | ||||
| Влияние модифицирующих добавок на субстратную специфичность МПК-1,2-ДО | ||||
| Субстрат* | Удельная активность (активность по сравнению с ПК, %) | |||
| Контроль | АФ №3 | АФ №1 | АФ №5 | |
| ПК | 14.4 (100) | 14.8 (100) | 14.1 (100) | 12.7 (100) |
| 3-ХПК | 1.9 (13.4) | 2.1 (14.1) | 2.2 (15.2) | 2.5 (19.9) |
| 4-ХПК | 15.8 (109.7) | 16.3 (110.2) | 15.9 (112.5) | 14.5 (119.5) |
| 3-МПК | 26.4 (183.4) | 29.0 (196) | 22.5 (158.7) | 25.8 (203.2) |
| 4-МПК | 36.1 (250.5) | 38.1 (257.7) | 33.0 (233.1) | 38.9 (306.6) |
| 3,5-диХПК | 2.3 (16.1) | 4.49 (30.3) | 2.4 (17.2) | 3.67 (28.9) |
| 4,5-диХПК | 0.67 (4.7) | 0.72 (4.7) | 0.47 (3.34) | 0.52 (4.09) |
| 3,6-диХПК | 0.35 (2.4) | 1.72(11.9) | 1.6 (11.3) | 1.8 (13.9) |
| 4-нитроПК | 0.049 (0.34) | 0.62 (4.2) | 0.1176 (0.83) | 0.088 (0.7) |
| * ПК - пирокатехин, ХПК - хлорпирокатехин, МПК - метилпирокатехин |
Нативный фермент МПК-1,2-ДО катализирует расщепление дихлорпирокатехинов (диХПК) с незначительной скоростью - 2-16%, по сравнению со скоростью окисления пирокатехина (ПК). Модификация МПК-1,2-ДО с АФ приводит к активации процесса. АФ №3 и 5 почти в 2 раза увеличивают скорость реакции МПК-1,2-ДО с 3,5-дихлорпирокатехином. Скорость окисления 3,6-дихлорпирокатехина увеличивается в пять раз под действием всех трех АФ. В 12 раз увеличивается скорость окисления 4-нитропирокатехина в присутствии добавки №3. Данный пример показывает, что заявленные добавки могут значительно изменять субстратную специфичность ферментов с широкой субстратной специфичностью.
Пример 6. Влияние модифицирующих добавок (АФ №1, 3 и 5) на субстратную специфичность фермента пирокатехин-1,2-диоксигеназы (ПК-1,2-ДО) (фермент с узкой субстратной специфичностью)
ПК-1,2-ДО относится к узкоспецифичным ферментам. Для нее слабо специфичными субстратами, кроме дихлорпирокатехинов, являются также хлорпирокатехины. Реакцию проводят как в примере 5. Результаты представлены в таблице 9. АФ №1 увеличивает скорость реакции с 3- и 4-хлорпирокатехинами почти в 3 раза. АФ №3 и 5 в реакции с 3,6-дихлорпирокатехином увеличивают скорость его окисления в 130 раз и 90 раз, соответственно. Скорость окисления 4-нитропирокатехина под действием АФ №5 увеличивается в 26 раз.
| Таблица 9 | ||||
| Влияние АФ на субстратную специфичность ПК-1,2-ДО | ||||
| Субстрат | Удельная активность (активность по сравнению с ПК, %) | |||
| Контроль | АФ №3 | АФ №1 | АФ №5 | |
| ПК | 7.7 (100) | 6.9 (100) | 8.6 (100) | 8.4 (100) |
| 3-ХПК | 0.08 (1.1) | 0.05 (0.7) | 0.35 (4.1) | 0 (0) |
| 4-ХПК | 0.24 (3.1) | 0.14 (2.0) | 0.76 (8.9) | 0.07 (0.9) |
| 3-МПК | 13.0 (168.6) | 11.4 (164.5) | 12.0 (139.5) | 15.1 (179.8) |
| 4-МПК | 17.7 (229.3) | 20.6 (298.0) | 21.3 (248.2) | 19.6 (233.8) |
| 3,5-диХПК | 0.33 (4.3) | инг | инг | инг |
| 4,5-диХПК | 0.13 (1.7) | инг | инг | 0.02 (0.2) |
| 3,6-диХПК | 0.03 (0.4) | 9.24 (133.8) | 7.86 (91.5) | 0 (0) |
| 4-нитроПК | 0.032 (0.4) | инг | инг | 0.82 (9.7) |
Результаты примеров №5 и 6 показывают, что заявленные модифицирующие добавки, расширяя спектр субстратной специфичности, оказывают более существенное влияние на изменение скорости реакций димерных ферментов с неспецифичными субстратами, чем со специфичными.
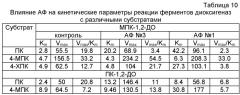
Кажущиеся константы Михаэлиса (Km) и значения Vmax определяют методом двойных обратных величин в координатах 1/V0 от 1/S, где S - концентрация субстрата, которая составляет 0.5-100 мкМ (пирокатехин, ПК), 0.5-400 мкМ (3-метилпирокатехин, 3-МПК, и 4-метилпирокатехин, 4-МПК), 1-100 мкМ (хлорпирокатехины, ХПК).
В таблице 10 приведены данные по влиянию введения заявленных модифицирующих добавок на два показателя каталитической активности белков - константу Михаэлиса и максимальную скорость реакции. АФ №3 увеличивает Km реакции обоих ферментов с пирокатехином в 6-7 раз и не влияет на константу Михаэлиса в реакциях с 4-МПК и 4-ХПК. АФ №1 также увеличивает Km реакции обоих ферментов с пирокатехином (в 4-5 раз), а также с другими проверенными субстратами в 2-4 раза. Изучение влияния АФ на Vmax показывает, что оба АФ значительно увеличивают максимальную скорость реакций (до 2-2.5 раз). При этом АФ №3 увеличивает константу специфичности с замещенными пирокатехинами у обоих ферментов, а АФ №1, наоборот, уменьшает. Важно отметить, что оба АФ уменьшали константу специфичности с незамещенным пирокатехином у обоих ферментов. То есть введением заявленных модифицирующих добавок можно направленно изменять активность ферментных белков.
Данные, приведенные в таблице 10, демонстрируют влияние АФ не только на Vmax, но и на константу Km в реакциях окисления диоксигеназами различных субстратов. Этот факт свидетельствует, что уменьшение у диоксигеназ специфичности в отношении "основного" субстрата компенсируется повышением их специфичности в отношении "чужеродных", что приводит к решению задачи расширения спектра используемых субстратов.
Пример 7. Влияние АФ №№1, 3 и 5 на активность пероксидазы
Пероксидаза (полисубъединичный белок) катализирует окисление полифенолов в присутствии органических перекисей или перекиси водорода. Образуя с перекисью комплексное соединение, она активирует кислород перекиси и с его участием окисляет субстрат (о-дианизидингидрохлорид). Активность пероксидазы измеряют колориметрическим методом по скорости развития окраски в индикаторной реакции разложения Н2О2 ферментом при рН 7.0 и температуре 25°С. Для проведения окисления субстрата готовят на фосфатном буфере 0.05 М (рН 7.0) растворы: субстрата - о-дианизидингидрохлорида 5 мг/мл; АФ с диапазоном концентраций от 0.018 до 0.36 г/л, ферментного препарата 0.002 мг/мл. Реакционная смесь включает 840 мкл 0.05 М K-фосфатного буфера (рН 7.0), 10 мкл 3% H2O2, 100 мкл субстрата, по 25 мкл ферментного препарата и раствора АФ определенных концентраций. В течение 5 мин измеряют изменение поглощения реакционной смеси при 436 нм. В контрольных вариантах вместо раствора АФ вносят 25 мкл 0.05 М K-фосфатного буфера. Активность в контроле принимают за 100%. Результаты представлены в табл.11. Модификация пероксидазы заявленными соединениями вызывает увеличение активности в зависимости от выбранного модификатора и его концентрации (0.018-0.36 г/л). Концентрация АФ №3 0.07 мг/л увеличивает пероксидазную активность до 143% от контроля; концентрация АФ №5 0.28 мг/л - до 135% (от контроля). В варианте с АФ №1 отмечены 2 максимума активности: при 0.018 г/л - 130% и 0.09 г/л - 115% активности от контроля.
Используя АФ №1 и 3 при концентрациях выше 0.18 мг/л, можно обеспечить ингибирование активности.
Данный пример демонстрирует возможность направленного изменения активности полисубьединичного фермента (пероксидазы) добавлением АФ в определенных концентрациях, оптимальные значения которых различны для разных препаратов и могут быть подобраны в соответствии с заявленным способом.
| Таблица 11 | ||
| Активность пероксидазы, модифицированной АФ №1, 3 | ||
| Активность пероксидазы, % от контроля | ||
| Концентрация АФ, г/л | АФ №1 | АФ №3 |
| Контроль | 100 | 100 |
| 0.018 | 130.0 | - |
| 0.028 | 120.0 | - |
| 0.036 | 120.3 | 129.4 |
| 0.056 | - | 135.7 |
| 0.07 | 105.5 | 143 |
| 0.09 | 115.0 | 136.7 |
| 0.14 | - | 128.6 |
| 0.18 | 100.0 | 115.5 |
| 0.28 | - | 84.2 |
| 0.36 | 73.7 | 79.6 |
Пример 8. Влияние АФ №4 на функциональную активность амилаз ФП Альфалад (завод «Энзим», г.Ладыжино, Украина; смесь α- и β-амилаз)
Модификацию препарата амилаз проводят как описано в примере №2.
Растворы АФ №4 смешивали с раствором концентрированного ФП «Альфалад» (разведение 1:10000) в соотношении 1:1 и выпаривали в течение 1 часа при 30°С (имитация стадии вакуум-выпаривания в заводском производстве). Осахаривающую активность амилазы определяют как в примере №2 по накоплению редуцирующих веществ (РВ), принимая за 1 ед. активности количество фермента, который образует 1 ммоль мальтозы в мин.
Разжижающую активность амилаз определяют вискозиметрически. Субстрат (10% р-р крахмала) и раствор фермента (разведение 1:10000) термостатируют при 30°С в течение 10 мин, вносят в вискозиметр в соотношении 1:1 и замеряют вязкость (время протекания) реакционной смеси через 5 и 10 мин против контроля, где раствор фермента заменяют на эквивалентное количество воды. Общий объем реакционной смеси 15 см3.
Декстринирующую активность амилаз определяют капельным методом с 1% раствором крахмала, фиксируя в опыте (с АФ) и контроле (без АФ) время, в течение которого происходит расщепление крахмала до продуктов, не окрашиваемых йодом. Результаты представлены в таблице 12.
| Таблица 12 | |||
| Влияние АФ №4 на активность препарата Альфалад | |||
| Концентрация АФ №4, г/л | Ферментативная активность, % от контроля | ||
| осахаривающая | разжижающая | декстринирующая | |
| 0 | 100 | 100 | 100 |
| 0.007 | 100 | 100 | 110 |
| 0.014 | 108 | 110 | 114 |
| 0.028 | 112 | 115 | 120 |
| 0.035 | 205 | 125 | 120 |
| 0.042 | 220 | 145 | 135 |
| 0.056 | 160 | 125 | 125 |
| 0.070 | 130 | 105 | 110 |
| 0.077 | 105 | 100 | 100 |
| 0.084 | 100 | 100 | 100 |
Оптимальной модифицирующей концентрацией АФ №4 была 42 мг/л по всем трем показателям активности. Пример показывает существенное повышение технологических показателей препарата амилаз при введении заявленной модифицирующей добавки (АФ №4).
Пример 9. Демонстрирует влияние введения АФ №3 на активность каталазы и пероксидазы зерна ячменя.
Зерно ячменя замачивают в растворе препарата АФ №3 в течение 6 часов, затем, чередуя выдержку на воздухе - 10 ч, и в воде - 4 ч, доводят влажность зерна до 45%. Увлажненный ячмень проращивают при температуре 14°С до достижения корешком длины, равной длине зерна. Навеску проросшего ячменя 2 г тщательно растирают в ступке, количественно переносят в мерную колбу на 100 см3, доводят водой до метки и настаивают 1 час. В полученном экстракте (растворе ферментов) определяют активность каталазы и пероксидазы. Активность каталазы определяли по методу Баха и Опарина. Смешивают 20 мл раствора фермента, 20 мл H2O и 3 мл 1% Н2О2. Время реакции 30 мин. Реакцию останавливают добавлением 5 мл 10% H2SO4. Остаток H2O2, не разложенный каталазой в реакционной смеси, оттитровывают 0.1 н. раствором KMnO4. Активность рассчитывают по разнице KМnO4 в контрольной (без АФ) и опытной пробах, принимая 1.7 мг Н2О2 эквивалентным 1 мл 0.1 н KМnО4.
Активность пероксидазы определяют как описано в примере 8. Результаты, представленные в таблицах 13 и 14, свидетельствуют о дозозависимости действия АФ на ферменты при оптимальной концентрации модификатора 0.1 г/л. Пример показывает, что модифицирующее действие заявленных добавок на ферментные белки обеспечивается в растительном организме.
| Таблица 13 | ||
| Влияние АФ №3 на активность каталазы (ед./г СВ зерна) прорастающего ячменя (2-е сутки роста) | ||
| Концентрация препарата, г/л | Активность каталазы, ед./г СВ зерна | |
| Стадия обработки при замачивании | ||
| Первая вода | Последняя вода | |
| 0 | 39 | 39 |
| 0.01 | 43 | 47 |
| 0.06 | 62 | - |
| 0.1 | 86 | 51 |
| 0.2 | 66 | - |
| 0.5 | 24 | 35 |
| Таблица 14 | ||
| Влияние АФ №3 на активность пероксидазы (ед./г СВ зерна) прорастающего ячменя (2-е сутки роста) | ||
| Концентрация препарата, г/л | Активность каталазы, ед./г СВ зерна | |
| Стадия обработки при замачивании | ||
| Первая вода | Последняя вода | |
| 0 | 6.0 | 6.0 |
| 0.01 | 6.3 | 6.6 |
| 0.06 | 8.3 | - |
| 0.1 | 9.8 | 8.0 |
| 0.2 | 8.6 | - |
| 0.5 | 1.5 | 5.2 |
Как видно из приведенных примеров, технический результат от осуществления изобретения заключается в обеспечении возможности направленно влиять на пространственную структуру ферментных белков как моно-, так и полисубъединичных, что приводит к направленному изменению их каталитической активности от стимуляции до ингибирования путем выбора модифицирующей добавки из заявленного ряда при концентрации, обеспечивающей заданное направление изменения. Кроме того, изобретение обеспечивает возможность расширения спектра используемых субстратов.
1. Способ направленного изменения активности ферментных белков, включающий введение раствора модифицирующей добавки в раствор, содержащий ферментный белок, отличающийся тем, что в качестве модифицирующей добавки используют соединения, представленные ацил- или алкилфенолами, имеющими от 1 до 3 углеродных циклов, причем алкильные радикалы имеют длину углеродной цепи C1-C2 или С6, при этом заданное направление изменения активности в сторону стимулирования или ингибирования осуществляют путем обеспечения оптимальной концентрации выбранной модифицирующей добавки в растворе ферментного белка.
2. Способ по п.1, отличающийся тем, что введение раствора модифицирующей добавки осуществляют в реакционную смесь, содержащую ферментный белок и субстрат.
3. Способ по п.1, отличающийся тем, что введение раствора модифицирующей добавки осуществляют в ферментный препарат до его внесения в реакционную смесь.
4. Способ по п.1, отличающийся тем, что для стимулирования активности моносубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С1-С2, находится в диапазоне 0,014-1,7 г/л.
5. Способ по п.1, отличающийся тем, что для стимулирования активности полисубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С1-С2, составляет 0,01-0,2 г/л.
6. Способ по п.1, отличающийся тем, что для ингибирования активности полисубъединичных ферментов концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы C1-C2, превышает 0,2 г/л.
7. Способ по п.1, отличающийся тем, что для стимулирования активности моносубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С6, находится в диапазоне 0,002-0,04 г/л.
8. Способ по п.1, отличающийся тем, что для стимулирования активности полисубъединичных ферментов оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С6, находится в диапазоне 0,018-0,18 г/л.
9. Способ по п.1, отличающийся тем, что для ингибирования активности моносубъединичных ферментов концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С6, превышает 0,04 г/л.
10. Способ по п.1, отличающийся тем, что для ингибирования активности полисубъединичных ферментов концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С6, превышает 0,2 г/л.
11. Способ по п.1, отличающийся тем, что для изменения субстратной специфичности полисубъединичных белков оптимальная концентрация в растворе модифицирующей добавки, имеющей алкильные радикалы С1-С2, С6, находится в диапазоне 0,03-0,08 г/л.