Способ получения агониста рецептора a2a-аденозина и его полиморфных модификаций
Иллюстрации
Показать всеИзобретение относится к способу получения моногидрата (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида путем контактирования соединения формулы (4):
с водным метиламином при температуре, равной приблизительно 2,5-7,5°С. Изобретение также относится к способу получения промежуточного соединения формулы (4), включающему взаимодействие соединения формулы (1) с 14,3-16,7-кратным молярным избытком гидрата гидразина при температуре, равной приблизительно 60-65°С, с получением соответствующего гидразина формулы (2), с последующим контактированием соединения формулы (2) с избытком этил-2-формил-3-оксопропионата необязательно в присутствии кислоты. Способ позволяет получать в одну стадию кристаллическое соединение в виде моногидрата, а также избавиться от нежелательных примесей соединения формулы (2) в целевом продукте за счет использования промежуточного продукта (4). 3 н. и 12 з. п. ф-лы,7 пр., 5 ил., 3 табл.
Реферат
Данная заявка представляет собой частичное продолжение патентной заявки США серийный № 11/701699, поданной 2 февраля 2007 года, по которой испрошен приоритет на основании предварительной патентной заявки США серийный № 60/801857, поданной 18 мая 2006 года, и предварительной патентной заявки США серийный № 60/765114, поданной 3 февраля 2006 года, полное раскрытие которых включено в настоящее описание в виде ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу крупномасштабного получения агониста рецептора А2А-аденозина, а также относится к полиморфным модификациям этого соединения и к способам выделения конкретной полиморфной модификации.
Уровень техники
Аденозин представляет собой природный нуклеозид, который проявляет свои биологические свойства посредством взаимодействия с семейством рецепторов аденозина, известных как А1, А2А, А2В и А3, каждый из которых модулирует важные физиологические процессы. Одно из биологических свойств аденозина заключается в его действии в качестве коронарного вазодилататора, причем указанное свойство является результатом взаимодействия с рецептором А2А аденозина. Обнаружено, что данный эффект аденозина полезен при визуализации сердца, когда необходимо расширить коронарные артерии перед применением радиофармацевтического препарата (например, таллия 201) и в результате посредством наблюдения полученных таким образом изображений определить наличие или отсутствие заболевания коронарных артерий. Преимущество подобной технологии заключается в том, что избегают более традиционного способа индуцирования коронарного сосудорасширения посредством упражнения на бегущей «дорожке», которое является, несомненно, нежелательным для пациента с коронарным заболеванием.
Однако применение аденозина имеет несколько недостатков. Аденозин обладает очень коротким временем полужизни в организме человека (менее чем 10 секунд), а также обладает всеми свойствами, связанными с агонистами А1, А2А, А2В и А3 рецепторов. Таким образом, применение селективного агониста рецептора А2А аденозина обеспечило бы превосходный способ осуществления коронарного сосудорасширения, особенно агониста с более длительным временем полужизни и некоторыми побочными эффектами или без них.
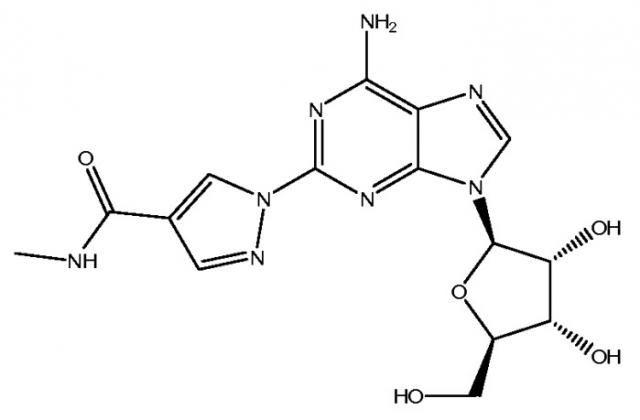
Класс соединений, обладающих этими желательными свойствами, раскрыт в патенте США № 6403567, полное раскрытие которого включено настоящим в виде ссылки. В частности, показано, что одно соединение, раскрытое в этом патенте, (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамид, представляет собой высокоселективный агонист рецептора А2А-аденозина и сейчас проходит клинические испытания в качестве коронарного вазодилататора, пригодного для кардиологической визуализации.
Принимая во внимание повышенный интерес к этому и сходным соединениям, стало желательным обнаружение новых способов синтеза, которые обеспечивают удобный способ получения больших количеств вещества с хорошим выходом и высокой чистотой. Патент, который раскрывает интересующее соединение (патент США № 6403567), предоставляет несколько способов получения соединения. Однако, хотя эти способы подходят для синтеза в небольшом масштабе, все способы синтеза, раскрытые в патенте, используют защитные группы, что является нежелательным для синтеза в большом масштабе.
Кроме того, обнаружено, что желаемый продукт (то есть (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамид) способен существовать по меньшей мере в трех различных кристаллических формах, наиболее стабильной из которых является моногидрат. Эта полиморфная модификация является стабильной в стрессовых состояниях относительной влажности, вплоть до его точки плавления. Соответственно является желательным, чтобы конечный продукт, произведенный путем нового синтеза, был получен в виде стабильного моногидрата.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, задача настоящего изобретения состоит в предоставлении удобного синтеза для крупномасштабного получения (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида и его полиморфных модификаций, предпочтительно в виде его моногидрата. Соответственно в первом аспекте изобретение относится к способу получения соединения формулы I:
Формула I
включающему
контактирование соединения формулы (3):
с метиламином.
В одном варианте осуществления реакцию проводят в водном растворе метиламина, первоначально при температуре приблизительно 0-5°С с последующим нагреванием до приблизительно 50-70°С. Альтернативно реакцию проводят, как описано выше, но в герметичном реакторе под давлением.
Во втором варианте осуществления продукт выделяют как чистый моногидрат посредством растворения продукта в растворителе, например диметилсульфоксиде, добавления очищенной воды, фильтрации образованной таким образом суспензии, промывания содержимого фильтра водой и далее этанолом и высушивания твердого вещества, которое находится под вакуумом при температуре, которая не превышает 40°С.
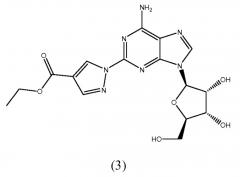
Во втором аспекте изобретение относится к способу получения соединения формулы (3):
включающему
контактирование соединения формулы (2):
с этил-2-формил-3-оксопропионатом.
В одном варианте осуществления реакцию проводят в этаноле при температуре, равной приблизительно 80°С, с приблизительно 1,1 молярными эквивалентами этил-2-формил-3-оксипропионата.
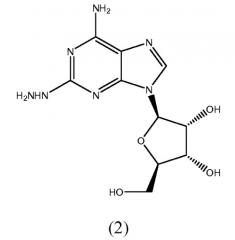
В третьем аспекте изобретение относится к способу получения соединения формулы (2):
включающему
контактирование соединения формулы (1):
с гидразином.
Можно применять 14,3-16,7-кратный молярный избыток гидразина и реакцию можно проводить при температуре, равной приблизительно 60-65°С. В одном варианте осуществления гидразин сначала нагревают до приблизительно 60-65°С с последующим добавлением соединения формулы (1). Соединение формулы (2) можно выделить посредством (а) охлаждения реакционной смеси до приблизительно 40°С, (b) добавления 4,2-4,9 массового эквивалентного количества воды, в то же время поддерживая температуру при приблизительно 40°С, (с) охлаждения смеси до приблизительно 10°С и поддержания при этой температуре по меньшей мере в течение приблизительно 1 часа, (d) фильтрации, (е) промывания содержимого фильтра водой и далее этанолом и (f) сушки твердого вещества, которое находится под вакуумом при температуре, которая не превышает 30°С, в течение по меньшей мере 12 часов.
Описанный выше способ является подходящим для крупномасштабного синтеза желаемого продукта, который обеспечивается с хорошим выходом, несмотря на присутствие в конечном продукте одной незначительной примеси. Показано, что эта примесь является неизменяемым промежуточным соединением формулы (2); то есть соединением формулы:
Хотя эту примесь можно удалить из конечного продукта кристаллизацией, было решено искать альтернативный синтез, который обладает всеми преимуществами приведенного выше синтеза, но не дает соединение формулы (2) в качестве примеси в конечном продукте.
Таким образом, в четвертом аспекте изобретение относится к способу синтеза (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида посредством контактирования соединения формулы (4):
с метиламином.
В одном варианте осуществления реакцию проводят в водном растворе метиламина, первоначально при температуре приблизительно 0-5°С с последующим нагреванием до приблизительно 50-70°С. Предпочтительно реакцию проводят в герметичном реакторе под давлением.
В другом варианте осуществления реакцию проводят при температуре приблизительно 2,5-7,5°С.
В еще одном варианте осуществления продукт выделяют как чистый моногидрат посредством растворения продукта в растворителе, например диметилсульфоксиде, добавления очищенной воды, фильтрации таким образом полученной суспензии, промывания содержимого фильтра водой и далее этанолом и осушения твердого вещества, которое остается под вакуумом при температуре, которая не превышает 40°С. В некоторых других вариантах осуществления продукт можно выделить как чистый моногидрат посредством (а) дегазации реакционной смеси под вакуумом при не более чем 35°С для удаления избытка метиламина, (b) сбрасывания вакуума и охлаждения до 0-5°С в течение приблизительно от 15 минут до одного часа, (с) фильтрации образованной таким образом суспензии, (d) промывания содержимого фильтра водой и далее этанолом и (е) осушения твердого вещества, которое остается под вакуумом при температуре, которая не превышает 40°С.
В некоторых вариантах осуществления (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамид дополнительно очищают для предоставления моногидратной формы посредством (i) растворения соединения в растворителе, таком как диметилсульфоксид, нагретого до приблизительно 78-88°, (ii) фильтрации любых твердых примесей из раствора, (iii) промывания дополнительным растворителем, (iv) добавления раствора к очищенной воде, которую поддерживают при приблизительно 78-88°С, образуя таким образом суспензию, (v) перемешивания суспензии, (vi) охлаждения суспензии, (vii) фильтрации, (viii) промывания содержимого фильтра водой и далее этанолом и (ix) осушения твердого вещества, который сохраняют под вакуумом при температуре, которая не превышает 40°С.
В пятом аспекте изобретение относится к способу синтеза соединения формулы (4):
включающему контактирование соединения формулы (2):
с избытком этил-2-формил-2-оксопропионата, предпочтительно приблизительно 2-10-кратным молярным избытком, более предпочтительно приблизительно 5-10-кратным избытком. В одном варианте осуществления реакцию проводят в этаноле при температуре приблизительно 80°С. Этил-2-формил-3-оксопропионат присутствует в 5-10-кратном избытке.
В дополнительном варианте осуществления также предоставляется дополнительный способ синтеза соединения формулы (4), включающий контактирование соединения формулы (2)
с избытком этил-2-формил-3-оксопропионата в присутствии кислоты. Реакция проходит при кипячении с обратным холодильником, и ее, как правило, проводят в этаноле. Реакция может протекать как в присутствии, так и в отсутствие HCl в качестве катализатора. Применяют вплоть до 0,1 молярного эквивалента, предпочтительно приблизительно 0,05 молярного избытка HCl и приблизительно 5-10-кратного молярного избытка, предпочтительно приблизительно 6,8-7,5-кратного молярного избытка этил-2-формил-3-оксопропионата. Продукт этой реакции можно выделить посредством (а) охлаждения реакционной смеси после завершения реакции до приблизительно 10°С, (b) фильтрации, (с) промывания содержимого фильтра этанолом и (d) осушения твердого вещества, которое остается под вакуумом при температуре, которая не превышает 40°С.
Определения и основные параметры
На фиг.1 представлен 1Н ЯМР-спектр моногидрата (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида (форма А).
На фиг.2 показан термический анализ моногидрата (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида.
На фиг.3 показана рентгеновская дифрактограмма моногидрата (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида.
На фиг.4 показана рентгеновская дифрактограмма (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида, форма В.
На фиг.5 показана рентгеновская дифрактограмма (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида, форма С по сравнению с формой А.
В контексте настоящего описания следующие термины и выражения, как правило, предназначены для определения установленных ниже значений, за исключением специально оговоренных случаев.
“Необязательный” или “необязательно” означает, что описанное последовательно событие или обстоятельство может или не может происходить и что описание включает случаи, где указанное событие или обстоятельство происходит, и случаи, в которых оно не происходит.
Термин “терапевтически эффективное количество” относится к количеству соединения формулы 1, которое является достаточным для эффективного лечения, как определено ниже, при введении млекопитающему при необходимости подобного лечения. Терапевтически эффективное количество будет варьироваться в зависимости от субъекта и условий заболевания для лечения, массы и возраста субъекта, тяжести условия заболевания, способа введения и подобного, что может быть легко определено обычным специалистом.
Термин “лечение” или “лечащий” означает любое лечение заболевания у млекопитающего, включая:
(i) предупреждение заболевания, то есть препятствие для развития клинических симптомов заболевания;
(ii) ингибирование заболевания, то есть приостановка клинических симптомов; и/или
(iii) облегчение заболевания, то есть регрессия клинических симптомов.
Как применяется в данном документе, “фармацевтически приемлемый носитель” включает любой и все растворители, дисперсные среды, покрытия, противомикробные и противогрибковые средства, изотонические и препятствующие абсорбции агенты и подобные. Применение подобных сред и агентов для фармацевтически активных веществ хорошо известно в технике. За исключением тех случаев, когда любая традиционная среда или агент являются несовместимыми с активным ингредиентом, их применение в терапевтических композициях предполагается. Также можно ввести в композиции дополнительные активные ингредиенты.
Термин “полиморфная модификация” предназначен для включения аморфных модификаций и сольватов (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида.
Обнаружено, что это соединение способно существовать по меньшей мере в трех различных кристаллических формах, упоминаемых в данном документе как форма А, форма В, форма С и аморфный продукт.
Форма А: Эту полиморфную модификацию можно получить посредством кристаллизации (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида из протонных растворителей, например этанола или смесей этанола и воды, или из полярного растворителя, например воды и диметилсульфоксида. Показано, что форма А является моногидратом и является наиболее стабильной из различных полиморфных модификаций при температурах окружающей среды. Она является стабильной в относительно влажных напряженных состояниях вплоть до точки ее плавления.
Форма В: Эту полиморфную модификацию получают посредством выпаривания под вакуумом раствора (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида в трифторэтаноле при температурах окружающей среды. Рентгеновский анализ кристаллов заметно отличался от любой другой полиморфной модификации (см. фиг.4), но определить его состав было затруднительно, так как рентгеновский анализ давал неупорядоченные широкие пики и полиморфная модификация содержала различные количества воды. Обнаружено, что трудно с большой вероятностью воспроизвести получение этой полиморфной модификации.
Форма С: Эту полиморфную модификацию получают посредством суспендирования (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида в ацетонитриле в течение длительного промежутка времени при 60°С. Рентгеновский анализ кристаллов заметно отличался от любой другой полиморфной модификации (см. фиг.5). Показано, что полиморфная модификация С представляет собой непостоянный гидрат, который при повышенных температурах десольватирует в нестабильную форму.
Аморфный материал: Эту полиморфную модификацию получают посредством нагревания полиморфной модификации Формы А при температуре вплоть до 200°С. Эта полиморфная модификация является нестабильной в присутствии атмосферной влаги, образуя различные гидраты.
Методики анализа форм А, В, С и аморфного материала
Порошковая рентгеновская дифракция
Анализ методом порошковой рентгеновской дифракции (XRPD) проводили на Shimadzu XRD-6000 порошковом рентгеновском дифрактометре с применением Cu Kα излучения. Прибор оснащали рентгеновской трубкой с тонкой фокусировкой и напряжение и силу тока в трубке устанавливали соответственно до 40 кВ и 40 мА. Дивергенцию и рассеивающие щели устанавливали на 1” и принимающую щель устанавливали на 0,15 мм. Дифрагированное излучение определяли NaI сцинтилляционным детектором. Применяли тэта-два тэта непрерывную развертку при 3°/мин (шаг 0,4 сек/0,02°) от 2,5-40°2θ. Для проверки настройки применяли кремниевый стандарт. Данные собирали и анализировали с применением XRD-6000 v. 4.1 программного обеспечения.
Анализы методом порошковой рентгеновской дифракции (XRPD) также выполняют с применением Inel XRG-3000 дифрактометра, оснащенного CPS (чувствительный с изогнутым положением) детектором с 28 интервалом 120°. Калибровку прибора выполняли с применением кремниевого ссылочного стандарта. Напряжение и силу тока в трубке устанавливали соответственно до 40 кВ и 30 мА. Монохромную щель устанавливали на 5 мм рядом с 80 мкм. Образцы помещали на держатель для образцов из алюминия с кремниевым вкладышем или в стеклянные капилляры XRPD-качества. Каждый капилляр устанавливали в головку гониометра, которую приводили в действие для предоставления кручения капилляра в ходе сбора данных. Получали данные реального времени с применением Cu-Kα излучения при разрешении 0,03°2θ. Типично данные собирали за период в 300 секунд. На нанесенных XRPD рисунках показаны только точки данных внутри интервала 2,5-40°2θ.
Термический анализ
Термогравиметрический (TG) анализ проводили на ТА Instruments 2050 или 2950 термогравиметрическом анализаторе. Калибровочными стандартами являлись никель и AlumelTM. Образцы помещали в поддон для образцов из алюминия, вставляли в TG печь и точно взвешивали. Образцы нагревали в азоте со скоростью 10°С/мин или до 300 или до 350°С. До тех пор пока иначе не утверждается, массы образцов перед анализом уравновешивали при 25°С в TGA печи.
Анализ методом дифференциальной сканирующей калориметрии (DSC) проводили на ТА Instruments дифференциальном сканирующем калориметре 2920. Точно взвешенные образцы помещали или в извитые поддоны или герметично закупоренные поддоны, которые содержат прокол, чтобы дать возможность для сброса давления. Каждый образец нагревали в азоте со скоростью 10°С/мин или до 300 или 350°С. В качестве калибровочного стандарта применяли металл индий. Температуры проводились в максимуме перехода.
Инфракрасная спектроскопия
Инфракрасные спектры получали на Magna 860® Fourier трансформированном инфракрасном (FT-IR) спектрофотометре (Nicolet Instrument Corp.), оснащенном Ever-Glo mid/far инфракрасным источником, светоделителем с расширенным интервалом из бромида калия и детектором из дейтерированного триглицин сульфата (DTGS). До тех пор пока иначе не утверждается, для выборочного исследования применяли Spectra-Tech, Inc. вспомогательное устройство для коэффициента диффузного отражения. Каждый спектр представляет 256 совместно добавленных сканирований при спектральном разрешении в 4 см-1. Получение образцов для соединения состояло в помещении образца в микрочашу и выравнивании материала с помощью матированного стеклянного предметного стекла. Установку основополагающих данных получали с помощью центрированного отражателя на месте. Спектры представляют отношение набора данных с однократным лучом образца к набору данных с фоновым однократным лучом. Калибровку длины волны прибора проводили с применением полистирола.
ЯМР спектроскопия
1Н ЯМР спектры в фазе раствора получали при температуре окружающей среды на модели спектрометра Bruker AM-250, оперируя при 5,87 Т (частота Larmor: 1Н=250 МГц). Данные промежутка времени получали с применением ширины пульсации в 7,5 пс и времени сбора в 1,6834 секунды на спектральном окне в 5000 Гц. Собирали сумму из 16384 точек данных. Между переходными состояниями использовали время задержки 5 секунд релаксации. Каждый набор данных типично состоял из 128 совместно усредненных переходных состояний. Спектры обрабатывали с использованием GRAMS132 A1 программного обеспечения, версия 6.00. Ослабление свободной индукции (FID) обнуляли до четырех раз по количеству точек данных и экспоненциально умножали на фактор уширения линий, равный 0,61 Гц перед преобразованием Фурье. В 1Н спектрах проводили внутреннее отнесение сигналов к тетраметилсилану (0 частей на миллион), который добавляли в качестве внутреннего стандарта.
Альтернативно ЯМР анализ проводили, как описано в примере 4.
Анализ сорбции/десорбции влаги
Данные сорбции/десорбции влаги собирали на VTI SCA-100 Анализаторе сорбции пара. Данные сорбции и десорбции собирали в интервале от 5% до 95% относительной влажности (RK) с 10% интервалами относительной влажности с продувкой азотом. В качестве калибровочных стандартов применяли хлорид натрия (NaCl) и поливинилпирролидон (PVP). Критерии равновесия, применяемые для анализа, составляли менее чем 0,0100% изменения массы за 5 минут с максимальным временем равновесия в 180 минут, если критерий массы не был достигнут. Нанесенные на график данные не были скорректированы для первоначального содержания влаги.
Номенклатура
Структура соединения (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида представляет собой следующую:
Синтез (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида
Один способ для крупномасштабного синтеза (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида показан на схеме реакции I. Все реакции обычно проводят в атмосфере азота.
СХЕМА РЕАКЦИИ I
Стадия 1 - Получение формулы (2)
Соединение формулы (2) получают из соединения формулы (1) посредством взаимодействия с моногидратом гидразина в отсутствие растворителя. Реакцию проводят при температуре приблизительно 45-55°С. Когда реакция завершается, продукт формулы (2) выделяют посредством перемешивания с протонным растворителем, в котором соединение формулы (2) имеет ограниченную растворимость, например этанолом или изопропанолом. Смесь перемешивают в течение приблизительно 1-5 часов и затем фильтруют. Твердое вещество очищают посредством перемешивания с водой, фильтрации и промывания водой и далее изопропанолом и сушки под вакуумом и берут его для следующей стадии без очистки.
Стадия 2 - Получение формулы (3)
Соединение формулы (2) затем преобразуют в соединение формулы (3) посредством взаимодействия с приблизительно 1-1,2 молярными эквивалентами этил-2-формил-3-оксопропионата. Реакцию проводят в протонном растворителе, предпочтительно этаноле, при приблизительно температуре кипячения с обратным холодильником в течение приблизительно 2-4 часов. После охлаждения до приблизительно 0°С твердое вещество отфильтровывают, промывают холодным этанолом и сушат при пониженном давлении. Продукт формулы (3) берут для следующей стадии без очистки.
Стадия 3 - Получение конечного продукта
Конечный продукт получают из соединения формулы (3) посредством взаимодействия с метиламином, предпочтительно водным метиламином. Реакцию проводят при приблизительно комнатной температуре в течение приблизительно 4 часов. Продукт формулы 1 выделяют традиционным образом, например посредством фильтрации, промывания твердого вещества холодным этанолом и сушки при пониженном давлении.
Получение исходных веществ
В качестве исходного вещества на стадии 1 применяют (4S,2R,3R,5R)-2-(6-амино-2-хлорпурин-9-ил)-5-(гидроксиметил)оксолан-3,4-диол. Это соединение является доступным на рынке.
В качестве исходного вещества на стадии 2 применяют этил-2-формил-3-оксопропионат. Он является доступным на рынке, или его можно получить, как показано на схеме реакции II.
СХЕМА РЕАКЦИИ II
Этил-3,3-диэтоксипропионат взаимодействует с этилформиатом в присутствии сильного основания, предпочтительно гидрида натрия. Реакцию проводят при приблизительно 0-5°С в течение приблизительно 24 часов. Продукт выделяют традиционным образом, например посредством добавления воды и экстракции примесей традиционным растворителем, например трет-бутилметиловым эфиром, подкисления водной фазы, например, хлористоводородной кислотой, с последующей экстракцией растворителем, таким как дихлорметан, и удалением растворителя из осушенного экстракта при пониженном давлении. Этил-2-формил-3-оксопропионат очищают посредством перегонки при пониженном давлении.
Предпочтительный способ для крупномасштабного синтеза (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамида показан на схеме реакции III.
СХЕМА РЕАКЦИИ III
Стадия 1 - Получение формулы (2)
Как прежде, соединение формулы (2) получают из соединения формулы (1) посредством взаимодействия с моногидратом гидразина в отсутствие растворителя. Однако в этом способе 14,3-16,7-кратный избыток моногидрата гидразина сначала нагревают до приблизительно 60-65°С с последующим добавлением соединения формулы (1). Температуру поддерживают при приблизительно 60-65°С в ходе взаимодействия, которое занимает до завершения приблизительно от 1 до 3 часов. Когда уровень остаточного соединения формулы (1) в смеси составляет не более чем приблизительно 0,10%, реакционную смесь охлаждают до приблизительно 40°С. Температуру поддерживают, пока медленно добавляют воду. Как только добавлена приблизительно 4,2-4,9 массовая эквивалентность, смесь охлаждают до приблизительно 10°С и выдерживают при этой температуре в течение не менее чем 1 час.
Затем продукт выделяют фильтрацией, промывают водой и затем промывают абсолютным этанолом. Твердое вещество сушат под вакуумом при вплоть до 30°С в течение не менее чем 12 часов и затем берут на следующую стадию без дополнительной очистки.
Стадия 2 - Получение формулы (4)
Соединение формулы (2) затем преобразуют в соединение формулы (4) посредством взаимодействия с избытком этил-2-формил-3-оксопропионата, например 2-10-кратным избытком, предпочтительно приблизительно 5-10-кратным, идеально приблизительно 6,8-7,5-кратным избытком. Реакцию можно проводить при таких же условиях, как условия, описанные для получения соединения формулы (3) в схеме реакции (I).
Альтернативно к реакционной смеси также можно добавить приблизительно 0,05 молярных эквивалентов кислоты, такой как HCl. Реакции дают возможность продолжаться при температуре кипения с обратным холодильником в течение приблизительно 2-4 часов, пока уровень остаточного соединения формулы (2) не составит не более чем 0,50% и количество любого соединения формулы (3), которое может быть образовано, не составит не более чем 2,5%. После охлаждения до приблизительно 10°С, твердое вещество отфильтровывают, промывают абсолютным этанолом и сушат под вакуумом при вплоть до 40°С для удаления остаточного этанола. Продукт формулы (4) берут для следующей стадии без очистки.
Соединение формулы (4) изображают как производное (2Е) алкена, так как оно представляет собой основной изомер, образованный в этой реакции. Однако следует отметить, что в этой реакции также может быть образовано значительное количество производного (2Z) алкена; то есть
названный как этил(2Z)-3-({9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-2-[4-(этоксикарбонил)пиразолил]пурин-6-ил}амино)-2-формилпроп-2-еноат.
Соответственно хотя соединение формулы (4) представлено только как производное (2Е) алкена, термин “соединение формулы (4)” предназначен для включения как случая, где он является единственно (2Е) изомером, так и случая, где основная часть продукта представляет собой (2Е) изомер и также присутствует минорная часть (2Z) изомера. Превращение соединения формулы (4) в конечный продукт посредством реакции с метиламином, как описано на стадии 3, протекает таким же образом, присутствует ли соединение формулы (4) как (2Е) изомер или как смесь (2Е) изомера и (2Z) изомера.
Стадия 3 - Получение конечного продукта
Конечный продукт получают из соединения формулы (4) посредством взаимодействия с метиламином, предпочтительно водным метиламином. Реакцию первоначально проводят при приблизительно 0-5°С в течение приблизительно 8 часов, предпочтительно в реакторе под давлением с последующим поднятием температуры до 50-60°С через приблизительно 1 час и поддержанием температуры в течение 15-30 минут.
Альтернативно сначала метиламин помещают в сосуд под давлением и охлаждают до приблизительно 2,5-7,5°С, а затем добавляют соединение формулы (4), в то время как поддерживают температуру. Реакция протекает до тех пор, пока уровень остаточного соединения формулы (3) не составит менее чем приблизительно 0,10%.
После завершения продукт выделяют традиционным образом, например посредством дегазации под вакуумом при не более чем приблизительно 35°С для удаления избытка метиламина. Затем вакуум спускают и смесь охлаждают до приблизительно 0-5°С и выдерживают при температуре в течение 15 минут до одного часа с последующей фильтрацией. Твердое вещество, полученное таким образом, промывают водой и далее этанолом и сушат при пониженном давлении при температуре не более чем приблизительно 40°С.
Этот способ предоставляет (1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-ил)-N-метилкарбоксамид в виде его моногидрата. Эту полиморфную модификацию можно дополнительно очистить посредством растворения в диметилсульфоксиде (DMSO), фильтрации из раствора любых твердых примесей, промывки дополнительным ДМСО и осаждения моногидрата из раствора посредством добавления к воде. Этот способ является особенно эффективным, когда раствор ДМСО и воду нагревают до приблизительно 78-88°С и выдерживают при этой температуре с перемешиванием в течение приблизительно 1 часа. После перемешивания суспензию медленно охлаждают до приблизительно 20°С. Затем конечный продукт выделяют посредством фильтрации, промывают очищенной водой и далее этанолом и сушат, как описано ранее.
ПРИМЕР 1
Получение этил-2-формил-3-оксопропионата
Трех- или четырехгорлую круглодонную колбу, оснащенную палочкой магнитной мешалки, термопарой, термометром с цифровой индикацией, входным и выходным отверстием для газа и дополнительной воронкой, продували аргоном. В дополнительную воронку загружали этил-3,3-диэтоксипропионат (64,5 г) в тетрагидрофуране. В реакционную колбу загружали гидрид натрия (21,2 г 60%-й дисперсии) вслед за тетрагидрофураном. Содержимое колбы охлаждали до 0-5°С на бане со льдом и добавляли этилформиат (257 г). Смесь охлаждали до 0-5°С и содержимое дополнительной воронки добавляли по каплям, поддерживая внутреннюю температуру менее чем 5°С. Удаляли баню со льдом и содержимому давали возможность нагреться до температуры окружающей среды. Расход этил-3,3-диэтоксипропионата отслеживали ТСХ анализом. Реакцию гасили посредством добавления воды со льдом (10,6 об.), экстрагировали три раза метил-трет-бутиловым эфиром (5,4 об. каждый) и отбрасывали органические слои. Водную фазу подкисляли концентрированной хлористоводородной кислотой до pH от 1 до 1,5. Подкисленный водный слой экстрагировали три раза дихлорметаном и объединенные органические слои сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток перегоняли под вакуумом для предоставления этил-2-формил-3-оксопропионата, 27,92 г, выход 70%.
ПРИМЕР 2
А. Получение 2-гидразиноаденозина (2)
Колбу, оснащенную механической мешалкой, входным и выходным отверстиями для газа и термопарой, продували аргоном. Добавляли гемигидрат 2-хлораденозина (53,1 г) с последующим добавлением моногидрата гидразина (134 г). Смесь перемешивали при нагреве при 40-45°С в течение 2 часов. Протекание реакции отслеживали посредством ТСХ-анализа. По завершении реакции источник тепла удаляли и добавляли этанол (800 мл). Смесь перемешивали в течение 2 часов при температуре окружающей среды, затем осадок собирали фильтрацией. Фильтровальную лепешку промывали этанолом и сушили при пониженном давлении в течение 30 минут. Твердые вещества переносили в чистую колбу, оснащенную механической мешалкой, и добавляли воду (300 мл). Суспензию перемешивали при комнатной температуре в течение 18 часов и твердые вещества выделяли фильтрацией. Фильтровальную лепешку промывали ледяной водой (300 мл) с последующей промывкой ледяным этанолом (300 мл). Твердое вещество сушили при пониженном давлении с получением 2-гидразиноаденозина (41,38 г, 81,4% выход, 99,3% чистота).
В. Альтернативное получение 2-гидразиноаденозина (2)
Сосуд для реакции, содержащий гидразингидрат (258 г, 250 мл), нагревали до 40-50°С. К теплой смеси по частям добавляли гемигидрат 2-хлораденозина (100 г), поддерживая температуру между 45-55°С. Температуру поддерживали при данном значении в течение двух часов и затем добавляли деионизированную воду (500 мл) в течение периода, равного 30 минутам, поддерживая температуру при 45-55°С. Смесь далее постепенно охлаждали до 0-5°С в течение периода, равного 3 часам, затем перемешивали при этой температуре в течение дополнительных 30 минут. Твердое вещество далее отфильтровывали и промывали холодной (2-5°С) деионизованной водой (200 мл) с последующей промывкой этанолом (400 мл). Твердое вещество сушили под вакуумом в течение 12 часов с получением 2-гидразиноаденозина.
С. Альтернативное получение 2-гидразиноаденозина (2)
В сосуд для реакции загружают гидразингидрат (1285 г). Раствор нагревают до приблизительно 62°С и добавляют 2-хлораденозин (500 г) при поддержании температуры, равной приблизительно 62°С. Смесь поддерживают при отметке 62°С в течение по меньшей мере 2 часов, пока уровень остаточного 2-хлораденозина в смеси не будет составлять не более чем 0,10%. Смесь охлаждают до приблизительно 40°С и смесь проверяют для подтверждения присутствия твердых веществ. Медленно добавляют воду (2275 г), при поддержании температуры, равной приблизительно 40°С. Смесь охлаждают до приблизительно 10°С и выдерживают в течение не менее 1 часа. Продукт выделяют фильтрацией, промывают водой (1195 г) и далее абсолютным этанолом (1885 г). Продукт сушат под вакуумом при температуре вплоть до 30°С в течение не менее 12 часов с получением 2-гидразиноаденозина.
ПРИМЕР 3
Получение этил-1-{9-[(4S,2R,3R,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6-аминопурин-2-ил}пиразол-4-карбоксилата (3)
Этил-2-формил-3-оксопропионат (23,93 г, 0,17 моль) помещали в колбу, снабженную механической мешалкой, входным и выходным отверстиями для газа и обратным холодильником. В колбу добавляли 2-пропанол с последую