Бактерия - продуцент продукта реакции, катализируемой белком, обладающим активностью 2-оксоглутарат-зависимого фермента, и способ продукции указанного продукта
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к способу получения продукта реакции, катализируемой белком, обладающим активностью 2-оксоглутарат-зависимого фермента, такого как (2S,3R,4S)-4-гидрокси-L-изолейцин или его соль и 4-гидрокси-L-пролин или его соль, с использованием бактерии, принадлежащей к роду, выбранному из группы, состоящей из Escherichia, Corynebacterium, Arthrobacter, Aspergillus и Bacillus, трансформированной фрагментом ДНК, содержащим ген, кодирующий белок, обладающий активностью 2-оксоглутарат-зависимого фермента, при этом указанная бактерия модифицирована таким образом, что: ген, кодирующий 2-оксоглутаратдегидрогеназу, инактивирован или ген, кодирующий 2-оксоглутаратдегидрогеназу, и ген, кодирующий аминотрансферазу аминокислот с разветвленной цепью, инактивированы. Изобретение позволяет получать (2S,3R,4S)-4-гидрокси-L-изолейцин или его соль и 4-гидрокси-L-пролин или его соль с высокой степенью эффективности. 4 н. и 10 з.п. ф-лы, 6 ил., 9 табл., 9 пр.
Реферат
Область техники
Настоящее изобретение относится к микробиологической промышленности, и в частности к способу получения продукта реакции, катализируемой белком, обладающим активностью 2-оксоглутарат-зависимого фермента, такого как 4-гидрокси-L-изолейцин или его соль, с использованием бактерии, трансформированной фрагментом ДНК, содержащим ген, кодирующий белок, обладающий активностью 2-оксоглутарат-зависимого фермента, так же как и L-изолейциндиоксигеназной активностью. Данная бактерия также модифицирована для усиления экспрессии гена, кодирующего транспортер L-изолейцина, и обладает способностью к продукции (2S,3R,4S)-4-гидрокси-L-изолейцина.
Описание предшествующего уровня техники
4-Гидрокси-L-изолейцин является аминокислотой, которая может быть экстрагирована и очищена из семян пажитника греческого (Trigonella foenum-graecum L.leguminosae). Препарат 4-гидроксиизолейцина проявляет инсулинотропную активность, что вызывает большой интерес, поскольку этот стимулирующий эффект явно зависит от концентрации глюкозы в плазме. Этот эффект показан как на модели изолированных перфузионных поджелудочных желез крыс, так и в кусочках ткани поджелудочных желез человека (Sauvaire, Y. et al, Diabetes, 47: 206-210 (1998)). Такая зависимость инсулинотропного эффекта от концентрации глюкозы не подтверждается в случае с сульфонилмочевиной (Drucker, D.J., Diabetes 47: 159-169 (1998)), единственным инсулинотропным препаратом, используемым в настоящее время для лечения диабета типа II [не инсулинзависимого диабета (NIDD) или (NIDDM)], и, как следствие, гипогликемия остается основным нежелательным побочным эффектом лечения сульфонилмочевиной (Jackson, J., and Bessler, R. Drugs, 22: 211-245; 295-320 (1981); Jennings, A. et al. Diabetes Care, 12: 203-208 (1989)). Известно также свойство 4-гидроксиизолейцина повышать толерантность организма к глюкозе (Am. J. Physiol. Endocrinol., Vol.287, E463-E471, 2004). Способность 4-гидроксиизолейцина ускорять метаболизм глюкозы и потенциальная возможность его применения в качестве лекарственного средства и компонента функционального питания были раскрыты в выложенной патентной заявке Японии No. Hei 6-157302 и в патентной заявке США US 2007-000463 A1.
4-Гидрокси-L-изолейцин обнаружен только в растениях и благодаря его специфической инсулинотропной активности может рассматриваться в качестве нового стимулятора секреции с потенциальным применением для лечения диабета II типа, т.к. это заболевание характеризуется недостаточной секрецией инсулина, связанной с различной степенью устойчивости к инсулину (Broca, С. et al, Am. J. Physiol. 277 (Endocrinol. Metab. 40): E617-E623 (1999)).
Метод окисления изолейцина кислородом воздуха в присутствии железа, аскорбиновой кислоты и 2-оксоглутаровой кислоты с использованием диоксигеназной активности экстракта пажитника греческого был предложен в качестве способа получения 4-гидрокси-L-изолейцина (Phytochemistry, Vol.44, No.4, pp.563-566,1997). Однако этот способ не пригоден для промышленного получения 4-гидроксиизолейцина, так как активность фермента ингибируется субстратом при концентрациях изолейцина от 20 мМ и выше, к тому же фермент до сих пор не идентифицирован, его получают из экстрактов растений в небольших количествах и активность его быстро падает.
К настоящему времени описан эффективный способ синтеза оптически чистого (2S,3R,4S)-4-гидроксиизолейцина с общим выходом 39%, состоящий из восьми стадий. Ключевая стадия этого процесса синтеза включает в себя биотрансформацию этил-2-метилацетоацетата в этил-(2S,3S)-2-метил-3-гидроксибутаноат с помощью Geotrichum candidum и асимметрического синтеза Штрекера (Wang, Q. et al, Eur. J. Org. Chem., 834-839 (2002)).
Также описан короткий шестистадийный ферментохимический способ синтеза (2S,3R,4S)-4-гидроксиизолейцина с общим контролем стереохимии, последней стадией которого является ферментативное разложение путем гидролиза производного N-фенилацетиллактона с использованием коммерчески доступной пенциллинацилазы G, иммобилизованной на Eupergit C(E-PAC) (Rolland-Fulcrand, V. et al, J. Org. Chem., 873-877 (2004)).
Однако в настоящее время отсутствуют сообщения о продукции (2S,3R,4S)-4-гидрокси-L-изолейцина с использованием бактерии, трансформированной фрагментом ДНК, содержащим ген, кодирующий белок с L-изолейциндиоксигеназной активностью; при этом бактерия также модифицирована с целью усиления экспрессии гена, кодирующего транспортер L-изолейцина; и обладает способностью к продукции (2S,3R,4S)-4-гидрокси-L-изолейцина.
Кроме того, (2S,3R,4S)-4-гидрокси-L-изолейцин, являющийся продуктом реакции, катализируемой белком, обладающим активностью 2-оксоглутарат-зависимого фермента, а также важным промышленным продуктом, был известен. Однако не было сообщений об эффективных способах получения и других продуктов с помощью белков, обладающих активностью 2-оксоглутарат-зависимого фермента.
Описание изобретения
Аспектом данного изобретения является увеличение продукции продукта реакции, сопряженного с образованием сукцината из 2-оксоглутарата под действием белка, обладающего активностью 2-оксоглутарат-зависимого фермента. К такому продукту относятся соединения как в свободной форме, так и их соли. Другим аспектом настоящего изобретения является предоставление промышленного способа получения продукта, сопряженного с образованием сукцината из 2-оксоглутарата с помощью бактерии, имеющей активность 2-оксоглутарат-зависимого фермента. Эта бактерия была модифицирована таким образом, что экспрессии гена, кодирующего оксоглутаратдегидрогеназу, ослаблены, предпочтительно модифицирована таким образом, что экспрессии генов, кодирующих оксоглутаратдегидрогеназу и изоцитратлиазу, ослаблены, более предпочтительно модифицирована таким образом, что экспрессии генов, кодирующих оксоглутаратдегидрогеназу, изоцитратлиазу и фосфатазу изоцитратдедгидрогеназы, ослаблены.
Другим аспектом настоящего изобретения является предоставление способа получения 4-гидроксиизолейцина, включая как его свободную форму, так и его соли. Данное соединение может также упоминаться как "(2S,3R,4S)-4HIL". Другим аспектом настоящего изобретения является предоставление способа продукции (2S,3R,4S)-4-гидрокси-L-изолейцина или его соли путем прямого энзиматического гидроксилирования L-изолейцина с использованием бактерии с L-изолейциндиоксигеназной активностью. В этой бактерии также осуществляется сверхэкспрессия гена, кодирующего транспортер L-изолейцина, и бактерия способна к продукции (2S,3R,4S)-4-гидрокси-L-изолейцина.
Ранее из природного источника выделена бактерия с высоким уровнем L-изолейциндиоксигеназной активности и клонирован ген, кодирующий L-изолейциндиоксигеназу. Обнаружено, что L-изолейциндиоксигеназу можно использовать для синтеза (2S,3R,4S)-4-гидрокси-L-изолейцина.
Другой аспект настоящего изобретения включает предоставление способа для увеличения продукции (2S,3R,4S)-4-гидрокси-L-изолейцина с использованием бактерии с активностью L-изолейциндиоксигеназы. Вышеуказанная цель была достигнута обнаружением того факта, что бактерия с активностью L-изолейциндиоксигеназы продуцирует больше (2S,3R,4S)-4-гидрокси-L-изолейцина в случае, если бактерия модифицирована таким образом, что экспрессия гена, кодирующего транспортер L-изолейцина, усилена.
Целью настоящего изобретения является предоставление бактерии, трансформированной фрагментом ДНК, содержащим ген, кодирующий белок с L-активностью изолейциндиоксигеназы, отличающейся тем, что указанная бактерия модифицирована таким образом, что экспрессия гена, кодирующего транспортер L-изолейцина, усилена и указанная бактерия обладает способностью к продукции (2S,3R,4S)-4-гидрокси-L-изолейцина.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом ген, кодирующий белок с L-изолейциндиогсигеназной активностью, выбран из группы, состоящей из:
(a) ДНК, включающей нуклеотидную последовательность, приведенную в Перечне последовательностей под номером 1 (SEQ ID No: 1);
(b) ДНК, гибридизующейся в жестких условиях с ДНК, включающей нуклеотидную последовательность, комплементарную нуклеотидной последовательности, приведенной в Перечне последовательностей под номером 1 (SEQ ID No: 1), при этом указанная ДНК кодирует белок с L-изолейциндиоксигеназной активностью;
(c) ДНК, включающей нуклеотидную последовательность, кодирующую белок, включающий аминокислотную последовательность, приведенную в Перечне последовательностей под номером 2 (SEQ ID No: 2);
(d) ДНК, включающей нуклеотидную последовательность, кодирующую белок, включающий аминокислотную последовательность, приведенную в Перечне последовательностей под номером 2 (SEQ ID No: 2), за исключением того, что указанная аминокислотная последовательность содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков и при этом указанный белок имеет L-изолейциндиоксигеназную активность; и
(e) ДНК, включающей нуклеотидную последовательность, кодирующую белок, включающий аминокислотную последовательность, гомологичную по крайней мере на 98% аминокислотной последовательности, приведенной в Перечне последовательностей под номером 2 (SEQ ID No: 2), при этом указанный белок имеет L-изолейциндиоксигеназную активность.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом бактерия модифицирована таким образом, что активность L-изолейциндиоксигеназы увеличена.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом активность L-изолейциндиоксигеназы увеличена за счет усиления экспрессии гена, кодирующего L-изолейциндиоксигеназу.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом экспрессия L-изолейциндиоксигеназы усилена путем модификации последовательности, контролирующей экспрессию гена, кодирующего L-изолейциндиоксигеназу, или путем увеличения числа копий гена, кодирующего L-изолейциндиоксигеназу.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом геном, кодирующим транспортер L-изолейцина, является ген brnQ из Escherichia coli.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом бактерия дополнительно модифицирована с целью ослабления экспрессии генов, кодирующих оксоглутаратдегидрогеназу, изоцитратлиазу и фосфатазу изоцитратдегидрогеназы.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная экспрессия ослаблена путем инактивации указанных генов.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом бактерия дополнительно модифицирована с целью ослабления экспрессии гена, кодирующего аминотрансферазу аминокислот с разветвленной цепью.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная экспрессия ослаблена путем инактивации указанного гена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом бактерия принадлежит к роду, выбранному из группы, состоящей из Escherichia, Pseudomonas, Corynebacterium, Arthrobacter, Aspergillus и Bacillus.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом бактерия выбрана из группы, состоящей из Escherichia coli, Arthrobacter simplex, Corynebacterium glutamicum, Arthrobacter globiformis, Arthrobacter sulfureus, Arthrobacter viscosus и Bacillus subtilis.
Также целью настоящего изобретения является предоставление способа продукции (2S,3R,4S)-4-гидрокси-L-изолейцина или его соли, включающего:
культивирование описанной выше бактерии - продуцента (2S,3R,4S)-4HIL в питательной среде, содержащей L-изолейцин; и
выделение (2S,3R,4S)-4-гидрокси-L-изолейцина.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом питательная среда содержит источник углерода, выбранный из группы, состоящей из углевода и спирта.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанным углеводом является глюкоза, а указанным спиртом - глицерин.
Другим аспектом настоящего изобретения является предоставление способа получения 4-гидрокси-L-пролина, включая как его свободную форму, так и его соли. Другим аспектом настоящего изобретения является предоставление способа продукции 4-гидрокси-L-пролина или его соли путем прямого ферментативного гидроксилирования L-пролина с использованием бактерии с L-пролингидроксилазной активностью.
Настоящее изобретение детально описано ниже.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
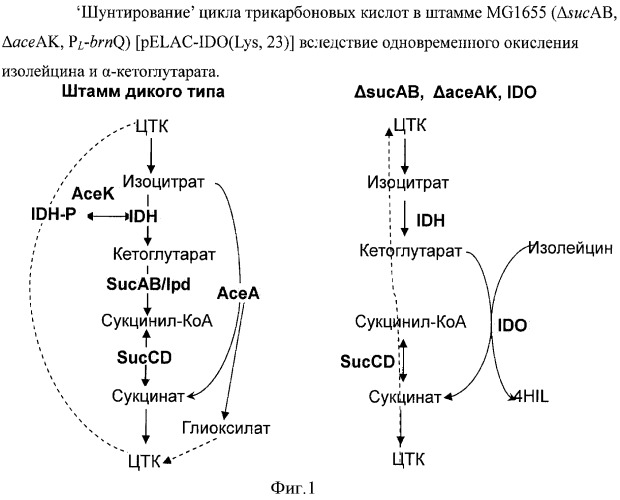
На Фигуре 1 показано 'шунтирование' цикла трикарбоновых кислот в штамме MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)_[pELAC-IDO(Lys, 23)] благодаря окислению изолейцина и α-кетоглутарата (2-оксоглутарата).
На Фигуре 2 показана схема рекомбинантной плазмиды pET-IlvA.
На Фигуре 3 показана схема рекомбинантной плазмиды pELAC-IDO(Lys, 23).
На Фигуре 4 показано конструирование штамма Е.coli MG1655(PL-brnQ).
На Фигуре 5 показан рост штаммов MG1655 и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) на синтетической среде М9, содержащей глюкозу или глицерин с добавлением или без добавления лизина, метионина и диаминопимелата (DAP-diaminopimelate). Штаммы выращивали на синтетической среде М9 с добавлением глюкозы или глицерина, а также лизина, метионина и диаминопимелата (DAP). Сокращения: Штаммы WT = MG1655; 2d = MG1655 (ΔsucAB, ΔaceAK, PL-brnQ); Среда: А = М9 + глюкоза; В = М9 + глюкоза + (Lys, Met, DAP); С = М9 + глицерин; D = М9 + глицерин + (Lys, Met, DAP).
На Фигуре 6 показан рост штаммов MG1655 [pELAC-IDO(Lys, 23)] и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) [pELAC-IDO(Lys, 23)] на синтетической среде М9 с добавлением или без добавления L-изолейцина. Сокращения: Штаммы 1 = MG1655[pELAC-IDO(Lys, 23)]; 2 = MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) [pELAC-IDO(Lys, 23)]; Среда: G = М9 + глюкоза (137 мМ); GI = М9 + глюкоза (137 мМ) + L-изолейцин (137 мМ); Y = М9 + глицерин (136 мМ); YI = М9 + глицерин (136 мМ) + L-изолейцин (137 мМ).
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
1. Бактерия согласно настоящему изобретению
Термин "бактерия", как он употребляется в настоящем описании, включает бактерию, продуцирующую фермент, мутант и генетический рекомбинант такой бактерии, в которой имеется или увеличена целевая ферментативная активность, и т.п.
Термин «активность 2-оксоглутарат-зависимого фермента», как он употребляется в настоящем описании, обозначает ферментативную активность, способную катализировать реакцию образования сукцината из 2-оксоглутарата.
Многие белки имеют активность 2-оксоглутарат-зависимого фермента, так же как и 2-оксоглутарат-зависимые диоксигеназы, что сообщалось ранее. Следующие примеры, включающие диоксигеназы, способные к продукции нужных продуктов, таких как Pro гидроксилаза, превращающая L-Pro в гидрокси-Pro (APPLIED AND ENVIRONMENTAL MICROBIOLOGY, Sept. 1999, p.4028-4031), γ-бутиробетаин гидроксилаза, превращающая γ-бутиробетаин в L-карнитин (WO 2005/083089). Кроме того, это диоксигеназы, о многих из которых уже сообщалось. Например, ссылка на: Critical Reviews in Biochemistry and Molecular Biology, 39: 21-68, 2004, and NATURE CHEMICAL BIOLOGY, 4 NUMBER 3 MARCH: 152-156, 2008. Что касается 2-оксоглутарт-зависимых диоксигеназ, описанных в обзорах, бактерия была модифицирована таким образом, что экспрессия гена, кодирующего оксоглутаратдегидрогеназу (такой как ΔsucAB, ΔsucA, ΔsucB), ослаблена; предпочтительно модифицирована таким образом, что экспрессии генов, кодирующих оксоглутаратдегидрогеназу и изоцитратлиазу (такие как (ΔsucAB, ΔsucA, или ΔsucB) плюс ΔaceA), ослаблены; более предпочтительно модифицирована таким образом, что экспрессии генов, кодирующих оксоглутаратдегидрогеназу, изоцитратлиазу и фосфатазу изоцитратдегидрогеназы (такие как (ΔsucAB, ΔsucA или ΔsucB) плюс ΔaceAK), ослаблены, которые представлены в Е.coli штаммом MG1655 (ΔsucAB, ΔaceAK), которые описаны в нижеупомянутых примерах, являются подходящими клетками-хозяевами, эффективно использующими 2-оксоглутарат, продуцирующий на средах, содержащих углерод в виде D-глюкозы, в 2-оксоглутарат-зависимых ферментативных реакциях.
Настоящее изобретение будет описано со ссылкой на Примеры, в которых в качестве белка с активностью 2-оксоглутарт-зависимого фермента приводится белок с активностью L-изолейциндиоксигеназы и продуктом реакции, катализируемой указанным белком, является (2S,3R,4S)-4-гидрокси-L-изолейцин. Однако настоящее изобретение не ограничивается этими примерами.
В настоящем изобретении термин "(2S,3R,4S)-4-гидрокси-L-изолейцин", или "(2S,3R,4S)-4HIL", или "4HIL" относится к отдельному химическому соединению или к смеси соединений, содержащей (2S,3R,4S)-4-гидроксиизолейцин.
Термин "бактерия", как он употребляется в настоящем описании, включает фермент-образующую бактерию, мутант и генетический рекомбинант такой бактерии, в которой имеется или увеличена целевая ферментативная активность, и т.п.
Можно употреблять аббревиатуру L-изолейциндиоксигеназы - IDO (L-isoleucine dioxygenase).
В результате скрининга природных микроорганизмов обнаружена уникальная бактерия - штамм Bacillus thuringiensis 2-e-2, обладающий активностью, катализирующей реакцию, в которой (2S,3R,4S)-4HIL образуется непосредственно из L-изолейцина, как в свободной форме, так и в форме соли. Из микробных клеток после культивирования очистили L-изолейциндиоксигеназу, в сокращенном варианте она может называться IDO(Lys, 23).
Кроме того, определена N-концевая аминокислотная последовательность IDO(Lys, 23) очищенной диоксигеназы штамма Bacillus thuringiensis 2-e-2. Штамм Bacillus thuringiensis 2-e-2 был назван Bacillus thuringiensis AJ110584 и депонирован в соответствии с будапештским Договором в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki 305-8566, Japan) 27 сентября 2006 г. с инвентарным номером FERM ВР-10688.
ДНК, кодирующая IDO(Lys, 23), представлена в Перечне последовательностей под SEQ ID No: 1. Кроме того, аминокислотная последовательность IDO(Lys, 23), кодируемой нуклеотидной последовательностью SEQ ID NO: 1, представлена в Перечне последовательностей под SEQ ID No: 2. SEQ ID NO: 2 - аминокислотная последовательность IDO(Lys, 23), кодируемой нуклеотидной последовательностью SEQ ID NO: 1. IDO(Lys, 23) с последовательностью SEQ ID NO: 2 обладает L-изолейциндиоксигеназной активностью и катализирует реакцию, в которой (2S,3R,4S)-4HIL, выраженный следующей формулой (I), синтезируется непосредственно из одной молекулы L-изолейцина.
ДНК, кодирующая IDO, катализирующую реакцию, в которой (2S,3R,4S)-4HIL образуется из L-изолейцина, - не только ДНК, представленная в SEQ ID No: 1. Это связано с возможностью различий в нуклеотидных последовательностях среди видов и штаммов Bacillus, образующих IDO, катализирующую реакцию образования (2S,3R,4S)-4HIL из L-изолейцина.
ДНК настоящего изобретения включает не только выделенную ДНК, кодирующую IDO, но также и ДНК, кодирующую IDO, в которую искусственно введены мутации. Эта ДНК может быть выделена из хромосомы продуцирующего IDO микроорганизма. ДНК настоящего изобретения должна кодировать IDO, способную катализировать вышеуказанную реакцию. Методы искусственного введения мутаций включают обычно используемые методы введения сайт-специфических мутаций, описанные в Method. in Enzymol., 154 (1987).
ДНК, гибридизующаяся в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID No: 1, и кодирующая белок с активностью IDO, также включена в ДНК настоящего изобретения. В рамках настоящего изобретения «жесткие условия» означают такие условия, при которых специфические гибриды образуются тогда, как неспецифические гибриды не образуются. Хотя количественное описание этих условий является затруднительным, в качестве примера можно сослаться на условия, при которых молекулы ДНК, имеющие более высокую гомологию, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительней не менее 90% и особенно предпочтительно не менее 95% или более, гибридизуются друг с другом, тогда как молекулы ДНК, имеющие более низкую гомологию, не гибридизуются друг с другом, или такие условия, при которых гибридизация имеет место при обычных условиях отмывки во время проведения гибридизации по Саузерну, которая проводится при концентрации солей, 0.1×SSC, 0.1% SDS при температуре 37°C, предпочтительно 0.1×SSC, 0.1% SDS при температуре 60°C и более предпочтительно 0.1×SSC, 0.1% SDS при температуре 65°C. Длина зонда может быть выбрана соответствующим образом, в зависимости от условий гибридизации и обычно варьирует от 100 п.о. до 1 тыс. п.о. Кроме того, "L-изолейциндиоксигеназная активность" может быть описана как активность, осуществляющая синтез (2S,3R,4S)-4HIL из L-изолейцина. Однако нуклеотидная последовательность, гибридизующаяся в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No: 1, предпочтительно сохраняет L-изолейциндиоксигеназную активность на 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более, относительно белка с аминокислотной последовательностью SEQ ID No: 2 в условиях 37°C и рН 8.
Кроме того, ДНК, кодирующая белок, по существу идентичный IDO, кодируемой SEQ ID No: 1, также включена в ДНК настоящего изобретения. А именно следующие ДНК также включены в ДНК настоящего изобретения:
(а) ДНК с нуклеотидной последовательностью SEQ ID No: 1;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No: 1, и кодирующая белок с L-изолейциндиоксигеназной активностью;
(c) ДНК, кодирующая белок с аминокислотной последовательностью SEQ ID No: 2;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No: 2, обладающий L-изолейциндиоксигеназной активностью; и
(e) ДНК, кодирующая белок с аминокислотной последовательностью, гомологичной по крайней мере на 70%, предпочтительно по крайней мере на 80%, более предпочтительно по крайней мере на 90% и еще более предпочтительно по крайней мере на 95% аминокислотной последовательности SEQ ID NO: 2, обладающий L-изолейциндиоксигеназной активностью.
В рамках настоящего изобретения фраза «один или несколько» означает диапазон изменений, при котором третичная структура белка или активность L-изолейциндиоксигеназы изменяется незначительно и, в частности, соответствует значениям от 1 до 78, предпочтительно от 1 до 52, более предпочтительно от 1 до 26 и еще более предпочтительно от 1 до 13.
Замена, делеция, вставка, добавление или инверсия одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность фермента при этом сохраняется. Примером консервативной мутации(ий) являет(ют)ся консервативная замена(ы). Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, Ile или Leu.
Кроме того, термин «L-изолейциндиоксигеназная активность» означает способность к продукции (2S,3R,4S)-4HIL из L-изолейцина, как описано выше. Однако в случае, когда аминокислотная последовательность содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No: 2, L-изолейциндиоксигеназная активность сохраняется, по крайней мере, не менее чем на 10%, предпочтительно не менее чем на 30%, более предпочтительно не менее чем на 50% и еще более предпочтительней на 70% и более от активности белка, имеющего аминокислотную последовательность SEQ ID No: 2, в условиях поддержания температуры на уровне 30°C и рН 6. L-изолейциндиоксигеназная активность IDO согласно настоящему изобретению может быть измерена путем анализа образования (2S,3R,4S)-4HIL из L-изолейцина с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).
Кроме того, фрагмент ДНК, гомологичный фрагменту ДНК, показанному на SEQ ID NO: 1, может быть использован в качестве гена, кодирующего L-изолейциндиоксигеназу согласно настоящему изобретению. Тот факт, что гомологичный фрагмент ДНК кодирует или не кодирует L-изолейциндиоксигеназу, может быть подтвержден путем измерения L-изолейциндиоксигеназной активности в клеточном лизате или в клеточном лизате микроорганизма, в котором гомологичный фрагмент ДНК сверхэкспрессируется.
Фрагмент ДНК, гомологичный показанному на SEQ ID NO: 1, может быть также приготовлен из геномной ДНК других видов бактерий рода Bacillus, например из Bacillus cereus, Bacillus weihenstephanensis.
Термин "бактерия, принадлежащая к роду Escherichia" означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (E.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Термин "бактерия, принадлежащая к роду Pseudomonas" означает, что данная бактерия классифицирована как принадлежащая к роду Pseudomonas согласно классификации, известной специалисту в области микробиологии.
Термин "бактерия, принадлежащая к роду Corynebacterium" означает, что данная бактерия классифицирована как принадлежащая к роду Corynebacterium согласно классификации, известной специалисту в области микробиологии. Примеры бактерии, принадлежащей к роду Corynebacterium, в качестве используемой в настоящем изобретении включают, но не ограничиваются, Corynebacterium glutamicum.
Термин "бактерия, принадлежащая к роду Arthrobacter" означает, что данная бактерия классифицирована как принадлежащая к роду Arthrobacter согласно классификации, известной специалисту в области микробиологии. Примеры бактерии, принадлежащей к роду Arthrobacter, в качестве используемой в настоящем изобретении включают, но не ограничиваются, Arthrobacter simplex, Arthrobacter globiformis, Arthrobacter sulfureus и Arthrobacter viscosus.
Термин "бактерия, принадлежащая к роду Aspergillus" означает, что данная бактерия классифицирована как принадлежащая к роду Aspergillus согласно классификации, известной специалисту в области микробиологии.
Термин "бактерия, принадлежащая к роду Bacillus" означает, что данная бактерия классифицирована как принадлежащая к роду Bacillus согласно классификации, известной специалисту в области микробиологии. Примеры бактерии, принадлежащей к роду Bacillus, в качестве используемой в настоящем изобретении включают, но не ограничиваются, Bacillus subtilis.
Ген brnQ E.coli (синонимы - ECK0395, b0401, hrbA) кодирует LIVCS транспортер аминокислот с разветвленной цепью BrnQ (синонимы - B0401, HrbA, LIV-II). Ген brnQ (нуклеотиды с 418815 по 420134; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между генами phoR и proY на хромосоме штамма E.coli K-12. Нуклеотидная последовательность гена brnQ и аминокислотная последовательность белка BrnQ, кодируемого геном brnQ, приведены в Перечне последовательностей под номерами 3 (SEQ ID NO: 3) и 4 (SEQ ID NO: 4) соответственно.
Ген sucA E.coli (синонимы - ECK0714, lys, b0726, lys+met) кодирует субъединицу E1(0) компонента оксоглутаратдегидрогеназного комплекса - SucA (синонимы - B0726, Lys). Ген sucA (нуклеотиды с 757,929 по 760,730; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между геном G6388, частично перекрываясь с ним, и геном sucB на хромосоме штамма E.coli K-12. Нуклеотидная последовательность гена sucA и аминокислотная последовательность белка SucA, кодируемого геном sucA, приведены в Перечне последовательностей под номерами 5 (SEQ ID NO: 5) и 6 (SEQ ID NO: 6) соответственно.
Ген sucB E.coli (синонимы - ECK0715, b0727) кодирует субъединицу Е2(0) компонента оксоглутаратдегидрогеназного комплекса - SucB (синоним B0727). Ген sucB (нуклеотиды с 760,745 по 761,962; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между генами sucA и sucC на хромосоме штамма E.coli K-12. Нуклеотидная последовательность гена sucB и аминокислотная последовательность белка SucB, кодируемого геном sucB, приведены в Перечне последовательностей под номерами 7 (SEQ ID NO: 7) и 8 (SEQ ID NO: 8) соответственно.
Ген асеА Е.coli (синонимы - ECK4007, b4015, icI) кодирует субъединицу изоцитратлиазы - АсеА (синонимы B4015, IcI). Ген асеА (нуклеотиды с 4,215,132 по 4,216,436; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между генами асеВ и aceK на хромосоме штамма Е.coli K-12. Нуклеотидная последовательность гена асеА и аминокислотная последовательность белка АсеА, кодируемого геном асеА, приведены в Перечне последовательностей под номерами 9 (SEQ ID NO: 9) и 10 (SEQ ID NO: 10) соответственно.
Ген aceK Е.coli (синонимы - ECK4008, b4016) кодирует субъединицу фосфатазы изоцитратдегидрогеназы - AceK (синоним В4016). Ген aceK (нуклеотиды с 4,216,619 по 4,218,355; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между геном асеА и геном arpA, в противоположной ориентации, частично перекрываясь с ним, на хромосоме штамма Е.coli K-12. Нуклеотидная последовательность гена aceK и аминокислотная последовательность белка AceK, кодируемого геном aceK, приведены в Перечне последовательностей под номерами 11 (SEQ ID NO: 11) и 12 (SEQ ID NO: 12) соответственно.
Ген ilvE E.coli (синонимы - ECK3762, b3770) кодирует субъединицу аминотрансферазы аминокислот с разветвленной цепью - IlvE (синоним В3770). Ген ilvE (нуклеотиды с 3,950,507 по 3,951,436; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между генами ilvM и ilvD на хромосоме штамма Е.coli K-12. Нуклеотидная последовательность гена ilvE и аминокислотная последовательность белка IlvE, кодируемого геном ilvE, приведены в Перечне последовательностей под номерами 13 (SEQ ID NO: 13) и 14 (SEQ ID NO: 14) соответственно.
Поскольку у представителей различных родов или штаммов семейства Enterobacteriaceae возможны некоторые вариации в нуклеотидных последовательностях, понятие гена brnQ с усиленной экспрессией или генов sucA, sucB, асеА, aceK, ilvE с ослабленной экспрессией не ограничивается генами, последовательности которых приведены в Перечне последовательностей под номерами SEQ ID No: 3, SEQ ID No: 5, SEQ ID No: 7, SEQ ID No: 9, SEQ ID No: 11 и SEQ ID No: 13, но также может включать и гены, гомологичные SEQ ID No: 3, SEQ ID No: 5, SEQ ID No: 7, SEQ ID No: 9, SEQ ID No: 11 и SEQ ID No: 13, кодирующие вариант белка BrnQ, SucA, SucB, АсеА, AceK и IlvE соответственно. Термин "вариант белка", используемый в настоящем изобретении, означает белок с изменениями в последовательности, будь то делеции, вставки, добавления или замены аминокислот, в котором сохраняется активность белка BrnQ/SucA/SucB/AceA/AceK/IlvE. Число изменений в варианте белка зависит от положения или типа аминокислотного остатка в третичной структуре белка. Оно может быть от 1 до 30, предпочтительно от 1 до 15, более предпочтительно от 1 до 5 в SEQ ID No: 4, SEQ ID No: 6, SEQ ID No: 8, SEQ ID No: 10, SEQ ID No: 12 и SEQ ID No: 14. Данные изменения в вариантах могут иметь место в областях, не критичных для функции белка. Данные изменения возможны потому, что некоторые аминокислоты имеют высокую гомологию друг другу, поэтому такие изменения не влияют на третичную структуру или активность. Следовательно, вариант белка, кодируемого геном brnQ/sucA/sucB/aceA/aceK/ilvE, может быть представлен белками с гомологией не менее 80%, предпочтительно не менее 90% и наиболее предпочтительно не менее 95%, по отношению к полной аминокислотной последовательности, приведенной в Перечне последовательностей под номером SEQ ID No: 4, SEQ ID No: 6, SEQ ID No: 8, SEQ ID No: 10, SEQ ID No: 12 и SEQ ID No: 14, при условии, что сохраняется активность белков BrnQ, SucA, SucB, AceA, AceK и IlvE (до инактивации гена sucA/sucB/aceA/aceK/ilvE).
Гомология между двумя аминокислотными последовательностями может быть определена с использованием известных методов, например компьютерной программы BLAST 2.0, которая считает три параметра: число аминокислот, идентичность и сходство.
Кроме того, гены brnQ, sucA, sucB, aceA, aceK, ilvE могут быть вариантом, который гибридизуется в жестких условиях с нуклеотидной последовательностью, приведенной в Перечне последовательностей под номером SEQ ID No: 3/SEQ ID No: 5/SEQ ID No: 7/SEQ ID No: 9/SEQ ID No: 11/SEQ ID No: 13, или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности, при условии, что до инактивации он кодирует функциональный белок BrnQ/SucA/SucB/AceA/AceK/IlvE. «Жесткие условия» включают такие условия, при которых специфические гибриды, например гибриды с гомологией не менее 60%, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90% и наиболее предпочтительно не менее 95%, образуются, а неспецифические гибриды, например гибриды с меньшей гомологией, чем указано выше, - не образуются. Практическим примером жестких условий является однократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°C. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, такова, как рекомендовано производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N+ (Amersham) при строгих условиях - 15 минут. Предпочтительна двух-, трехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации и обычно составляет около 100-1000 п.н.
Термин "усиленная экспрессия гена" или "сверхэкспрессия гена" означает, что экспрессия гена выше, чем в немодифицированном штамме, например в штамме дикого типа. Примеры таких модификаций включают увеличение числа копий гена на клетку, увеличение уровня экспрессии гена и т.д. Количество копий экспрессирующегося гена определяют, например, с использованием рестрикции хромосомной ДНК с последующим блоттингом по Саузерну с использованием зонда на основе последовательности гена, флуоресцентной гибридизацией in situ (FISH- fluorescence in situ hybridization) и т.п.
Уровень экспрессии гена можно определить с использованием различных известных методов, включая блоттинг по Нозерну, количественную RT-PCR, и т.п. Количество кодируемого геном белка можно определить с использованием известных методов, включая электрофорез в SDS-ПААГ с последующим иммуноблоттингом (Western блоттинг) и т.п. Кроме того, штаммы дикого типа, которые могут использоваться в качестве контрольных, включают, например, Escherichia coli K-12.
Термин «трансформация бактерии с помощью фрагмента ДНК, кодирующего белок» означает введение фрагмента ДНК в бактерию, например, традиционными методами. Трансформация этой ДНК приведет к усилению экспрессии гена, кодирующего белок согласно настоящему изобретению, и к увеличению активности белка в этой бактериальной клетке. Способы трансформации включают любые известные методы, которые к настоящему времени уже описаны. Например, может быть использован метод обработки реципиентных клеток хлоридом кальция таким образом, чтобы увеличить проницаемость клеток для ДНК. Этот метод был описан для штамма Escherichia coli K-12 (Mandel, M. and Higa, A., J. Mol. Biol., 53, 159 (1970)).
Методы сверхэкспрессии гена или усиления экспрессии гена включают увеличение числа копий гена. Введение гена в вектор, способный функционировать в бактерии семейства Enterobacteriaceae, увеличивает число копий гена. Преимущественно используют низкокопийные векторы. Примеры низкокопийных векторов включают, но не ограничиваются ими, pSC101, pMW118, pMW119 и т.п. Термин "низкокопийный вектор" используется для векторов, число копий которого в клетке достигает пяти.
Усиление экспрессии гена может также быть достигнуто путем введения множества копий гена в бактериальную хромосому, например, методом гомологичной рекомбинации, Mu интеграции и т.п. Например, один акт Mu интеграции позволяет ввести в бактериальную хромосому до 3 копий гена.
Увеличение числа копий гена также может быть достигнуто путем введения множества копий гена в хромосомную ДНК бактерии. Для введения множества