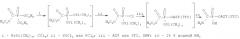Способ получения 5'-аминокарбонилфосфонатов нуклеозидов и способ получения хлорангидрида триметилсилильного эфира этоксикарбонилфосфоновой кислоты
Иллюстрации
Показать всеНастоящее изобретение относится к новому улучшенному способу получения 5'-аминокарбонилфосфонатов нуклеозидов и способу получения хлорангидрида триметилсилильного эфира этоксикарбонилфосфоновой кислоты - реагенту для получения 5'-аминокарбонилфосфонатов нуклеозидов, и может быть использовано в фармацевтической промышленности. Предложенный способ включает взаимодействие фосфонилирующего реагента - хлорангидрида триметилсилильного эфира этоксикарбонилфосфоновой кислоты в присутствии диметилформамида с нуклеозидом в инертном апротонном растворителе и обработку промежуточных 5'-этоксикарбонилфосфонатов водным раствором аммиака. Хлорангидрид триметилсилильного эфира этоксикарбонилфосфоновой кислоты получают последовательной обработкой триэтилфосфоноформиата триметилбромсиланом, а затем пентахлоридом фосфора или тионилхлоридом. Предложенный способ получения 5'-аминокарбонилфосфонатов нуклеозидов упрощает технологический процесс за счет использования эффективного реагента хлорангидрида триметилсилильного эфира этоксикарбонилфосфоновой кислоты, 2 н.п. ф-лы, 3 пр.
Реферат
Изобретение относится к области молекулярной биологии, химической технологии и медицины и касается усовершенствования способа получения 5'-аминокарбонилфосфонатов нуклеозидов.
Модифицированные нуклеозиды широко применяются для лечения и профилактики многих вирусных заболеваний. В настоящее время схемы противоретровирусной терапии первой линии включают зидовудин (3'-азидо-3'-дезокситимидин, AZT) и ламивудин (2',3'-дидезокси-3'-тиацитидин, 3ТС). Известно, что в ряде случаев депо-формы этих анти-ВИЧ лекарственных препаратов имеют преимущества по сравнению с соответствующими базовыми нуклеозидами. В частности, они менее токсичны и имеют улучшенную фармакокинетику. Примером такого соединения является первый российский оригинальный анти-ВИЧ препарат - 5'-Н-фосфонат 3'-азидо-3'-дезокситимидина (Никавир®). Будучи латентной формой AZT, Никавир® обладает рядом преимуществ перед ним: он менее токсичен для пациентов и обладает меньшим спектром побочных действий. Его время выведения из организма вдвое больше, что позволяет снизить частоту приема и, наконец, резистентность к нему вырабатывается гораздо медленнее и на значительно более низком уровне. Ранее было показано, что 5'-аминокарбонилфосфонаты 3'-азидо-3'-дезокситимидина и 2',3'-дидезокси-3'-тиацитидина являются эффективными депо-формами зидовудина и ламивудина соответственно [Kukhanova М.К., Jasco M.V., Shipitzyn A.V. et al. // New depot forms of AZT and 3TC based on their phosphonate derivatives: anti-HIV activity and pharmacokinetic parameters // Nucleic Acids Symp.Ser. (Oxf)., 2008, 52, 597-598; Khandazhinskaya A.L., Yanvarev D.V., Jasko M.V. et al. // 5'-aminocarbonyl phosphonates as new zidovudine depot forms: antiviral properties, intracellular transformations, and pharmacokinetic parameters // Drug Metab. Dispos., 2009, 37(3), 494-501].
Известные способы синтеза предполагают использование сложных приемов хроматографического выделения и очистки и ориентированы на получение небольших количеств 5'-аминокарбонилфосфонатов нуклеозидов. Поэтому актуальной задачей представляется разработка упрощенного способа фосфонилирования нуклеозидов, реализуемого в типовой промышленной аппаратуре, позволяющего получать 5'-аминокарбонилфосфонаты нуклеозидов с хорошим выходом и степенью чистоты, превышающей 96%.
Известен способ получения 5'-алкоксикарбонилфосфонатов 3'-азидо-3'-дезокситимидина, предшественников в синтезе 5'-аминокарбонилфосфонатов, через монохлорпроизводное диалкилфосфоноформиата [Saha J., Ruprecht R.M., Rosowsky A. // Phosphonoformate esters of anti-HIV nucleosides: 3'-azido-3'-deoxythymidine and 2',3'-dideoxycytidine derivatives containing a small 5'-(O-alkoxycarbonylphosphinyl) or 5'-(О-cholesterylcarbonylphosphinyl) substituent // Nucleosides &
Nucleotides, 1991, 10(7), 1465-1475; United States Patent 5132414 - Dideoxynucleoside-5'-phosphonoformic acid compounds.].
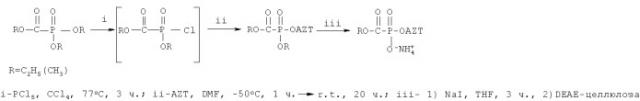
Соответствующий триалкилфосфоноформиат обрабатывают пятихлористым фосфором в четыреххлористом углероде при нагревании и вводят в реакцию с 3'-азидо-3'-дезокситимидином в диметилформамиде при температуре -50°С с последующим нагреванием до комнатной температуры. Фосфонилированный продукт выделяют flash-хроматографией на силикагеле, обрабатывают иодидом натрия в сухом тетрагидрофуране при комнатной температуре для удаления О-алкильной группы с атома фосфора. целевых 5'-алкоксикарбонилфосфонатов получают анионообменной хроматографией на DEAE-целлюлозе. Общий выход на всю схему: 45% и 12% для этилового и метилового эфиров, соответственно, что не позволяет масштабировать синтез.
В другом методе 5'-аминокарбонилфосфонат 3'-азидо-3'-дезокситимидина получают из пиридиниевой соли этоксикарбонилфосфоновой кислоты в присутствии пивалоилхлорида [Широкова Е.А., Ясько М.В., Хандажинская А.Л. и др. // Новые производные 3'-азидо-3'-дезокситимидина и фосфономуравьиной кислоты // Биоорганическая Химия, 2004, 30 (3), 273-280] или дициклогексилкарбодиимида [Jasko М.; Shipitsin A.; Shirokova Е. et al. // 5'-Phosphonates of ribonucleosides and 2'-deoxyribonucleosides: synthesis and antiviral activity // Nucleosides & Nucleotides, 1993, 12(8), 879-893].
Триэтилфосфоноформиат превращают в пиридиниевую соль этоксикарбонилфосфоновой кислоты последовательным действием триметилбромсилана и водного пиридина, а затем вводят в реакцию с нуклеозидом и пивалоилхлоридом или дициклогексилкарбодиимидом в пиридине. Продукт реакции выделяют колоночной хроматографией (DEAE-Toyopearl, элюент - линейный градиент концентрации NH4HCO3 в воде, 0→0,15 М), очищают еще раз на колонке (LiChroprep RP-8, элюент - вода). После выдерживания 5'-этоксикарбонилфосфоната 3'-азидо-3'-дезокситимидина в 25% водном растворе аммиака получают целевой 5'-аминокарбонилфосфонат, который очищают колоночной хроматографией (DEAE-Toyopearl, элюент - линейный градиент NH4HCO3 в воде, 0→0,1 М, а затем LiChroprep RP-18, элюент - вода).
Несмотря на высокие выходы (70-80% в расчете на исходный нуклеозид), описанный метод синтеза обладает рядом существенных недостатков, а именно, в синтезе используются сильно токсичные пиридин и пивалоилхлорид, а также дициклогексилкарбодиимид - мощный аллерген. Кроме того, этот метод синтеза подразумевает многократную очистку с помощью колоночной хроматографии на специфических сорбентах с получением больших объемов водных фракций. Таким образом, метод технологически сложен и неэкономичен, а следовательно, не пригоден для масштабирования.
Наиболее близким к заявляемому является способ получения 5'-аминокарбонилфосфонатов аденозина и гуанозина через дихлорангидрид этоксикарбонилфосфоновой кислоты [Vaghefi М.М., McKernan Р.А., Robins R.K. // Synthesis and antiviral activity of certain nucleoside 5'-phosphonoformate derivatives//J. Med. Chem., 1986,29(8), 1389-1393].
Бис(триметилсилил)этоксикарбонилфосфонат получают конденсацией
трис(триметилсилил)фосфита с хлорангидридом этоксимуравьиной кислоты, вводят в реакцию с тионилхлоридом при 70°С и перегоняют в глубоком вакууме. К полученному дихлорангидриду этоксикарбонилфосфоновой кислоты в триметилфосфате на холоду добавляют 2',3'-изопропилиденаденозин или 2',3'-изопропилиденгуанозин. Изопропилиденовую защиту удаляют действием 80% муравьиной кислоты. Полученный продукт очищают на колонках с Dowex 2 (Cl--форма, элюент - вода и градиент LiCl 0→0,15 М), и Dowex 50 (Н+-форма), лиофилизуют и сушат над Р2О5. К полученному 5'-этоксикарбонилфосфонату добавляют насыщенный раствор аммиака в метаноле и перемешивают 36 ч при комнатной температуре. Полученный 5'-аминокарбонилфосфонат очищают хроматографией на колонке с DEAE-Sephadex (элюент - градиент концентраций NH4HCO3 в воде). Общий выход на всю схему: 49,5% и 65% для аденозина и гуанозина соответственно.
Синтез дихлорангидрида этоксикарбонилфосфоновой кислоты требует кипячения в тионилхлориде, что приводит к образованию примесей, в первую очередь, продуктов димеризации. Побочные продукты сильно усложняют следующую стадию фосфорилирования, следовательно, необходима дополнительная очистка фосфонилирующего реагента, а именно, перегонка в глубоком вакууме. Таким образом, стадия получения фосфонилирующего реагента сложна с технологической точки зрения.
Коме того, к недостаткам данного метода можно отнести использование малодоступного и дорогостоящего трис(триметилсилил)фосфита и токсичного хлорангидрида этоксимуравьиной кислоты, а также многократное использование колоночной хроматографии на специфических сорбентах.
Настоящее изобретение позволяет упростить процесс фосфонилирования нуклеозидов и делает возможным его осуществление в типовой промышленной аппаратуре.
Предлагаемый способ синтеза 5'-аминокарбонилфосфонатов нуклеозидов заключается в использовании в качестве фосфонилирующего реагента хлорангидрида триметилсилильного эфира этоксикарбонилфосфоновой кислоты, получаемого из триэтилфосфоноформиата, его взаимодействии с нуклеозидом в инертном апротонном растворителе в присутствии диметилформамида с последующей обработкой раствором водного аммиака для превращения этоксикарбонильной группы в амидную.
Получение хлорангидрида триметилсилильного эфира этоксикарбонилфосфоновой кислоты согласно изобретению осуществляется следующим образом.
Триэтилфосфоноформиат растворяют в четыреххлористом углероде, охлаждают до температуры -10-0°С, порциями приливают триметилбромсилан и перемешивают 30 мин при той же температуре, затем раствор выдерживают 12-24 ч при комнатной температуре. Реакционную смесь упаривают в вакууме до прекращения конденсатообразования и дважды переупаривают с четыреххлористым углеродом (добавляют четыреххлористый углерод, упаривают, добавляют четыреххлористый углерод, упаривают). Остаток охлаждают до температуры -4°С -0° и при перемешивании добавляют небольшими порциями пятихлористый фосфор или тионилхлорид, затем перемешивают 12-24 ч при комнатной температуре. Реакционную массу упаривают в вакууме до прекращения конденсатообразования, дважды переупаривают с четыреххлористым углеродом и получают смесь, содержащую 80-85% (по данным 1Н и 31Р-ЯМР-спектроскопии) целевого фосфонилирующего реагента (1Н-ЯМР, CDCl3, 400 МГц: 4,24 (2Н, м, СН 2-СH3), 1,30 (3Н, т, J=7,0, СН2-СH 3, 0,30 (9Н, с, (CH 3)3Si). 31Р-ЯМР, CDCl3, 162 МГц: -9,2 с.), которую используют без дополнительной очистки. Данная смесь также содержит 4-6% бистриметилсилилового эфира этоксикарбонилфосфоновой кислоты (1Н-ЯМР, CDCl3, 400 МГц: 4,21 (2Н, м, CH 2-СН3), 1,25 (3Н, т, (1Н-ЯМР, CDCl3, 400 МГц: 4,21 (2Н, м, СН 2-СН3), 1,25 (3Н, т, J=7,1, CH2-CH 3, 0,25 (18Н, с, 2×(CH 3)3Si). 31Р-ЯМР, CDCl3, 162 МГц: -25,3 с), 6-8% дихлорангидрида этоксикарбонилфосфоновой кислоты (1Н-ЯМР, CDCl3,400 МГц: 4,50 (2Н, м, СH 2-СН3), 1,37 (3Н, т, J=7,2, CH2-CH 3). 31Р-ЯМР, CDCl3, 162 МГц: 10,1 с) и около 3% неидентифицированных фосфорсодержащих примесей. Использование данного фосфонилирующего реагента ранее известно не было.
При получении хлорангидрида триметилсилильного эфира этоксикарбонилфосфоновой кислоты оптимальным избытком триметилбромсилана является 3,5-4,0 моль на 1 моль триэтилфосфоноформиата. При меньших количествах реакция не проходит до конца, поэтому в конечном продукте имеется примесь этилового эфира аминокарбонилфосфоновой кислоты (по данным 31Р-ЯМР-спектроскопии). В результате оптимизации не было установлено существенной разницы между использованием тионилхлорида и пятихлористого фосфора в реакции получения фосфонилирующего реагента, однако необходимо отметить, что тионилхлорид берут в избытке, а пентахлорид фосфора - в недостатке. Это связано с тем, что тионилхлорид в условиях протекания реакции (при комнатной температуре) может заместить на С1 только один триметилсилильный остаток, а его избыток легко удалить упариванием в вакууме. В то же время, избыток пентахлорида фосфора приводит к увеличению образования дихлорангидрида этоксикарбонилфосфоновой кислоты, а непрореагировавший пентахлорид фосфора нельзя удалить из реакционной массы без использования перегонки или хроматографической очистки.
Способ получения 5'-аминокарбонилфосфонатов нуклеозидов согласно изобретению осуществляется следующим образом.
К охлажденному до -4-0°С раствору фосфонилирующего реагента в инертном апротонном растворителе (ацетонитрил, диоксан, тетрагидрофуран, дихлорэтан, хлороформ, хлористый метилен) приливают по каплям диметилформамид (4-5 моль на 1 моль нуклеозида), перемешивают 20-30 мин при той же температуре, затем добавляют порциями нуклеозид, перемешивают 3-6 ч при температуре -4-0°С и оставляют на 18-24 ч при температуре 0-4°С до окончания фосфонилирования (окончание фосфонилирования определяют методом ТСХ). Реакционную смесь охлаждают до температуры -20 - -18°С, добавляют охлажденный 25% водный аммиак, перемешивают 3-6 ч при температуре -12 - -8°С и приливают свежую порцию аммиака, после чего выдерживают при температуре 0-4°С до окончания аммонолиза (окончание аммонолиза определяют методом ТСХ). Реакционную массу трижды экстрагируют хлороформом, упаривают в вакууме досуха и дважды переупаривают с изопропанолом. Остаток растворяют в метаноле, перемешивают 20-30 мин и фильтруют через фильтр. Осадок на фильтре последовательно промывают изопропанолом и ацетоном, тщательно отжимают и очищают хроматографией на силикагеле (в качестве элюента используют систему хлороформ-метанол-водный аммиак). Целевые фракции упаривают в вакууме досуха. В результате получают чистый водный аммиак). Целевые фракции упаривают в вакууме досуха. В результате получают чистый 5'-аминокарбонилфосфонат нуклеозида (чистота по данным ВЭЖХ - 97-99%) с выходом 60-65% в пересчете на исходный нуклеозид, а также около 30% технического продукта (чистота по данным ВЭЖХ - 86-88%), пригодного для повторной очистки.
Структура и чистота полученных соединений доказана с помощью методов ВЭЖХ, УФ-, ИК- и ЯМР-спектроскопии.
В предлагаемом способе используется принципиально новый фосфонилирующий реагент - хлорангидрид триметилсилильного эфира этоксикарбонилфосфоновой кислоты, который получают последовательной обработкой триэтилфосфоноформиата сначала триметилбромсиланом, а затем пентахлоридом фосфора или тионилхлоридом. В отличие от вышеописанного метода, получаемый продукт реакции не требует дополнительной перегонки в глубоком вакууме, что приводит к значительному упрощению технологического процесса.
Было установлено, что оптимальным количеством является 1,7-2,0 моль фосфонилирующего реагента на 1 моль нуклеозида: меньшее количество не приводит к полной утилизации нуклеозида, большее - увеличивает количество этоксикарбонилфосфоновой кислоты в конечном продукте, что сильно затрудняет очистку.
Использование на стадии фосфонилирования избытка диметилформамида в диапазоне 4-5 моль на 1 моль нуклеозида позволяет снизить количество инертного апротонного растворителя, в более концентрированном растворе реакция протекает быстрее, с меньшим количеством побочных продуктов. Следует отметить, что диметилформамид повышает растворимость фосфонилированного продукта в реакционной массе. При меньшем количестве диметилформамида необходимо увеличение объемов растворителя, а дальнейшее увеличение - осложняет последующую экстракцию, и, следовательно, технологически нецелесообразно.
Целевые 5'-аминокарбонилфосфонаты очищают препаративной колоночной хроматографией на силикагеле, используемой в промышленности. В качестве элюента используются системы на основе хлороформа и метанола, которые легко удаляются отгонкой в вакууме при низких температурах, а добавление в элюент небольшого количества аммиака позволяет контролировать pH.
Для лучшего понимания сущности изобретения ниже приводятся примеры его конкретного исполнения.
Пример 1. К раствору триэтилфосфоноформиата (37 г, 33 мл, 0,18 моль) в четыреххлористом углероде (75 мл) при температуре -10°С порциями приливают триметилбромсилан (100 г, 86 мл, 0,65 моль) и перемешивают 30 мин при этой же температуре. Затем выдерживают 18 ч при комнатной температуре. Реакционную смесь упаривают на роторном испарителе, переупаривают с четыреххлористым углеродом (2×25 мл). К остатку, содержащему биссилиловый эфир этоксикарбонилфосфоновой кислоты (52,5 г, 0,18 моль), при температуре 0°С добавляют тионилхлорид (90 г, 54 мл, 0,76 моль) и перемешивают 18 ч при комнатной температуре. Реакционную смесь, содержащую хлорангидрид триметилсилильного эфира этоксикарбонилфосфоновой кислоты, упаривают на роторном испарителе, переупаривают с четыреххлористым углеродом (2×25 мл). К охлажденному до -4°С раствору фосфонилирующего реагента (52,5 г, 0,18 моль) в ацетонитриле (25 мл) добавляют по каплям диметилформамид (29,2 г, 31 мл, 0,4 моль), перемешивают 30 мин при температуре -4°С. Затем при температуре -4°С порциями добавляют 3'-азидо-3'-дезокситимидин (26,7 г, 0,1 моль), перемешивают 4 ч при температуре -4°С и оставляют на 18 ч при температуре 4°С. Реакционную смесь охлаждают до температуры -18°С, добавляют 250 мл охлажденного 25% водного аммиака и перемешивают в течение 4 ч при температуре -10°С. Затем добавляют свежую порцию аммиака (25 мл) и выдерживают при температуре 4°С до окончания аммонолиза (контроль по ТСХ, пластинки "Merck" Kieselgel 60 F254, система хлороформ-метанол-водный аммиак 30:9:1). К реакционной смеси добавляют хлороформ (100 мл), перемешивают 20 мин и разделяют слои. Процедуру экстракции повторяют еще два раза. Водный слой упаривают на роторном испарителе, переупаривают с изопропанолом (25 мл). К остатку добавляют 90 мл метанола, перемешивают 30 мин и фильтруют. Осадок на фильтре дополнительно промывают изопропанолом (50 мл) и ацетоном (50 мл), тщательно отжимают и очищают хроматографией на силикагеле (элюент: хлороформ-метанол-водный аммиак в объемном соотношении 20:10:1). Целевые фракции упаривают досуха на роторном испарителе. В результате получают 25 г 5'-аминокарбонилфосфоната 3'-азидо-3'-дезокситимидина (чистота 97% по данным ВЭЖХ, выход 62% в пересчете на исходный нуклеозид) и 12,7 г технического 5'-аминокарбонилфосфоната 3'-азидо-3'-дезокситимидина (чистота 86% по данным ВЭЖХ, выход 28% в пересчете на исходный нуклеозид).
Время удерживания на колонке Luna 100 С18(2)) 150×4,6 мм - 2,4 мин (элюент - 0,05 М водный раствор ацетата аммония-ацетонитрил в объемном соотношении 8:1, температура колонки 40°С, скорость потока 1 мл/мин).
УФ-спектр (вода): λmax 266,5 нм (ε 9800).
ИК-спектр, ν, см-1: 3400 (NH2), 2100 (N3), 1700 (С=O), 1265 (Р=O).
1Н-ЯМР (D2O), м.д.: 7,56 (1Н, уш.с, Н6), 6,12 (1H, т, J 6,7 Гц, Н1'), 4,38 (1H, м, Н3'), 4,09 (3Н, м, Н4', Н5'), 2,38 (2Н, т, J 6,2 Гц, Н2'), 1,79 (3Н, с, 5-СН3).
31Р-ЯМР (D2O), м.д.: -1,56 (с).
13С-ЯМР (D2O), м.д.: 176,2 (д, 1JC,P 209,0 Гц, С(О)Р), 166,8 (с, С4), 152,0 (с, С2), 137,9 (с, С6), 112,1 (с, С5), 85,6 (с, С1'), 83,5 (д, 3JC,P 6,9 Гц, С4'), 65,6 (д, 2JC,P 5,3 Гц, С5'), 61,0 (с, С3'), 36,9 (с, С2'), 12,1 (с, 5-Ме).
Пример 2. К раствору триэтилфосфоноформиата (37 г, 33 мл, 0,18 моль) в четыреххлористом углероде (75 мл) при температуре 0°С порциями приливают триметилбромсилан (100 г, 86 мл, 0,65 моль) и перемешивают 30 мин при этой же температуре. Затем выдерживают 18 ч при комнатной температуре. Реакционную смесь упаривают на роторном испарителе, переупаривают с четыреххлористым углеродом (2×25 мл). К остатку, содержащему биссилиловый эфир этоксикарбонилфосфоновой кислоты (52,5 г, 0,18 моль), при температуре 0°С, добавляют небольшими порциями пятихлористый фосфор (34,8 г, 0,167 моль) и перемешивают 18 ч при комнатной температуре. Реакционную смесь, содержащую хлорангидрид триметилсилильного эфира этоксикарбонилфосфоновой кислоты, упаривают на роторном испарителе, переупаривают с четыреххлористым углеродом (2×25 мл). Далее процесс осуществляют, как описано в примере 1. В результате получают 25 г 5'-аминокарбонилфосфоната 3'-азидо-3'-дезокситимидина (чистота 97% по данным ВЭЖХ, выход 62% в пересчете на исходный нуклеозид) и 12,7 г технического 5'-аминокарбонилфосфоната 3'-азидо-3'-дезокситимидина (чистота 86% по данным ВЭЖХ, выход 28% в пересчете на исходный нуклеозид).
Пример 3. К раствору фосфонилирующего реагента (14,97 г, 61,18 ммоль), полученного как описано в примере 1, в диоксане (100 мл) добавляют по каплям диметилформамид (10,21 г, 139,7 ммоль) и перемешивают 30 мин при температуре 0°С. Затем при температуре 0°С порциями добавляют 2',3'-дидезокси-3'-тиацитидин (10 г, 43,62 ммоль). Реакционную смесь перемешивают 4 ч при температуре -0°С и оставляют на 18 ч при той же температуре. Реакционную смесь охлаждают до температуры -20°С, добавляют 250 мл охлажденного 25% водного аммиака и перемешивают в течение 4 ч при этой же температуре. Затем выдерживают при температуре 4°С до окончания аммонолиза (контроль по ТСХ, пластинки "Merck" Kieselgel 60 F254, система хлороформ-метанол-водный аммиак 10:10:1). К реакционной смеси добавляют хлороформ (50 мл), перемешивают 20 мин и разделяют слои. Процедуру экстракции повторяют еще два раза. Водный слой упаривают досуха на роторном испарителе и переупаривают с изопропанолом (25 мл). К остатку добавляют 40 мл метанола, перемешивают 30 мин и фильтруют. Осадок на фильтре дополнительно промывают изопропанолом (20 мл) и ацетоном (20 мл), тщательно отжимают и очищают хроматографией на силикагеле (элюент: хлороформ-метанол-водный аммиак в объемном соотношении 10:10:1). Целевые фракции упаривают досуха на роторном испарителе. В результате получают 9,5 г 5'-аминокарбонилфосфоната 2',3'-дидезокси-3'-тиацитидина (чистота 96% по данным ВЭЖХ, выход 59% в пересчете на исходный нуклеозид) и 5,6 г технического 5'-аминокарбонилфосфоната 2',3'-дидезокси-3'-тиацитидина (чистота 88% по данным ВЭЖХ, выход 32% в пересчете на исходный нуклеозид).
Время удерживания на колонке Kromasil 100 С18(2) 250×4,6 мм - 2,7 мин (элюент - 0,05 водный раствор ацетата аммония-ацетонитрил в объемном соотношении 15:1, температура колонки 40°С, скорость потока 1 мл/мин).
УФ-спектр (вода): λmax 271 нм (ε 9400).
1Н-ЯМР (D2O), м.д.: 8,14 д (1Н, J 7,8 Гц, H6), 6,30 дд (1Н, J 4,4 и 4,6 Гц, Н1'), 6,11 д (1H, J 7,8 Гц, Н5), 5,44 м (1H, Н4'), 4,36 м (1Н, Н5'а), 4,23 м (1Н, Н5'δ), 3,56 м (1H, Н2'а), 3,24 м (1H, Н2'δ).
31Р-ЯМР (D2O), м.д.: - 1,65 (с).
13С-ЯМР (D2O), м.д.: 176,2 (д, 1JC,P 208,8 Гц, С(О)Р), 165,9 (с, С4), 156,6 (с, С2), 142,5 (с, С6), 96,3 (с, С5), 88,0 (с, С1'), 84,8 (д, 3JC,P 7,2 Гц, С4'), 66,5 (д, 2JC,P 4,8 Гц, С5'), 37,4 (с, С2').
1. Способ получения 5'-аминокарбонилфосфонатов 3'-азидо-3'-дезокситимидина и 2',3'-дидезокси-3'-тиацитидина, включающий взаимодействие фосфонилирующего реагента с нуклеозидом в инертном апротонном растворителе и обработку промежуточных 5'-этоксикарбонилфосфонатов водным раствором аммиака, отличающийся тем, что в качестве фосфонилирующего реагента используют хлорангидрид триметилсилильного эфира этоксикарбонилфосфоновой кислоты, а фосфорилирование проводят в присутствии диметилформамида.
2. Способ получения хлорангидрида триметилсилильного эфира этоксикарбонилфосфоновой кислоты, заключающийся в последовательной обработке триэтилфосфоноформиата сначала триметилбромсиланом (3,5-4,0 моль на 1 моль триэтилфосфоноформиата), а затем пентахлоридом фосфора или тионилхлоридом при охлаждении (-4-0°С) с постепенным нагреванием до комнатной температуры.