Препаративные формы с контролируемым высвобождением
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики, конкретно к препаративной форме с контролируемым высвобождением на основе соединения формулы I, представляющего собой пероральный цитокиновый ингибитор фермента, превращающего интерлейкин-1 бета. Способ изготовления указанной препаративной формы включает гранулирование соединения формулы (I) в присутствии органического растворителя - изопропилового спирта. Стабильность соединения формулы (I) в органическом растворителе является такой, что растворитель не вызывает разложения более чем 5% соединения формулы (I) за 24 часа при комнатной температуре или ниже. Материал, полученный влажным гранулированием, имеет плотность от, приблизительно, 0,40 г/см3 до, приблизительно, 0,90 г/см3. Предложены варианты препаративной формы с контролируемым высвобождением, содержащей соединение формулы (I), подвергнутое гранулированию с изопропиловым спиртом. Группа изобретений благодаря проведению влажного гранулирования соединения формулы (I) перед полным смешением со всеми вспомогательными веществами обеспечивает получение гранул с улучшенной плотностью и текучестью. 7 н. и 83 з.п. ф-лы, 2 ил., 5 пр.
Реферат
Перекрестные ссылки
Данная заявка заявляет приоритет предварительной заявки США №60/809779, поданной 31 мая 2006.
Область техники, к которой относится изобретение
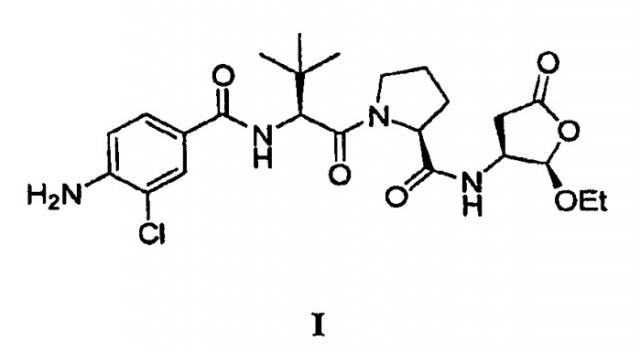
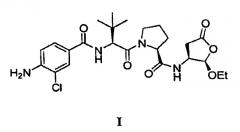
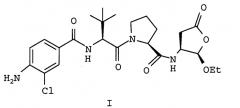
Соединение формулы (I),
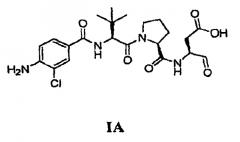
является оральным цитокиновым ингибитором фермента, превращающего интерлейкина-1 бета, которое предназначено для контролирования симптомов и прогрессирования воспалительных заболеваний, включая ревматоидный артрит и псориаз. Соединение (I) гидролизуется in vivo в соединение формулы (IA), показанного ниже
Исследования местной абсорбции соединения формулы (I) показали абсорбцию в толстой кишке.
Сущность изобретения
В общем, данное изобретение относится к препаративной форме с контролируемым высвобождением для перорального цитокинового ингибитора фермента, превращающего интерлейкин-1 бета. В одном аспекте данное изобретение относится к препаративной форме с контролируемым высвобождением и способам ее получения. В некоторых вариантах осуществления способ изготовления препаративной формы соединения формулы (I)
включает гранулирование соединения формулы (I) в присутствии органического растворителя; в котором (а) стабильность соединения формулы (I) является такой, что растворитель не вызывает разрушения более чем 5% (например, 2%) соединения формулы (I) за 24 часа при комнатной температуре или ниже, (b) влажный гранулированный материал имеет собственную величину растворения меньше чем, приблизительно, 0,15 мг/мин/см2 и (с) материал, полученный влажным гранулированием, имеет плотность от, приблизительно, 0,20 г/см3 до, приблизительно, 0,90 г/см3.
Варианты осуществления этих аспектов могут включать один или более из следующих признаков. Плотность материала, полученного влажным гранулированием, может быть от, приблизительно, 0,50 г/см3 до, приблизительно, 0,90 г/см3. Органический растворитель может быть изопропиловым спиртом. Соединение формулы (I) может быть подвергнуто влажному гранулированию с органическим растворителем и первым связывающим агентом, где первый связывающий агент может быть легко растворен как в используемом во влажном гранулировании органическом растворителе, так и в воде. Первый связывающий агент может содержать гидроксипропилцеллюлозу (например, от, приблизительно, 0,5 мас.% до, приблизительно, 10 мас.% или, приблизительно, 5 мас.%) или поливинилпирролидон (например, от, приблизительно, 1 мас.% до, приблизительно, 20 мас.%). Смесь для гранулирования может содержать, по крайне мере, 40 мас.% соединения формулы (I). Смесь для гранулирования можно составлять со вторым связующим агентом, таким как полиметакрилат или этилцеллюлоза, пористым агентом, таким как лактоза или маннит, веществом, способствующим скольжению, таким как тальк и смазывающим веществом, таким как натрия стеарилфумарат. Смесь для гранулирования можно составлять с от, приблизительно, 0 мас.% до, приблизительно, 20 мас.% второго связывающего агента; от, приблизительно, 0 мас.% до, приблизительно, 20 мас.% пористого агента; от, приблизительно, 0,1 мас.% до, приблизительно, 4 мас.% вещества, способствующего скольжению; от, приблизительно, 0,1 мас.% до, приблизительно, 3 мас.% смазывающего агента. Смесь для гранулирования можно составлять с от, приблизительно, 5 мас.% до, приблизительно, 20 мас.% второго связывающего агента; от, приблизительно, 10 мас.% до, приблизительно, 20 мас.% пористого агента; от, приблизительно, 1 мас.% до, приблизительно, 2 мас.% вещества, способствующего скольжению; от, приблизительно, 0,5 мас.% до, приблизительно, 3 мас.% смазывающей добавки. Гранулированные смеси или смеси составления для гранулирования можно таблетировать для получения гранул. Гранулированную смесь или составленную смесь для гранулирования можно таблетировать до степени твердости от, приблизительно, 5 кПа до, приблизительно, 16,0 кПа.
В некоторых аспектах препаративная форма может высвобождать соединение формулы (I) в течение, приблизительно, 8 часов (например, ±2 часа) в тесте на растворимость, таком как описан в примере 1. Например, препаративная форма может высвобождать от, приблизительно, 70% до, приблизительно, 90% соединения формулы (I) через, приблизительно, 8 часов в тесте на растворимость. Препаративная форма может высвобождать менее чем, приблизительно, 40%, например, от 5% до 40%,
соединения формулы (I) в течение первых 100 минут в испытании на собственное растворение. Препаративная форма может высвобождать менее чем, приблизительно, 65%, например, от 20% до 60%, соединения формулы (I) в течение первых 300 минут в тесте на растворимость. Препаративная форма может высвобождать от, приблизительно, 60% до, приблизительно, 80%, соединения формулы (I) в течение первых 600 минут в тесте на растворимость.
Конкретные препаративные формы могут содержать, приблизительно, 69,8 мас.% соединения формулы (I), приблизительно, 1,6 мас.% HPC EXF, приблизительно, 10 мас.% Aqualon T10, приблизительно, 16,5 мас.% Pearlitol 200 SD, приблизительно, 1,4 мас.% талька и, приблизительно, 0,7 мас.% SSF. Смесь для гранулирования может содержать, приблизительно, 69,8 мас.% соединения формулы (I), приблизительно, 1,6 мас.% Klucel EXF, приблизительно, 15 мас.% Eudragit RL PO, приблизительно, 11,5 мас.% Pearlitol 200 SD, приблизительно, 1,4 мас.% талька и, приблизительно, 0,7 мас.% SSF. Другая препаративная форма может содержать, приблизительно, 94,8 мас.% соединения формулы (I), приблизительно, 2,2 мас.% Klucel EXF, приблизительно, 1,9 мас.% талька и, приблизительно, 1,1 мас.% SSF. Еще другая препаративная форма может содержать, приблизительно, 95% и, приблизительно, 5 мас.% HPC EXF. Еще другая препаративная форма может содержать, приблизительно, 97% и, приблизительно, 3 мас.% HPC EXF.
Предпочтительно, чтобы соединение формулы (I) при влажном гранулировании обеспечивало увеличенную плотность, дающую улучшенные свойства текучести.
В данном описании, соединение формулы (I) включает свободную форму этого соединения и его фармацевтически приемлемые соли. Термин «органический растворитель» включает любой растворитель, за исключением воды. Примеры органического растворителя включают, без ограничения, изопропиловый спирт, гексан и ацетон. Термин «мас.%» относится к процентам масс. Как используется в данном описании, термин «связывающий агент» (или взаимозаменяемо «замедляющий полимер» или «матричный полимер») относится к агентам, которые можно использовать в качестве носителя для доставки соединения формулы (I) контролируемым способом. Подходящие агенты могут быть растворимыми или нерастворимыми в воде. Примеры подходящих агентов включают, без ограничений, Aqualon T10 этилцеллюлозу (Hercules), Klucel гидроксипропилцеллюлозу (HPC), EXF (Hercules), Klucel HPC, JXF (Hercules), Klucel HPC, MXF (Hercules), Klucel HPC, HXF (Hercules), Eudragit RL PO, полиметакрилат (Degussa) и Avicel PH113, микрокристаллическую целлюлозу (FMC). Термин «с контролируемым высвобождением» или «с замедленным высвобождением» относится к высвобождению лекарственного средства или пролекарства из его носителя со скоростью и способом, который отличен от естественной скорости или носителя, обычно медленнее и обычно, предпочтительно, более линейно или близко к линейной. Когда высвобождение увеличивается на длительный период времени (например, 10 часов) линейным способом (например, при скорости, которая близка к скорости в продолжение всего процесса высвобождения), его также называют «замедленным высвобождением».
Если не определенно обратное, все термины в данном описании должны иметь те же значения, как и в данной области техники. Все цитируемые в данном описании публикации включены полностью с помощью ссылки.
Подробное описание чертежей
На фигуре 1 показаны кривые собственного растворения трех препаративных форм в виде таблеток данного изобретения.
На фигуре 2 показаны кривые собственного растворения трех препаративных форм в виде гранул данного изобретения.
Подробное описание изобретения
В общем препаративные формы с контролируемым высвобождением настоящего изобретения содержат соединение формулы (I) во влажно-гранулированном виде. Гранулы соединения формулы (I) можно приготовить хорошо известными в данной области техники способами, смотри, например, Pharmaceutics: The Science of Dosage Form Design, изданной Michael E. Aulton, Churchill Livingstone (Edinburgh; New York), 2002; и Cyclodextrins in Pharmacy, Karl-Heinz Frömming and József Szejtli, Kluwer Academic Publisher (Dordrecht; Boston), 1994.
В некоторых вариантах осуществления гранулы соединения формулы (I) изготавливают влажным гранулированием с неводным растворителем, таким как органический растворитель. Обычно, для влажного гранулирования соединения формулы (I) можно использовать любой растворитель при условии, что полученная в результате величина собственного растворения таблеток, приготовленных из материала, полученного влажным гранулированием, составляет меньше, чем величина собственного растворения аналогичных таблеток, приготовленных из чистой формы соединения формулы (I), например величина собственного растворения составляет меньше чем 0,15 мг/мин/см2, например, приблизительно, 0,095 мг/мин/см2. Величину собственного растворения можно измерить в воде при 37°С согласно U.S. Pharmacopeia (USP) рекомендациям, например, как представлено на сайте .
В некоторых вариантах осуществления, по крайне мере, 50% соединения формулы (I) высвобождается из гранул, описанных выше, в течение первых 10 часов в тесте на растворимость in vitro, как измерено способом, известным в данной области техники. Примером походящего метода является USP протокол для препаративных форм с замедленным высвобождением в аппарате 2 (смотри, например, ). Альтернативный способ включает использование лопастного способа при 50 об/мин в течение вплоть до 10 часов. В еще другом способе величины растворения in vitro можно определить, используя ВЭЖХ, чтобы оценить растворенные количества соединения формулы (I) и его метаболитов. Количество выделившегося соединения можно определить, например, сравнением суммарной площади пиков с площадью для внешнего стандарта. Примеры колонок, которые можно использовать в этом способе, включают Waters Symmetry C-18 50×4,6 мм, 3,5 мкм колонка (PN# WAT200625) с подвижной фазой, состоящей из воды, метанола, ацетонитрила и pH 5,0 фосфатного буфера в условиях градиентного элюирования. Обнаружение можно проводить с помощью поглощения ультрафиолетового излучения (UV) при 280 нм. Полученные в результате образцы из обоих способов можно анализировать с помощью ВЭЖХ. Также можно использовать другие известные в данной области техники способы, чтобы получить профиль высвобождения из гранул соединения формулы (I) или каждой препаративной формы, содержащей соединение формулы (I). Смотри, например, Controlled Drug Delivery: Fundamentals and Applications, 2nd Edition, J.R. Robinson and V.H.L.Lee Marcel Dekker (New York), 1987. Например, образец препаративной формы можно помещать в водную среду и концентрацию соединения формулы (I) в среде можно определять, например, измерением активности фермента, превращающего интерлейкин-1 бета, - фермента-мишени соединения формулы (I).
В некоторых вариантах осуществления можно использовать любой органический растворитель для влажного гранулирования соединения формулы (I) при условии, если: (а) стабильность соединения формулы (I) в органическом растворителе является такой, что растворитель не вызывает разрушения более чем 5% соединения формулы (I) за 24 часа при комнатной температуре или ниже, (b) влажный гранулированный материал имеет собственную величину растворения меньше чем, приблизительно, 0,15 мг/мин/см2 и (с) влажный гранулированный материал имеет плотность от, приблизительно, 0,20 г/см3 до, приблизительно, 0,90 г/см3, например, от, приблизительно, 0,5 до, приблизительно, 0,65 г/см3. Увеличение плотности гранулированного материала относительно негранулированного материала приводит к улучшенным характеристикам текучести, которые облегчают обработку процесса изготовления, таком как создание препаративной формы. Объемную плотность и плотность после гранулирования можно измерить с помощью мерного цилиндра. Можно использовать величины объемной плотности (pB) и плотности утряски (pt), чтобы рассчитать коэффициент сжимаемости (% сжимаемости), который отражает свойства текучести материала. % сжимаемости можно вычислить с помощью следующей формулы: % сжимаемости =[(pt-pb)/pt]×100%. Смотри, например, The theory and practice of industrial pharmacy, L.Lachman, H.Lieberman, and J.Kanig, в Varghese Publishing House, 3rd Indian Edition, (Hind Rajasthan Bldng, Dagar Bombay 400014), 1987, p.184. Также текучесть материала можно вычислить Flodex анализом. Прибор для испытаний Flodex является идеальным для определения собственной текучести порошков (который рекомендуют для качественного контроля порошков). Прибор Flodex включает полный набор дисков индекса текучести с отверстиями различного диаметра. Испытуемый порошок течет через отверстие. Способность порошка протекать через отверстие отражает свойства текучести испытуемого порошка. Смотри, например, Composite Method to Quantify Powder Flow as a Screening Method in Early Tablet or Capsule Formulation Development, Michael K.Taylor, Jery Ginsburg, Anthony Hickey and Ferdous Gheyas, in AAPS PharmSciTech, 2000, 1(3): article 18.
В определенных вариантах осуществления соединение формулы (I) подвергают влажному гранулированию с изопропиловым спиртом (IPA).
В общепринятых подходах влажного гранулирования большинство вспомогательных веществ для таблеток, таких как наполнители, связующие и замедляющие высвобождение полимеры, обычно смешивают с лекарственным веществом перед гранулированием. В отличие от общепринятых способов, материал соединения формулы (I) подвергают влажному гранулированию перед полным смешением со всеми вспомогательными веществами препаративных форм, чтобы преодолеть низкую плотность и плохую текучесть негранулированного материала, получая гранулы со значительно улучшенными плотностью и текучестью. Полученные в результате гранулы легко смешать с различными матричными полимерами и другими вспомогательными веществами, чтобы получить препаративные формы с контролируемым высвобождением.
В некоторых вариантах осуществления соединение формулы (I) подвергают влажному гранулированию с органическим растворителем, таким как IPA, и полученные в результате гранулы смешивают со вспомогательными веществами и другими компонентами препаративных форм с контролируемым высвобождением. В других вариантах осуществления соединение формулы (I) и первый связующий агент подвергают влажному гранулированию. В еще некоторых других вариантах осуществления соединение формулы (I) можно гранулировать с растворителем без связывающих агентов.
Первый связывающий агент может быть любым агентом, который растворяется как в органическом растворителе, используемом для влажного гранулирования, так и в воде. Примеры первого связующего агента включают, без ограничений, гидроксипропилцеллюлозу (HPC) и поливинилпирролидон (PVP).
Количество первого связующего компонента, используемого во влажном гранулировании, может быть любым количеством, которое дает полученные в результате гранулы, имеющие размер в диапазоне от, приблизительно, 150 мкм до, приблизительно, 500 мкм, содержащие более чем 90% соединения формулы (I), и имеющие плотность от 0,35 до, приблизительно, 0,70 г/см3. В определенных вариантах осуществления соединение формулы (I) подвергают влажному гранулированию с Klucel HPC EXF или PVP (10% в растворе IPA). В некоторых вариантах осуществления соединение формулы (I) подвергают влажному гранулированию с от, приблизительно, 0,5 мас.% до, приблизительно, 10 мас.%, например, с, приблизительно, 5 мас.% Klucel HPC EXF или от, приблизительно, 1% до, приблизительно, 20%, например, с приблизительно, 10% PVP в растворителе IPA.
Перед гранулированием сыпучий материал соединения формулы (I) можно просеивать, например, используя 500 мкм сита.
В некоторых вариантах осуществления гранулы соединения формулы (I) можно смешивать со связующим агентом и, не обязательно, другими известными в фармацевтике вспомогательными веществами (например, другими связующими агентами, пористыми агентами или наполнителем), чтобы получить фармацевтическую препаративную форму. При водной среде такая фармацевтическая препаративная форма обычно способна высвобождать соединение формулы (I) контролируемым способом. Кроме того, в зависимости от типа связующих агентов и других вспомогательных веществ и массового отношения гранул соединения формулы (I) и связующих агентов и других вспомогательных веществ, фармацевтическая препаративная форма может обеспечивать замедленное высвобождение соединения формулы (I) с определенной концентрацией в течение продолжительного периода времени, например, в течение, по крайне мере, 8 часов или от 8 до 10 часов, так что высвобождается от, приблизительно, 70% до, приблизительно, 90% соединения формулы (I). Профиль высвобождения соединения формулы (I) можно изменить, подбирая тип и количество связующих агентов и других вспомогательных веществ, содержащихся в препаративной форме, твердость таблеток и гранул. В некоторых вариантах осуществления препаративной формы с контролируемым высвобождением обеспечивают высвобождение менее чем, приблизительно, 40%, например, от, приблизительно, 5% до, приблизительно, 40% соединения формулы (I) в первые 100 минут после помещения в растворяющую среду, как измерено с помощью методологии растворения, описанной в данном описании. В определенных аспектах этих вариантов осуществления препаративной формы с контролируемым высвобождением обеспечивают высвобождение менее чем, приблизительно, 40%, например, от, приблизительно, 5% до, приблизительно, 40% соединения формулы (I) за первые 100 минут, и высвобождение менее чем, приблизительно, 65%, например, от, приблизительно, 20% до, приблизительно, 60% соединения формулы (I) за первые 300 минут. В других аспектах этих вариантов осуществления препаративной формы с контролируемым высвобождением обеспечивают высвобождение менее чем, приблизительно, 40%, например, от, приблизительно, 5% до, приблизительно, 40% соединения формулы (I) за первые 100 минут, высвобождение менее чем, приблизительно, 65%, например, от, приблизительно, 20% до, приблизительно, 60% соединения формулы (I) за первые 300 минут, и высвобождение от, приблизительно, 60% до, приблизительно, 80% соединения формулы (I) за первые 600 минут. В других вариантах осуществления препаративной формы с контролируемым высвобождением обеспечивают высвобождение менее чем, приблизительно, 25%, например, от, приблизительно, 5% до, приблизительно, 20% соединения формулы (I) за первые 100 минут.
Еще в других вариантах осуществления способ формулирования гранул, содержащих соединение формулы (I), можно проводить в отсутствии органического или водного растворителя, например, сухим гранулированием. Как результат, таким образом, полученные гранулы могут содержать, приблизительно, 100 мас.% соединения формулы (I), которые могут также обладать теми же особенностями или свойствами, как описанные в данном описании.
Фармацевтические препаративные формы можно перерабатывать в форму таблеток или гранул для перорального приема. Препаративные формы в виде таблеток и препаративные формы в виде гранул содержат от, приблизительно, 300 мг, до, приблизительно, 1000 мг соединения формулы (I).
Препаративные формы с замедленным высвобождением, которые дают близкое к линейному высвобождение соединения формулы (I) в течение, приблизительно, 10 часов, включают гранулы или таблетки гранул, полученные в результате влажного гранулирования соединения формулы (I) с менее чем 35 мас.% гидроксипропилцеллюлозы. В некоторых вариантах осуществления таблетки, содержащие препаративные формы с замедленным высвобождением, имеют твердость менее чем 10кПа, например, таблетки имеют твердость от, приблизительно, 6,5 до, приблизительно 9,0 кПа. В некоторых вариантах осуществления твердость таблеток составляет от, приблизительно, 7,0 кПа до, приблизительно, 9,0 кПа.
Препаративная форма может также содержать дополнительные вспомогательные вещества, включая, без ограничений, дополнительные связующие агенты, например полиметакрилат или этилцеллюлозу; пористые агенты, например лактозу или маннит; вещества, способствующие скольжению, например тальк; и смазывающие вещества, например натрия стеарилфумарат (SSF).
В некоторых вариантах осуществления препаративная форма, содержащая соединение формулы (I) после влажного гранулирования, содержит второй связующий агент в количестве от, приблизительно, 0 мас.% до, приблизительно, 20 мас.%, например от 5 мас.% до, приблизительно, 20 мас.%; пористого агента в количестве от 0 мас.% до, приблизительно, 20 мас.%, например, от, приблизительно, 10 мас.% до, приблизительно, 20 мас.%; вещества, способствующего скольжению в количестве, от, приблизительно, 0,1 мас.% до, приблизительно, 4 мас.%, например, от, приблизительно, 1 мас.% до, приблизительно, 2 мас.%; и смазывающее вещество в количестве от, приблизительно, 0,1 мас.% до, приблизительно, 3 мас.%, например, от, приблизительно, 0,5 мас.%, до, приблизительно, 1,5 мас.%.
Примеры данного изобретения, не предназначенные для того, чтобы ограничивать объем заявленного изобретения, а представлены с целью иллюстрации.
Пример 1: Величины растворимости
Тест на растворимость был взят из статьи фармакопеи США о растворимости. Аппарат 2 (лопастной способ) применяли при 50 об/мин в течение вплоть до 10 часов. Анализы полученных образцов проводили ВЭЖХ.
С помощью ВЭЖХ способа определяли количество соединения формулы (I) и его метаболитов, присутствующих в растворенном образце, используя Waters Symmetry C-18, 50×4,6 мм, 3,5 м колонку (Part No. WAT200625) с подвижной фазой, состоящей из воды, метанола, ацетонитрила и фосфатного буфера pH 5,0 в условиях градиентного элюирования. При потоке 2,5 мл/мин и температуре колонки 45°С время удержания соединения формулы (I) и его метаболитов было, приблизительно, 3,7 минуты и 1,5 минуты, соответственно. Детектирование проводили с помощью поглощения УФ-света при 280 нм. Высвобождение соединения формулы (I) рассчитывали сравнением суммарной площади пиков соединения формулы (I) и его метаболитов с внешним стандартом - раствором соединения формулы (I).
Пример 2: Сыпучий негранулированный материал
Сыпучий материал соединения формулы (I) выделяли в виде белого порошка с некоторыми агрегатами. Вначале материал просеивали через 500 мкм сита. Обнаружили, что плотность просеянного через 500 мкм сита материала составляет, приблизительно, 0,24 г/см3 с очень плохой текучестью. Строение материала исследовали с помощью оптического микроскопа и обнаружили, что большая часть сыпучего материала агрегируется из намного более мелких кристаллов. Эти агрегаты являются высокопористыми и, следовательно, являются причиной низкой насыпной плотности и плохой текучести, которая делает прямое прессование в таблетки очень сложным.
Пример 3: Влажное гранулирование соединения формулы (I)
Чтобы приготовить гранулы соединения формулы (I) влажным гранулированием, сыпучий материал соединения формулы (I) (просеянный через 500 мкм сита) помещали в ступку и, затем, добавляли по каплям раствор первого связующего агента (например, HPC EXF при 5 мас.% или PVP при 10 мас.%) в изопропиловом спирте и смешивали, используя пестик до достижения полного гранулирования. Затем массу вручную пропускали через сита (например, 1,18 мм) и сушили при комнатной температуре в течение ночи. Затем гранулы пропускали через более мелкие сита (например, 500 мкм) до разрушения агрегатов. Большие частицы можно размалывать, используя ступку и пестик и, снова, просеивая через более мелкие сита. Затем таким образом полученные гранулы просеивали снова, чтобы удалить фракцию порошка, а именно, например, с размерами, меньшими чем 150 мкм. Объемную плотность, плотность гранул и текучесть конечных гранул можно исследовать, как описано выше. Гранулы соединения формулы (I) хранили в емкости из желтого стекла при комнатной температуре.
По сравнению с сыпучей формой соединения формулы (I), гранулы, полученные влажным гранулированием, имеют более высокую плотность и лучшую текучесть и, таким образом, более подходят для приема высоких доз. Например, в зависимости от количества используемого в гранулах связующего агента и длины гранул, плотность гранул соединения формулы (I) можно увеличить до, например, более чем 0,4 г/см3 (например, 0,5-0,65 г/см3) от, приблизительно, 0,2 г/см3 в естественной форме.
Пример 4: Приготовление таблеток для контролируемого высвобождения соединения формулы (I)
Следующие таблетки приготовляли, используя материал, полученный влажным гранулированием, и вспомогательные вещества:
| Таблетки | Композиция/таблетка | Размер таблетки | Твердость |
| 991-26-1 | Влажное гранулирование: соединение формулы (I) (600 мг, 69,8%) и HPC EXF (1,6%) с IPA, Aqualon T10 (10,0%), Pearticol 200 SD (16,5%), тальк (1,4%), SSF (0,7%) | 18×9 мм860 мг | 7,6 кПа |
| 991-26-5 | Влажное гранулирование: соединение формулы (I) (600 мг, 69,8%) и Klucel EXF (1,6%) с IPA, Eudragit RL PO (15,0%), Pearticol 200 SD (11,5%), тальк (1,4%), SSF (0,7%) | 18×9 мм860 мг | 8,6 кПа |
| 991-26-6 | Влажное гранулирование: соединение формулы (I) (600 мг, 94,8%) и Klucel EXF (2,2%), тальк (1,9%), SSF (1,1%) | 18×9 мм633 мг | 7,8 кПа |
Фигура 1 показывает профили растворения в течение 10 часов. Три таблетки показывали хорошие профили растворения, т.е. близкие к линейным, высвобождая от, приблизительно, 70% до, приблизительно, 80% соединения формулы (I) в течение 10- часового периода.
Пример 5: приготовление препаративных форм в гранулах
Гранулы приготовляли в 30-граммном масштабе. Фракция гранулометрического состава препаративной формы в гранулах была 800/1180 мкм. Детали препаративных форм в виде гранул включены в следующую таблицу. Исследовали плотность конечных гранул и гранулы хранили в пробирке перед испытанием на растворение.
Следующие гранулы приготовляли, используя материал, полученный влажным гранулированием, как показано ниже:
| Препаративная форма | Ингредиенты | Плотность гранул (г/см 3 ) |
| 991-29-2 | Влажное гранулирование соединения формулы (I) с HPC EXF (95:5) в IPA | 0,51 |
| 991-29-3 | Влажное гранулирование соединения формулы (I) с HPC JXF (97:3) в IPA | 0,62 |
| 991-31-1 | Влажное гранулирование соединения формулы (I) с IPA | 0,61 |
Фигура 2 показывает профили растворения препаративных форм 991-29-2, 991-29-3 и 991-31-1 в течение 10 часов. Три препаративные формы в гранулах показали хорошие профили растворения, т.е. почти линейные, высвобождая от, приблизительно, 60% до, приблизительно, 80% соединения формулы (I) в течение 10-часового периода.
Другие варианты осуществления
Очевидно, что, когда данное изобретение описывают вместе с подробным его описанием, вышеуказанное описание предназначено для того, чтобы проиллюстрировать, а не ограничить объем данного изобретения, которое определяется объемом формулы изобретения. Другие аспекты, преимущества и модификации включены в объем настоящего изобретения.
1. Способ изготовления препаративной формы с контролируемым высвобождением на основе соединения формулы (I) включающий гранулирование соединения формулы (I) в присутствии органического растворителя, представляющего собой изопропиловый спирт; в котором (а) стабильность соединения формулы (I) в органическом растворителе является такой, что растворитель не вызывает разложения более чем 5% соединения формулы (I) за 24 ч при комнатной температуре или ниже, и (b) материал, полученный влажным гранулированием, имеет плотность от приблизительно 0,40 г/см3 до приблизительно 0,90 г/см3.
2. Способ по п.1, в котором плотность материала, полученного влажным гранулированием, составляет от приблизительно 0,50 г/см3 до приблизительно 0,90 г/см3.
3. Способ по п.1, в котором соединение формулы (I) подвергают влажному гранулированию с органическим растворителем и первым связывающим агентом, в котором первый связывающий агент растворяют как в используемом при влажном гранулировании органическом растворителе, так и в воде.
4. Способ по п.3, в котором первый связывающий агент содержит гидроксипропилцеллюлозу или поливинилпирролидон.
5. Способ по п.4, в котором материал, полученный влажным гранулированием, содержит от приблизительно 0,5 мас.% до приблизительно 10 мас.% гидроксипропилцеллюлозы.
6. Способ по п.5, в котором материал, полученный влажным гранулированием, содержит приблизительно 5 мас.% гидроксипропилцеллюлозы.
7. Способ по п.4, в котором материал, полученный влажным гранулированием, содержит от приблизительно 1 мас.% до приблизительно 20 мас.% поливинилпирролидона в органическом растворителе.
8. Способ по п.1, в котором формулированная смесь для гранулирования содержит, по крайней мере, 40 мас.% соединения формулы (I).
9. Способ по п.8, в котором формулированная смесь для гранулирования содержит, по крайней мере, 85 мас.% соединения формулы (I).
10. Способ по п.1, дополнительно включающий формулирование смеси для гранулирования со вторым связывающим агентом.
11. Способ по п.10, в котором второй связывающий агент включает полиметакрилат или этилцеллюлозу.
12. Способ по п.1, дополнительно включающий формулирование смеси для гранулирования с пористым агентом.
13. Способ по п.12, в котором пористый агент включает лактозу или маннит.
14. Способ по п.1, дополнительно включающий формулирование смеси для гранулирования с веществом, способствующим скольжению.
15. Способ по п.14, в котором вещество, способствующее скольжению, включает тальк.
16. Способ по п.1, дополнительно включающий формулирование смеси для гранулирования со смазывающим веществом.
17. Способ по п.16, в котором смазывающее вещество включает натрия стеарилфумарат.
18. Способ по п.1, дополнительно включающий формулирование смеси для гранулирования со вторым связывающим агентом, пористым агентом, веществом, способствующим скольжению, и смазывающим веществом.
19. Способ по п.18, в котором второй связывающий агент включает полиметакрилат или этилцеллюлозу, пористый агент включает лактозу или маннит, вещество, способствующее скольжению, включает тальк, и смазывающее вещество включает натрия стеарилфумарат.
20. Способ по п.19, в котором смесь для гранулирования формулируют с от приблизительно 0 мас.% до приблизительно 20 мас.% второго связывающего агента; от приблизительно 0 мас.% до приблизительно 20 мас.% пористого агента; от приблизительно 0,1 мас.% до приблизительно 4 мас.% вещества, способствующего скольжению; от приблизительно 0,1 мас.% до приблизительно 3 мас.% смазывающего вещества.
21. Способ по п.20, в котором смесь для гранулирования формулируют с от приблизительно 5 мас.% до приблизительно 20 мас.% второго связывающего агента; от приблизительно 10 мас.% до приблизительно 20 мас.% пористого агента; от приблизительно 1 мас.% до приблизительно 2 мас.% вещества, способствующего скольжению; от приблизительно 0,5 мас.% до приблизительно 1,5 мас.% смазывающего вещества.
22. Способ по п.1, в котором сформулированная смесь для гранулирования содержит приблизительно 69,8 мас.% соединения формулы (I), приблизительно 1,6 мас.% гидроксипропилцеллюлозы, приблизительно 10 мас.% этилцеллюлозы, приблизительно 16,5 мас.% маннита, приблизительно 1,4 мас.% талька и приблизительно 0,7 мас.% натрия стеарилфумарата.
23. Способ по п.1, в котором сформулированная смесь для гранулирования содержит приблизительно 69,8 мас.% соединения формулы (I), приблизительно 1,6 мас.% гидроксипропилцеллюлозы, приблизительно 15 мас.% полиметакрилата, приблизительно 11,5 мас.% маннита, приблизительно 1,4 мас.% талька и приблизительно 0,7 мас.% натрия стеарилфумарата.
24. Способ по п.1, в котором составленная смесь для гранулирования содержит приблизительно 94,8 мас.% соединения формулы (I), приблизительно 2,2 мас.% гидроксипропилцеллюлозы, приблизительно 1,9 мас.% талька и приблизительно 1,1 мас.% натрия стеарилфумарата.
25. Способ по п.1, в котором сформулированная смесь для гранулирования содержит приблизительно 95% соединения формулы (I) и приблизительно 5 мас.% гидроксипропилцеллюлозы.
26. Способ по п.1, в котором составленная смесь для гранулирования содержит приблизительно 97% соединения формулы (I) и приблизительно 3 мас.% гидроксипропилцеллюлозы.
27. Способ по п.1, в котором гранулированную смесь или сформулированную смесь для гранулирования таблетируют до твердости от приблизительно 6,5 кПа до приблизительно 16,0 кПа.
28. Способ по п.1, дополнительно включающий образование гранул с гранулированной смесью или сформулированной смесью для гранулирования.
29. Способ по п.27 или 28, в котором препаративная форма высвобождает соединение формулы (I) через приблизительно 8 ч в тесте на растворимость.
30. Способ по п.27 или 28, в котором препаративная форма высвобождает от приблизительно 70% до приблизительно 90% соединения формулы (I) через приблизительно 8 ч в тесте на растворение.
31. Способ по п.27 или 28, в котором препаративная форма высвобождает менее чем приблизительно 40% соединения формулы (I) в течение первых 100 мин в тесте на растворимость.
32. Способ по п.31, в котором препаративная форма высвобождает от приблизительно 5% до приблизительно 40% соединения формулы (I) в течение первых 100 мин в тесте на растворимость.
33. Способ по п.27 или 28, в котором препаративная форма высвобождает менее чем приблизительно 65% соединения формулы (I) в течение первых 300 мин в тесте на растворимость.
34. Способ по п.33, в котором препаративная форма высвобождает от приблизительно 20% до приблизительно 60% соединения формулы (I) в течение первых 300 мин в тесте на растворимость.
35. Способ по п.27 или 28, в котором препаративная форма высвобождает от приблизительно 60% до приблизительно 80% соединения формулы (I) в течение первых 600 мин в тесте на растворимость.
36. Способ по п.1, в котором, по крайней мере, 50% соединения формулы (I) высвобождается из гранулированной смеси или формулированной смеси для гранулирования в течение первых 10 ч в тесте на растворимость.
37. Препаративная форма с контролируемым высвобождением, содержащая материал, полученный влажным гранулированием, который содержит соединение формулы (I) и органический растворитель, представляющий собой изопропиловый спирт, в которой материал, полученный влажным гранулированием, показывает плотность от приблизительно 0,40 г/см3 до приблизительно 0,90 г/см3.
38. Препаративная форма с контролируемым высвобождением по п.37, в которой материал, полученный влажным гранулированием, показывает плотность от приблизительно 0,50 до приблизительно 0,90 г/см3.
39. Препаративная форма с контролируемым высвобождением по п.37, в которой материал, полученный влажным гранулированием, дополнительно содержит первый связывающий агент, в которой первый связывающий агент растворяют как в используемом при влажном гранулировании органическом растворителе, так и в воде.
40. Препаративная форма с контролируемым высвобождением по п.37, в которой первый связывающий агент содержит гидроксипропилцеллюлозу или поливинилпирролидон.
41. Препаративная форма с контролируемым высвобождением по п.40, в которой материал, полученный влажным гранулированием, содержит от приблизительно 0,5 мас.% до приблизительно 10 мас.% гидроксипропилцеллюлозы.
42. Препаративная форма с контролируемым высвобождением по п.41, в которой материал, полученный влажным гранулированием, содержит приблизительно 5 мас.% гидроксипропилцеллюлозы.
43. Препаративная форма с контролируемым высвобождением по п.40, в которой материал, полученный влажным гранулированием, содержит от приблизительно 1 мас.% до приблизительно 20 мас.% поливинилпирролидона.
44. Препаративная форма с контролируемым высвобождением по п.37, в которой смесь, полученная влажным гранулированием, содержит, по крайней мере, 85 мас.% соединения формулы (I).
45. Препаративная форма с контролируемым высвобождением по п.37, дополнительно включающая второй связывающий агент.
46. Препаративная форма с контролируемым высвобождением по п.45, в которой второй связывающий агент включает полиметакрилат или этилцеллюлозу.
47. Препаративная форма с контролируемым высвобождением по п.45, дополнительно включающая пористый агент.
48. Препаративная форма с контролируемым высвобожд