Способ детекции 17 мутаций генов gjb2 и gjb6 при наследственной несиндромальной глухоте
Иллюстрации
Показать всеИзобретение относится к области медицинской генетики и может быть использовано в оториноларингологии для диагностики наследственной несиндромальной глухоты (ННГ). Предложен способ молекулярно-генетической диагностики ННГ, предусматривающий детекцию 17 связанных с данным заболеванием мутаций в генах GJB2 и GJB6 с помощью ПЦР-амплификации соответствующих областей этих генов, которую проводят в 8 реакционных смесях с использованием специфических пар праймеров, и последующего анализа полученных ампликонов, проводимого либо без предварительного расщепления эндонуклеазами (при определении мутаций c.312del14, c.333-334delAA, ΔGJB6-D13S1830, ΔGJB6-D13S1854), либо после гидролиза соответствующими специфическими рестриктазами (при определении мутаций IVS1+1G>A, c.35delG, c.71G>A, c.79G>A, c.167delT, c.235delC, c.224G>A, c.299-300delAT, c.360delGAG, c.341A>G, c.269T>C, c.101T>C, c.109G>A). Использование изобретения позволяет получить точный, объективный диагноз наследственной аутосомно-рецессивной потери слуха. 2 табл., 8 ил., 3 пр.
Реферат
Способ молекулярно-генетической диагностики наследственной несиндромальной глухоты относится к медицине, а именно к медицинской генетике и оториноларингологии.
Среди всех идентифицированных генов, вовлеченных в функционирование системы звуковосприятия, наиболее значимыми являются гены белков-коннексинов 26 (GJB2) и 30 (GJB6), вклад которых в развитие несиндромальных и некоторых синдромальных форм, по данным различных авторов, составляет до 80% [Petersen et. al., 2006]. Известны также случаи дигенного наследования по мутациям генов GJB2 и GJB6 [Pallarez-Ruez et al., 2002; del Castillo et al., 2005; Fieldmanet al., 2009; Wlch et al., 2010], картированных в одном локусе - DFNB1 (13q11-q12). Поскольку получены высокие частоты встречаемости мутаций генов GJB2 и GJB6 у больных наследственной несиндромальной глухотой [Джемилева с соавт., 2005; 2006; 2009; Posukh et al., 2005; Барашков с соавт., 2007, 2008], молекулярно-генетическое исследование спектра мутаций в генах GJB2 и GJB6 является актуальным для оценки риска возникновения сенсоневральной глухоты в семьях с отягощенным наследственным анамнезом, а также разработки схем дородовой диагностики повреждений генов GJB2 и GJB6 у плода.
Предлагаемый способ основан на молекулярно-генетических методах исследования с помощью проведения полимеразной цепной реакции с 6-ю оригинальными и 2-мя известными последовательностями олигонуклеотидов, перекрывающих необходимые участки нуклеотидной последовательности, содержащих мутации генов GJB2 и GJB6, приводящих к несиндромальной сенсоневральной глухоте. Олигонуклеотидные праймеры сконструированы таким образом, что при обработке продуктов полимеразной цепной реакции специфичными эндонуклеазами рестрикции, амплифицированные фрагменты узнаются и разрезаются или не узнаются и не расщепляются при приобретении или утрате сайтов рестрикции в результате мутаций. Полученные фрагменты распределяются в зависимости от их молекулярного веса в полиакриламидном геле под действием электрического тока. Результаты визуализируются в УФ-свете.
Известны способы детекции мутаций генов GJB2 и GJB6 при секвенировании всей кодирующей области гена или его фрагментов, с помощью предложенных ранее праймеров (Kelsell D.P., Dunlop J., Stevens H.P., et al. Connexin 26 mutations in hereditary nonsyndromic sensorineural deafness. Nature. 1997; 387: 80-83.; Kelley P.M., Harris D.J., Comer B.C. et al. Novel mutations in the connexin 26 gene (GJB2) that cause autosomal recessive (DFNB1) hearing loss. // Am. J. Hum. Genet. 1998; 62: 792-799.; Zelante L., Gasparini P., Estivill X., et al. Connexin 26 mutations associated with the most common form of non-syndromic neurosensory autosomal recessive deafness (DFNB1) in Mediterranean. Hum. Mol. Genet. 1997; 6: 1605-1609).
Однако молекулярно-генетические методы, применяемые при подобном способе детекции, являются трудоемкими и требуют наличия технологически сложного оборудования (секвенатор) и пакета программ для обработки данных, соответствующих дорогостоящих расходных материалов, наличия специализированного штата сотрудников для технического обслуживания и работы прибора. В связи с этим данный способ может употребляться только в крупных медицинских центрах страны и достаточно проблематичен для рутинного исследования в обычных лечебно-профилактических учреждениях.
Сложность создания рутинных методов исследования для детекции мутаций генов GJB2 и GJB6 заключается в том, что в настоящее время известно более 150 мутаций в генах GJB2 и GJB6, приводящих к наследственной несиндромальной глухоте. Большинство этих мутаций являются редкими, часть - этноспецифичными, а для некоторых мутаций существует определенный географический ареал их распространения. Мутация c.35delG с высокой частотой встречается, в основном, в популяциях Европы и Ближнего Востока [Gasparini et al., 2000; Хидиятова с соавт., 2002; Mahdieh et al., 2009]. Мутация c.235delC является мажорной для монголоидных популяций и встречается, в основном, в Восточной Азии - у японцев, китайцев, корейцев, регистрируется она также у монголов и алтайцев [Yan et al., 2003, Posukh et al., 2005; Tekin et al., 2010]. Мутация c.167delT распространена, преимущественно, среди евреев ашкенази, но встречается и у некоторых народов Средиземноморья, Восточной Европы, а спорадически и по всей Евразии [Morell et al., 1998, Джемилева с соавт.,
2009]. Мутация р.Trp24X наиболее распространена в Индии [Ramshankar et al., 2003], a p.Arg143Trp является мажорной мутацией в Гане (Африка) [Hammelman et al., 2001].
Таким образом, в различных регионах Российской Федерации целесообразна разработка оптимальных алгоритмов детекции наиболее часто встречающихся в данном регионе мутаций. Кроме того, техническая сложность применения способов детекции мутаций генов GJB2 и GJB6 заключается в том, что не во всех областях этих генов имеются естественные сайты рестрикции для известных эндонуклеаз, поэтому аллель-специфичная идентификация некоторых мутаций, таких как c.35delG, p.Val37Ile и p.Met34Thr невозможна при применении классических подходов к ПДРФ-анализу.
Наиболее близким аналогом молекулярно-генетической диагностики наследственной несиндромальной глухоты является диссертационная работа, опубликованная в 2007 году (Барашков Н.А. «Молекулярно-генетическое изучение наследственной несиндромальной сенсоневральной глухоты в Республике Саха (Якутия)», Уфа, 2007).
Согласно разработанных в данной работе способов и алгоритма ДНК-диагностики наследственной глухоты, лишь некоторые мутации гена GJB2 (c.35delG, c.167delT, c.235delC) и гена GJB6D (GJB6D13S1830) возможно идентифицировать с помощью рутинных методов молекулярно-генетического исследования (ПЦР и ПДРФ-анализ), а остальные мутации предлагается идентифицировать с помощью SSCP-анализа с последующим секвенированием образцов с измененной конформационной подвижностью. Основным недостатком ближайшего аналога является то, что применение предложенного способа SSCP-анализа гена GJB2 из-за ограничений в специфичности в конечном итоге требует секвенирования образцов ДНК, что как было указано выше практически не применимо в большинстве лечебно-профилактических учреждений РФ. При использовании данного алгоритма ДНК-диагностики 80% мутантных аллелей у больных наследственной несиндромальной сенсоневральной глухотой не было идентифицировано.
Техническим результатом предлагаемого изобретения является повышение точности ДНК-тестирования при наследственной несиндромальной глухоте, за счет разработки диагностического теста на 15 наиболее часто встречающихся мутаций - q.-3179 (IVS1+1G>A), c.35delG, c.71G>A, c.79G>A, c.167delT, c.235delC, c.224G>A, c.299-300delAT, c.312del14, c.333-334delAA, c.360delGAG, c.341A>G, c.269T>C, c.101T>C, c.109G>A гена GJB2 и двух мутаций ΔGJB6-D13S1830, ΔGJB6-D13S185 гена GJB6 (Пример 1), с помощью выделения геномной ДНК с последующей полимеразной цепной реакцией, ПДРФ-анализом (в том числе с искусственно созданными сайтами рестрикции, для тех мутаций, для которых отсутствуют естественные сайты узнавания известных эндонуклеаз) и электрофоретическим разделением продуктов гидролиза в полиакриламидном геле и визуализацией результатов в ультрафиолетовом свете у больных наследственной несиндромальной глухотой (Таблица 1).
Положительным эффектом при применении предлагаемого диагностического теста является расширение спектра кандидатов, что связано с увеличением общего числа мутаций, включенных в диагностическую панель (17 мутаций). Спектр мутаций, включенных в предлагаемый диагностический тест, основано на проведенных молекулярно-генетических исследованиях с помощью различных методов молекулярно-генетического анализа (ПЦР/ПДРФ, SSCP-анализ, DHPLC-анализ и прямое секвенирование) из трех регионов Российской Федерации (Волго-Уральский регион, Республика Алтай, Якутия) (Пример 1). В целом предлагаемый спектр из 15 мутаций гена GJB2 и двух мутаций гена GJB6 покрывает около 55% мутантных аллелей выявленных у больных наследственной несиндромальной глухотой в РФ (Пример 1), что увеличивает точность предлагаемой тест системы по сравнению с ближайшим аналогом, где с помощью различных методов исследования (ПЦР/ПДРФ/SSCP и прямое секвенирование) было идентифицировано около 20% мутантных аллелей.
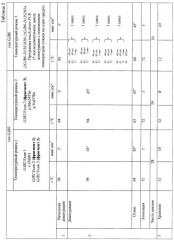
Указанный технический результат достигается тем, что в способе, включающем выделение ДНК из лимфоцитов периферической крови методом фенольно-хлороформной экстракции, проведение полимеразной цепной реакции с последующей детекцией в 8-10%-ных полиакриламидных гелях и визуализацией в ультрафиолетовом спектре после окрашивания раствором бромистого этидия, амплифицируют последовательно восемь участков генов GJB2 и GJB6 в восьми реакционных смесях из десяти пар последовательностей олигонуклеотидов (IVS1+1G>A) (F) 5'
Способ осуществляется следующим образом
ДНК выделяют из лимфоцитов периферической крови. В качестве консерванта используют раствор следующего состава: 0,48% лимонной кислоты, 1,32% цитрата натрия, 1,47% глюкозы. При заборе крови к 1 мл консерванта добавляют 4 мл венозной крови и хорошо перемешивают.
Для получения ДНК необходимой степени чистоты и достаточного молекулярного веса используется метод выделения ДНК из крови фенольно-хлороформной экстракцией, описанный Метью (Mathew С.С. The isolation of high molecular weight eucariotic DNA. // Methods in Molecular Biology. / Ed. Walker J.M.Y.L.: Human Press. 1984. - V.2. - P.31-34).
1. Кровь в пробирке с консервантом тщательно перемешивается и переливается в центрифужный стакан объемом 50 мл, туда же добавляем 30 мл охлажденного лизирующего буфера, содержащего 320 мМ сахарозы, 1% раствор тритона Х-100, 5 мМ MgCl2, 10 мМ трис HCl (рН 7,6).
2. Смесь центрифугируется 20 мин при 4000 об/мин.
3. Надосадочную жидкость сливают, к получившемуся осадку приливают 0,4 мл 10% SDS и протеиназу К (концентрация 10 мг/мл). Смесь для лизиса оставляют на 16 часов в термостате при температуре 37°С.
Экстракцию ДНК осуществляют в следующем порядке:
4. К лизату добавляют 0,5 мл фенола, насыщенного 1М трис HCl до рН 7,8.
5. Смесь встряхивают на шейкере и центрифугируют 10 мин при 6000 об/мин.
6. Отбирают водную фазу, содержащую ДНК и неденатурированные белки.
7. Отобранную фазу обрабатывают смесью фенол-хлороформа (1:1), а затем хлороформом.
8. Препараты осаждают двумя объемами охлажденного этанола 96%.
9. Образовавшийся осадок ДНК растворяют в 1,5 мл деионизированной Н2О; раствор хранят при -20°С.
В дальнейшем полученную ДНК используют в качестве матрицы для полимеразной цепной реакции (ПНР) для амплификации нужного фрагмента региона генов GJB2 и GJB6. Специфические последовательности олигонуклеотидных праймеров для детекции мутаций IVS1+1G>A, c.35delG, c.71G>A, c.79G>A, c.167delT, c.235delC, c.224G>A, c.299-300delAT, c.312del14, c.333-334delAA, c.360delGAG, c.341A>G, c.269T>C, c.101T>C, c.109G>A гена GJB2 и мутаций ΔGJB6-D13S1830, ΔGJB6-D13S1854 гена GJB6 и их оптимальные концентрации в реакционной смеси подобраны с помощью пакета биологических программ DNASTAR (Primer select 5.05 1993-2002). Используются следующие последовательности олигонуклеотидов: (IVS1+1G>A) (F) 5'
Способ осуществляется с применением стандартного состава реакционной смеси: 0,8 мкг геномной ДНК, соответствующее кол-во каждого олигонуклеотида, 125 мкМ каждого дезоксинуклеозидтрифосфата (Promega, USA) помещают в 12,5 мкл однократного буфера для ПЦР следующего состава: 67 mM Tris-HCl, рН 8.8, 6.7 тМ MgCl2, 16,6 mM (NH4)2SO4, 0.01% Tween-20. К полученной смеси прибавляют 5 единиц термофильной ДНК-полимеразы, 20-30 мкл стерильного минерального масла. Применяют три режима амплификации: 1) предварительная денатурация 5 минут при 94°С, затем 28 циклов со следующими параметрами - 94°С - 45 секунд, 64°С - 45 секунд, 72°С - 1 минута. После 28-го цикла проводят инкубацию при 72°С в течение 10 минут 2) предварительная денатурация 5 минут при 94°С, затем 29 циклов со следующими параметрами - 94°С - 45 секунд, 65°С - 45 секунд, 72°С - 1 минута. После 29-го цикла проводят инкубацию при 72°С в течение 10 минут. 3) предварительная денатурация 5 минут при 95°С, затем один цикл со следующими параметрами - 94°С - 40 секунд, 65°С - 40 секунд, 72°С - 1 минута, затем один цикл со следующими параметрами - 94°С - 40 секунд, 64°С - 40 секунд, 72°С - 1 минута, затем один цикл со следующими параметрами - 94°С - 40 секунд, 63°С - 40 секунд, 72°С - 1 минута, затем один цикл со следующими параметрами - 94°С - 40 секунд, 62°С - 40 секунд, 72°С - 1 минута и, наконец, 30 циклов со следующими параметрами - 94°С - 40 секунд, 60°С - 45 секунд, 72°С - 1 минута затем После 30-го цикла проводят инкубацию при 72°С в течение 10 минут.
При амплификации с олигонуклеотидными праймерами (IVS1+1G>A) (F) 5' ccgggaagctctgaggacccagagg 3', (R) 5' tggccgggcagtccggggccggcgggctga 3', при температурном режиме 1 (Таблица 2), с последующей обработкой по протоколу производителя эндонуклеазой Kzo9I после разделения продуктов рестрикции в 4%-ном агарозном геле в 0,5% трис-ацетатном буферном растворе в течении 25 минут при напряжении поля в 100 В, детекция на электрофореграмме аллелей в 320 п.н. и в 288 п.н. будет указывать на гетерозиготное носительство мутации IVS1+1G>A; детекция аллели в 320 п.н. - на гомозиготное состояние по мутации IVS1+1G>A (Фигура 1). При амплификации с олигонуклеотидными праймерами (c.35delG) (F) 5' tacatttaatcctatgacaaa 3' (R), 5' tttccaatgctggtggagtgtttgttcccacc 3', при температурном режиме 1 (Таблица 2), с последующей обработкой по протоколу производителя эндонуклеазой BslI после разделения продуктов рестрикции в 4%-ном агарозном геле в 0,5% трис-ацетатном буферном растворе в течении 25 минут при напряжении поля в 100 В, детекция на электрофореграмме аллелей в 290 п.н. и в 270 п.н. будет указывать на гетерозиготное носительство мутации c.35delG, аллели в 320 п.н. - на гомозиготное состояние по мутации c.35delG (Фигура 2); при амплификации с олигонуклеотидными праймерами (GJB2 Exon 2, фрагмент 1) (F) 5 ttcgtcttttccagagcaaa 3', (R) 5' gacacgaagatcagctgcag 3', при температурном режиме 1 (Таблица 2), с последующей обработкой по протоколу производителя эндонуклеазами AMI и BstFSI после разделения продуктов рестрикции в 8%-ном акриламидном геле в 1% трис-боратном буферном растворе в течении 2 часов при напряжении поля в 300 В, детекция на электрофореграмме аллелей в 276 п.н., 168 п.н. и в 108 п.н. будет указывать на гетерозиготное носительство мутации р.Trp24X, аллелей в 168 п.н. и 108 п.н. - гомозиготное состояние по мутации р.Trp24X (Фигура 3А); наличие аллелей в 247 п.н., 141 и в 106 п.н. будет указывать на гетерозиготное носительство полиморфного варианта p.Val27Ile, аллели в 141 п.н. и 106 п.н. - гомозиготное состояние по полиморфному варианту p.Val27Ile (Фигура 3Б); при амплификации с олигонуклеотидными праймерами (GJB2 Exon 2, фрагмент 2) (F) 5' ttggaaagatctggctcacc 3', (R) 5' ctcccccttgatgaacttcc 3', при температурном режиме 1 (Таблица 2), с последующей обработкой по протоколу производителя эндонуклеазами PstI, Apal, MspI после разделения продуктов рестрикции в 8%-ном акриламидном геле в 1% трис-боратном буферном растворе в течении 2,5 часов при напряжении поля в 300 В, детекция на электрофореграмме аллелей в 181 п.н., 112 п.н., 91 п.н. и 69 п.н. будет указывать на гетерозиготное носительство мутации c.167delT, аллелей в 118 п.н. и 91 п.н. на - гомозиготное состояние по мутации c.167delT (Фигура 4А); наличие аллелей в 272 п.н., 176 п.н. и 96 п.н. будет указывать на гетерозиготное носительство мутации c.235delC, аллели в 272 п.н. на - гомозиготное состояние по мутации c.235delC (Фигура 4Б); наличие аллелей в 233 п.н., 164 п.н. и 69 п.н. будет указывать на гетерозиготное носительство мутации p.Arg75Gln, аллели в 233 п.н. на - гомозиготное состояние по мутации p.Arg75Gln (Фигура 4В); при амплификации с олигонуклеотидными праймерами (GJB2 Exon 2 фрагмент 3) (F) 5' ctagtggccatgcacgtggc 3', (R) 5' atctcctcgatgtccttaaa-3', при температурном режиме 2 (Таблица 2), с последующей обработкой по протоколу производителя эндонуклеазами HinlII, BseRIl, TasI, NlaIII после разделения продуктов рестрикции в 10%-ном акриламидном геле в 1% трис-боратном буферном растворе в течении 3 часов при напряжении поля в 300 В, детекция на электрофореграмме аллелей в 81 п.н. и 61 п.н. будет указывать на гетерозиготное носительство мутации с.299-300delAT, аллели в 81 п.н. на - гомозиготное состояние по мутации с.299-300delAT (Фигура 5А); наличие аллелей в 95 п.н. и 81 п.н. будет указывать на гетерозиготное носительство мутации c.312del14, аллели в 81 п.н. на - гомозиготное состояние по мутации c.312del14 (Фигура 5Б); наличие аллелей в 95 п.н. и 93 п.н. будет указывать на гетерозиготное носительство мутации c.333-334delAA, аллели в 93 п.н. на - гомозиготное состояние по мутации c.333-334delAA (Фигура 5В); наличие аллелей в 95 п.н. и 73 п.н. будет указывать на гетерозиготное носительство мутации p.Glu114Gly, аллели в 95 п.н. на - гомозиготное состояние по мутации p.Glu114Gly (Фигура 5Д); наличие аллелей в 95 п.н. и 91 п.н. будет указывать на гетерозиготное носительство мутации p.Leu95Pro, аллели в 95 п.н. - на гомозиготное состояние по мутации p.Leu95Pro (Фигура 5Е); при амплификации с олигонуклеотидными праймерами (p.Met34Trp) (F) 5' atctggctcaccgtcctcttcatttttcgcatca-3', (R) 5' tcgtagcacacgttcttgcagc 3' при температурном режиме 2 (Таблица 2), с последующей обработкой по протоколу производителя эндонуклеазой NlaIII после разделения продуктов рестрикции в 4%-ном агарозном геле в 0,5% трис-ацетатном буферном растворе в течении 25 минут при напряжении поля в 100 В, детекция на электрофореграмме аллелей в 131 п.н. и в 95 п.н. будет указывать на гетерозиготное носительство мутации p.Met34Thr, аллели в 131 п.н. на - гомозиготное состояние по мутации p.Met34Thr (Фигура 6); при амплификации с олигонуклеотидными праймерами (p.Val37Ile) (F) 5' tcttttccagagcaaaccgc 3', (R) 5' tgctcatctccccacacctcctttgcagcgtcaa 3' при температурном режиме 2 (Таблица 2), с последующей обработкой по протоколу производителя эндонуклеазой HindII после разделения продуктов рестрикции в 4%-ном агарозном геле в 0,5% трис-ацетатном буферном растворе в течении 25 минут при напряжении поля в 100 В, детекция на электрофореграмме аллелей в 131 п.н. и в 95 п.н. будет указывать на гетерозиготное носительство мутации p.Val37Ile; аллели в 131 п.н. на - гомозиготное состояние по мутации p.Val37Ile (Фигура 7); при амплификации с олигонуклеотидными праймерами (ΔGJB6-D13S1830/ΔGJB6-D13S1854) (GJB6-1R) 5' tttagggcatgattggggtgattt 3', (BKR-1), 5' caccatgcgtagccttaaccatttt 3', (DelBK1) 5' tcatagtgaagaactcgatgctgttt 3', (DelBK2) 5' cagcggctaccctagttgtggt 3', (Сх30Ех1А) 5' cgtctttgggggtgttgctt 3', (Сх30Ех1В) 5' catgaagagggcgtacaagttagaa 3', при температурном режиме 3 (Таблица 2) после разделения продуктов рестрикции в 4%-ном агарозном геле в 0,5% трис-ацетатном буферном растворе в течении 25 минут при напряжении поля в 100 В, детекция на электрофореграмме аллелей в 460 п.н. и в 333 п.н. будет указывать на гетерозиготное носительство мутации ΔGJB6-D13S1830 гена GJB6, аллели в 460 п.н. на - гомозиготное состояние по мутации ΔGJB6-D13S1830 гена GJB6 (Фигура 8 А); наличие аллелей в 564 п.н. и в 333 п.н. будет указывать на гетерозиготное носительство мутации ΔGJB6-D13S1854 гена GJB6 (Фигура 8 Б), аллели в 564 п.н. на - гомозиготное состояние по мутации ΔGJB6-D13S1854 гена GJB6 (Фигура 8 Б), наличие аллелей в 564 п.н. и в 460 п.н. будет указывать на компаунд-гетерозиготное носительство обеих мутаций ΔGJB6-D13S1854 и ΔGJB6-D13SI830 гена GJB6 (Фигура 8 Б).
Время исследования составляет 2 дня.
Пример 1
В качестве конкретных примеров обследовано в целом 320 больных с наследственными формами потери слуха, состоящих на учете по данному виду патологии в г.Уфе (n=158), г.Якутске (n=86), г.Горно-Алтайске (n=76), а также члены их семей и здоровые доноры, проживающие в Волго-Уральском регионе, Южной и Восточной Сибири.
В данной выборке больных были проведены молекулярно-генетические исследования с помощью различных методов молекулярно-генетического анализа (ПЦР/ПДРФ, SSCP-анализ, DHPLC-анализ и прямое секвенирование). В целом в исследованной выборке больных были идентифицированы 15 мутаций гена GJB2 IVS1+1G>A, c.35delG, c.71G>A, c.79G>A, c.167delT, c.235delC, c.224G>A, c.299-300delAT, c.312de114, c.333-334delAA, c.360delGAG, c.341A>G, c.269T>C, c.101T>C, c.109G>A и одна мутация ΔGJB6-D13SI830 гена GJB6.
Из 320 неродственных пробандов из Башкирии, Якутии и Алтая мутация c.35delG выявлена у 62 больных в гомозиготном состоянии (19,3%), в компаунд гетерозиготном состоянии с другими мутациями генов GJB2 и GJB6 (IVS1+10A, c.35delG, c.71G>A, c.79G>A, c.167delT, c.235delC, c.224G>A, c.299-300delAT, c.312de114, c.333-334delAA, c.360delGAG, c.341A>G, c.269T>C, c.101T>C, c.109G>A, ΔGJB6-D13S1830) - у 27 больных (8,75%). Таким образом, из 640 проанализированных хромосом 151 (23,6%) содержали мутацию c.35delG.
Мутация IVS1+1G>A гена GJB2 в гомозиготном состоянии была идентифицирована у 73 пациентов и у 23 пациентов данная мутация обнаружена в компаунд гетерозиготном состоянии с мутациями c.35delG, c.312del14, c.333-334delAA, p.Val27I1e+p.Glu114Gly с наследственной глухотой из Якутии и Башкирии. Мутация c.235delC была обнаружена у 2 неродственных пациентов с несиндромальной глухотой из Алтая в гомозиготном состоянии и у 4 больных из Башкортостана в компаунд гетерозиготном состоянии с мутациями c.35delG, c.312dell4 и c.167delT. Мутация c.312de114 была идентифицирована у 3 неродственных пациентов в гомозиготном состоянии из Башкирии и Алтая, и в компаунд гетерозиготном состоянии с мутациями c.35delG, c.235delC, c.299-300delAT и IVS1+1G>A у 12 человек. Мутация c.109G>A была выявлена у 2 пациентов из Якутии в гомозиготном состоянии. Мутация c.299-300delAT была обнаружена в компаунд гетерозиготном состоянии с мутацией c.35delG у четырех пациентов из Башкортостана.
На основании этого анализа у больных с идентифицированными мутациями генов GJB2 и GJB6 в гомозиготном и компаунд-гетерозиготном состоянии подтвержден диагноз - наследственной несиндромальной глухоты, и установлен тип наследования заболевания в семье - аутосомно-рецессивный. Таким образом, среди больных с несиндромальной потерей слуха наиболее частой причиной является мутационное повреждение гена GJB2, а наиболее частыми мутациями являются c.35delG, IVS1+1G>A, c.312dell4, c.235delC, p.Val37Ile и c.299-300delAT.
Общий вклад, идентифицированный мутаций генов GJB2 и GJB6, составил 55% в исследованной выборке больных. Полученные высокие значения частоты данных мутаций среди больных наследственной несиндромальной глухотой из Якутии, Башкирии и Алтая подтверждают важность определения этих мутаций в гене GJB2 при медико-генетическом консультировании пациентов с высоким риском рождения глухого ребенка.
Пример 2. Пациент А., 1990 год рождения, город Якутск, Республика Саха (Якутия). Диагноз двухсторонней сенсоневральной глухоты установлен в 1992 году. В настоящее время пациент использует слуховой аппарат. Наследственный анамнез отягощен. В семье имеется еще два разнополых пораженных сибса, родители слышащие, других известных глухих родственников нет. При молекулярно-генетическом тестировании у больного, его сибсов и родителей было взято по 8 мл венозной крови с последующим выделением ДНК и амплификацией семи участков гена GJB2 и двух участков гена GJB6 в реакционной смеси, содержащей 0,8 мкг геномной ДНК, соответствующее кол-во каждого олигонуклеотида, 125 мкМ каждого дезоксинуклеозидтрифосфата в 12,5 мкл однократного буфера для ПЦР. Затем полученные аплификаты были обработаны вышеуказанными эндонукеазами рестрикции в условиях указанных в протоколе производителя, затем провели электрофорез продуктов рестрикции в агарозных и полиакриламидных гелях при постоянном напряжении от 100 до 300 вольт. После окончания электрофореза гели окрашивали раствором бромистого этидия в течение 10 минут и проанализировали при ультрафиолетовом освещении. Исследование ДНК больного, его сибсов и родителей выявило гетерозиготное носительство мутации c.35delG у отца (аллели 290 пн и 270 пн), и гетерозиготное носительство мутации c.35delG у матери (аллели 290 пн и 270 пн). У пациента и его сибсов была выявлена мутация c.35delG (аллель в 290 п.н.), в гомозиготном состоянии, которая является причиной глухоты у всех исследованных детей данной семьи. Время исследования составило 2 дня.
Пример 3. Пациент Д.., 1986 года рождения, город Якутск, Республика Саха (Якутия). Диагноз двухсторонней сенсоневральной глухоты установлен в 1988 году. Наследственный анемнез отягощен. Со стороны мужа наследственность отягощена по врожденной глухоте. Также выявлены нарушения слуха у старшего брата пациента, у других сибсов слух в норме. Оба родителя - слышащие. При молекулярно-генетическом тестировании у больного, его сибсов и родителей было взято по 8 мл венозной крови с последующим выделением ДНК и амплификацией семи участков гена GJB2 и двух участков гена GJB6 в реакционной смеси, содержащей 0,8 мкг геномной ДНК, соответствующее кол-во каждого олигонуклеотида, 125 мкМ каждого дезоксинуклеозидтрифосфата в 12,5 мкл однократного буфера для ПЦР. Затем полученные аплификаты были обработаны вышеуказанными эндонукеазами рестрикции в условиях указанных в протоколе производителя, затем провели электрофорез продуктов рестрикции в агарозных и полиакриламидных гелях при постоянном напряжении от 100 до 300 вольт. После окончания электрофореза гели окрашивали раствором бромистого этидия в течение 10 минут и проанализировали при ультрафиолетовом освещении.
Исследование ДНК больного, его сибсов и родителей выявило гетерозиготное носительство мутации c.35delG у отца и одного из братьев (аллели 290 пн и 270 пн), гетерозиготное носительство мутации IVS1+1G>A идентифицировано у матери и одной из сестер (аллели в 320 пн и 288 пн). У пациента и его старшего глухого брата были выявлены обе мутации c.35delG (аллель в 290 п.н.) и IVS1+1G>A в компаунд гетерозиготном состоянии, которые явились причиной глухоты у двоих детей этой семьи. Время исследования составило 2 дня.
Пример 4.
Больной М.А., 1986 год рождения, город Нефтекамск, Республика Башкортостан. Диагноз нейросенсорной двухсторонней глухоты установлен в 1987 году. В настоящее время пациент использует слуховой аппарат. Со стороны родителей и ближайших родственников - наследственность отягощена - диагноз наследственной несиндромальной нейросенсорной тугоухости поставлен родителям пациента, его старшему брату и сестре. При молекулярно-генетическом тестировании у больного, его родителей и сибсов было взято по 8 мл венозной крови с последующим выделением ДНК и амплификацией трех участков 1 экзона гена GJB2 в реакционной смеси, содержащей 0,8 мкг геномной ДНК, соответствующее кол-во каждого олигонуклеотида, 125 мкМ каждого дезоксинуклеозидтрифосфата в 12,5 мкл однократного буфера для ПЦР. Затем провели электрофорез амплифицированных ПЦР-продуктов при постоянном напряжении 250-300 вольт. После окончания электрофореза гель окрасили раствором бромистого этидия в течение 10 минут и проанализировали при ультрафиолетовом освещении. Исследование ДНК больного, его сибсов и родителей выявило гетерозиготное носительство мутаций c.35delG у отца и у брата (аллели 290 пн и 270 пн), гетерозиготное носительство мутации 299-300delAT идентифицировано у матери и у сестры (аллели в 320 пн и 288 пн). У пациента были выявлены обе мутации c.35delG (аллель в 290 п.н.) и 299-300delAT (аллели в 81 п.н. и 61 п.н), которые явились причиной глухоты у двоих детей этой семьи. Время исследования составило 2 дня.
Способ молекулярно-генетической диагностики наследственной несиндромальной глухоты путем исследования образца ДНК пациента на наличие мутаций в генах GJB2 и GJB6, связанных с развитием указанного заболевания, с помощью ПЦР-амплификации соответствующих участков последовательности названных генов и последующего анализа полученных ампликонов, отличающийся увеличением числа включаемых в диагностическую панель мутаций до 17 и унификацией метода анализа ПЦР-продуктов, где амплификацию проводят в 8 реакционных смесях, используя олигонуклеотидные праймеры, представленные в таблице 1, а заключение составляют по результатам электрофоретического разделения ПЦР-продуктов, которое при определении мутаций c.312del14, с.333-334delAA, ΔGJB6-D13S1830, ΔGJB6-D13S1854 осуществляют без предварительного расщепления специфической рестриктазой, а при определении мутаций IVS1+1G>A, c.35delG, c.71G>A, c.79G>A, c.167delT, c.235delC, c.224G>A, c.299-300delAT, c.360delGAG, c.341A>G, c.269T>C, с.101Т>С и c.109G>A - после гидролиза эндонуклеазами рестрикции - Kzo9I, BslI, AluI, BstF5I, PstI, ApaI, MspI, HinlII, BseRI, TasI, NlaIII, NlaIII и HindIII, соответственно.