Способ получения -кетосульфонов и 1,4-дикетонов
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к способу получения β-кетосульфонов общей формулы Iа-д и 1,4-дикетонов IIа-ж
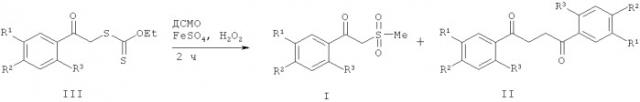
который заключается в том, что фенацилксантогенаты IIIа-ж в диметилсульфоксиде в присутствии сульфата железа (II) в соотношении фенацилксантогената IIIа-ж и сульфата железа (II) 1:1.1 моль обрабатывают 30% перекисью водорода в течение 2 ч при комнатной температуре, затем разбавляют реакционную массу водой. Выпавший осадок отфильтровывают и обрабатывают 1N раствором гидроксида натрия для получения 1,4-дикетона IIа-ж. Щелочной раствор фильтруют, подкисляют 30% серной кислотой до рН=4 для получения β-кетосульфона Iа-д. Технический результат - разработан новый способ, который позволяет синтезировать β-кетосульфоны и 1,4-дикетоны в одну стадию из дешевых исходных соединений при комнатной температуре, избегая токсичных органических реагентов. β-Кетосульфоны применяют в синтезе препаратов фармацевтического назначения и в качестве исходных реагентов в органическом синтезе. 1,4-Дикетоны используют в синтезе различных гетероциклов. 3 табл., 3 пр.
Реферат
Изобретение относится к области органической химии - новому методу синтеза β-кетосульфонов, которые применяют в синтезе препаратов фармацевтического назначения и в качестве реагентов в органическом синтезе, и 1,4-диарил-1,4-дикетонов, применяющихся в синтезе различных гетероциклов, например 2,5-диарилпирролов, 2,5-диарилтиофенов и 2,5-диарилфуранов - структурных единиц многих биологически активных соединений.
Изобретение относится к способу получения β-кетосульфонов общей формулы Iа-д, проявляющих фунгицидные свойства [M.W.Wolf. J. Mol. Struct., 1999, 474, 113-124] и, благодаря наличию в их структуре активного метиленового фрагмента, нашедших широкое применение в синтетической практике [E.S.Gladkov, V.A.Chebanov, S.M.Desenko, O.V.Shishkin, S.V.Shishkma, D.Dallmger, C.O.Kappe. Heterocycles, 2007, 73, p.469-480], [M.Takahashi, T.Mamiya, M.Wakao. J. Heterocyclic Chem., 1986, 23, p.77-80], [L.J.Powers, S.W.Fogt, Z.S.Ariyan, D.I.Rippin, R.D.Heilman, R.J.Matthews. J. Med. Chem. 1981, 24, 5, p.604-609], [H.Guo, Y.Zhang. Synth. Comm., 2000, 30 (14), 2559-2564], а также 1,4-дикетонов общей формулы IIа-ж, применяющихся в синтезе различных гетероциклов, например, 2,5-диарилфуранов [V.Amamath, К.Amamath. J. Org. Chem., 1995, 60, 2, p.301-307] - структурных единиц многих биологически активных соединений [D.J.Mortensen, A.L.Rodriguez, K.E.Carlson, J. Sun, B.S.Katzenellenbogen, J.A. Katzenellenbogen, J. Med. Chem., 2001, 44, 3838-3848], [I.Francesconi, W.D.Wilson, F.A.Tanious, J.E.Hall, B.C.Bender, R.R.Tidwell, D.McCurdy, D.W.Boykin, J. Med. Chem., 1999, 42, 2260-2265], [S.M.Rahmathullah, J.E.Hall, B.С.Bender, D.R.McCurdy, R.R.Tidwell, D.W.Boykin. J. Med. Chem., 1999, 42, 3994-4000], а также 2,5-диарилпирролов [D.C.Cole, J.R.Stock, R.Chopra, R.Cowling, J.W.Ellingboe, K.Y.Fan, B.L.Harrison, Y.Hu, S.Jacobsen, L.D.Jennings, G.Jin, P.A.Lohse, M.S.Malamas, E.S.Manas, W.J.Moore, M.O'Donnell, A.M.Olland, A.J.Robichaud, K.Svenson, J.J.Wu, E.Wagner, J. Bard. Bioorg. Med. Chem. Letters, 2008, 18 p.1063-1066] и 2,5-диарилтиофенов [E.Campaigne, W.O.Foye. J. Org. Chem., 1952, 17, 1405-1412].
| Соединение | R1 | R2 | R3 |
| Ia, IIа | Н | Br | Н |
| Iб, IIб | H | ОСН3 | H |
| Iв, IIв | Н | NO2 | H |
| Iг, IIг | Cl | Cl | H |
| Iд, IIд | Cl | Н | Cl |
| IIе | ОСН3 | ОСН3 | H |
| IIж | H | NHCOCH3 | H |
Традиционные методы синтеза β-кетосульфонов включают: ацилирование алкилсульфонов [W.E.Truce, R.H.Knospe. J. Am. Chem. Soc., 1955, 77, 5063-5067], [H.-D.Becker, G.A.Russell. J. Org. Chem., 1963, 28, 1896-1898], [M.L.Miles, C.R.Hauser. J. Org. Chem., 1964, 29, 2329-2331], [H.O.House, J.K.Larson. J. Org. Chem., 1968, 33, 61-65], [J.Einhom, J.L.Luche. J. Org. Chem., 1987, 52, 4124-4126], [M.W.Thomsen, B.M.Handworker, S.A.Katz, R.B.Belser. J. Org. Chem., 1988, 53, 906-907], [I.B.Douglass, F.J.Ward, R.V.Norton. J. Org. Chem., 1967, 32, 324-326], [C.Alvarez Ibarra, R.Cuervo Rodriguez, M.C.Femandez Monreal, F.J.Garcia Navarro, J.Matin Tesorero. J. Org. Chem., 1989, 54, 5620-5623], [A.R.Katritzky, A.A.A. Abdel-Fattah, M. Wang. J. Org. Chem., 2003, 68, 1443-1446], [W.E. Truce, W.W.Bannister, R.H.Knospe. J. Org. Chem., 1962, 27, 2821-2828], алкилирование сульфинатов [J.Wildeman, A.M.van Leusen. Synthesis, 1979, 733-734], [L.Field, J.W.McFarland. J. Am. Chem. Soc., 1953, 75, 5582-5586], [Y.-Y.Xie, Z.-C.Chen. Synth. Comm., 2001, 31(20), 3145-3149], окисление β-кетосульфидов и сульфоксидов [D.Scholz. Monat. Chem., 1981, 112, 241-243], [A.-L.Fan, S.Chao, Z.Zhang. J. Heterocyclic Chem., 1997, 34, 1657-1660], [F.Bohlmann, G.Haffer. Chem. Ber., 1969, 102, 4017-4024], синтезы с участием силиленольных эфиров [N.Kamigata, К.Udodaira, Т.Shimizu. J. Chem. Soc., Perkin Trans. 1, 1997, 783-786], [Y.Matano, N.Azuma, H.Suzuki. J. Chem. Soc., Perkin Trans. 1, 1994, 1739-1747], перегруппировку производных тиетандиоксида [W.O.Siegl, C.R.Johnson. J. Org. Chem., 1970, 35, 3657-3663], [R.A.Ferri, G.Pitacco, E.Valentin. Tetrahedron, 1978, 34, 2537-2543], [D.Young, C.J.M.Stirling. J. Chem. Soc., Perkin Trans. 1, 1997, 425-429], свободно-радикальную перегруппировку енолсульфонатов [W.Nagata, Т.Wakabayashi Y.Hayase, M.Narisada, S.Kamata. J. Am. Chem. Soc., 1970, 92, 3203-3205], присоединение сульфонилхлоридов и воды к арилацетиленам в присутствии каталитических количеств n-толуолсульфокислоты [С.Lai, С.Xi, Y. Jiang, R. Hua. Tetrahedron Lett., 2005, 46, 513-51].
Большинство из перечисленных методов требует присутствия сильных оснований, жестких условий, труднодоступных реагентов или включает в себя несколько стадий.
Наиболее популярный метод получения 1,4-дикетонов заключается в кипячении фенацилгалогенидов в органических растворителях в присутствии цинка [M.Ceylan, M.B.Guerdere, Y.Budak, С.Kazaz, H.Secen. Synthesis, 2004, 11, p.1750-1754], [M.Iyoda, M.Sakaitani, A.Kojima, M.Oda, Tetrahedron Lett., 1985, 26, 31, p.3719-3722]. Однако данный метод не позволяет получать целевые соединения при наличии в исходном субстрате легковосстанавливающихся групп.
Задача изобретения - разработка нового способа получения β-кетосульфонов I и 1,4-дикетонов II в мягких условиях при комнатной температуре без применения токсичных органических реагентов.
Техническим результатом является новый метод синтеза β-кетосульфонов Ia-д и 1,4-дикетонов IIа-ж, позволяющий в зависимости от заместителя в ароматическом кольце в одну стадию получать легкоразделяемую смесь β-кетосульфонов Ia-д и 1,4-дикетонов IIа-ж или исключительно 1,4-дикетоны IIе, ж.
Технический результат достигается тем, что в способе получения β-кетосульфонов Ia-д и 1,4-дикетонов IIа-ж
| Соединение | R1 | R2 | R3 |
| Ia, IIа, IIIа | Н | Br | Н |
| Iб, IIб, IIIб | Н | ОСН3 | Н |
| Iв, IIв, IIIв | Н | NO2 | Н |
| Iг, IIг, IIIг | Cl | Cl | Н |
| Iд, IIд, IIIд | Cl | Н | С1 |
| IIе, IIIе | ОСН3 | ОСН3 | Н |
| IIж, IIIж | Н | NHCOCH3 | Н |
фенацилксантогенаты IIIа-ж в диметилсульфоксиде (ДМСО) обрабатывают 30% перекисью водорода в присутствии сульфата железа (II), в соотношении фенилксантнгената IIIа-ж и сульфата железа (II) 1:1.1 моль, в течение 2 ч при комнатной температуре. Реакционную массу разбавляют водой, выпавший осадок отфильтровывают и растворяют в 1N растворе гидроксида натрия, нерастворившийся 1,4-дикетон IIа-ж отфильтровывают. Щелочной раствор подкисляют 30% серной кислотой до рН=4 для получения β-кетосульфона Ia-д.
При наличии в ароматическом кольце электроноакцепторных заместителей в результате реакции образуется легкоразделимая смесь β-кетосульфонов I и 1,4-дикетонов II с преобладанием β-кетосульфонов I. В случае сильных электронодонорных заместителей выход 1,4-дикетонов увеличивается, а в некоторых случаях они выступают единственными продуктами реакции.
Исходные фенацилксантогенаты IIIа-ж получают простой обработкой фенацилбромидов О-этилксантогенатом калия [D.Skwarski, H.Sobolewski. ActaPol. Pharm., 1993, 50, 213-218].
Полученный технический результат позволяет синтезировать β-кетосульфоны Ia-д и 1,4-дикетоны IIа-ж в одну стадию, в течение 2 часов при комнатной температуре, без применения токсичных реагентов. Выделение продуктов отличается простотой, выходы варьируются от умеренных до хороших.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Температуры плавления, данные элементного анализа и спектральные характеристики β-кетосульфонов Ia-д и 1,4-дикетонов IIа-ж приведены в таблице 3.
Примеры осуществления заявляемого способа получения β-кетосульфона Ia и 1,4-дикетона IIа
Первый пример
К раствору 1.37 г (0.009 ммоль) сульфата железа (II) в 20 мл ДМСО добавляют 3.19 г (0.01 моль) соединения IIIа (соотношение соединения IIIа и сульфата железа (II) 1:0.9 моль) и при охлаждении на водяной бане прикапывают 2 мл 30% перекиси водорода в течение 0.5 часа. Через 30 мин перемешивания добавляют еще 2 мл перекиси водорода в течение 0.5 часа. Через 30 мин в реакционную массу добавляют 50 мл воды. При этом выпадает осадок, который отфильтровывают и растворяют в 10 мл 1N раствора гидроксида натрия. Нерастворившуюся часть осадка отфильтровывают и перекристаллизовывают из этанола. Получают 1,4-дикетон IIа с выходом 26% (0.48 г).
Фильтрат подкисляют 30% серной кислотой до рН=4, при этом выпадает осадок, который промывают водой и перекристаллизовывают из этанола. Получают β-кетосульфон Ia с выходом 62% (1.72 г).
1-(4-Бромфенил)-2-(метилсульфонил)этанон Ia
Светло-бежевые кристаллы.
Т.пл. 152-154°С (из этанола).
ИК (ваз. масло) υ: 3038, 1676, 1585, 1482, 1315, 1293, 1131, 1070 см-1. ЯМР 1H (CDCl3, 250 МГц) δ: 3.13 (с, 3Н, Me), 4.55 (с, 2Н, СН2), 7.66 (д, J=8.5 Гц, 2Н, HAr), 7.86 (д, J=8.5 Гц, 2Н, HAr).
ЯМР 13С (CDCl3, 250 МГц) δ: 42.17, 61.72, 130.84, 131.12, 132.84, 134.73, 188.75.
Вычислено для C9H9BrO3S: С, 39.00; Н, 3.27. Найдено: С, 39.01; Н, 3.26.
1,4-Бис(4-бромфенил)бутан-1,4-дион IIа
Светло-бежевые кристаллы.
Т.пл. 174-175°С (из этанола).
ИК (ваз. масло) υ: 1670, 1586, 1458, 1326, 1280, 1075 см-1.
1H (CDCl3, 250 МГц) δ: 3.40 (с, 4Н, СН2), 7.60 (д, J=8.3 Гц, 4Н, HAr), 7.87 (д, J=8.3 Гц, 4Н, HAr).
ЯМР 13С (CDCl3, 250 МГц) 5: 32.86, 128.83, 130.05, 132.37, 135.81, 197.90.
Вычислено для C16H12Br2O2: С, 48.52; Н, 3.05. Найдено: С, 48.50; Н, 3.03.
Второй пример
К раствору 1.67 г (0.011 ммоль) сульфата железа (II) в 20 мл ДМСО добавляют 3.19 г (0.01 моль) соединения IIIа (соотношение соединения IIIа и сульфата железа (II) 1: 1.1 моль) и при охлаждении на водяной бане прикапывают 2 мл 30% перекиси водорода в течение 0.5 часа. Через 30 мин перемешивания добавляют еще 2 мл перекиси водорода в течение 0.5 часа. Через 30 мин в реакционную массу добавляют 50 мл воды. При этом выпадает осадок, который отфильтровывают и растворяют в 10 мл 1N раствора гидроксида натрия. Нерастворившуюся часть осадка отфильтровывают и перекристаллизовывают из этанола. Получают 1,4-дикетон IIа с выходом 28% (0.56 г).
Фильтрат подкисляют 30% серной кислотой до рН=4, при этом выпадает осадок, который промывают водой и перекристаллизовывают из этанола. Получают β-кетосульфон Ia с выходом 58% (1.6 г).
Третий пример
К раствору 2.28 г (0.015 ммоль) сульфата железа (II) в 20 мл ДМСО добавляют 3.19 г (0.01 моль) соединения IIIа (соотношение соединения IIIа и сульфата железа (II) 1:1.5 моль) и при охлаждении на водяной бане прикапывают 2 мл 30% перекиси водорода в течение 0.5 часа. Через 30 мин перемешивания добавляют еще 2 мл перекиси водорода в течение 0.5 часа. Через 30 мин в реакционную массу добавляют 50 мл воды. При этом выпадает осадок, который отфильтровывают и растворяют в 10 мл 1N раствора гидроксида натрия. Нерастворившуюся часть осадка отфильтровывают и перекристаллизовывают из этанола. Получают 1,4-дикетон IIа с выходом 34% (0.67 г).
Фильтрат подкисляют 30% серной кислотой до рН=4, при этом выпадает осадок, который промывают водой и перекристаллизовывают из этанола. Получают β-кетосульфон Ia с выходом 55% (1.52 г).
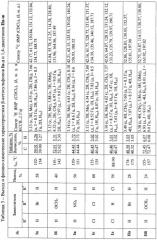
В таблице 1 представлены данные о влиянии соотношения сульфата железа (II) и исходного фенацилксантогената IIIа на выход β-кетосульфона Ia и 1,4-дикетона IIа (примеры 1-3).
| Таблица 1 | ||||
| Влияние количества сульфата железа (II) на выход β-кетосульфона Ia 1,4-дикетона IIа | ||||
| Пример | Соотношение в молях | Выход Ia, % | Выход IIа, % | |
| Соединение IIIa | Сульфат железа (II) | |||
| 1 | 1 | 0.9 | 62 | 26 |
| 2 | 1 | 1.1 | 56 | 28 |
| 3 | 1 | 1.5 | 55 | 34 |
Как видно из таблицы 1, оптимальным соотношением фенацилксантогенат IIIа: сульфат железа (II) является 1:1.1 моль. Увеличение загрузки сульфата железа (II) до 1.5 моль приводит к незначительному уменьшению выхода β-кетосульфона и увеличению выхода 1,4-дикетона, требуя большего расхода сульфата железа (II). В диапазоне 0.9-1.5 моль выход целевых продуктов меняется незначительно - в пределах 10%.
В таблице 2 представлены данные о влиянии природы заместителя на соотношение продуктов β-кетосульфон I: 1,4-дикетон II при загрузке сульфата железа (II) 1.1 моль.
| Таблица 2 | |||||
| Влияние природы заместителей R1-R3 навыход β-кетосульфонов I и 1,4-дикетонов II | |||||
| Индекс | R1 | R2 | R3 | Выход I, % | Выход II, % |
| а | Н | Br | Н | 58 | 28 |
| б | Н | ОСН3 | Н | 40 | 24 |
| в | Н | NO2 | Н | 56 | 19 |
| г | Cl | Cl | Н | 88 | 11 |
| д | Cl | Н | Cl | 56 | 27 |
| е | ОСН3 | ОСН3 | Н | - | 35 |
| ж | Н | NHCOCH3 | Н | - | 40 |
Согласно данным таблицы, наличие в ароматическом кольце электроноакцепторных заместителей приводит к легкоразделимой смеси β-кетосульфонов I и 1,4-дикетонов II с преобладанием β-кетосульфонов I. В случае сильных электроне донорных заместителей выход 1,4-дикетонов увеличивается, а в некоторых случаях они выступают единственными продуктами реакции.
Заявляемым способом получен ряд β-кетосульфонов Ia-д и 1,4-дикетонов IIа-ж.
Способ получения производных β-кетосульфонов общей формулы Iа-д и 1,4-дикетонов IIа-ж
| Соединение | R1 | R2 | R3 |
| Iа, IIа, IIIа | Н | Br | Н |
| Iб, IIб, IIIб | H | ОСН3 | H |
| Iв, IIв, IIIв | Н | NO2 | H |
| Iг, IIг, IIIг | Cl | Cl | H |
| Iд, IIд, IIIд | Cl | Н | Cl |
| IIе, IIIe | ОСН3 | ОСН3 | H |
| IIж, IIIж | H | NHCOCH3 | H |