Способ получения n-(1-адамантил)ацетамида
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к новому способу получения N-(1-адамантил)ацетамида, применяющегося для получения фармацевтических препаратов, который заключается во взаимодействии 1-хлорадамантана с ацетонитрилом в присутствии воды под действием марганецсодержащих катализаторов, таких как MnCl2, MnBr2, Mn(асас)2, Mn2(СО)10 при температуре 130°С в течение 2-3 часов, при мольном соотношении реагентов [Ad-Cl]:[CH3CN]:[H2O]:[Mn]=100:300-400:100:3. Технический результат заявленного способа заключается в полной конверсии 1-бромадамантана и отсутствии побочных продуктов, т.е. единственным продуктом реакции является N-(1-адамантил)ацетамид. 8 пр., 1 табл.
Реферат
Изобретение относится к области органической химии, в частности к способу получения N-(1-адамантил)ацетамида.
N-(1-адамантил)ацетамид (1) находит применение в синтезе ряда замещенных адамантанов, перспективных в отношении биологической активности и труднодоступных другими способами, а также служит исходным сырьем для синтеза лекарственных препаратов, используемых для лечения и профилактики гриппа, болезни Паркинсона, воспаления легких и т.д. Амиды адамантанкарбоновой кислоты, замещенные по азоту, оказывают выраженное седативное действие и используются в качестве антиаллергического средства (Багрий Е.И. Адамантаны, получение, свойства, применение. М.: Наука. - 1989. - 264 с. /1/ К.Gerson, Е.Krumkalns, R.Brindle, F.Marshall and М.Root. J. Med. Chem., v.6, 760 (1963) /2/ B.A.Ермохин, П.П.Пурыгин, Ю.П.Зарубин. Вестник Самарского университета. Естественно-научная серия. №9 (49), 92 (2006) /3/).
Азотсодержащие производные ряда адамантана получают чаще всего обычными методами, основанными на использовании соединений, уже содержащих в качестве заместителя бром, хлор и гидроксигруппу.
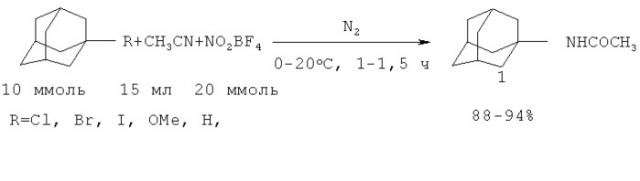
Описано превращение адамантилгалогенидов и адамантилметиловых эфиров в N-(1-адамантил)ацетамид (1) под действием нитронийтетрафторбората в сухом ацетонитриле в токе азота за 1-1.5 часа при 20°C с последующей обработкой водой. В случае экзотермической реакции (R=I, Br, OMe) реакцию проводят 15 минут при 0°C и затем 1-6 часов при 20°C. По реакционной способности галогениды и эфиры адамантана образуют ряд: AdI>AdBr> AdOMe>>AdH>AdCl>AdF (R.D.Bach, J.W.Holubka, T.A.Taffee. J. Org. Chem. T.44, №10, 1739-1740 (1979) /4/ R.D.Bach, T.H.Taffee. Rajan Org. Chem. T.45, №1, 165-167 (1980) /5/).
По аналогичной схеме происходит взаимодействие галогенпроизводных адамантана с ацетонитрилом в присутствии нитрозония гексафторофосфата (NOPF6). (G.A.Olah, В.G.В.Gupta, S.С.Narang. Synthesis, №4, 274-276 (1979) /6/).
Недостатки методов.
1. Использование большого избытка NO2BF4 и NOPF6
2. Труднодоступность фтор-, иод- и метоксипроизводных адамантана.
3. Необходимость проведения реакции с охлаждением (0°С). Окисление адамантана, 1-бромадамантана в ацетонитриле на Pt-аноде приводит к (1) с выходом 75 и 89% соответственно. В случае использования 1-хлорадамантана продуктом реакции является 3-хлор-N-(адамантил-1)ацетамид (выход 91%) (V.R.Koch, L.L.Miller. Tetrahedron Lett. №9, 693-696 (1973) /7/).
Недостатки метода:
1. Метод предполагает использование дорогостоящих платиновых электродов
N-(1-адамантил)ацетамид(1) получают по реакции 1-хлорадамантана с ацетонитрилом в присутствии серной кислоты в среде хлористого метилена. К 243 г 80%-ного 1-хлорадамантана и 296 мл ацетонитрила в 185 мл хлористого метилена при температуре ≤50-55°C добавляют за 1 час 210 г 95%-ной серной кислоты, перемешивают 1-2 часа (или 24 часа при 25°C), прибавляют 750 мл хлористого метилена, суспензию промывают при комнатной температуре 1.2 л CH2Cl2 и 750 мл воды, отделяют раствор (1) в CH2Cl2. Полученный раствор обрабатывают 2%-ным раствором соды до pH 5-5.5, отгоняют растворитель и получают 250 г (1) (примеси 10% адамантана и 10% 1,3-дихлорадамантана) (М.Lazarescu, E.Cornilescu, M.Jonescu, J.C.Costea. Пат. 88535, СРР (1986) /8/).
На основании сходства по двум признакам (исходный реагент - 1-хлорадамантан, образование в результате реакции N-(1-адамантил)ацетамида) за прототип взят метод получения N-(1-адамантил)ацетамида из 1-хлорадамантана и ацетонитрила в присутствии серной кислоты в среде хлористого метилена.
Недостатки прототипа:
1. Использование большого избытка концентрированной серной кислоты (катализатор) и растворителя (хлористого метилена).
2. Сильное разбавление реакционной массы и необходимость нейтрализации H2SO4 основаниями.
3. Образование побочных продуктов адамантана (10%) и 1,3-дихлорадамантана создает сложности при выделении целевого продукта.
Авторами предлагается способ синтеза N-(1-адамантил)ацетамида, лишенный указанных недостатков.
Сущность способа заключается во взаимодействии 1-хлорадамантана с ацетонитрилом в присутствии воды под действием Mn-содержащих катализаторов, таких как MnCl2, MnBr2, Mn(acac)2, Mn2(CO)10 при температуре 130°C в течение 2-3 часов, при мольном соотношении реагентов [Ad-Cl]:[CH3CN]:[H2O]:[Mn]=100:300-400:100:3.
В оптимальных условиях при полной конверсии 1-хлорадамантана единственным продуктом реакции является М-(1-адамантил)ацетамид.
Существенные отличия предлагаемого способа от прототипа:
1. Для получения N-(1-адамантил)ацетамида из 1-хлорадамантана и ацетонитрила в присутствии воды используются марганецсодержащие катализаторы, взятые в количестве 3% к субстрату.
2. Высокий выход целевого продукта и отсутствие побочных продуктов.
3. Высокая производительность и низкий расход катализатора.
4. Упрощение технологии в целом за счет отказа от использования сильных кислот (H2SO4).
5. Упрощение процедуры очистки целевого продукта, который можно выделить возгонкой под вакуумом или хроматографированием.
6. Непрореагировавший ацетонитрил без дополнительной очистки может быть возвращен в реакцию.
Предлагаемый способ поясняется примерами:
Общая методика:
Пример 1. В микроавтоклав из нержавеющей стали (V=20 мл) или в стеклянную ампулу (V=17 мл) (результаты параллельных опытов практически не отличаются) помещали 0.3 ммоль MnBr2, 40 ммоль свежеперегнанного ацетонитрила, 10 ммоль 1-хлорадамантана, 10 ммоль воды. Автоклав герметично закрывали (ампулу запаивали) и реакционную смесь нагревали при 130°C в течение 2 часов при перемешивании.
После окончания реакции автоклав (ампулу) охлаждали до комнатной температуры, вскрывали, после обработки реакционной массы был выделен N-(1-адамантил)ацетамид с выходом 95%. Полученный N-(1-адамантил)ацетамид имел: Тпл. 147-147.5°C (метанол).
ИК-спектр (ν, см-1): 3220 (NH), 1645 (C=O), 1545 (NH). Спектр ЯМР 13C (CDCl3, δ, м.д.): 51.61 (C1), 41.50 (C2, C8, C9), 30.85 (C3, C5, C7), 36.42 (C4, C6,C10), 25.40 (CH3), 160.86 (С=O). Масс-спектр, m/z (Jотн (%)): 193 [M]+, (43), 192(9), 150(7), 137(8), 136(100), 135(24), 134(25), 100(8), 94(45), 93(18), 92(16), 91(17), 79(15), 77(14), 58(8), 55(7), 43(31), 42(12), 41(21), 39(14). Найдено: C 74.61; H 9.88; N 7.19. C12H19NO. Вычислено: C 74.56; H 9.91; N 7.25.
Другие примеры, подтверждающие способ, приведены в таблице 1.
| Таблица 1 | ||||||
| Влияние условий реакции на выход N-(1-адамантил)ацетамида | ||||||
| № | кат | Мольное соотношение[Ad-Cl]:[CH3CN]:[H2O]:[Mn] | Т, °C | t, ч | Конверсия1-AdCl, % | Выход (1), % |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1 | MnCl2 | 100:300:100:3 | 130 | 3 | 79 | 100 |
| 2 | --«»-- | 100:300:100:3 | -«»- | -«»- | 82 | 100 |
| 3 | MnBr2 | 100:300:100:3 | 130 | 2 | 93 | 100 |
| 4 | -«»- | 100:300:100:3 | -«»- | -«»- | 95 | 100 |
| 5 | Mn(OAc)2 | --«»-- | -«»- | -«»- | 91 | 100 |
| 6 | Mn(acac)2 | -«»-- | 130 | 2 | 93 | 100 |
| 7 | Mn(асас)3 | --«»-- | -«»- | -«»- | 94 | 100 |
| 8 | Mn2(СО)10 | -«»-- | -«»- | -«»- | 100 | 100 |
Способ получения N-(1-адамантил)ацетамида формулы взаимодействием 1-хлорадамантана с ацетонитрилом, отличающийся тем, что реакцию проводят в водной среде в присутствии марганецсодержащих катализаторов, выбранных из ряда: MnCl2, MnBr2, Mn(асас)2, Mn2(СО)10, при температуре 130°С в течение 2-3 ч, при мольном соотношении реагентов [Ad-Cl]:[CH3CN]:[H2O]:[Mn]=100:300-400:100:3.