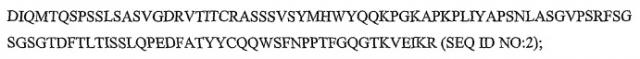Способ лечения повреждения суставов
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к ревматологии, и может быть использована для лечения повреждения сустава у индивида, страдающего ревматоидным артритом (RA). Для этого пациенту, который проявляет неадекватный ответ или имеет чрезмерную чувствительность к одному или нескольким ингибиторам фактора некроза опухоли (TNF), вводят ритуксимаб. При этом пациенту был проведен, по меньшей мере, один курс лечения ритуксимабом, и лечение включает проведение, по крайней мере, еще одного курса лечения ритуксимабом. Дополнительный курс лечения проводят через 24 недели после начала предшествующего курса лечения ритуксимабом. Каждый курс включает введение двух внутривенных доз по 1000 мг с интервалом 14 дней. Также способ включает проведения через 52 недели после начала введения ретуксимаба радиографического анализа. Группа изобретений обеспечивает уменьшение повреждения сустава у указанной группы пациентов. 2 н. и 7 з.п. ф-лы, 46 ил., 2 табл., 5 пр.
Реферат
Область техники
Настоящее изобретение относится к способам лечения повреждения суставов у индивидов, страдающих этим нарушением.
Предпосылки создания изобретения
Воспаление суставов является широко известным клиническим проявлением при различных аутоиммунных нарушениях, в том числе ревматоидном артрите (RA), псориатическом артрите (PsA), системной красной волчанке (SLE), синдроме Шегрена и полимиозите. У большинства больных при физическом обследовании обнаруживаются деформации суставов, но обычно только у больных RA и PsA обнаруживаются эрозии кости при обследовании с получением изображений.
RA представляет собой хроническое воспалительное заболевание, которое поражает приблизительно 0,5-1% взрослой популяции северной Европы и Северной Америки и немного меньшую часть в других частях света (Alamonosa and Drosos, Autoimmun. Rev., 4: 130-136 (2005)). Он является системным воспалительным заболеванием, характеризующимся хроническим воспалением синовиальной оболочки пораженных суставов, которое, в конечном счете, приводит к утрате ежедневной функции вследствие хронических боли и усталости. У большинства больных также имеет место прогрессирующее разрушение хряща и кости в пораженных суставах, которое может, в конечном счете, привести к необратимой нетрудоспособности. Долгосрочный прогноз RA является плохим, при этом у приблизительно 50% больных развивается значительная функциональная неполноценность в пределах 10 лет от момента диагноза (Keystone, Rheumatology, 44 (Suppl. 2): ii8-ii12 (2005)). Вероятная продолжительность жизни уменьшается в среднем на 3-10 лет (Alamanos and Rosos, выше). Больные с высоким титром ревматоидного фактора (RF) (приблизительно 80% больных) имеют более агрессивное заболевание (Bukhari et al., Arthritis Rheum. 46: 906-912 (2002)), с худшим долгосрочным прогнозом и повышенной смертностью по сравнению с больными, отрицательными по RF (Heliovaara et al., Ann. Rheum. Dis. 54: 811-814 (1995)).
Патогенез хронических воспалительных заболеваний кости, таких как RA, не полностью понятен. Такие заболевания сопровождаются утратой кости вокруг поврежденных суставов вследствие повышенной резорбции остеокластов. Этот процесс опосредуется, по большей части, увеличенной местной продукцией провоспалительных цитокинов (Teitelbaum Science, 289: 1504-1508 (2000); Goldring and Gravallese Arthritis Res. 2(1): 33-37 (2000)). Эти цитокины могут действовать непосредственно на клеточные линии остеокластов или опосредованно, влияя на продукцию остеобластными/стромальными клетками важного фактора дифференциации остеокластов, рецепторного активатора лиганда NF<B (RANKL), I и/или его растворимого ложного рецептора, остеопротегерина (OPG), (Hossbauer et al. J. Bone Miner. Res. 15(1): 2-12 (2000)). TNF-альфа является главным медиатором воспаления, значение которого в патогенезе различных форм утраты кости поддерживается несколькими линиями экспериментальных и клинических доказательств (Feldmann et al. Cell 85(3): 307-310 (1996). Однако TNF-альфа не является существенным для остеокластогенеза (Douni et al. J. Inflamm. 47: 27-38 (1996)), эрозийного артрита (Campbell et al. J. Clin. Invest. 107(12): 1519-1527 (2001)) или остеолизиса (Childs et al. J. Bon. Min. Res. 16: 338-347 (2001)), поскольку они могут наблюдаться в отсутствие TNF-альфа.
В частности, при RA иммунный ответ, как полагают, инициируется/поддерживается одним или несколькими антигенами, присутствующими в синовиальном компартменте, что приводит к притоку клеток острого воспаления и лимфоцитов в сустав. Последующие атакующие цепи воспаления приводят к образованию инвазивной и эрозивной ткани, называемой паннусом. Он содержит пролиферирующие подобные фибробластам синовиоциты и макрофаги, продуцирующие провоспалительные цитокины, такие как фактор-альфа некроза опухолей (TNF-альфа) и интерлейкин-1 (IL-1). Большой вклад в повреждение ткани вносят местное высвобождение протеолитических ферментов, различные медиаторы воспаления и активация остеокластов. Имеет место утрата суставного хряща и образование эрозий кости. Воспалительный процесс может затронуть окружающие сухожилия и синовиальную сумку. В конечном счете, нарушается целостность структуры сустава, что приводит к нетрудоспособности.
Точное влияние В-клеток в иммунопатогенезе RA не полностью охарактеризовано. Однако существует несколько возможных механизмов, с помощью которых В-клетки могут принимать участие в патологическом процессе (Silverman and Carson, Arthritis Res. Ther., 5 Suppl. 4: S1-6 (2003)).
Исторически считают, что В-клетки вносят вклад в патологический процесс при RA, являясь, главным образом, предшественниками продуцирующих аутоантитела клеток. Был идентифицирован ряд специфичностей аутоантител, в том числе аутоантитела к коллагену типа II и протеогликанам, а также к ревматоидным факторам. Образование больших количеств антител приводит к образованию иммунных комплексов и активации системы комплемента. Это в свою очередь усиливает иммунный ответ и может привести к местныму лизису клеток. Повышенный синтез RF и истощение комплемента коррелировало с активностью заболевания. Присутствие самого RF связано с более тяжелой формой RА и наличием дополнительных признаков, кроме суставных.
Недавно полученные данные (Janeway and Katz, J. Immunol., 138: 1051 (1998); Rivera et al., Int. Immunol., 13: 1583-1593 (2001)) указывают на то, что В-клетки являются в высокой степени эффективными антигенпрезентирующими клетками (АРС). В-клетки RF-положительных больных могут быть особенно сильными АРС, поскольку их поверхностный иммуноглобулин делает возможным легкий захват любых иммунных комплексов, не обращая внимание на антигены, присутствующие внутри них. Многие антигены могут, таким образом, процессироваться для презентации Т-клеткам. Кроме того, недавно было сделано предположение, что это может также сделать возможной самоподдержку В-клеток RF-положительных больных (Edwards et al., Immunology, 97: 188-196 (1999)).
Для активации Т-клеток в клетку должны быть доставлены два сигнала; один - через Т-клеточный рецептор (TCR), который распознает процессированный пептид в присутствии антигена главного комплекса гистосовместимости (MHC), а второй - через костимулирующие молекулы. При активации В-клетки экспрессируют костимулирующие молекулы на своей поверхности и могут, таким образом, обеспечить второй сигнал активации Т-клеток и образования эффекторных клеток.
В-клетки могут усиливать свою собственную функцию, а также функцию других клеток благодаря продукции цитокинов (Harris et al., Nat. Immunol., 1: 475-482 (2000)). Среди некоторых цитокинов, которые могут продуцировать В-клетки в синовиальной оболочке при RA, находятся TNF-альфа и IL-1, лимфотоксин-альфа, IL-6 и IL-10.
Хотя считают, что активация Т-клеток является решающим компонентом патогенеза RA, в недавней работе, в которой использовались эксплантаты синовиальной оболочки человека для мышей с тяжелыми комбинированными иммунодефицитными нарушениями (SCID), было показано, что активация Т-клеток и ретенция в суставе критическим образом зависят от присутствия В-клеток (Takemura et al., J. Immunol., 167: 4710-4718 (2001). Точная роль в этом В-клеток не ясна, поскольку другие АРС, по-видимому, не имели такого же эффекта на Т-клетки.
Повреждение структуры суставов является важным последствием хронического синовиального воспаления. У 60-95% больных ревматоидным артритом (RA) обнаруживается по крайней мере одна рентгенографическая эрозия в пределах 3-8 лет от начала заболевания (Paulus et al., J. Rheumatol., 23: 801-805 (1996); Hulsmans et al., Arthritis Rheum. 43: 1927-1940 (2000)). При RA на ранней стадии корреляция между рентгенографическими показателями повреждения и функциональной способностью является слабой, но после 8 лет болезни коэффициенты корреляции могут достигать настолько больших значений, как 0,68 (Scott et al., Rheumatology, 39: 122-132 (2000)). У 1007 больных, моложе 60 лет, имеющих RA на протяжении по крайней мере четырех лет, Wolfe и др. (Arthritis Rheum, 43 Suppl. 9: S403 (2000)) обнаружили значительную связь между скоростью прогрессирования рентгенографического показателя повреждения Larsen (Larsen et al., Acta Radiol. Diagn. 18: 481-491 (1977)), увеличением степени нетрудоспособности, оплачиваемой из средств социального обеспечения, и уменьшением дохода семьи.
Профилактика или замедление рентгенографического повреждения является одной из целей лечения RA (Edmonds et al., Arthritis Rheum. 36: 336-340 (1993)). При контролируемом клиническом испытании на протяжении 6 или 12 месяцев документировали, что прогрессирование рентгенографических показателей повреждения было более быстрым в группе плацебо, чем в группе, которая получала метотрексат (МТХ) (Sharp et al., Arthritis Rheum. 43: 495-505 (2000), лефлуномид (Sharp et al., выше), сульфасалазин (SSZ) (Sharp et al., выше), преднизолон (Kirwan et al., N. Engl. J. Med., 333: 142-146 (1995); Wassenburg et al., Arthritis Rheum, 42: Suppl 9: S243 (1999)), антагонист рецептора интерлейкина-1 (Bresnihan et al., Arthritis Rheum, 41: 2196-2204 (1998)) или комбинацию инфликсимаб/МТХ (Lipsky et al., N. Eng. J. Med., 343: 1594-1604 (2000)), и что рентгенографическое прогрессирование после лечения этанерцептом было менее быстрым, чем после лечения МТХ (Bathon et al., N. Engl. J. Med., 343: 1586-1593 (2000)). В других исследованиях оценивалось рентгенографическое прогрессирование у больных, которые получали лечение кортикостероидами (Joint Committee of the Medical Research Council and Nuffield Foundation, Ann. Rheum. Dis. 19: 331-337 (1960); Van Everdingen et al., Ann. Intern. Med., 136: 1-12 (2002)), циклоспорином А (Pasero et al., J. Rheumatol., 24: 2113-2118 (1997); Forre, Arthritis Rheum., 37: 1506-1512 (1994)), MTX в сравнении с азатиоприном (Jeurissen et al., Ann. Intern. Med., 114: 999-1004 (1991)), MTX в сравнении с ауранофином (Weinblatt et al., Arthritis Rheum., 36: 613-619 (1993)), МТХ (мета-анализ) (Alarcon et al., J. Rheumatol., 19: 1868-1873 (1992)), гидроксихлорохином (HCQ) в сравнении с SSZ (Van der Heijde et al., Lancet, 1: 1036-10380), SSZ (Hannonen et al., Arthritis Rheum. 36: 1501-1509 (1993)), комбинацией COBRA (Combinatietherapei Bij Reumatoide Artritis) преднизолона, MTХ и SSL (Boers et al., Lancet, 350: 309-318 (1997); Landewe et al., Arthritis Rhreum., 46: 347-356 (2002)), комбинацией MTX, SSZ и HCQ (O'Dell et al., N. Engl. J. Med., 334: 1287-1291 (1996); Mottonen et al., Lancet, 353: 1568-1573 (1999)); комбинацией циклофосфамида, азатиоприна и HCQ (Csuka et al., JAMA, 255: 2115-2119 (1986)) и комбинацией адалимумаба с MTX (Keystone et al., Arthritis Rheum., 46 Suppl. 9: S205 (2002)).
Управление по контролю за продуктами и медикаментами (FDA) недавно разрешило утверждение на этикетке, что некоторые лекарственные средства, например лефлуномид, этанерцепт и инфликсимаб, замедляют прогрессирование рентгенографического повреждения сустава. Эти утверждения основаны на статистически значимых различиях в скоростях прогрессирования, наблюдаемых между случайно заданными группами, получающими лечение, и контрольными группами. Однако скорость прогрессирования у индивидуумов в пределах групп, получающих лечение, и контрольных групп в значительной степени перекрываются; следовательно, несмотря на значительную разницу между группами, получающими лечение, эти данные нельзя использовать для оценки вероятности того, что у больного, на начальных этапах лечения, будет наблюдаться благоприятный исход в отношении прогрессирования рентгенографического повреждения. Были предложены различные способы определения категории спаренных рентгенограмм индивидуальных больных как не прогрессирующей, например, показатели повреждения, составляющие 0, в обоих моментах времени, нет увеличения показателей повреждения, нет новых суставов с эрозиями, и изменение показателя, не превышающее наименьшего определяемого различия (т.е. 95% доверительный интервал для различия между повторными считываниями одной и той же рентгенограммы) (Lassere et al., J. Rheumatol., 26: 731-739 (1999)).
Определение того, увеличилось ли структурное повреждение у конкретного больного во время интервала между моментами времени получения спаренных рентгенограмм, которые приходятся на начало и конец 6- или 12-месячного клинического испытания, было трудным по нескольким причинам. Скорость рентгенографического повреждения не является постоянной внутри популяции больных RA; маленькая часть больных может иметь быстро прогрессирующее повреждение, но у многих больных может наблюдаться небольшое прогрессирование или его может не быть; особенно если интервал является относительно коротким. Способы определения показателей рентгенографического повреждения, например Sharp (Sharp et al., Arthritis Rheum., 14: 706-720 (1971); Sharp et al., Arthritis Rheum., 28: 1326-13335 (1985)), Larsen (Larsen et al., Acta Radial. Diagn., 18: 481-491 (1977)) и модификации этих способов (Van der Heijde, J. Rheumatol., 27: 261-263 (2000)) зависят от оценки и интерпретации специалистом, анализирующим рентгенограмму, того факта, является реальным кажущееся нарушение субхрящевой кортикальной пластины или является ли реальным уменьшение расстояния между поверхностями на противоположных сторонах сустава, или оно обусловлено незначительным изменением положения сустава относительно пленки и рентгеновского луча, изменением рентгеновской экспозиции или другим техническим фактором.
Следовательно, определенный показатель является приближением действительного повреждения и для многих индивидов наименьшее определяемое различие между повторными показателями одних и тех же рентгенограмм является больше действительного изменения, которое может иметь место во время интервала между моментами времени базовой линии и конечных рентгенограмм. Если специалист не различает временного порядка следования пленок, неизбежные ошибки в показателях могут быть в одном из двух направлений, приводя к кажущемуся «излечиванию» при снижении показателей или кажущемуся быстрому прогрессированию, если ошибка специалиста увеличивает различие между пленками. Когда в исследование вовлечена достаточно большая популяция больных, которым случайным образом назначено получение эффективного лечения, по сравнению с плацебо, погрешности с положительным и отрицательным знаком специалиста, проводящего анализ, компенсируют друг друга и можно определить небольшое, но реальное различие между подвергаемыми лечению группами.
Погрешность клинических показателей, используемых для количественной оценки активности заболевания RA, вызывала сходные трудности; статистически значимые различия между определенными результативными показателями из клинических испытаний не подходили для оценки вероятности улучшения индивидуума, на ранних этапах лечения (Paulus et al., Arthritis Rheum., 33: 477-484 (1990)). Атрибуция индивидуального улучшения стала возможной на практике с созданием American College of Rheumatology (ACR) составных критериев 20% улучшения (ACR20), с помощью которого пациента относили в категорию пациентов с улучшениями, если существовало 20% снижении числа болезненных и опухших суставов, и 20% улучшение в по крайней мере 3 из 5 дополнительных показателях (боль, физическая функция, общая оценка здоровья пациентом, общая оценка здоровья врачом и уровни реагентов острой фазы) (Felson et al., Arthritis Rheum., 38: 727-735 (1995)). Все эти показатели имеют большую ценность для наименьшего определяемого различия, зато в результате требования одновременного улучшения в 5 из 7 аспектов одного и того же процесса (активности заболевания) случайность 7 ошибок измерений ограничена и легко приписать индивидууму реальное улучшение.
При RA повреждение сустава является широко известным признаком. Рентгенологические параметры нарушения суставов рассматриваются в качестве ключевых результативных показателей при характеристике исхода заболевания. На недавнем заседании по согласованию OMERACT (результативных показателей при ревматологических клинических испытаниях) рентгенология была выбрана частью основного набора результативных показателей для продольных исследований по данным наблюдений (Wolfe et al., Arthritis Rheum., 41 Supp 9: S204 (1998) abstract). Рентгенология также является частью требуемого WHO/ILAR (World Health Organization/International League of Associations for Rheumatology) основного набора показателей для продолжительных клинических испытаний (Tugwell and Boers, J. Rheumatol., 20: 528-530 (1993)).
Доступные данные в отношении результата рентгенологического повреждения при RA были получены как при кратковременных, так и при продолжительных исследованиях. При кратковременных исследованиях больных RA с недавно возникшим заболеванием рентгенограммы, получаемые каждые 6 месяцев, показали, что после первоначального быстрого прогрессирования происходит снижения скорости прогрессирования рентгенологического повреждения рук и ног после 2-3 лет (Van der Heijde et al., Arthritis Rheum., 35: 26-34 (1992); Fex et al., Br. J. Rheumatol., 35: 1106-1055 (1996)). При длительных исследованиях с получением рентгенограмм менее часто была обнаружена постоянная скорость прогрессирования с неумолимым ухудшением повреждения вплоть до 25 лет продолжительности заболевания (Wolfe and Sharp, Arthritis Rheum., 41: 1571-1582 (1998); Gradual et al., Arthritis Rheum., 41: 1470-1480 (1998); plant et al., J. Rheumatol., 25: 417-426 (1998); Kaarela and Kautiainen, J. Rheumatol., 24: 1285-1287 (1997)). Обусловлены ли эти различия в рентгенографической картине прогрессирования различиями в способах определения показателей не ясно.
Используемые системы определения показателей отличаются по числу подвергаемых определению суставов, наличию независимых показателей для эрозий (ERO) и сужения суставного пространства (JSN), максимальному показателю на сустав и взвешиванию рентгенологической аномалии. До сих пор нет консенсуса в отношении предпочтительного способа определения показателей. В течение первых трех лет наблюдения при исследовании группы больных артритом на ранней стадии обнаружено, что JSN и ERO отличаются по их вкладу в измеряемое прогрессирование рентгенологического повреждения рук и ног (Van der Heijde et al., Arthritis Rheum., 35: 26-34 (1992)). Кроме того, обнаружено, что способы, в которых независимо определяются показатели для JSN и ERO, такие как показатели Sharp и Kellgren, являются более чувствительными к изменению при RA на ранней стадии, чем способы, в которых используются общие показатели, такие как показатель Larsen (Plant et al., J. Rheumatol., 21: 1808-1813 (1994); Cuchacovich et al., Arthritis Rheum., 35: 736-739 (1992). Способ определения показателя Sharp является очень трудоемким способом (Van der Heijde, Baillieres Clin. Rheumatol., 10: 435-533 (1996)). При RA на поздней или деструктивной стадии обнаружено, что способы Sharp и Larsen обеспечивают сходную информацию. Однако чувствительность к смене различных способов определения показателей при заболевании на поздней стадии еще не была исследована, и это может служить доводом в пользу того, что способы определения показателей, в которых независимо измеряются ERO и JSN, обеспечивают пригодную информацию (Pincus et al., J. Rheumatol., 24: 2106-2122 (1997)). Смотри также работу Drossaers-Bakker et al., Arthritis Rheum., 43: 1465-1472 (2000), в которой сравниваются три системы определения рентгенологических показателей для продолжительной оценки RA.
Paulus и др. (Arthritis Rheum., 50: 1083-1096 (2004)) определяли рентгенографическое повреждение суставов у индивидуумов с RA, участвующих в клинических испытаниях, как прогрессирующее или непрогрессирующее, и заключили, что повреждение устава при RA в наблюдаемой группе можно определить как прогрессирующее или непрогрессирующее с использованием составного определения, которое включает ряд неточных и родственных, но различных измерений структурного повреждения сустава. Представляется, что при повседневном наблюдении больных RA должно иметь место изменение интервала между парой рентгенограмм, составляющее по крайней мере пять единиц рентгенографического показателя повреждения по Sharp, прежде чем рассматривать структурное изменение реальным и использовать его в качестве основы для решения проводить лечение.
На протяжении последних 10 лет был достигнут основной прогресс в лечение RA. Комбинированное использование модифицирующих существующее заболевание противоревматических средств (DMARD) вместе с новыми биологическими агентами обеспечило более высокие уровни эффективности у большей доли больных, в то время как ранняя диагностика и лечение заболевания также улучшило исходы.
Этанерцепт является полностью человеческим слитым белком, ингибирующим фактор некроза опухолей (TNF) и последующий каскад воспалительных цитокинов. Продемонстрировано, что этанерцепт является безопасным и эффективным для быстрого снижения активности заболевания у взрослых с RA и для поддержки этого улучшения (Bathon et al., N. Eng. J. Med., 343: 1586-1593 (2000); Moreland et al., N. Engl. J. Med., 337: 141-147 (1997); Moreland et al., Ann. Intern. Med., 130: 478-486 (1999); Weinblatt et al., N. Engl. J. Med., 340: 253-259 (1999); Moreland et al., J. Rheumatol., 28: 1238-1244 (2001)). Он является одинаково эффективным для детей с ювенильным ревматоидным полиартритом (Lovell et al., N. Engl. J. Med., 342: 763-769 (2000)). Этанерцепт разрешен для использования в виде монотерапии, а также в виде комбинированной терапии с МТХ, для лечения RA.
Утрата функции и рентгенографическое изменение имеют место на ранней стадии в течение болезни. Эти изменения можно отсрочить или предупредить с помощью использования некоторых DMARD. Хотя некоторые DMARD были первоначально клинически эффективными и хорошо переносились, с течением времени многие из этих лекарственных средств стали менее эффективными или проявляют увеличенную токсичность. На основе своей эффективности и переносимости МТХ стал стандартной терапией, с которой сравнивают другие лечения (Bathon et al., N. Eng. J. Med., 343: 1586-1593 (2000); Albert et al., J. Rheumatol., 27: 644-652 (2000)).
В недавних исследованиях изучалось рентгенографическое прогрессирование у больных RA на поздней стадии, которые принимали лефлуномид, МТХ или плацебо (Stand et al., Arch. Intern. Med., 159: 2542-2550 (1999)), а также у больных, которые принимали лефлуномид плюс МТХ или плацебо плюс МТХ, с последующим частичным реагированием на МТХ (Lipsky et al., N. Engl. J. Med., 343: 1594-1602 (2000); Maini et al., Lancet, 354: 1932-1939 (1999)). В первый год Enbrel-испытания RA на ранней стадии обнаружено, что этанерцепт является значительно более эффективным, чем МТХ в улучшении признаков и симптомов заболевания и в ингибировании рентгенографического прогрессирования (Bathon et al., N. Eng. J. Med., 343: 1586-1593 (2000)). Genovese и др. (Arthritis Rheum. 46: 1443-1450 (2002) сообщают результаты второго года исследования, делая заключение, что этанерцепт в качестве монотерапии является безопасным и превосходит МТХ в уменьшении активности заболевания, в остановке структурного повреждения и в снижении нетрудоспособности на протяжении 2 лет у больных агрессивным RA на ранней стадии.
Кроме того, снижение рентгенографического прогрессирования в руках и ногах наблюдалось у больных ревматоидным артритом ранней стадии после получения инфликсимаба в комбинации с метотрексатом (Van der Heijde et al., Annnals Rhermatic Diseases 64: 418-419 (2005)). У больных ревматоидным артритом на ранней стадии наблюдалось клинически значимое и устойчивое улучшение физической функции после лечения инфликсимабом (Smolen et al., Annals Rheumatic Diseases 64: 418 (2005)). Об эффекте инфликсимаба и метотрексата на рентгенографическое прогрессирование у больных ревматоидным артритом на ранней стадии сообщается Van der и др. (Annals Rheumatic Diseases 64: 417 (2005)). Лечение инфликсимабом больных алкилозирующим спондилоартритом приводит к изменению маркеров воспаления и сменяемости кости, связанных с его клинической эффективностью (Visvanathan et al., Annals Rheumatic Diseases 64: 319 (2005)).
Об эффекте лечения инфликсимабом на плотность минеральных веществ в кости у больных алкилозирующим спондилоартритом (AS), наблюдаемым при рандомизированном, контролируемым плацебо испытании, названным ASSERT, сообщается Van der Heijde et al., Annals Rheumatic Diseases 64: 319 (2005). Обнаружено, что инфликсимаб уменьшает усталость и боль у больных AS в результате ASSERT (Van der Heijde et al., Annals Rheumatic Diseases 64: 318-319 (2005). Кроме того, эффективность и безопасность инфликсимаба для больных AS в результате ASSERT описывается Van der Heijde и др. (Arthritis Rheum. 5: 582-591 (2005). Авторы делают заключение, что инфликсимаб хорошо переносится и эффективен для большой группы больных AS на протяжении периода исследования, составляющего 24 недели. Кроме того, эффект лечения инфликсимабом воспаления позвоночника был оценен при получении изображения с помощью магнитного резонанса в рандомизированном, контролируемым плацебо, испытании 279 больных AS (Van der Heijde et al., Annals Rheumatic Diseases 64: 317 (2005)). Вопрос о способе, с помощью которого следует определять эффект лечения на рентгенографическое прогрессирование в позвоночнике больных AS, рассматривается Heijde и др. (Arthritis Rheum. 52: 1979-1985 (2005).
Результаты анализов рентгенограмм при международном, контролируемом испытании инфликсимаба для лечения псориатического артрита (IMPACT) спустя год сообщаются Antoni и др. (Annals Rheumatic Diseases 64: 107 (2005)). Доказательство рентгенографической пользы лечения инфликсимабом плюс МТХ больных ревматоидным артритом без клинического улучшения с детальным субанализом данных испытания антител против фактора некроза опухолей для лечения ревматоидного артрита с исследованием сопутствующей терапии приводится Smolen и др. (Arthritis Rheum. 52: 1020-1030 (2005)). Рентгенографическое прогрессирование, измеренное с помощью среднего изменения модифицированного van der Heijde показателя Sharp, было намного больше у больных, получающих МТХ плюс плацебо, чем у больных, получающих инфликсимам плюс МТХ. Авторы делают заключение, что даже у больных без клинического улучшения лечение инфликсимабом плюс МТХ приносило значительную пользу, что касается деструктивного процесса, что говорит о том, что у таких больных эти два показателя заболевания разобщены. Связь между рентгенографическим повреждением на базовой линии и улучшением физической функции после лечения больных, страдающих ревматоидным артритом, инфликсимабом описывается Breedveld et al., Annals Rheumatic Diseases 64: 52-55 (2005). Структурное повреждение оценивается с использованием модифицированного van der Heijde показателя Sharp. Авторы делают заключение, что более сильное повреждение сустава на базовой линии ассоциируется с более плохой физической функцией на базовой линии и меньшим увеличением физической функции после лечения, что подчеркивает важность раннего вмешательства для замедления прогрессирования разрушения сустава.
Антитела против CD20 и лечение ими
Лимфоциты являются одним из многих типов лейкоцитов, продуцируемых в костном мозге во время процесса гемопоэза. Существует две основных популяции лимфоцитов: В-лимфоциты (В-клетки) и Т-лимфоциты (Т-клетки). Представляющими здесь особый интерес лимфоцитами являются В-клетки.
В-клетки созревают в костном мозге и покидают костный мозг, экспрессируя на своих клеточных поверхностях антигенсвязывающее антитело. Когда не обученная В-клетка впервые встречает антиген, в отношении которого является специфичным ее связанное с мембраной антитело, клетка начинает быстро делиться, и ее потомство дифференцируется в В-клетки памяти и эффекторные клетки, называемые «плазмацитами». В-клетки памяти имеют более продолжительное время жизни и продолжают экспрессировать связанное с мембраной антитело с той же самой специфичностью, что и первоначальная родительская клетка. Плазмациты не продуцируют связанное с мембраной антитело, но вместо этого продуцируют антитело в форме, которая может секретироваться. Секретируемые антитела являются главными эффекторными молекулами гуморального иммунитета.
Антиген CD20 (также называемый ограниченный В-лимфоцитами человека антиген дифференциации, Вр35 или В1) представляет собой четырехпроходной, гликозилированный интегральный мембранный белок с молекулярной массой, составляющей 35 кДа, находящийся на пре-В-клетках и зрелых В-лимфоцитах (Valentine et al., J. Biol. Chem. 264(19): 11282-11287 (1989) и Einfeld et al., EMBO J. 7(3): 711-717 (1988)). Антиген также экспрессируется на более чем 90% В-клеточных неходжкинских лимфом (NHL) (Anderson et al. Blood 63(6): 1424-1433 (1984)), но он не обнаружен на гемопоэтических стволовых клетках, про-В-клетках, нормальных плазмацитах и в других нормальных тканях (Tedder et al. J. Immunol. 135(2): 973-979 (1985)). CD20 регулирует раннюю стадию(и) активационного процесса инициации клеточного цикла и дифференциации (Tedder et al., выше) и, возможно, функции кальциевых ионных каналов (Tedder et al., J. Cell Biochem. 14D: 195 (1990). В активированных В-клетках CD20 подвергается фосфорилированию (Riley and Sliwkowski Semin Oncol, 27(12), 17-24 (2000)). CD20 появляется на поверхности В-лимфоцитов на стадии пре-В-клеток и обнаруживается на зрелых В-клетках и В-клетках памяти, но не на плазмацитах (Stashenko et al. J. Immunol. 125: 1678-1685 (1980)); Clark and Ledbetter Adv. Cancer Res. 52, 81-149 (1989)). CD20 имеет активность в отношении кальциевых каналов и может играть роль в развитии В-клеток. Связь между лизисом периферических В-клеток CD20+ in vitro и активностью ритуксимаба in vivo не ясна. Ритуксимаб проявляет антителозависимую клеточноопосредованную цитотоксичность (ADCC) in vitro (Reff et al. Blood 83: 435-445 (1994)). Сильная комплементзависимая цитотоксическая (CDC) активность ритуксимаба также наблюдалась в отношении клеток и клеточных линий лимфомы (Reff et al., выше, 1994) и в некоторых моделях ксенотрансплантатов на мышах (Di Gaetano et al. J. Immunol. 171: 1581-1587 (2003)). Показано, что несколько антител против CD20, в том числе ритуксимаб, когда сшиты с помощью вторичного антитела или другим способом, индуцируют апоптоз in vitro (Ghetie et al. Proc. Natl. Acad. Sci. 94, 7509-7514 (1997)).
При условии, что CD20 экспрессируется в В-клеточных лимфомах, этот антиген может служить кандидатом для «нацеливания» на такие лимфомы. В сущности, такое нацеливание можно обобщенно представить следующим образом: больному вводят антитела, специфичные в отношении поверхностного антигена CD20 В-клеток. Эти антитела против CD20 специфично связываются с антигеном CD20 (по-видимому) как нормальных, так и злокачественных В-клеток; связанное с поверхностным антигеном CD20 антитело может привести к разрушению и истощению неопластических В-клеток. Кроме того, антитело против CD20 можно конъюгировать с химическими агентами или радиоактивными метками, имеющими активность уничтожать опухоль, так что агент специфически «доставляется» к неопластическим В-клеткам. Независимо от подхода главная цель - уничтожить опухоль; специфический подход может определяться конкретным используемым антителом против CD20, и, следовательно, доступные подходы к нацеливанию на антиген CD20 могут значительно варьировать.
Антителом ритуксимаб (RITUXAN®) является полученное методами генной инженерии химерное крысиное/человеческое моноклональное антитело, направленное против антигена CD20. Ритуксимаб является антителом, называемым «С2В8» в патенте США № 5736137, выданным 7 апреля 1998 (Anderson et al.). Ритуксимаб показан для лечения больных рецидивирующими или резистентными недоброкачественными или фолликулярными, CD20-положительными, В-клеточными неходжкинскими лимфомами. Исследования in vitro механизма действия показали, что ритуксимаб связывается с комплементом человека и лизирует лимфоидные В-клеточные линии через CDC (Reff et al., Blood 83(2): 435-445 (1994)). Кроме того, он обладает значительной активностью в анализах ADCC. Более недавно показано, что ритуксимаб оказывает антипролиферативные действия в анализах включения меченного тритием тимидина и непосредственно индуцируют апоптоз, в то время как другие антитела против CD19 и CD20 не оказывают таких действий (Maloney et al. Blood 88(10): 637a (1996)). Экспериментально также наблюдали синергизм между ритуксимабом и химиотерапевтическими агентами и токсинами. В частности, ритуксимаб сенсибилизирует устойчивые к лекарственным средствам линии клеток В-клеточных лимфом человека к цитотоксическим действиям доксорубицина, CDDDP, VP-16, дифтерийного токсина и рицина (Demidem et al., Cancer Chemotherapy & Radiopharmaceuticals 12(3): 177-186 (1997)). In vivo преклинические исследования показали, что ритуксимаб истощает В-клетки из периферической крови, лимфатических узлов и костного мозга яванских макак, предположительно через опосредуемыми комплементом и клетками процессы (Reff et al., Blood 83: 435-445 (1994)).
В Соединенных Штатах в ноябре 1997 г. ритуксимаб был разрешен для лечения больных рецидивирующими или резистентными недоброкачественными или фолликулярными, CD20+ В-клеточными неходжкинскими лимфомами в дозе 375 мг/м2 раз в неделю на протяжении четырех доз. В апреле 2001 Управление по контролю за продуктами и медикаментами (FDA) разрешило дополнительные показания для лечения недоброкачественных неходжкинских лимфом: повторное лечение (раз в неделю на протяжении четырех доз) и дополнительную схему дозирования (раз в неделю на протяжении восьми доз). Более 300000 больных подверглись воздействию ритуксимаба или в виде монотерапии, или в комбинации с иммунодепрессантами или химиотерапевтическими агентами. Больных подвергали лечению ритуксимабом в виде профилактической терапии в течение вплоть до 2 лет (Hainsworth et al., J. Clin. Oncol. 21: 1746-1751 (2003); Hainsworth et al., J. Clin. Oncol. 20: 4261-4267 (2002)). Также ритуксимаб использовали для лечения злокачественных и не злокачественных плазмаклеточных нарушений (Treon and Anderson, Semin. Oncol. 27: 79-85 (2000)).
Ритуксимаб также исследовали при различных не злокачественных аутоиммунных нарушениях, при которых В-клетки и аутоантитела, по-видимому, играют роль в патофизиологии заболевания (Edwards et al., Biochem. Soc. Trans. 30: 824-828 (2002)). Сообщалось, что ритуксимаб сильно уменьшает признаки и симптомы, например, ревматоидного артрита (RA) (Leandro et al., Ann. Rheum. Dis. 61: 883-888 (2002); Edwards et al., Arthritis Rheum., 46 (Suppl. 9): S46 (2002); Stahl et al., Ann. Rheum. Dis., 62 (Suppl. 1): OP004 (2003); Emery et al., Arthritis Rheum. 48(9): S439 (2003)), обыкновенной волчанки (Eisenberg, Arthritis. Res. Ther. 5: 157-159 (2003); Leandro et al. Arthritis Rheum. 46: 2673-2677 (2002); Gorman et al., Lupus, 13: 312-316 (2004)), иммунной тромботической пурпуры (D'Arena et al., Leuk. Lymphoma 44: 561-562 (2003); Stasi et al., Blood, 98: 952-957 (2001); Saleh et al., Semin. Oncol., 27 (Supp 12): 99-103 (2000); Zaia et al., Haematolgica, 87: 189-195 (2002); Ratanatharathorn et al., Ann. Int. Med., 133: 275-279 (2000)), истинной эритроцитарной аплазии (Auner et al., Br. J. Haematol., 116: 725-728 (2002)); аутоиммунной анемии (Zaja et al., Haematologica 87: 189-195 (2002) (опечатка появляется в Haematologica 87: 336 (2002))), болезни холодового агглютинина (Layios et al., Leukemia, 15: 187-8 (2001); Berentsen et al., Blood, 103: 2925-2928 (2004); Berentsen et al., Br. J. Haematol., 115: 79-83 (2001); Bauduer, Br. J. Haematol., 112: 1083-1090 (2001); Damiani et al., Br. J. Haematol., 114: 229-234 (2001)); синдрома типа В тяжелой инсулинорезистентности (Coll et al., N. Engl. J. Med., 350: 310-311 (2004)); смешанной криоглобулинемии (DeVita et al., Arthritis Rheum. 46 Suppl. 9: S206/S469 (2002)); тяжелой миастении (Zaja et al., Neurology, 55: 1062-63 (2000); Wylam et al., J. Pediatr., 143: 674-677 (2003)); грануломатоза Вегенера (Specks et al., Arthritis & Rheumatism 44: 2836-2840 (2001)); рефракторной обыкновенной пузырчатки (Dupuy et al., Arch Dermatol., 140: 91-96 (2004)); дерматомиозита (Levine, Arthritis Rheum., 46 (Suppl. 9): S1299 (2002)), синдрома Шегрена (Somer et al., Arthritis & Rheumatism, 49: 394-398 (2003)), активной криоглобулинемии смешанного типа II (Zaja et al., Blood, 101: 3827-3834 (2003)); обыкновенной пузырчатки (Dupay et al., Arch. Dermatol., 140: 91-95 (2004)); аутоиммунной невропатии (Pestronk et al., J. Neurol. Neurosurg. Psychiatry 74: 485-489 (2003)); паранеопластического синдрома пляшущих глаз и судорожного подергивания мышц (Pranzatelli et al. Neurology 60 (Suppl. 1) PO5.128: A395 (2003)) и возвращающегося-прекращающегося рассеянного склероза (RRMS) (Cross et al. (abstract) “Preliminary Results from a Phase II Trial of Rituximab in MS” Eighth Annual Meeting of the Americas Committes for Research and Treatment in Multiple Sclerosis, 20-21 (2003)).
Исследование фазы II (WA16291) проводилось на больных ревматоидным артритом (RA) с предоставлением данных контроля на протяжении 48 недель в отношении безопасности и эффективности ритуксимаба (Emery et al., Arthritis Rheum 48(9): S439 (2003); Szczepanski et al. Arthritis Rheum 48(9): S121 (2003)). В целом 161 больных равномерно рандомизировали в четыре подвергаемые лечению группы: метотрексат, только ритуксимаб, ритуксимаб плюс метотрексат и ритуксимаб плюс циклофосфамид (СТХ). Схема лечения ритуксимабом была один грамм, вводимый внутривенно в дни 1 и 15. Большинство больных RA хорошо переносили инфузии ритуксимаба, при этом у 36% больных имел место по крайней мере один побочный эффект во время первой инфузии (по сравнению с 30% больных, получающих плацебо). В общем, большинство побочных эффектов считались по тяжести от слабых до умеренных и были сбалансированы по всем подвергаемых лечению группам. Во всех четырех группах на протяжении 48 недель было в общем 19 серьезных побочных эффектов, которые были немного более частыми в группе ритуксимаб/CTX. Инфекционные заболевания были хорошо сбалансированы по всем группам. Средняя частота серьезных инфекций в этой популяции больных RA была 4,66 на 100 пациентов в год, что ниже частоты инфекций, требующей госпитализации, у больных RA (9,57 на 100 пациентов в год), о которой сообщалось в общественном эпидемиологическом исследовании (Doran et al., Arthritis Rheum. 46: 2287-2293 (2002)).
Сообщаемый профиль безопасности ритуксимаба при использовании небольшого количества больных неврологическими нарушениями, в том числе аутоиммунной невропатией (Pestronk et al., выше); синдромом пляшущих глаз и судорожного подергивания мышц (Pranzatelli et al., выше) и RRRMS (Cross et al., выше), был схож с профилем, о котором сообщалось при онкологии или RA. В проводящемся, финансируемом исследователями испытании (IST) ритуксимаба в комбинации с интерфероном-бета (IFN-β) или глатирамера ацетатом на больных RRRMS (Cross et al., выше) 1 из 10 подвергаемых лечению больных был госпитализирован для наблюдения в течение ночи после того, как у него имели место лихорадка и озноб средней степени после первой инфузии ритуксимаба, в то время как для остальных 9 больных полностью выполнили схему из четырех инфузий без каких-либо сообщенных побочных эффектов.
Патенты и патентные публикации, касающиеся антител против CD20 и связывающих CD20 молекул, включают патенты США № 5776456, 5736137, 5843439, 6399061 и 6682734, а также US 2002/0197255, US 2003/0021781, US 2003/0082172, US 2003/0095963, US 2003/0147885 (Anderson et al.); патент США № 6455043 и WO 2000/09160 (Grillo-Lopez, A.); WO 2000/27428 (Grillo-Lopez and White); WO 2000/27433 (Grillo-Lopez and Leonard); WO 2000/44788 (Braslawsky et al.); WO 2001/10462 (Rastetter, W.); WO 2001/10461 (Rastetter and White); WO 2001/10460 (White and Grillo-Lopez); US 2001/0018041, US 2003/0180292, WO 2001/34194 (Hanna and Har