1-замещенные производные тетрагидроизохинолина, фармацевтическая композиция на их основе и способы их применения
Иллюстрации
Показать всеНастоящее изобретение относится к конкретным соединениям 1-замещенного производного 3,4-тетрагидроизохинолина. Также изобретение относится к фармацевтической композиции на основе заявленных соединений, к блокатору Са2+-канал N-типа на основе заявленных соединений, к применению заявленных соединений, а также к способу предупреждения или лечения некоторых патологических состояний. Технический результат: получены новые производные 3,4-тетрагидроизохинолина, имеющие заместитель в 1-положении и обладающие блокирующим действием на Са2+-каналы N-типа. 7 н. и 8 з. п. ф-лы, 129 табл., 17 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к лекарственному средству и, конкретно, к 1-замещенному производному тетрагидроизохинолина, которое является применимым в качестве активного ингредиента фармацевтической композиции для предупреждения и/или лечения боли, абдоминальных симптомов, спастической констипации и синдрома раздраженной толстой кишки.
Уровень техники
Боль является важным механизмом биологической защиты, которая отражает появление любого заболевания в организмах. Когда боль или дизестезия все же сохраняется, даже после того, как тканевое повреждение или заболевания, являющиеся причиной появления боли, подвергали лечению, такое состояние идентифицируют как заболевание. Боль в общем классифицируют на ноцицептивную боль и невропатическую боль. Ноцицептивная боль включает боль, вызванную воспалением ткани, сдавливанием нерва, индуцированным раком или тому подобное (воспалительную боль, раковую боль и т.д.). Нестероидные противовоспалительные лекарственные средства (NSAID) или опиоиды являются терапевтически эффективными для лечения ноцицептивной боли.
С другой стороны, невропатическая боль является хронической болью, вызванной повреждением или сдавливанием нервной ткани, или тому подобным. Симптомы невропатической боли включают неприятную дизестезию, такую как непрерывная или внезапная самопроизвольная боль, онемение, ощущение жжения, боль, испытываемую, когда пациента как бы разрезают на маленькие кусочки, и кинжальная боль; состояние, которое является болезненной реакцией на обычно неболезненный слабый стимул (гипералгезия); боль вследствие стимула, который обычно не вызывает боль (аллодиния), такая как вызванная контактированием с одеждой или изменениями в температурах, и тому подобное. Конкретные заболевания невропатической боли включают невралгию тройничного нерва, синдром комплексной региональной боли, синдром после спинальной хирургии, фантомную боль конечностей, боль после повреждения плечевого сплетения, боль после повреждения спинного мозга, боль после удара, болезненную диабетическую невропатию, постгерпетическую невралгию, ВИЧ-индуцированную невропатию и, кроме того, некоторые случаи раковой боли и боли поясницы, на которые не оказывают достаточные аналгезирующие действия опиоиды, в дополнении к невропатии, индуцированной противораковыми лекарственными средствами и лекарственными средствами против ВИЧ.
Невропатическая боль известна как боль, при лечении которой NSAID или опиоидами, которые являются эффективными при лечении ноцицептивной боли, трудно достичь терапевтической эффективности. При практической лекарственной терапии облегчение боли выполняют коноплей, кремом капсаицина или интраспинальным введением опиоидов, а также введением антидепрессантов (дулоксетина, амитриптилина и т.д.), антиэпилептических лекарственных средств (прегабалина, карбамазепина и т.д.) или местных аналгетиков (мексилетина и т.д.). К сожалению, действия этих лекарственных средств ограничены, поскольку многие невропатические боли развиваются посредством перекрытия многочисленных патогенных причин, и отдельные пациенты имеют разные фоны заболеваний. Кроме того, имеются также проблемы, связанные с побочными действиями, свойственными отдельным лекарственным средствам. В результате этого, существует огромная потребность в средстве против невропатической боли, которое является более сильнодействующим и имеет более широкий спектр аналгезирующего действия и более слабые побочные действия.
Синдром раздраженной толстой кишки (IBS) является синдромом, который вызывают абдоминальные симптомы, такие как абдоминальная боль и вздутие живота, и нарушения стула, такие как диарея или острый позыв к дефекации и констипация или трудность в дефекации вследствие дисфункции нижнего пищеварительного тракта около толстой кишки, несмотря на отсутствие органического изменения, такого как воспаление и опухоль. В зависимости от доминирующих особенностей стула, IBS в общем субклассифицируют на IBS типа диареи (IBS-D), IBS типа констипации (IBS-C) и IBS смешанного типа (IBS-M) с чередующейся диареей и констипацией (Gastroenterology 130: 1377-90, 1480-91 (2006)). В качестве средств для лекарственной терапии для IBS здесь можно указать антихолинергические лекарственные средства для абдоминальной боли, трициклические антидепрессанты (ТСА) для улучшения (повышения) пониженного порога болевой чувствительности пищеварительного тракта и в случае нарушения перистальтики кишечника, средства против диареи или кишечные лекарственные средства против диареи и слабительные соли против констипации, которые являются только средствами аллопатических терапий и являются также ненадежными в их действиях (синдром раздраженной толстой кишки ~ связь между головным мозгом и кишечником (ISBN4-521-67671-5, 2006)).
В качестве лекарственных средств, которые за последнее время привлекали внимание, можно указать алосетрон, который является антагонистом 5-НТ3-рецептора, и тегасерод, который является агонистом 5-НТ4-рецептора, их применяют для IBS-D и IBS-C соответственно. Однако применение алосетрона ограничено вследствие распространенности констипации у 30-35% пациентов в сочетании с серьезными побочными действиями ишемического колита (включая смертельные случаи), даже хотя он проявляет относительно высокую степень улучшения, от 40% до 60%, абдоминальных симптомов и диареи (Drug Today 36: 595-607 (2000), FDA information about lotronex, GlaxoSmithKline press release). Кроме того, указывается, что тегасерол обладает незначительным действием на абдоминальные симптомы вследствие незначительных ослабляющих констипацию действий, которые могут привести к риску появления тахифилаксии (феномен индуцирования резистенции к лекарственному средству после многократно введенных доз на протяжении короткого периода времени) (Clinical Therapeutics 25: 1952-1974 (2003)). Кроме того, применение тегасерола сильно ограничивается также с точки зрения побочных действий вследствие имеющихся отрицательных действий на сердечно-сосудистую систему (FDA information about zelnorm, Novartis press release).
Известно, что опиоиды, такие как морфин, которые обычно применяли в качестве ослабляющих боль лекарственных средств, вызывают серьезную дисфункцию пищеварительного тракта, включающую констипацию, которую называют опиоидной дисфункцией пищеварительного тракта (OBD). Среди симптомов OBD имеется очень быстрое появление констипации без проявления резистентности к лекарственному средству, в отличие от других побочных действий на центральную нервную систему, индуцированных опиоидами, поэтому необходимо применять подходящие дозы, чтобы разрешить данную проблему (American J. Surgery 182: 11S-18S (2001), Jpn. Cancer Chemother. 32: 1377-1383 (2005)). По этой причине при лечении опиоидом, особенно пациентов с раковыми болями, существенное значение имеет комбинированное профилактическое лечение слабительным средством с начала введения опиоидного лекарственного средства, но нелегко регулировать дефикацию при помощи слабительного средства (Drugs 63: 649-671 (2003), Pharmacotherapy 22: 240-250 (2002)).
Пищеварительный тракт обеспечен независимой нервной сетью, называемой брюшной нервной системой. В брюшной нервной системе присутствуют различные типы нейронов, они являются ответственными за регулирование соответствующих функций пищеварительного тракта. Среди этих нейронов собственные первичные афферентные нейроны (IPAN) являются нейронами, которые главным образом воспринимают изменения в полости пищеварительного тракта. IPAN детектируют физические или химические изменения в полости пищеварительного тракта и передают информацию двигательным нейронам или сенсорным нейронам. Поэтому лекарственные средства, изменяющие активность IPAN, вызывают изменения в функции пищеварительного тракта, называемой перистальтикой кишечника или висцеральной перцепцией (Progress in Neurobiol. 54: 1-18 (1998)). Кроме того, на основании того факта, что Са2+-канал N-типа экспрессируется в IPAN и содействует активности IPAN (J. Comp. Neurol. 409: 85-104 (1999)), можно считать, что соединение, блокирующее Са2+-каналы N-типа, может быть применимым при функциональных заболеваниях пищеварительного тракта изменением функций пищеварительного тракта.
Кроме того, известно, что сигналы абдоминальной боли, подобно сигналам соматической боли, перемещаются в головной мозг через ганглии задних корешков спинномозговых нервов (DRG) и спинной мозг (Neurogastroentel. Motil. 16: 113-124 (2004)). Этот путь передачи сигналов гиперсенсибилизирован у пациентов с IBS, что позволяет предположить существенные проявления абдоминальных симптомов (Gut 53: 1465-1470 (2004)). Поэтому ожидается, что блокатор Са2+-канала N-типа, участвующий в этом пути передачи болевого сигнала, может быть эффективным терапевтическим агентом против абдоминальных симптомов IBS. В действительности, описано, что габапентин или прегабалин, который является лигандом для α2δ-субъединицы Са2+-канала, оказывает аналгезирующие действия на животных моделях гиперсенсибилизации абдоминальной боли (J. Pharmacol. Exp. Ther. 295: 162-167 (2000), Anesthesiology 98: 729-733 (2003)).
В клетках имеется много типов Са2+-зависимых функциональных белков, и изменения в концентрации внутриклеточного Са2+ играют важную роль в проявлении или регуляции различных физиологических функций, таких как нейрональная жизнеспособность, синаптическая пластичность и экспрессия гена. Среди Са2+-каналов, присутствующих на клеточной мембране, канал, использующий мембранный потенциал в качестве триггера при открытии канала, называют потенциал-зависимым Са2+-каналом (VDCC), который состоит в основном из α1-субъединицы, образующей тело канала, β-субъединицы, регулирующей уровень экспрессии α1-субъединицы или функции канала, и α2δ-субъединицы (Trends Neurosci. 21 148-154 (1998)). Ca2+-каналы классифицируют на Ca2+-каналы с высоким потенциалом порога активации, такие как каналы L-типа (α1S, C, D и F), P/Q-типа (α1A), N-типа (α1B) и R-типа (α1E); и Ca2+-каналы с низким потенциалом порога активации, такие как каналы T-типа (α1G, H, I), в зависимости от типа α1-субъединицы и потенциала порога активации (Rev. Physiol. Biochem. Pharmacol. 139: 33-87 (1999)).
Среди Са2+-каналов с высоким потенциалом порога активации Са2+-каналы P/Q-, N- и R-типа присутствуют в синаптических терминалях нейронов и служат в качестве триггера секреции нейромедиаторов. В частности, Ca2+-канал N-типа значительно экспрессируется в ганглии задних корешков спинномозговых нервов (DRG) (J. Neurosci. 15: 4315-4327 (1995)), который является скоплением тел клеток сенсорных нейронов, или заднем роге спинного мозга (J. Neurosci. 18: 6319-6330 (1998)), который является областью синаптического выступа сенсорных нейронов. Кроме того, задний рог спинного мозга крысиных моделей невропатической боли обнаруживал повышенную экспрессию Са2+-канала N-типа синхронно с развитием гиперплазии (Exp. Brain Res. 147: 456-463 (2002)). На основании этих фактов считается, что Са2+-канал N-типа играет роль триггера, который передает избыток болевых сигналов в головной мозг.
На основании последних обзоров, показывающих, что блокирующий Ca2+-канал N-типа селективный пептид, ω-конотоксин (ω-CTx), проявляет аналгезирующие действия широкого спектра на животных моделях ноцицептивной, воспалительной и невропатической боли, соответственно (J. Pharmacol. Exp. Ther. 279: 1243-1249 (1996), J. Pharmacol. Exp. Ther. 287: 232-237 (1998), J. Pharmacol. Exp. Ther. 269: 1117-1123 (1994)) и что и не имеет место невропатическая боль у мышей с дефицитом α1B (EMBO J. 20: 2349-2356 (2001)), было предположено, что Ca2+-канал N-типа принимает глубинное участие в патогенезе невропатической боли. Действительно, было описано, что постоянное спинальное введение циконотида (ω-конотоксин MVIIA:ω-CTxMVIIA) посредством имплантируемого насоса улучшает состояние гипералгезии и аллодинии у невосприимчивых к морфину пациентов с невропатической болью (Clin. J. Pain 13: 256-259 (1997)). Кроме того, было показано, что габапентин или прегабалин, часто применяемый в качестве средства, действующего против невропатической боли, связывается с высокой аффинностью с α2δ-субъединицей Са2+-канала, тем самым проявляя аналгезирующие действия (J. Pharm. Sci. 100: 471-486 (2006)). На основании вышеуказанных открытий предполагается, что блокатор Ca2+-канала N-типа является превосходным терапевтическим средством против боли, особенно невропатической боли. Кроме того, на основании факта, что Са2+-канал N-типа принимает участие в гиперактивности нейронов, клеточной гибели и тому подобном, предполагается, что блокатор Са2+-канала N-типа является применимым для предупреждения или лечения состояний или заболеваний, связанных с активацией Са2+-канала N-типа, помимо вышеуказанной боли. В общем, считается, что соединение, обладающее действием, блокирующим Са2+-канал N-типа, может быть применимым при различных болях, таких как невропатическая боль и ноцицептивная боль, головные боли, такие как мигрень и кластерная головная боль, заболеваниях центральной нервной системы, таких как тревога, депрессия, эпилепсия, церебральный удар и синдром усталых ног, заболеваниях пищеварительной системы, таких как абдоминальная боль и синдром раздраженной толстой кишки, и заболеваниях мочевых путей, таких как гиперактивный мочевой пузырь и интерстициальный цистит.
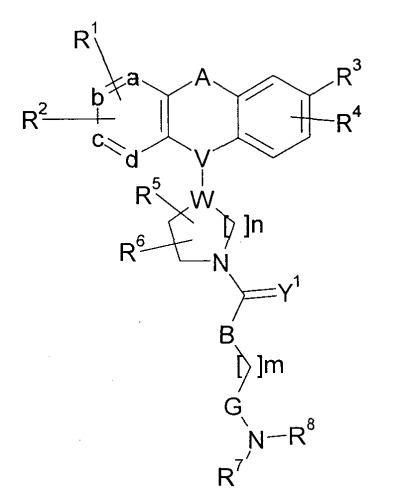
К настоящему времени описаны соединения, блокирующие Са2+-каналы N-типа. Например, было описано, что нижеследующие производные бензазепина обладают блокирующим действием на Са2+-каналы N-типа и являются применимыми в качестве средства для предупреждения и/или лечения церебрального инфаркта, преходящего нарушения мозгового кровообращения, энцефаломиелопатии после хирургической операции на сердце, васкулярных нарушений спинного мозга, индуцированной стрессом гипертензии, невроза, эпилепсии, астмы, частого мочеиспускания и глазных заболеваний, или в качестве лекарственных средств против боли (патентный документ 1).
[Химическое соединение 1]
(См. в указанном выше документе значения для символов в формуле).
Однако не имеется конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению.
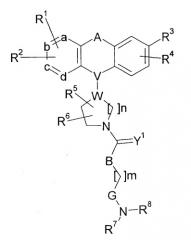
Далее, было описано, что нижеследующие производные диарилалкена или диарилалкана обладают блокирующим действием на Са2+-каналы N-типа и являются применимыми для лечения боли, инфаркта головного мозга, церебральных нарушений, вызванных острой ишемией после начала внутримозгового кровоизлияния, болезни Альцгеймера, связанной со СПИД деменции, болезни Паркинсона, прогрессирующих дегенеративных заболеваний головного мозга, неврологических нарушений, вызванных повреждением головы, бронхиальной астмы, нестабильной стенокардии, воспалительных заболеваний раздраженной толстой кишки и синдромов отмены чрезмерного употребления лекарственных средств (патентный документ 2).
[Химическое соединение 2]
(См. в указанном выше документе значения для символов в формуле).
Однако не имеется конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению.
Далее, было описано, что нижеследующие трициклические гетероароматические соединения обладают блокирующим действием на Са2+-каналы N-типа и являются применимыми в качестве лекарственного средства, особенно аналгезирующего средства (патентный документ 3)
[Химическое соединение 3]
(См. в указанном выше документе значения для символов в формуле).
Однако не имеется конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению.
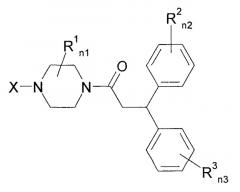
Далее, было описано, что нижеследующие замещенные производные пиперазина обладают блокирующим действием на Са2+-каналы N-типа и являются применимыми для лечения церебрального удара, боли, тревоги, депрессии, желудочно-кишечных нарушений, нарушения мочеполовой системы, сердечно-сосудистого нарушения, эпилепсии, диабета и рака (патентный документ 4).
[Химическое соединение 4]
(См. в указанном выше документе значения для символов в формуле).
Однако не имеется конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению.
Далее, было описано, что нижеследующие азациклосоединения являются применимыми для лечения или предупреждения заболеваний, связанных с потоком ионов натрия канала сенсорных нейронов, например боли, такой как хроническая и острая боль, аллергических болезней, таких как заболевания мочевого пузыря и синдром раздраженной толстой кишки, и демиелирующих заболеваний (патентный документ 5).
[Химическое соединение 5]
(См. в указанном выше документе значения для символов в формуле).
Однако не имеется конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению.
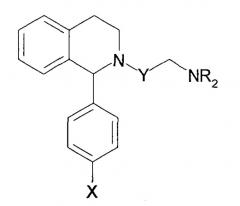
Далее, было описано, что нижеследующие соединения обладают ингибирующей фарнезилпротеинтрансферазу активностью и являются применимыми в качестве противораковых агентов (патентный документ 6).
[Химическое соединение 6]
(См. в указанном выше документе значения для символов в формуле).
Однако не имеется конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению. Кроме того, не имеется описания или предположения об их блокирующем действии на Са2+-каналы N-типа, их действии на боль, включающую невропатическую боль, и на заболевания пищеварительной системы, включающие синдром раздраженной толстой кишки.
Далее, было описано, что нижеследующие соединения обладают антиаритмическим действием (непатентный документ 1).
[Химическое соединение 7]
(См. в указанном выше документе значения для символов в формуле).
Однако English Abstract, относящийся к вышеуказанному документу, не содержит конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению. Кроме того, не имеется описания или предположения об их блокирующем действии на Са2+-каналы N-типа, их действии на боль, включающую невропатическую боль, и заболевания пищеварительной системы, включающие синдром раздраженной толстой кишки.
Далее, было описано, что нижеследующие соединения обладают антиаритмическим действием (непатентный документ 2).
[Химическое соединение 8]
(См. в указанном выше документе значения для символов в формуле).
Однако English Abstract, относящийся к вышеуказанному документу, не содержит конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению. Кроме того, не имеется описания или предположения об их блокирующем действии на Са2+-каналы N-типа, их действии на боль, включающую невропатическую боль, и заболевания пищеварительной системы, включающие синдром раздраженной толстой кишки.
Далее, было описано, что нижеследующие соединения обладают блокирующим действием на Са2+-каналы и являются применимыми в качестве гипотензивных средств и антиаритмических средств (непатентный документ 3).
[Химическое соединение 9]
(См. в указанном выше документе значения для символов в формуле).
Однако English Abstract, относящийся к вышеуказанному документу, не содержит конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению. Кроме того, не имеется описания или предположения об их блокирующем действии на Са2+-каналы N-типа, их действия на боль, включающую невропатическую боль, и заболевания пищеварительной системы, включающие синдром раздраженной толстой кишки.
Далее, было описано, что нижеследующие соединения обладают блокирующим действием на Са2+-каналы, блокирующим действием на Na+-каналы и ингибирующей калмодулин активностью и возможно являются применимыми в нейрозащитной терапии (непатентные документы 4 и 5).
[Химическое соединение 10]
(См. в указанном выше документе значения для символов в формуле).
Однако не имеется конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению.
Далее, были описаны нижеследующие соединения в качестве антагониста рецептора орексина-2 (непатентный документ 6). Кроме этого, было также высказано предположение, что рецептор орексина-2 принимает участие в передаче ноцицептивных стимулов.
[Химическое соединение 11]
(Ме в формуле представляет собой метил).
Однако не имеется конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению.
В качестве других ссылок, в которых описаны соединения, имеющие скелет тетрагидроизохинолина, имеются патентные документы 7-9. Однако эти документы не содержат конкретного описания 1-замещенного производного тетрагидроизохинолина, которое относится к настоящему изобретению.
[Патентный документ 1] JP-A-2002-363163.
[Патентный документ 2] Бюллетень международной публикации No. WO 03/018538.
[Патентный документ 3] Бюллетень международной публикации No. WO 2004/089950.
[Патентный документ 4] Бюллетень международной публикации No. WO 2005/021523.
[Патентный документ 5] Бюллетень международной публикации No. WO 2005/005392.
[Патентный документ 6] Выложенная публикация заявки на европейский патент No. EP 0696593.
[Патентный документ 7] Бюллетень международной публикации No. WO 01/85693
[Патентный документ 8] Бюллетень международной публикации No. WO 02/079189.
[Патентный документ 9] Бюллетень международной публикации No. WO 03/082828.
[Непатентный документ 1] Fudan University Journal of Medical Science, 1987, 14(1), 15-20.
[Непатентный документ 2] Fudan University Journal of Medical Science, 1989, 16(1), 71-74.
[Непатентный документ 3] Journal of China Pharmaceutical University, 1993, 24(4), 193-201.
[Непатентный документ 4] Biological & Pharmaceutical Bulletin, 2000, 23(3), 375-378.
[Непатентный документ 5] Neurochemical Research, 2003, 28(12), 1813-1818.
[Непатентный документ 6] Bioorganic & Medicinal Chemistry Letters, 2003, 13(24), 4497-4499.
Описание изобретения
Проблема, которая должна быть разрешена изобретением
Задачей настоящего изобретения является обеспечение лекарственного средства, обладающего селективным блокирующим действием на Са2+-каналы N-типа, и особенно соединения, применимого в качестве активного ингредиента фармацевтической композиции для предупреждения и/или лечения боли и синдрома раздраженной толстой кишки.
Соединение настоящего изобретения имеет структурную характеристику, по которой в формуле (1) по меньшей мере один из R1a и R1b представляет собой заместитель, отличающийся от -Н, и R22 представляет собой гидроксилсодержащий заместитель. Кроме того, соединение настоящего изобретения обладает фармакологическими свойствами, проявляющимися в том, что оно обладает действием, блокирующим Са2+-каналы N-типа, действием против ноцицептивной боли, действием против невропатической боли, действием, ингибирующим абдоминальную боль, и действием, улучшающим состояние констипации, индуцированной опиоидами.
Способ разрешения проблемы
В результате интенсивных изучений соединений, обладающих селективным блокирующим действием на Са2+-каналы N-типа, авторами настоящего изобретения обнаружено, что 1-замещенное производное тетрагидроизохинолина настоящего изобретения обладает действием, селективно блокирующим Са2+-каналы N-типа, действием против ноцицептивной боли, действием против невропатической боли, действием, ингибирующим абдоминальную боль, и действием, улучшающим состояние констипации, индуцированной опиоидами. Настоящее изобретение было завершено на основании этих полученных данных.
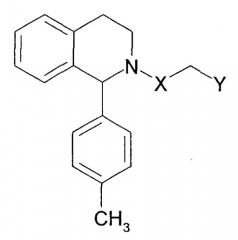
То есть настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли и фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент.
[1]
Соединение формулы (I)
[Химическое соединение 12]
где символы в формуле имеют следующие значения:
R1a и R1b являются одинаковыми или разными и представляют собой -H, C1-6алкил, который может быть замещен, циклоалкил, который может быть замещен, арил, который может быть замещен, или ароматический гетероцикл, который может быть замещен, при условии, что оба из R1a и R1b не могут быть -H, и R1a и R1b, взятые вместе с атомом углерода, к которому они присоединены, могут представлять собой циклоалкил, который может быть замещен,
R3a, R3b, R4a и R4b являются одинаковыми или разными и представляют собой -H или C1-6алкил,
R5, R6, R7 и R8 являются одинаковыми или разными и представляют собой -H, C1-6алкил, который может быть замещен, -O-(C1-6алкил), который может быть замещен, циано, карбамоил, который может быть замещен одним или двумя C1-6алкилами, или галоген, и любые две соседние группы R5, R6, R7 и R8, взятые вместе, могут образовывать -O-CH2-O- или -O-(CH2)2-O-,
R11, R12, R13, R14, R15 и R16 являются одинаковыми или разными и представляют собой -H или C1-6алкил,
R21 представляет собой -H, C1-6алкил, который может быть замещен, или циклоалкил, который может быть замещен,
R22 представляет собой
(1) циклоалкил, который замещен одной или несколькими группами, выбранными из группы, состоящей из -OH и -CH2OH, и который может быть дополнительно замещен;
(2) C1-8алкил, замещенный одним или двумя -OH, где C1-8алкил может иметь дополнительный заместитель, и одна или две метиленовые группы (-CH2-), содержащиеся в этой алкильной цепи, могут быть заменены на -O-; или
(3) C1-6алкил, замещенный циклоалкилом, который замещен одной или несколькими группами, выбранными из группы, состоящей из -OH и -CH2OH, и который может быть дополнительно замещен, где C1-6алкил может быть замещен -OH, и одна или две метиленовые группы (-CH2-), содержащиеся в этой алкильной цепи, могут быть заменены на -O-;
n и m являются одинаковыми или разными и равны 0 или 1,
R12 и R21, взятые вместе, могут образовывать метилен, этилен или триметилен и в этом случае R11 может представлять собой -OH, или
R21 и R22, взятые вместе с атомом азота, к которому они присоединены, могут образовывать азетидин, пирролидин, пиперидин, азепан, азокан, морфолин, тетрагидроизохинолин или тиоморфолин, которые замещены -OH или C1-6алкилом, замещенным -OH; или его фармацевтически приемлемая соль.
[2]
Соединение согласно [1], где m равно 0, n равно 0 и каждый из R1a, R3a, R3b, R4a, R4b, R11, R12 и R21 представляет собой -Н, или его фармацевтически приемлемая соль.
[3]
Соединение согласно [2], где R1b представляет собой изопропил, метоксиметил, фенил, 2-(трифторметил)бензил или циклогексил, или его фармацевтически приемлемая соль.
[4]
Соединение согласно [2] или [3], где R5, R6, R7 и R8 являются одинаковыми или разными и независимо выбраны из группы, состоящей из -Н, метила, этила, метокси и фтора, или его фармацевтически приемлемая соль.
[5]
Соединение согласно [2], [3] или [4], где R22 представляет собой 2-гидроксипропан-1-ил, 2-гидрокси-3-метоксипропан-1-ил или (1-гидроксициклогексил)метил, или его фармацевтически приемлемая соль.
[6]
Соединение согласно [1], которое представляет собой
1-[({2-[(1S)-1-циклогексил-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол,
(2S)-1-({2-[(1S)-1-циклогексил-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)-3-метоксипропан-2-ол,
1-({[2-(1(1S)-изопропил-6-метокси-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}метил)циклогексанол,
(2R)-1-({2-[(1S)-8-метокси-1-фенил-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)пропан-2-ол,
1-[({2-[(1R)-7-этил-1-(метоксиметил)-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол,
(2S)-1-метокси-3-[(2-oxo-2-{1(1S)-[2-(трифторметил)бензил]-3,4-дигидроизохинолин-2(1H)-ил}этил)амино]пропан-2-ол,
1-({[3-(1-циклогексил-3,4-дигидроизохинолин-2(1H)-ил)-3-оксопропил]амино}метил)циклогексанол,
(2R)-1-{[2-(1-циклогексил-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}пропан-2-ол,
(2R)-1-[(2-оксо-2-{1-[2-(трифторметил)фенил]-3,4-дигидроизохинолин-2(1H)-ил}этил)амино]пропан-2-ол,
(2S)-1-{[2-(1-циклогексил-7-метил-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}-3-метоксипропан-2-ол,
(2R)-1-({2-оксо-2-[(1S)-1-фенил-3,4-дигидроизохинолин-2(1H)-ил]этил}амино)пропан-2-ол,
1-[({2-[7-фтор-1-(метоксиметил)-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол,
1-[({2-[7-этил-1-(метоксиметил)-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол,
1-({[2-(1-изопропил-6-метокси-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}метил)циклогексанол,
1-[({2-[5-метокси-1-(метоксиметил)-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол,
1-[({2-[1-(метоксиметил)-6-метил-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол,
(1S,2S)-2-{[2-(1-циклогексил-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}-1-фенилпропан-1,3-диол,
1-({(2R)-2-[(1-циклогексил-3,4-дигидроизохинолин-2(1H)-ил)карбонил]пирролидин-1-ил}метил)циклогексанол,
(2R)-1-{[2-(1-циклогексил-1-метил-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}пропан-2-ол,
1-({[2-(3',4'-дигидро-2'H-спиро[циклогексан-1,1'-изохинолин]-2'-ил)-2-оксоэтил]амино}метил)циклогексанол,
(2R)-1-[(2-оксо-2-{1-[2-(трифторметокси)фенил]-3,4-дигидроизохинолин-2(1H)-ил}этил)амино]пропан-2-ол,
(2R)-1-{[2-(1-циклогексил-7-этил-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}пропан-2-ол,
1-({[2-(6-фтор-1-изопропил-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}метил)циклогексанол,
1,1-дициклопропил-2-({2-[6-фтор-1-(метоксиметил)-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)этанол,
1-({[2-(1-трет-бутил-8-метокси-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}метил)циклогексанол,
1-({[2-(1-изопропил-6-метил-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}метил)циклогексанол,
1-({[2-(6-фтор-1-пропил-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}метил)циклогексанол,
1-[({2-[1-(метоксиметил)-7-метил-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол,
1-({[2-(5-фтор-1-пропил-3,4-дигидроизохинолин-2(1H)-ил)-2-оксоэтил]амино}метил)циклогексанол,
1-[({2-[5-фтор-1-(метоксиметил)-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол,
1-[({2-[8-метокси-1-(метоксиметил)-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол,
1-[({2-[1-(этоксиметил)-7-метил-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)метил]циклогексанол или
(1R,2S)-2-({2-[(1R)-1-(2-метоксифенил)-3,4-дигидроизохинолин-2(1H)-ил]-2-оксоэтил}амино)циклопентанол или его фармацевтически приемлемая соль.
[7]
Фармацевтическая композиция, содержащая соединение [1] или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент.
[8]
Блокатор Са2+-канала N-типа, содержащий соединение [1] или его фармацевтически приемлемую соль.
[9]
Фармацевтическая композиция для предупреждения или лечения боли, невропатической боли, абдоминального симптома, спастической констипации, индуцированной опиоидом констипации, синдрома раздраженной толстой кишки или синдрома раздраженной толстой кишки типа констипации, содержащая соединение [1] или его фармацевтически приемлемую соль.
[10]
Фармацевтическая композиция согласно [9], которая является фармацевтической композицией для предупреждения или лечения боли.
[11]
Фармацевтическая композиция согласно [10], которая является фармацевтической композицией для предупреждения или лечения невропатической боли.
[12]
Фармацевтическая композиция согласно [9], которая является фармацевтической композицией для предупреждения или лечения абдоминального симптома.
[13]
Фармацевтическая композиция по [9], которая является фармацевтической композицией для предупреждения или лечения спастической констипации.
[14]
Фармацевтическая композиция по [13], которая является фармацевтической композицией для предупреждения или лечения индуцированной опиоидом констипации.
[15]
Фармацевтическая композиция по [9], которая является фармацевтической композицией для предупреждения или лечения синдрома раздраженной толстой кишки.
[16]
Фармацевтическая композиция по [15], которая является фармацевтической композицией для предупреждения или лечения синдрома раздраженной толстой кишки типа констипации.
[17]
Фармацевтическая композиция, содержащая соединение [1] или его фармацевтически приемлемую соль и опиоид в качестве активных ингредиентов.
[18]
Фармацевтическая композиция, содержащая соединение [1] или его фармацевтически приемлемую соль в качестве активного ингредиента, где композицию применяют в комбинации с опиоидом.
[19]
Применение соединения [1] или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для предупреждения или лечения боли, невропатической боли, абдоминального симптома, спастической констипации, индуцированной опиоидом констипации, синдрома раздраженной толстой кишки или синдрома раздраженной толстой кишки типа констипации.
[20]
Соединение [1] для применения в качестве активного ингредиента фармацевтической композиции для предупреждения или лечения боли, невропатической боли, абдоминального симптома, спастической констипации, индуцированной опиоидом констипации, синдрома раздраженной толстой кишки или синдрома раздраженной толстой кишки типа констипации.
[21]
Способ предупреждения или лечения боли, невропатической боли, абдоминального симптома, спастической констипации, индуцированной опиоидом констипации, синдрома раздраженной толстой кишки или синдрома раздраженной толстой кишки типа констипации, содержащий введение пациенту эффективного количества соединения [1] или его фармацевтически приемлемой соли.
Кроме того, настоящее изобретение относится к фармацевтической композиции для лечения боли, в определенном варианте осуществления невропатической боли; абдоминальных симптомов; спастической констипации, в определенном варианте осуществления индуцированной опиоидом констипации; или синдрома раздраженной толстой кишки, в определенном варианте осуществления синдрома раздраженной толстой кишки типа констипации, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, т.е. фармацевтической композиции для предупреждения и/или лечения боли, в определенном варианте осуществления невропатической боли; абдоминальных симптомов; спастической констипации, в определенном варианте осуществления индуцированной опиоидом констипации; или синдрома раздраженной толстой кишки, в определенном варианте осуществления синдрома раздраженной толстой кишки типа констипации, содержащей соединение формулы (I) или его фармацевтически приемлемую соль.
Далее, настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для лечения боли, в определенном варианте осуществления невропатической боли; абдоминальных симптомов; спастической констипации, в определенном варианте осуществления индуцированной опиоидом констипации; или синдрома раздраженной толстой кишки, в определенном варианте осуществления синдрома раздраженной толстой кишки типа констипации, и способу лечения боли, в определенном варианте осуществления невропатической боли; абдоминальных симптомов; спастической констипации, в определенном варианте осуществления индуцированной опиоидом констипации; или синдрома раздраженной толстой кишки, в определенном варианте осуществления синдрома раздраженной толстой кишки типа констипации, содержащему введение пациенту эффективного количества соедине