Способ получения гидроксилированного l-лейцина и бактерия, трансформированная днк, кодирующей диоксигеназу
Иллюстрации
Показать всеИзобретение относится к области биохимии. Представлен способ получения 4-гидрокси-L-лейцина или его соли методом ферментативной конверсии L-лейцина или его соли в присутствии бактериальной диоксигеназы, выбранной из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов. Раскрыт способ получения 4-гидрокси-L-лейцина или его соли в содержащей L-лейцин или его соль среде в присутствии первой бактерии, трансформированной молекулой ДНК, кодирующей диоксигеназу, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов. Представлена бактерия-продуцент 4-гидрокси-L-лейцина или его соли, трансформированная молекулой ДНК, кодирующей бактериальную диоксигеназу, выбранную из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов, в среде, содержащей L-лейцин или его соль. Изобретение позволяет получить 4-гидрокси-L-лейцин или его соль с высокой степенью эффективности. 3 н. и 6 з.п. ф-лы, 24 ил., 5 табл., 11 пр.
Реферат
Область техники
Настоящее изобретение относится к микробиологической промышленности и, в частности, к способу получения гидроксилированных L-аминокислот с использованием бактерии, содержащей ДНК, кодирующую бактериальную диоксигеназу. Более конкретно и в частности, настоящее изобретение относится к способу получения гидроксилированного L-лейцина.
Описание предшествующего уровня техники
Гидроксилированные аминокислоты могут иметь большое практическое значение. Так, 4-гидроксиизолейцин проявляет инсулинотропную активность, что вызывает большой интерес, поскольку его стимулирующий эффект явно зависит от концентрации глюкозы в окружающей среде. Данный эффект был показан как на модели изолированных перфузионных поджелудочных желез крыс, так и в кусочках ткани поджелудочных желез человека (Sauvaire, Y. et al. Diabetes, 47:206-210, (1998)). Такая зависимость инсулинотропного эффекта от концентрации глюкозы не подтверждается в случае с сульфонилмочевиной (Drucker, D. J., Diabetes 47:159-169, (1998)), единственным инсулинотропным препаратом, используемым в настоящее время для лечения диабета типа II [не инсулинзависимого диабета (NIDD) или (NIDDM)], и, как следствие, гипогликемия остается основным нежелательным побочным эффектом лечения сульфонилмочевиной (Jackson, J., and Bessler, R. Drugs, 22:211-245; 295-320, (1981); Jennings, A. et al. Diabetes Care, 12:203-208, (1989)). Способы повышения толерантности организма к глюкозе известны (Am. J. Physiol. Endocrinol., Vol.287, E463-E471, 2004). Эта способность 4-гидроксиизолейцина ускорять метаболизм глюкозы и потенциальная возможность его применения в качестве лекарственного средства и компонента функционального питания были раскрыты в выложенной патентной заявке Японии No. Hei 6-157302 и в патентной заявке США US2007-000463A1.
4-гидрокси-L-изолейцин обнаружен до настоящего времени только в растениях и благодаря своему частичному инсулинотропному действию может рассматриваться как новое средство, усиливающее секрецию инсулина, с возможным применением для лечения диабета II типа, заболевания, характеризующегося нарушением секреции инсулина, связанным с развитием инсулиновой резистентности различной степени тяжести (Broca, С. et al., Am. J. Physiol. 277 (Endocrinol. Metab. 40): E617-E623, (1999)).
Метод окисления изолейцина кислородом воздуха в присутствии железа, аскорбиновой кислоты, α-кетоглутаровой кислоты и кислородзависимого изолейцина с использованием диоксигеназной активности экстракта пажитника греческого был предложен в качестве способа получения 4-гидрокси-L-изолейцина (Phytochemistry, Vol.44, No. 4, p.563-566, 1997). Однако этот способ не пригоден для промышленного получения 4-гидроксиизолейцина, так как активность фермента ингибируется субстратом при концентрациях изолейцина от 20 мМ и выше, к тому же фермент до сих пор не идентифицирован, его получают из экстрактов растений в небольших количествах, и он нестабилен.
К настоящему времени описан эффективный восьмистадийный способ синтеза оптически чистого (2S,3R,4S)-4-гидроксиизолейцина с общим выходом 39%. Ключевая стадия этого синтеза включает в себя биотрансформацию этил-2-метилацетоацетата в этил-(2S,3S)-2-метил-3-гидроксибутаноат с использованием Geotrichum candidum и асимметрического синтеза Штрекера (Wang, Q. et al., Eur. J. Org. Chem., 834-839 (2002)).
Также описан короткий шестистадийный ферментохимический способ синтеза (2S,3R,4S)-4-гидроксиизолейцина с общим контролем стереохимии, последней стадией которого является ферментативное разложение путем гидролиза производного N-фенилацетиллактона с использованием коммерчески доступной пенициллинацилазы G, иммобилизованной на Eupergit C(E-PAC) (Rolland-Fulcrand, V. et al., J. Org. Chem., 873-877 (2004)).
Однако в настоящее время отсутствуют сообщения о получении гидроксилированных L-аминокислот путем ферментативной конверсии исходных, негидроксилированных L-аминокислот с использованием диоксигеназы. В частности, в настоящее время нет данных, описывающих способы получения гидроксилированного L-лейцина из L-лейцина с помощью бактериальной диоксигеназы. Также, нет данных, сообщающих о получении гидроксилированных L-аминокислот, в частности гидроксилированного L-лейцина, с использованием бактерии, содержащей ДНК, кодирующую бактериальную диоксигеназу.
Описание изобретения
Целью настоящего изобретения является предоставление способа получения гидроксилированных L-аминокислот методом ферментативной конверсии L-аминокислот с использованием диоксигеназы. В частности, целью настоящего изобретения является предоставление способа получения гидроксилированного L-лейцина методом ферментативной конверсии L-лейцина в присутствии диоксигеназы, выделенной из бактерии.
Вышеуказанная цель была достигнута благодаря обнаружению того факта, что бактериальные диоксигеназы могут участвовать в образовании гидроксилированных L-аминокислот. В частности, диоксигеназы, например, из Bacillus, Gloeobacter, Gluconobacter, Methylobacillus и Nostoc могут участвовать в гидроксилировании L-лейцина с образованием его гидроксилированного производного.
Целью настоящего изобретения является предоставление способа получения гидроксилированной L-аминокислоты или ее соли, в частности гидроксилированного L-лейцина или его соли, методом ферментативной конверсии с использованием диоксигеназы, выделенной из бактерии, принадлежащей к группе, включающей роды Bacillus, Gloeobacter, Gluconobacter, Methylobacillus и Nostoc.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная диоксигеназа выбрана из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:22, SEQ ID NO:54, SEQ ID NO:62 или их вариантов
Также целью настоящего изобретения является предоставление способа получения гидроксилированного L-лейцина или его соли в среде в присутствии первой бактерии, обладающей активностью диоксигеназы, выделенной из второй бактерии, принадлежащей к группе, включающей роды Bacillus, Gloeobacter, Gluconobacter, Methylobacillus и Nostoc.
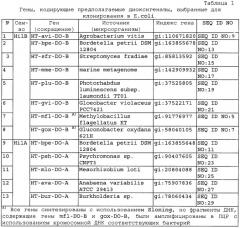
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что первая бактерия, обладающая активностью бактериальной диоксигеназы, выбрана из группы бактерий, включающей роды Agrobacterium, Anabaena, Bacillus, Bordetella, Burkholderia, Escherichia, Gloeobacter, Gluconobacter, Mesorhizobium, Methylobacillus, Nostoc, Pantoea, Photorhabdus, Pseudomonas, Psychromonas и Streptomyces.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что первая бактерия, обладающая активностью бактериальной диоксигеназы, модифицирована таким образом, что активность бактериальной диоксигеназы повышена.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что активность бактериальной диоксигеназы повышена путем усиления экспрессии гена, кодирующего бактериальную диоксигеназу.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что экспрессия гена, кодирующего бактериальную диоксигеназу, усилена путем трансформации первой бактерии молекулой ДНК, кодирующей бактериальную диоксигеназу, способную конвертировать L-лейцин в гидроксилированный L-лейцин.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная бактериальная диоксигеназа выбрана из группы, состоящей из бактериальных диоксигеназ с аминокислотной последовательностью SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:22, SEQ ID NO:54, SEQ ID NO:62 или их вариантов.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная среда содержит L-лейцин или его соли.
Также целью настоящего изобретения является предоставление бактерии-продуцента гидроксилированного L-лейцина или его соли, трансформированной молекулой ДНК, кодирующей бактериальную диоксигеназу, способной конвертировать L-лейцин в гидроксилированный L-лейцин.
Также целью настоящего изобретения является предоставление описанной выше бактерии-продуцента, отличающейся тем, что указанная бактерия принадлежит к группе, включающей роды Agrobacterium, Anabaena, Bacillus, Bordetella, Burkholderia, Escherichia, Gloeobacter, Gluconobacter, Mesorhizobium, Methylobacillus, Nostoc, Pantoea, Photorhabdus, Pseudomonas, Psychromonas и Streptomyces.
Также целью настоящего изобретения является предоставление описанной выше бактерии-продуцента, отличающейся тем, что указанная бактериальная диоксигеназа выделена из другой бактерии, принадлежащей к группе, включающей роды Bacillus, Gloeobacter, Gluconobacter, Methylobacillus и Nostoc.
Также целью настоящего изобретения является предоставление описанной выше бактерии-продуцента, отличающейся тем, что указанная бактериальная диоксигеназа, кодируемая трансформирующей молекулой ДНК, выбрана из группы, состоящей из бактериальных диоксигеназ с аминокислотной последовательностью SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:22, SEQ ID NO:54, SEQ ID NO:62 или их вариантов.
Настоящее изобретение детально описано ниже.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На Фигуре 1 показаны результаты определения соединений Х (4'-HIL) и Y (4',4-DHIL). А, В, С - HPLC-анализ аминокислотного профиля в полученных культурах штаммов MG1655[pMW119], MG1655[pETAC-HilA-HilB] и MG1655[pETAC-HilA] соответственно. D - ТСХ анализ аминокислотного профиля в полученных культурах штаммов MG1655[pMW119] (2), MG1655[pETAC-HilA-HilB] (3) и MG1655 [рЕТАС-HilA] (4) соответственно. Дорожки 1 и 2 - стандарт Ile. S1, S2 - "системные" пики.
На Фигуре 2 показаны биосинтез и очистка соединения Х (4'-HIL).
На Фигуре 3 показаны биосинтез и очистка 4',4-DHIL.
На Фигуре 4 показан каскад гидроксилирования изолейцина, катализируемый HilA и HilB.
На Фигуре 5 показана очистка HilA и his6-tag-HilB. A - SDS-PAGE белковых фракций, полученных в процессе очистки: 1 - маркер молекулярной массы, 2 - неочищенный лизат клеток штамма MG1655[pETAC-HilA], 3 - несвязавшаяся с колонкой DEAE фракция, 4 - стадия осаждения аммонием, 5 - активная фракция, элюированная с SEC-колонки. В - SDS-PAGE полученного препарата his6-tag-HilB. Дорожки: 1 - белковый маркер с известными молекулярными массами; препарат белка 2, 3 - his6-tag-HilB (20 мкг и 40 мкг соответственно).
На Фигуре 6 показаны результаты определения субстратной специфичности his6-tag-HilB. Дорожки А1, А6, В1 и В6 - стандарты 4'-HIL, Ile, Met и Leu соответственно; А2, А7, В2 и В7 - полные реакционные смеси, содержащие 4'-HIL, Ile, Met и Leu соответственно. Реакционные смеси, содержащие все компоненты кроме Fe2+ (A3, А8, В3, В8), L-аскорбата (А4, А9, В4, В9) и α-кетоглутарата (А5, А10, В5, В10) соответственно.
На Фигуре 7 показаны результаты выравнивания по гомологии с 4-IDO Bacillus subtilis. Сокращения: mor-DO-B - гипотетический белок РЕ36_03361 из Moritella sp. PE36 [gi|149908332]; mme-DO-B - гипотетический белок GOS_1822161 [метагеном морских организмов, gi|142909932]; plu-DO-B - гипотетический белок plu1881 из Photorhabdus luminescens subsp. laumondu TT01 [gi|37525805]; sat-DO-B - консервативный гипотетический белок из Streptomyces atroolivaceus [gi|26541515]; sfr-DO-B - гипотетический белок из Streptomyces fradiae [gi|85813592]; gvi-DO-B - гипотетический белок gh-2602 из Gloeobacter violaceus PCC 7421 [gi|37522171]; avi-DO-B -гипотетический белок из Agrobacterium vitis [gi|110671820]; bpe-DO-B - гипотетический белок Bpet1371 из Bordetella petrii DSM 12804 [gi|163855678]; cvi-DO-B - гипотетический белок CV_3308 из Chromobacterium violaceum ATCC 12472 [gi|34498763]; vvu-DO-B - гипотетический белок VV2_1380 из Vibrio vulnificus CMCP6 [gi|27367746]; mfl-DO-B - гипотетический белок Mfla_2629 из Methylobacillus flagellatus KT [gi|91776977]; gau-DO-B - консервативный гипотетический белок из Caulobacter sp. K31 [gi|167645207]; gbe-DO-B - гипотетический белок GbCGDNIH1_2096 из Granulibacter bethesdensis [gi|114328760]; swi-DO-B - гипотетический белок Swit_3525 из Sphingomonas wittichii RW1 [gi|148556427]; gdi-DO-B - гипотетический белок GDI0791 из Gluconacetobacter diazotrophicus PA1 [gi|162146613]; gox-DO-B - гипотетический белок GOX1674 из Gluconobacter oxydans 621H [gi|58040106]; msi-DO-B - консервативный гипотетический белок из Methylocella silvestris [gi|172066227]. Консервативные остатки выделены синим цветом, идентичные - желтым цветом.
На Фигуре 8 показаны результаты выравнивания членов семейства диоксигеназ HilA. Сокращения: mlr-DO-А - гипотетический белок mlr5944 из Mesorhizobium loti MAFF303099 (GI:13474949); mlo-DO-А - гипотетический белок из Mesorhizobium loti (GI:20804088); plu-DO-A - гипотетический белок plu0160 из Photorhabdus luminescens subsp. laumondii TTO1 (GI:37524182); psyHilA - гипотетический белок PSPPH_3987 из Pseudomonas syringae (GI:20804088); paaHilA - белок HilA из Pantoea ananatis SC17; mme-DO-A - гипотетический белок GOS_9268270 из метагенома морских организмов (GI:135403471); bce-DO-A - предполагаемый сигнальный белок трансдукции из Bacillus cereus subsp. cytotoxis NVH 391-98 (GI:152974310); bha-DO-A - гипотетический белок ВН2933 из Bacillus halodurans C-125 (GI:15615495); ava-DO-A - гипотетический белок Ava_1614 из Anabaena variabilis ATCC 29413 (GI:75907836); ssc-DO-A - гипотетический белок SS1G_11624 из Sclerotinia sclerotiorum 1980 (GI:156042147); mgr-DO-A - гипотетический белок MGG_11067 из Magnaporthe grisea 70-15 (GI:39977483); met-DO-A - гипотетический белок GOS_9492232 из метагенома морских организмов (GI:135192580); pfl-DO-A - гипотетический белок PFL_1388 из Pseudomonas fluorescens Pf-5 (GI:70728768); bur-DO-A - предполагаемая пролил-4-диоксигеназа, α-субъединица из Burkholderia sp. (GI:78060434); bpe-DO-A - гипотетический белок Bpet1341 из Bordetella petrii DSM 12804 (GI:163855648); psh-DO-A - гипотетический белок PCNPT3_00501 из Psychromonas sp. CNPT3 (GI:90407605). Консервативные остатки выделены синим, идентичные - желтым.
На Фигуре 9 показана структура плазмид pSlo и рЕТ, содержащих синтезированный ген диоксигеназы (н-р HT-avi-DO-B).
На Фигуре 10 показаны результаты определения активности HT-bpe-DO-A. Белок гидроксилировал метионин (дорожки 1-5) и изолейцин (дорожки 6-10). Дорожки 3 и 8 - контрольные реакции без Fe2+. Реакции 1, 2 и 6, 7 проводили в HEPES буфере, а реакции 4, 5 и 9, 10 в 50 мМ Трис буфере рН 8. Каждую реакцию дублировали.
На Фигуре 11 показана новая треонин-4-диоксигеназная активность диоксигеназы из штамма Bordetella petrii DSM 12804. А. Новая треонин-4-диоксигеназная активность диоксигеназы из штамма Bordetella petrii DSM 12804. В. Результаты ТСХ-анализа реакционной смеси, содержащей 100 мМ Hepes pH7, 5 мМ треонина, 5 мМ α-кетоглутарата, очищенный HT-bpe-DO-B и 5 мМ Fe2+ (дорожка 1). В качестве контрольной реакции использовали ту же смесь без Fe2+.
На Фигуре 12 показаны результаты исследования субстратной специфичности gvi-DO-B в отношении некоторых аминокислот, включая Leu и Met. Полные реакционные смеси обозначены как «+». Контрольные реакционные смеси (без Fe2+) обозначены «-». Гидроксилированные лейцин и метионин обведены окружностью красного цвета.
На Фигуре 13 показана структура плазмиды pELAC-HT-mfl-DO-B.
На Фигуре 14 показана структура плазмиды pELAC-IDO(Lys, 23).
На Фигуре 15 показана схема биотрансформации Ile→4',4-DHIL.
На Фигуре 16 показаны результаты, касающиеся процесса биотрансформации Ile→4',4-DHIL. TCX проводили с использованием щелочного (А) и кислотного (В) проявителя. Дорожки: А1, А4, А7, В1, В2, В7 и В10 - начальные реакционные смеси, содержащие 100 мМ Ile; А2(В2), А3(В3) и А5(В5), А6(В6) - продублированные реакционные смеси А и С после 16 ч культивирования соответственно (в качестве ссылки см. Фиг.1); А8(В8), А9(В9) и А10(В11), А11(В12) - дублированные реакционные смеси В и D после 16 ч культивирования соответственно.
На Фигуре 17 показаны результаты очистки 4',4-DHIL с использованием DOWEX 50 W-X2. Показаны элюированные фракции (2-13), стандартные растворы глутамата (Glu) и стандартная смесь глутамата и 4-HIL (mix).
На Фигуре 18 показаны результаты частичной очистки hLeu. A - Хроматография 1, фракции 10-12 были объединены; В, С - Хроматография 2, фракции 10-14 были объединены. Старт - наносимый препарат.
На Фигуре 19 показаны результаты очистки hVal. Старт - культуральная жидкость после процесса биотрансформации; 1-6 - хроматографические фракции.
На Фигуре 20 показаны результаты очистки метионинсульфоксида. Старт - культуральная жидкость после биотрансформации; 1-12 - хроматографические фракции.
На Фигуре 21 показаны результаты, касающиеся гидроксилирования треонина с использованием неочищенного лизата клеток BL21(DE3)[pET-HT-bpe-DO-B]. Проявитель - ацетон:изопропанол:аммиак:H2O=25:25:6:4. Дорожки: 1(6), 2(7), 3(8), 4(9), 5(10) - реакции, содержащие 10 мМ, 20 мМ, 50 мМ, 70 мМ, 100 мМ Thr соответственно. (Для уравнивания количества применяемых аминокислот реакционные смеси разводили водой в 2 (20 мМ), 5 (50 мМ), 7 (70 мМ), 10 (100 мМ) раз.)
На Фигуре 22 показаны результаты очистки hThr, фракции 9-14 были объединены.
На Фигуре 23 показана стандартная ВЭЖХ-хроматограмма рацемической смеси L-метионинсульфоксида, подвергнутого дериватизации реагентом Marfey.
На Фигуре 24 показаны результаты ВЭЖХ продуктов реакции с использованием IDO после обработки реагентом Marfey.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
1. Диоксигеназа настоящего изобретения.
Термин "диоксигеназы", как он употребляется в настоящем описании, относится к группе ферментов, катализирующих включение молекулы кислорода в состав молекулы органического субстрата. Диоксигеназы согласно настоящему изобретению имеют α-кетоглутарат-зависимую и Fe2+-зависимую активность. Термин "α-кетоглутарат-зависимая активность", как он употребляется в настоящем описании, относится к ферментативной активности катализа реакции, сопряженной с образованием сукцината из α-кетоглутарата. Термин "Fe2+-зависимая активность" означает, что каталитический центр фермента содержит ион Fe2+. Более конкретно, диоксигеназа согласно настоящему изобретению содержит в каталитическом центре ион Fe2+ и катализирует включение одного атома кислорода в молекулу субстрата, конкретно в молекулу L-аминокислоты, сопряженное с образованием сукцината из α-кетоглутарата с использованием другого атома кислорода.
Термин "гидроксилированная L-аминокислота", как он употребляется в настоящем описании, относится к L-аминокислоте, содержащей дополнительно одну гидроксильную группу или более как результат гидроксилирования с участием диоксигеназы. Согласно настоящему изобретению гидроксилированной L-аминокислотой может быть гидроксилированная L-аминокислота, однако предпочтительней гидроксилированный изолейцин, гидроксилированный метионин, гидроксилированный треонин, гидроксилированный лейцин или гидроксилированный валин. Например, изолейцин в результате реакции гидроксилирования может быть трансформирован в 4-гидроксиизолейцин, 4'-гидроксиизолейцин, 3-гидроксиизолейцин, 5-гидроксиизолейцин, 4,4'-дигидроксиизолейцин, 3,4-дигидроксиизолейцин и т.д.; валин может быть трансформирован в 3-гидроксивалин, 4-гидроксивалин, 4'-гидроксивалин, 3,4-дигидроксивалин или 3,4'-дигидроксивалин; треонин может быть трансформирован в 4-гидрокситреонин; лейцин может быть трансформирован в 3-гидроксилейцин, 4-гидроксилейцин, 5-гидроксилейцин, 5'- гидроксилейцин, 3,4-дигидроксиизолейцин, 5,5'-дигидроксиизолейцин и т.д.; метионин может быть трансформирован в 3-гидроксиметионин, 2-амино-4-(метилсульфокси)масляную кислоту.
Авторы настоящего изобретения обнаружили процесс каскадного гидроксилирования изолейцина с участием оксигеназ HilA и HilB. HilA катализирует трансформацию Ile (2S, 3R) в 4'-HIL (2S, 3R), а HilB катализирует трансформацию 4'-HIL (2S, 3R) в 4',4-DHIL (2S, 3R, 4S) и 4',4-DHIL (2S, 3R, 4R) (Фиг.4). Авторы настоящего изобретения клонировали, экспрессировали как his6-tag производные и очистили предполагаемые диоксигеназы из: Pantoea ananatis (HT-paa-HilA и HT-paa-HilB), Methylobacillus flagellatus KT (HT-mfl-DO-B), Gluconobacter oxydans 621H (HT-gox-DO-B), Agrobacterium vitis (HT-avi-DO-B); Bordetella petrii DSM 12804 (HT-bpe-DO-A и HT-bpe-DO-B); Streptomyces fradiae (HT-sfr-DO-В); метагеном морских организмов (НТ-mme-DO-B); Photorhabdus luminescens subsp. laumondu TTO1 (HT-plu-DO-B); Gloeobacter violaceus PCC7421 (HT-gvi-DO-B); Psychromonas sp. CNPT3 (HT-psh-DO-A); Mesorhizobium loti (HT-mlo-DO-A); Anabaena variabilis ATCC 29413 (HT-ava-DO-A); Burkholderia sp. (HT-bur-DO-A). Сконструирована библиотека из 15 диоксигеназ, принадлежащих к семействам HilA и HilB диоксигеназ.
ДНК, кодирующая диоксигеназу HT-paa-HilA (из Pantoea ananatis), представлена в Перечне последовательностей под номером SEQ ID No:1. Кроме того, аминокислотная последовательность HT-paa-HilA, кодируемой нуклеотидной последовательностью SEQ ID NO:1, представлена в Перечне последовательностей под номером SEQ ID No:2.
ДНК, кодирующая диоксигеназу HT-paa-HilB (из Pantoea ananatis), представлена в Перечне последовательностей под номером SEQ ID No:3. Кроме того, аминокислотная последовательность HT-paa-HilB, кодируемой нуклеотидной последовательностью SEQ ID NO:3, представлена в Перечне последовательностей под номером SEQ ID No:4.
ДНК, кодирующая диоксигеназу KT HT-mfl-DO-B (из Methylobacillus flagellatus), представлена в Перечне последовательностей под номером SEQ ID No:5. Кроме того, аминокислотная последовательность KT HT-mfl-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:5, представлена в Перечне последовательностей под номером SEQ ID No:6.
ДНК, кодирующая диоксигеназу HT-gox-DO-B (из Gluconobacter oxydans 621H), представлена в Перечне последовательностей под номером SEQ ID No:7. Кроме того, аминокислотная последовательность HT-gox-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:7, представлена в Перечне последовательностей под номером SEQ ID No:8.
ДНК, кодирующая диоксигеназу HT-avi-DO-B (из Agrobacterium vitis), представлена в Перечне последовательностей под номером SEQ ID No:9. Кроме того, аминокислотная последовательность HT-avi-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:9, представлена в Перечне последовательностей под номером SEQ ID No:10.
ДНК, кодирующая диоксигеназу HT-bpe-DO-A (из Bordetella petrii DSM 12804), представлена в Перечне последовательностей под номером SEQ ID No:11. Кроме того, аминокислотная последовательность HT-bpe-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:11, представлена в Перечне последовательностей под номером SEQ ID No:12.
ДНК, кодирующая диоксигеназу HT-bpe-DO-B (из Bordetella petrii DSM 12804), представлена в Перечне последовательностей под номером SEQ ID No:13. Кроме того, аминокислотная последовательность HT-bpe-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:12, представлена в Перечне последовательностей под номером SEQ ID No:14.
ДНК, кодирующая диоксигеназу HT-sfr-DO-B (из Streptomyces fradiae), представлена в Перечне последовательностей под номером SEQ ID No:15. Кроме того, аминокислотная последовательность HT-sfr-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:15, представлена в Перечне последовательностей под номером SEQ ID No:16.
ДНК, кодирующая диоксигеназу HT-mme-DO-B (из метагенома морских организмов), представлена в Перечне последовательностей под номером SEQ ID No:17. Кроме того, аминокислотная последовательность HT-mme-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:17, представлена в Перечне последовательностей под номером SEQ ID No:18.
ДНК, кодирующая диоксигеназу HT-plu-DO-B (из Photorhabdus luminescens subsp. laumondii TT01), представлена в Перечне последовательностей под номером SEQ ID No:19. Кроме того, аминокислотная последовательность HT-plu-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:19, представлена в Перечне последовательностей под номером SEQ ID No:20.
ДНК, кодирующая диоксигеназу T-gvi-DO-B (из Gloeobacter violaceus PCC7421), представлена в Перечне последовательностей под номером SEQ ID No:21. Кроме того, аминокислотная последовательность T-gvi-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:21, представлена в Перечне последовательностей под номером SEQ ID No:22.
ДНК, кодирующая диоксигеназу HT-psh-DO-A (из Psychromonas sp. CNPT3), представлена в Перечне последовательностей под номером SEQ ID No:23. Кроме того, аминокислотная последовательность HT-psh-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:23, представлена в Перечне последовательностей под номером SEQ ID No:24.
ДНК, кодирующая диоксигеназу HT-mlo-DO-A (из Mesorhizobium loti), представлена в Перечне последовательностей под номером SEQ ID No:25. Кроме того, аминокислотная последовательность HT-mlo-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:25, представлена в Перечне последовательностей под номером SEQ ID No:26.
ДНК, кодирующая диоксигеназу T-ava-DO-A (из Anabaena variabilis ATCC 29413), представлена в Перечне последовательностей под номером SEQ ID No:27. Кроме того, аминокислотная последовательность T-ava-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:27, представлена в Перечне последовательностей под номером SEQ ID No:28.
ДНК, кодирующая диоксигеназу HT-bur-DO-A (из Burkholderia sp.), представлена в Перечне последовательностей под номером SEQ ID No:29. Кроме того, аминокислотная последовательность HT-bur-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:29, представлена в Перечне последовательностей под номером SEQ ID No:30.
ДНК, кодирующая диоксигеназу Ido (из Bacillus thuringiensis 2e2), представлена в Перечне последовательностей под номером SEQ ID No:53. Кроме того, аминокислотная последовательность Ido, кодируемой нуклеотидной последовательностью SEQ ID NO:53, представлена в Перечне последовательностей под номером SEQ ID No:54.
ДНК, кодирующая диоксигеназу Dox1 (из Pseudomonas syringae pv. phaseolicola 1448A), представлена в Перечне последовательностей под номером SEQ ID No:55. Кроме того, аминокислотная последовательность Dox1, кодируемой нуклеотидной последовательностью SEQ ID NO:55, представлена в Перечне последовательностей под номером SEQ ID No:56.
ДНК, кодирующая диоксигеназу Dox2 (из Pseudomonas syringae pv. phaseolicola 1448A), представлена в Перечне последовательностей под номером SEQ ID No:57. Кроме того, аминокислотная последовательность Dox2, кодируемой нуклеотидной последовательностью SEQ ID NO:57, представлена в Перечне последовательностей под номером SEQ ID No:58.
ДНК, кодирующая диоксигеназу Dox (из Burkholderia phytofirmans PsJN), представлена в Перечне последовательностей под номером SEQ ID No:59. Кроме того, аминокислотная последовательность Dox, кодируемой нуклеотидной последовательностью SEQ ID NO:59, представлена в Перечне последовательностей под номером SEQ ID No:60.
ДНК, кодирующая диоксигеназу Dox (из Nostoc punctiforme PCC 73102), представлена в Перечне последовательностей под номером SEQ ID No:61. Кроме того, аминокислотная последовательность Dox, кодируемой нуклеотидной последовательностью SEQ ID NO:61, представлена в Перечне последовательностей под номером SEQ ID No:62.
ДНК, кодирующая диоксигеназу Dox (из Burkholderia ambifaria AMMD), представлена в Перечне последовательностей под номером SEQ ID No:63. Кроме того, аминокислотная последовательность Dox, кодируемой нуклеотидной последовательностью SEQ ID NO:63, представлена в Перечне последовательностей под номером SEQ ID No:64.
ДНК, кодирующая диоксигеназу, принадлежащую к семейству диоксигеназ HilA или HilB, - не только ДНК, представленная в Перечне последовательностей под номером SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63. Это связано с тем, что у представителей различных родов или штаммов бактерий, образующих диоксигеназы, принадлежащие к семейству диоксигеназ HilA или HilB, возможны некоторые вариации в нуклеотидных последовательностях.
ДНК согласно настоящему изобретению включает в себя не только выделенную из бактерии ДНК, кодирующую диоксигеназу, принадлежащую к семейству диоксигеназ HilA или HilB, но также и ДНК, кодирующую диоксигеназу, принадлежащую к семейству диоксигеназ HilA или HilB, в которую были искусственно введены мутации. Эта ДНК может быть выделена из хромосомы микроорганизма, синтезирующего диоксигеназу, принадлежащую к семейству диоксигеназ НПА или НПВ. ДНК настоящего изобретения должна кодировать диоксигеназу, способную катализировать реакцию гидроксилирования аминокислоты. Способы искусственного введения мутаций включают типичные способы введения сайт-специфических мутаций, описанные в Method, in Enzymol., 154 (1987).
ДНК согласно настоящему изобретению также включает в себя ДНК, гибридизующуюся в жестких условиях с ДНК, нуклеотидная последовательность которой комплементарна нуклеотидной последовательности SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63, и кодирующую диоксигеназу, способную катализировать реакцию гидроксилирования аминокислоты. «Жесткие условия» включают такие условия, при которых специфические гибриды образуются, а неспецифические гибриды не образуются.
Хотя трудно точно численно выразить эти условия, в качестве примера, условия, при которых молекулы ДНК, имеющие более высокую гомологию, например предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90% и наиболее предпочтительно не менее 95%, гибридизуются, а молекулы ДНК, имеющие более низкую гомологию, не гибридизуются друг с другом, или такие условия, при которых гибридизация имеет место в типичных условиях отмывки, соответствующих методике гибридизации по Саузерну, таких как концентрация солей 0.1×SSC и 0.1% SDS при 37°С, предпочтительно 0.1×SSC и 0.1% SDS при 60°С и более предпочтительно 0.1×SSC и 0.1% SDS при 65°С. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно она варьирует от 100 до 1000 п.н. Кроме того, "активность диоксигеназы L-аминокислоты" может быть описана как активность, осуществляющая синтез гидроксилированной L-аминокислоты из L-аминокислоты. Однако, когда нуклеотидная последовательность гибридизуется в жестких условиях с ДНК, нуклеотидная последовательность которой комплементарна нуклеотидной последовательности SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63, она предпочтительно сохраняет активность диоксигеназы L-аминокислоты на уровне 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более, от активности белка, имеющего аминокислотную последовательность, представленную в Перечне последовательностей под номером SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62 или SEQ ID No:64 соответственно, в условиях 37°С и рН 8.
Кроме того, ДНК согласно настоящему изобретению также включает в себя ДНК, кодирующую белок, в большой степени идентичный диоксигеназе L-аминокислоты, кодируемой ДНК с нуклеотидной последовательностью SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63. А именно, следующие ДНК также включены в понятие ДНК согласно настоящему изобретению:
(a) ДНК с нуклеотидной последовательностью SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК, нуклеотидная последовательность которой комплементарна нуклеотидной последовательности SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63, и кодирующая белок, обладающий активностью диоксигеназы L-аминокислоты;
(c) ДНК, кодирующая белок с аминокислотной последовательностью SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62 или SEQ ID No:64;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62 или SEQ ID No:64, обладающий активностью диоксигеназы L-аминокислоты; и
(e) ДНК, кодирующая белок с аминокислотной последовательностью, которая имеет гомологию по крайней мере 70%, предпочтительно гомологию по крайней мере 80%, более предпочтительно гомологию по крайней мере 90% и еще более предпочтительно гомологию по крайней мере 95% с аминокислотной последовательностью SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62 или SEQ ID No:64, обладающий активностью диоксигеназы L-аминокислоты.
В рамках настоящего изобретения фраза «один или несколько» означает диапазон, вне которого стереоизомерия аминокислотных остатков белка или активность диоксигеназы L-аминокислоты изменяется незначительно и, в частности, соответствует значениям от 1 до 78, предпочтительно от 1 до 52, более предпочтительно от 1 до 26 и еще более предпочтительно от 1 до 13.
Замена, делеция, вставка, добавление или инверсия одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность фермента при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, Ile или Leu.
Кроме того, "активность диоксигеназы L-аминокислоты" может быть описана как катализирующая реакцию гидроксилирования аминокислоты. Однако, когда аминокислотная последовательность SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62, SEQ ID No:64 содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков, она предпочтительно сохраняет активность диоксигеназы L-аминокислоты на уровне 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более, по сравнению с белком с аминокислотной последовательностью SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62, SEQ ID No:64 в услових 30°С и рН 6.0. Активность диоксигеназы L-аминокислоты диоксигеназы настоящего изобретения может быть определена методом анализа образования гидроксилированной L-аминокислоты из L-аминокислоты с использованием высокоэффективной жидкой хроматографии (ВЭЖХ).
Кроме того, ДНК, гомологичная ДНК с последовательностью SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61, SEQ ID No:63, может быть использована в качестве гена, кодирующего диоксигеназу L-аминокислоты настоящего изобретения. Кодирует гомологичная ДНК диоксигеназу L-аминокислоты или нет, может быть подтверждено измерением активности диоксигеназы L-аминокислоты лизата клеток или лизата микроорганизма, в котором гомологичная ДНК сверхэкспрессированна.
ДНК, гомологичная ДНК с последовательностью SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61, SEQ ID No:63, также может быть получена из генома других видов бактерий, принадлежащих к родам Pantoea, Methylobacillus, Gluconobacter, Agrobacterium, Bordetella, Streptomyces, Photorhabdus, Gloeobacter, Psychromonas, Mesorhizobium, Anabaena, Burkholderia, или бактерий, геном которых описан в проекте метагенома морских организмов.
1. Бактерия согласно настоящему изобретению.
Термин «бактерия/микроорганизм», как он используется в настоящем описании, включает в себя синтезирующую фермент бактерию/микроорганизм, мутант и генетический рекомбинант такой бактерии/микроорганизма, в которых присутствует или увеличена активность целевого фермента и т.п.
Имеются сведения о довольно большом числе белков, обладающих α-кетоглутарат-зависимой ферментной активностью, таких как α-кетоглутарат-зависимые диоксигеназы. Примеры таковых включают диоксигеназы, используемые для получения полезных продуктов, такие как Pro диоксигеназа, трансформирующая L-Pro в гидрокси-Pro (APPLIED AND ENVIRONMENTAL MICROBIOLOGY, Sept. 1999, p.4028-4031), γ-бутиробетаиндиоксигеназа, конвертирующая γ-бутиробетаин в L-карнитин (WO2005/083089). Кроме этих диоксигеназ, имеются сведения о большом числе диоксигеназ. Например, в: Critical Reviews in Biochemistry and Molecular Biology, 39:21-68, 2004; NATURE CHEMICAL BIOLOGY, 4 NUMBER 3 MARCH: 152-156, 2008. Что касается описанных в обзорах α-кетоглутарат-зависимых диоксигеназ, бактерия модифицирована с целью ослабления экспрессии гена, кодирующего оксоглутаратдегидрогеназу (например, ΔsucAB, ΔsucA, ΔsucB), предпочтительно модифицирована с целью ослабления экспрессии генов, кодирующих оксоглутаратдегидрогеназу и изоцитратлиазу (например, (ΔsucAB, ΔsucA или ΔsucB) плюс ΔасеА), более предпочтительно модифицирована с целью ослабления экспрессии генов, кодирующих оксоглутаратдегидрогеназу, изоцитратлиазу и фосфатазу изоцитратдегидрогеназы (например, (ΔsucAB, ΔsucA или ΔsucB) плюс ΔaceAK), такая бактерия представлена штаммом Е.coli MG1655 (ΔsucAB, ΔaceAK), описанным в нижеприведенных Примерах, она рассматривается как основной хозяин для эффективного использования α-кетоглутарата, образующегося из источника углерода, такого как D-глюкоза, в α-кетоглутарат-зависимых ферментативных реакциях.
Настоящее изобретение