Фармацевтическая композиция
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, в частности к пероральной фармацевтической композиции в прессованной таблетированной форме, включающей паратироидный гормон (РТН), 5-CNAC или ее соль, дезинтегрирующий агент и растворитель, при этом время распадаемости композиции составляет не более 6 мин, а растворимость более 90% происходит в течение 20 мин, а также к способу получения указанной фармацевтической композиции. Группа изобретений обеспечивает эффективную доставку РТН, таблетка быстро распадается и/или растворяется и активный ингредиент оказывает терапевтическое воздействие. 2 н. и 8 з.п. ф-лы, 7 пр., 5 ил., 2 табл.
Реферат
Настоящее изобретение относится к новой фармацевтической композиции для пероральной доставки фармацевтических соединений, прежде всего полиаминокислот, включая пептиды, или в другом варианте пептидомиметики.
Прежде всего, настоящее изобретение относится к новой пероральной фармацевтической композиции, включающей полиаминокислоты, предназначенные для лечения нарушения, вызванного аномальной резорбцией костной ткани и/или для лечения артрита и других заболеваний.
Предпосылки создания настоящего изобретения
Гормоны
Полиаминокислоты, которые используют или предлагают для использования в фармацевтических или ветеринарных целях, включают, без ограничения перечисленным, соединения из синтетического, природного или рекомбинантного источников: полипептидные гормоны, такие как кальцитонины, например кальцитонин лосося, гормон роста, включая гормон роста человека (hGH), рекомбинантный гормон роста человека (rhGH), бычий гормон роста и свиной гормон роста, факторы, высвобождающие гормон роста и гипофизарный гормон.
Паратироидный гормон (РТН) является полноцепным пептидом, содержащим 84 аминокислотных остатка, и включает, например, гормон человека, hPTH (1-84), или любой полипептид, белок, фрагмент белка или модифицированный фрагмент, т.е. РТН-родственные пептиды и аналоги РТН, способные проявлять активность hPTH (1-84) в контролируемом метаболизме кальция и фосфатов для формирования костной ткани в организме человека. Фрагменты РТН обычно включают по крайней мере первые 28 N-концевых остатков и включают, например, РТН (1-28), РТН (1-31), РТН (1-34), РТН (1-37), РТН (1-38) и РТН (1-41) и их аналоги, например PTS893. РТН является индивидуальным соединением или комбинацией двух или более РТН.
Предпочтительным фрагментом РТН является РТН (1-34).
Указанные паратироидные гормоны выпускаются в промышленности или их получают рекомбинантным способом, пептидным синтезом или экстракцией из биологических жидкостей человека по известным методикам.
РТН обычно вводят в эффективном количестве для стимуляции образования новой костной ткани, т.е. в терапевтически эффективном количестве. Это количество зависит от возраста, массы, пола и состояния субъекта, нуждающегося в таком лечении, природы и тяжести заболевания и т.п. Однако однократная доза может включать меньшую дозу по сравнению с назначенной дозой, если вводить несколько лекарственных композиций, т.е. можно вводить общее эффективное количество, которое составляет сумму однократных доз. Однократная доза РТН может иногда включать большую дозу по сравнению с эффективным количеством, если композиция является средством с замедленным высвобождением фармакологически активного агента. Общее количество используемого РТН определяют известными способами. Однако в общем случае удовлетворительные результаты получают при систематическом введении суточной дозы от приблизительно 0,001 мкг/кг до приблизительно 10 мг/кг массы тела животного, предпочтительно от 1 мкг/кг до приблизительно 6 мкг/кг массы тела.
Предпочтительным фармакологически активным агентом является фармакологически активный пептид, прежде всего кальцитонин. Известный класс фармакологически активных агентов, к которому относятся кальцитонины, используют в различных областях фармацевтики и обычно применяют для лечения, например, болезни Педжета, гиперкальцемии и постклимактерического остеопороза. Кальцитонин, например кальцитонин угря (Asu-17) или человека, является длинноцепочечным полипептидным гормоном, секретируемым парафолликулярными клетками щитовидной железы млекопитающих, ультимобранхиальными железами рыб и птиц. Различные кальцитонины, включая кальцитонин лосося, свиньи и угря, являются коммерческими препаратами и обычно применяются для лечения, например, заболевания Педжета, злокачественной гиперкальцемии и остеопороза. Кальцитонин означает любой кальцитонин, включая природный, синтетический или рекомбинантный, а также производные кальцитонина, такие как кальцитонин угря 1,7-Asu. Композиции включают индивидуальный кальцитонин или любые комбинации двух и более кальцитонинов. Предпочтительным является синтетический кальцитонин лосося.
Кальцитонин является коммерческим препаратом или его получают с использованием известных методик.
Количество фармакологически активного агента обычно означает эффективное количество, обеспечивающее достижение требуемой цели, например терапевтически эффективное количество. Однако однократная доза может включать меньшую дозу по сравнению с назначенной дозой, если вводить несколько лекарственных композиций, т.е. можно вводить общее эффективное количество, которое составляет общую дозу. Однократная доза активного агента может иногда включать большую дозу по сравнению с эффективным количеством, если композиция является средством с замедленным высвобождением фармакологически активного агента. Общее количество используемого активного агента определяют известными способами. Однако поскольку композиции обеспечивают более эффективную доставку активного агента по сравнению с известными композициями, субъекту можно вводить меньшее количество активного агента по сравнению и известными стандартными лекарственными формами или системами доставки, при этом достигается аналогичный уровень лекарственного агента в крови и/или терапевтический эффект.
Пригодная доза кальцитонина зависит, например, от количества вводимого кальцитонина и тяжести состояния, подлежащего лечению. Однако в общем случае удовлетворительные результаты получают при систематическом интраназальном введении или введении в виде инъекций в суточной дозе от приблизительно 0,5 мкг/кг до приблизительно 10 мкг/кг массы тела животного в сутки, предпочтительно от 1 мкг/кг до приблизительно 6 мкг/кг массы тела.
Гормон роста человека (hGH) (или соматотропный гормон или соматотропин) представляет собой полипептидный гормон, секретируемый передней долей гипофиза, который обеспечивает рост тела, прежде всего за счет стимуляции высвобождения соматомедина, и влияет на метаболизм белков, углеводов и липидов.
Термин hGH включает различные природные или синтетические соединения, регулирующие рост животных или растений, такие как гипофизарный гормон роста у позвоночных и ауксин у растений.
Заболевания костной ткани
Известно множество заболеваний костной ткани. Первый класс заболеваний относится к нарушениям, вызванным резорбцией костной ткани. Примеры таких нарушений включают остеопороз, остеолиз и заболевание Педжета.
Ко второму классу нарушений относятся артриты. Примерами таких нарушений являются остеоартриты.
Новые составы
В последнее время предпринималось множество попыток улучшить абсорбцию полиаминокислот, таких как пептиды и белки, например гормоны. В основном предполагается, что пептиды и белки необходимо защищать от воздействия среды желудочно-кишечного тракта, в которой содержится большое количество пептидаз и происходит деградация пептидов и белков. Установлено, что нанесение энтеросолюбильного покрытия и добавление ингибиторов пептидаз в состав фармацевтических композиций эффективно повышает абсорбцию полиаминокислот, например белков и пептидов при пероральном введении.
Однако такие подходы сами по себе не обеспечивают достаточной защиты для достижения удовлетворительного уровня концентрации пептидов и белков в плазме, таким образом существует необходимость в разработке альтернативных способов доставки лекарственных средств, включающих пептиды и белки, и одновременно способов их защиты от химической и ферментативной деградации для обеспечения терапевтического эффекта.
Разработка таких способов прежде всего необходима в случае кальцитонинов, для которых пероральный способ является предпочтительным способом введения, поскольку этот способ является наиболее простым, удобным и практически безболезненным, что повышает согласие пациентов с курсом лечения по сравнению с другими курсами лечения.
Краткое изложение сущности изобретения
Настоящее изобретение относится к фармацевтической композиции для эффективной доставки лекарственных средств в фармацевтически эффективном количестве, прежде всего полиаминокислот, таких как пептиды, пептидомиметики и белки, например гормоны, при пероральном введении субъекту для достижения требуемого терапевтического эффекта.
Настоящее изобретение также относится к пероральной фармацевтической композиции, включающей в качестве активного ингредиента полиаминокислоту, например пептид или белок, при этом время распадаемости фармацевтической композиции и/или скорость растворения являются достаточно высокими, чтобы активный ингредиент оказывал терапевтический эффект.
В одном объекте настоящего изобретения предлагаются фармацевтические композиции, включающие в качестве активного ингредиента пептид или белок, при этом время распадаемости фармацевтической композиции, например таблетки, составляет до 10 мин.
Настоящее изобретение также относится к фармацевтической композиции, например таблетке или капсуле, время растворения которых составляет до 30 мин, например до 20 мин, обычно до 10 мин.
Прежде всего, настоящее изобретение относится к фармацевтическим композициям, включающим в качестве активного ингредиента кальцитонин в смеси с агентом для доставки 5-CNAC, и полученная фармацевтическая композиция обеспечивает улучшенную пероральную биодоступность, например удовлетворительную или оптимальную пероральную биодоступность кальцитонина в качестве активного ингредиента.
Термин «биодоступность», использованный в настоящем описании, означает часть дозы, которая достигает кровотока после введения указанной лекарственной формы. Более подробно указанный термин означает отношение количества лекарственного средства, «абсорбированного» из исследуемого состава, к количеству, «абсорбированному» после введения стандартного состава. Часто термин «стандартный состав», используемый для оценки биодоступности, означает водный раствор лекарственного средства, который вводят внутривенно.
Абсорбированное количество лекарственного средства рассматривают как меру способности состава доставлять лекарственное средство к участку воздействия, которая зависит от распадаемости и растворения лекарственной формы и скорости биотрансформации по отношению к скорости абсорбции.
Лекарственные формы, включающие одинаковое количество активного лекарственного средства, могут значительно различаться по биодоступности лекарственного средства и, следовательно, по способности проявлять ожидаемые фармакодинамические и терапевтические свойства лекарственного средства.
В настоящем изобретении неожиданно было установлено, что более быстрая распадаемость фармацевтических композиций по настоящему изобретению у субъекта, например, в желудке обеспечивает улучшенные абсорбционные свойства активных пептидов и белков, где пептиды и белки в значительной степени расщепляются в присутствии пепсина или других ферментов.
Настоящее изобретение также относится к фармацевтической композиции для доставки пептида или белка при пероральном введении без необходимости нанесения энтеросолюбильного покрытия или включения ингибитора пептидаз. Таким образом, в одном варианте композиции по настоящему изобретению не содержат энтеросолюбильное покрытие или ингибиторы пептидаз, или не используют оба варианта.
Включающие кальцитонин композиции по настоящему изобретению можно использовать для лечения нарушений, связанных с аномальной резорбцией костной ткани или артрита, как описано в данном контексте.
В одном варианте настоящего изобретения предлагается пероральная фармацевтическая композиция в твердой фазе, включающая:
1) полиаминокислоту,
2) агент для доставки и необязательно,
3) разбавитель,
где время распадаемости композиции составляет не более 10 мин, а растворение >80% происходит в течение 20 мин, прежде всего время распадаемости составляет не более 6 мин, а растворение >90% происходит в течение 20 мин.
Прежде всего, композиция по настоящему изобретению характеризуется временем распадаемости не более 2 мин.
В еще одном варианте композиция по настоящему изобретению дополнительно включает дезинтегрирующий агент, прежде всего выбранный из группы, включающей любой из супердезинтегрирующих агентов, таких как кросповидон или повидон, и/или другой агент, снижающий время распадаемости, например, при получении шипучих таблеток или других лекарственных форм.
В другом варианте настоящего изобретения фармацевтическая композиция характеризуется растворением в желудочной среде >80% в течение не более 20 мин.
Настоящее изобретение также относится к фармацевтической композиции в форме таблетки, прежде всего прессованной таблетки, твердость которой составляет от 3 кПа до 20 кПа, прежде всего от 5 кПа до 15 кПа, более предпочтительно от 5 кПа до 7 кПа.
В одном варианте композиция по настоящему изобретению включает полипептидный гормон, прежде всего кальцитонин, более предпочтительно кальцитонин лосося.
Прежде всего кальцитонин содержится в терапевтически эффективном количестве в свободной форме или в форме соли, что обеспечивает достижение максимальной концентрации в плазме крови (Сmах) не менее 400 пг/мл, прежде всего не менее 800 пг/мл, более предпочтительно не менее 1000 пг/мл, и/или снижение уровня кальция в плазме до величины >20% в течение 6 ч, как показано на модели приматов, прежде всего обезьян.
В еще одном варианте настоящего изобретения композиция включает терапевтически эффективное количество кальцитонина в свободной форме или в форме соли в количестве от 0,15 мг до 2,5 мг, прежде всего от 0,15 мг до 0,4 мг.
Композиция по настоящему изобретению может также включать агент для доставки 5-CNAC и/или кросповидон и/или повидон в качестве дезинтегрирующего агента. Композиция также может включать один или более загустителей, стабилизаторов и сухих связующих агентов.
В одном варианте настоящего изобретения предлагается фармацевтическая композиция в форме таблетки массой 500 мг.
В отдельном варианте настоящего изобретения фармацевтическая композиция включает:
| Кальцитонин лосося | от 0,03 до 0,5 мас.% |
| Тонкоизмельченный 5-CNAC | от 5 до 80 мас.% |
| Avicel PH 102 или 101 | от 0 до 70 мас.% |
| Кросповидон NF | от 0 до 10 мас.% |
| Стеарат магния | от 0 до 1,5 мас.% |
| Cab-o-sil | от 0 до 1,5 мас.% |
где общее количество составляет 100%.
Настоящее изобретение также относится к фармацевтической композиции, включающей:
а) композицию по настоящему изобретению, описанную в данном контексте и
б) совместный агент, которым является ингибитор резорбции костной ткани или ингибитор катепсина К.
В еще одном варианте изобретение относится к способу получения пероральной фармацевтической композиции, который включает следующие стадии:
а) смешивание полиаминокислоты, носителя и дезинтегрирующего агента, при этом получают первую смесь,
б) необязательно добавление сухого связующего в первую смесь, при этом получают вторую смесь,
в) необязательно добавление стабилизатора во вторую смесь, при этом получают третью смесь,
г) прессование третьей смеси в таблетки, твердость которых составляет от 5 кПа до 20 кПа.
В еще одном варианте изобретение относится к применению фармацевтической композиции по настоящему изобретению, описанной в данном контексте, для получения лекарственного средства, предназначенного для лечения заболеваний, вызванных аномальной резорбцией костной ткани, таких как, например, остеопороз, артрит или остеоартрит.
Настоящее изобретение также относится к способу определения абсорбционных свойств композиции по настоящему изобретению, описанной в данном контексте, который заключается в том, что:
а) определяют время распадаемости,
б) коррелируют время распадаемости и время растворения.
В другом варианте настоящее изобретение относится к способу предварительного определения максимума концентрации активного ингредиента (Сmах) в плазме пациента, которого лечат при пероральном введении фармацевтической композиции, включающей указанный активный ингредиент, предпочтительно кальцитонин, более предпочтительно кальцитонин лосося, и агент для доставки. Указанный способ включает такое сочетание времени распадаемости фармацевтической композиции и/или времени растворения активного ингредиента, которое обеспечивает благоприятное микроокружение в желудочно-кишечном тракте для растворения активного ингредиента в кишечнике, чтобы оптимизировать абсорбцию активного ингредиента и достижение терапевтически эффективной максимальной концентрации активного ингредиента в плазме крови, прежде всего максимальная концентрация в плазме составляет не менее 400 пг/мл.
Прежде всего, благоприятное микроокружение в желудочно-кишечном тракте для растворения активного ингредиента в кишечнике обеспечивается при добавлении в композицию 5-CNAC.
В одном варианте предлагается способ предварительного определения максимальной концентрации активного ингредиента в плазме (Сmах) у пациента, которого лечат при пероральном введении фармацевтической композиции, и пероральную фармацевтическую композицию получают в форме таблетки, а время распадаемости регулируют при изменении твердости таблетки, прежде всего получают таблетки, твердость которых составляет от 3 кПа до 20 кПа и/или время распадаемости которых составляет менее 10 мин, прежде всего менее 1 мин.
В еще одном варианте настоящее изобретение относится к применению для получения пероральной фармацевтической композиции, характеризующейся временем распадаемости и/или растворения не более 10 мин, и включающей
1) полиаминокислоту,
2) агент для доставки,
3) дезинтегрирующий агент.
Прежде всего, для обеспечения благоприятного микроокружения для растворения кальцитонина лосося в желудочно-кишечном тракте используют 5-CNAC.
Подробное описание вариантов осуществления изобретения
Настоящее изобретение относится к пероральной фармацевтической композиции, включающей полиаминокислоту в качестве активного ингредиента, например пептид или белок, а время распадаемости фармацевтической композиции является достаточным, чтобы обеспечивать адекватное терапевтическое действие активного ингредиента.
Настоящее изобретение также относится к пероральной фармацевтической композиции, включающей в качестве активного ингредиента полиаминокислоту, например пептид или белок, а скорость растворения фармацевтической композиции является достаточной, чтобы обеспечивать адекватное терапевтическое действие активного ингредиента.
Настоящее изобретение относится к пероральной фармацевтической композиции, включающей в качестве активного ингредиента полиаминокислоту, например пептид или белок, в которой величины и времена распадаемости и скорости растворения фармацевтической композиции являются достаточными, чтобы обеспечивать адекватное терапевтическое действие активного ингредиента.
Учитывая, что скорость распадаемости является высокой, т.е. составляет миллисекунды, предполагается, что такая быстрая раепадаемость не компенсируется растворением. Однако неожиданно было установлено, что достаточно высокий терапевтический уровень активного ингредиента достигается за относительно короткий промежуток времени, который компенсирует биохимическое разложение (например, в желудочно-кишечном тракте) активного ингредиента.
Следует отметить, что в результате увеличения концентрации терапевтически активного ингредиента в плазме исключается необходимость добавлять в композицию значительное количество активного ингредиента по сравнению с композициями, не обладающими свойствами, описанными в данном контексте. Такие свойства обеспечивают не только преимущество за счет снижения стоимости полученного лекарственного средства, но и снижают риск образования нежелательных или даже токсичных метаболитов активного ингредиента в организме у субъекта.
Кроме того, композиции по настоящему изобретению можно использовать в способе контроля терапевтического уровня активного ингредиента, например концентрации активного ингредиента в плазме. Другими словами, если существует линейная или практически линейная зависимость между распадаемостью, растворением и/или концентрацией активного ингредиента в плазме, то можно предварительно определить требуемую концентрацию в плазме в любое данное время при выборе конкретного состава с определенным временем распадаемости и/или растворения.
С этой целью настоящее изобретение также включает библиотеку композиций с различным временем распадаемости и/или растворения, как описано в данном контексте. Одна группа композиций включает таблетки, характеризующиеся различной твердостью, например от 3 кПа до 20 кПа, предпочтительно от 5 кПа до 20 кПа, более предпочтительно от 5 кПа до 15 кПа, наиболее предпочтительно от 5 кПа до 7 кПа. В подгруппе этой группы каждая таблетка с определенной твердостью может также включать, например, различное количество активного ингредиента, носителя, разбавителя, замасливателя, глиданта или дезинтегрирующего агента.
Настоящее изобретение также включает библиотеку композиций, в которых отсутствие замасливателя может приводить к более быстрому началу распадаемости и растворения.
В одном объекте настоящего изобретения предлагается пероральная фармацевтическая композиция, для которой время растворения или время распадаемости составляет до 10 мин, или оба параметра составляют до 10 мин.
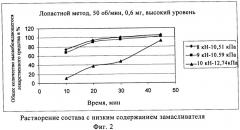
Настоящее изобретение относится к композициям, степень растворения которых составляет от 20% до 100% по данным анализа USP II с использованием лопастной мешалки при растворении в 0,1 н. НСl и 0,01% твин-80 в течение определенного периода времени.
Прежде всего композиции по настоящему изобретению характеризуются степенью растворения от 20% до 100%, например 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% и 100% в течение периода времени от 0 до 60 мин, например, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55 и 60 мин.
В предпочтительном объекте настоящего изобретения время растворения и степень растворения, как описано выше, соответствуют композициям, время распадаемости которых составляет менее 10 мин.
В одном варианте воплощения настоящего изобретения композиция характеризуется временем распадаемости не более 10 мин и степенью растворения >80% в течение не более 20 мин, прежде всего временем распадаемости не более 6 мин и степенью растворения >90% в течение не более 20 мин, прежде всего в желудочной среде.
В еще одном варианте композиция характеризуется временем распадаемости не более 10 мин и степенью растворения >80% в течение 20 мин, прежде всего временем распадаемости не более 6 мин и степенью растворения >90% в течение 20 мин, прежде всего в желудочной среде.
Специалисту в данной области представляется очевидным, что на время распадаемости или растворения твердой фазы перорального состава влияют различные параметры, включающие:
- лекарственную форму (капсулу или таблетку),
- конкретный активный агент,
- конкретные дополнительные ингредиенты, например агент для доставки, дезинтегрирующий агент, глидант, замасливатель, разбавитель,
- количество (соотношение) ингредиентов,
- размеры частиц,
- твердость таблетки.
Таким образом, невозможно установить универсальный набор параметров, определяющих все композиции, характеризующиеся определенным временем распадаемости и/или растворения, исключив все остальные композиции. Тем не менее, специалист в данной области может получить композиции, характеризующиеся указанными временем растворения и распадаемости. Чтобы исключить сомнения, в настоящее описание включена методика измерения времени распадаемости и растворения, а также способы получения композиций с определенным временем распадаемости и растворения.
Время растворения соединения может напрямую влиять на концентрацию активного ингредиента в плазме в любое заданное время.
Настоящее изобретение включает фармацевтическую композицию в твердой фазе, включающую:
полиаминокислоту,
агент для доставки и
при необходимости разбавитель,
и композиция характеризуется временем распадаемости не более 10 мин.
Прежде всего настоящее изобретение включает:
фармацевтическую композицию для пероральной доставки полиаминокислот, включающую:
1) полиаминокислоту,
2) агент для доставки,
3) разбавитель,
и композиция характеризуется временем распадаемости не более 10 мин. Настоящее изобретение также относится к
твердой фармацевтической композиции для пероральной доставки полиаминокислот, включающей:
1) полиаминокислоту,
2) агент для доставки
3) дезинтегрирующий агент
4) разбавитель
и композиция характеризуется временем распадаемости не более 10 мин.
Твердую композицию можно получать в форме таблетки. Таблетки можно получать прессованием, как описано в данном контексте.
Полиаминокислотой является любое лекарственное средство на основе полиаминокилоты, например, включающее белок или его фрагмент. Полиаминокислота означает любую полиаминокислоту, описанную выше в разделе «Предпосылки создания настоящего изобретения». Отдельный класс фармацевтических композиций включает в качестве полиаминокислоты гормон, например полипептидный гормон, такой как кальцитонин, например кальцитонин лосося, гормон роста, включая гормоны роста человека (hGH), рекомбинантные гормоны роста человека (rhGH), свиные и бычьи гормоны роста, факторы, высвобождающие гормоны роста, и гипофизарные гормоны.
Предпочтительным активным ингредиентом является полиаминокислота.
Вопреки общепринятому мнению, неожиданно было установлено, что более быстрая распадаемость фармацевтических композиций по настоящему изобретению, например, в желудке у субъекта обеспечивает лучшие абсорбционные характеристики активных пептидов и белков, где основное расщепление пептидов и белков происходит под действием пепсина и других ферментов.
Предпочтительный класс фармацевтических композиций включает в качестве активного ингредиента кальцитонин лосося. Полиаминокислота находится в свободной форме или в форме соли.
Содержание полиаминокислоты, например кальцитонина, в композиции предпочтительно составляет от 0,03 мас.% до 1 мас.%, предпочтительно от 0,05 мас.% до 1 мас.%, более предпочтительно от 0,03 мас.% до 0,5 мас.% в расчете на общую массу фармацевтической композиции. Прежде всего, содержание полиаминокислоты, например кальцитонина, в композиции составляет от 0,05 мас.% до 0,5 мас.%, например от 0,1 мас.% до 0,2 мас.%. Например, если масса конечной фармацевтической композиции составляет 500 мг, то содержание полиаминокислоты, например кальцитонина, составляет от 0,25 мг до 5 мг.
Агентом для доставки является любой агент для доставки, пригодный для доставки полиаминокислоты пероральным способом. Агенты для доставки, использованные для получения составов, например пероральных составов, включают любые агенты, пригодные для доставки конкретного фармакологичеки активного агента. Пригодные агенты для доставки включают любые модифицированные аминокислоты, описанные в упомянутом выше патенте US 5866536 или любые модифицированные аминокислоты, описанные в упомянутом патенте US 5773647, а также любые их комбинации. Содержание упомянутых патентов US 5773647 и 5866536 включено в данный контекст в качестве ссылки.
Кроме того, в качестве агента для доставки можно использовать двунатриевую соль любой упомянутой модифицированной аминокислоты, а также их этанольные сольваты и гидраты. Пригодные соединения включают соединения формулы I:
где R1, R2, R3 и R4 независимо означают водород, -ОН, -NR6R7, галоген, С1-С4 алкил или С1-С4 алкокси,
R5 означает замещенный или незамещенный С2-С16 алкилен, замещенный или незамещенный С2-С16 алкенилен, замещенный или незамещенный С1-С12 алкил(арилен) или замещенный или незамещенный арил (C1-С12 алкилен), а
R6 и R7 независимо означают водород, кислород или С1-С4 алкил
или их гидраты и спиртовые сольваты.
Соединения формулы I, а также их двунатрисвые соли и спиртовые сольваты и гидраты, а также способы их получения описаны в заявке WO 00/059863.
Кроме того, в качестве агента для доставки можно использовать двунатриевую соль любой упомянутой выше модифицированной аминокислоты, а также ее этанольный сольват или гидрат.
Двунатриевую соль получают из этанольного сольвата при упаривании или высушивании этанольного сольвата по известной методике, при этом получают безводную двунатриевую соль. Высушивание обычно проводят при температуре от приблизительно 80 до приблизительно 120°С, предпочтительно от приблизительно 85 до приблизительно 90°С, наиболее предпочтительно при приблизительно 85°С. Стадию высушивания обычно проводят при давлении 26 мм рт.ст или более. Безводная двунатриевая соль обычно содержит приблизительно менее 5 мас.% этанола, предпочтительно менее приблизительно 2 мас.% этанола в расчете на 100% безводной двунатриевой соли. Двунатриевую соль агента для доставки также получают при суспендировании агента для доставки в воде и добавлении двух молярных эквивалентов водного раствора гидроксида натрия, алкоксида натрия и т.п.
Пригодные алкоксиды натрия включают, без ограничения перечисленным, метоксид натрия, этоксид натрия и их смеси. Еще один способ получения двунатриевой соли включает взаимодействие агента для доставки с одним молярным эквивалентом гидроксида натрия, при этом получают двунатриевую соль. Двунатриевую соль выделяют в виде твердого вещества при концентрировании раствора двунатриевой соли до состояния густой пасты при перегонке в вакууме. Пасту высушивают в вакуумном шкафу, при этом получают двунатриевую соль агента для доставки в виде твердого вещества. Твердое вещество также получают при высушивании водного раствора двунатриевой соли в сушилке с распылением. Агенты для доставки получают по известным методикам, например, как описано выше, а также как описано в US 5773647 и 5866536. Этанольные сольваты, как описано в заявке WO 00/059863, включают, без ограничения перечисленным, молекулярные или ионные комплексы молекул или ионов этанола с молекулами или ионами двунатриевой соли агента для доставки. Обычно этанольные сольваты включают приблизительно одну молекулу или один ион этанола на каждую молекулу двунатриевой соли агента для доставки. Этанольный сольват двунатриевой соли агента для доставки получают при растворении агента для доставки в этаноле.
Обычно один грамм агента для доставки растворяют в приблизительно от 1 до приблизительно 50 мл этанола, в общем случае в приблизительно от 2 до приблизительно 10 мл этанола. Агент для доставки/раствор в этаноле затем взаимодействует с молярным избытком натриевой соли, например мононатриевой соли, в отношении к агенту для доставки, т.е. на каждый моль агента для доставки добавляют более одного моля катионов натрия, при этом получают этанольный сольват. Пригодные мононатриевые соли включают, без ограничения перечисленным, гидроксид натрия, алкоксид натрия, например метоксид натрия и этоксид натрия, или любую их комбинацию.
Предпочтительно по крайней мере два молярных эквивалента мононатриевой соли добавляют в раствор этанола, т.е. на каждый моль агента для доставки добавляют приблизительно по крайней мере два моля катионов натрия. В общем случае реакцию проводят при температуре кипения смеси или менее, например, при КТ. Этанольный сольват затем выделяют по известным методикам, таким как концентрирование полученной суспензии при перегонке в атмосферных условиях, охлаждение концентрата и фильтрование твердого вещества. Полученное твердое вещество затем высушивают в вакууме и получают этанольный сольват. Гидраты двунатриевой соли агентов для доставки получают при высушивании этанольного сольвата с образованием безводной двунатриевой соли, как описано выше, и при гидратации безводной двунатриевой соли. Предпочтительно образуется моногидрат двунатриевой соли. Поскольку безводная двунатриевая соль является чрезвычайно гигроскопичной. гидрат образуется под действием влаги из атмосферы.
В общем случае стадию гидратации проводят при температуре от КТ до приблизительно 50°С, предпочтительно от КТ до 30°С и при относительной влажности окружающей среды по крайней мере 50%. В другом варианте безводную двунатриевую соль гидратируют паром.
Предпочтительные агенты для доставки выбирают из группы, включающей N-(5-хлорсалицилоил)-8-аминокаприловую кислоту (5-CNAC), N-(10-[2-гидроксибензоил]амино)каприновую кислоту (SNAD), N-(8-[2-гидроксибензоил]амино)каприловую кислоту (SNAC) и их моно- и дисоли, например мононатриевая или двунатриевая соли, этанольные сольваты солей и моногидраты солей и любые комбинации вышеперечисленных соединений, такие как, например, этанольные сольваты натриевых солей и моногидраты натриевых солей в любой комбинации. Также можно использовать другие соли, например соли калия, лития и кальция. Агенты для доставки 5-CNAC, SNAD и SNAC характеризуются высокой растворимостью в воде, прежде всего в щелочной среде кишечника и практически полностью, т.е. более 90% абсорбируются в желудочно-кишечном тракте, например в двенадцатиперстной кишке, после проглатывания в виде тонкоизмельченных или крупных частиц. Напротив, агенты для доставки могут образовывать осадок в кислотной среде, например в желудке. Предпочтительно агент для доставки получают в виде тонкоизмельченных частиц.
Неожиданно было также установлено, что определенный агент для доставки может влиять на время растворения активного ингредиента. Например, если носителем является 5-CNAC, превращение нерастворимой формы, например твердой формы натриевой соли или свободной кислоты 5-CNAC, в конкретной окружающей среде, например в кишечнике, в растворимую форму 5-CNAC, например образование раствора 5-CNAC, происходит по механизму, который способствует увеличению скорости растворения активного ингредиента, например скорость растворения составляет не более 10 мин.
Таким образом, можно предположить, что нерастворимая форма агента для доставки, которая переходит в растворимую при контактировании с окружающей средой желудочно-кишечного тракта (например, двенадцатиперстной кишки), обеспечивает высокую скорость растворения активного ингредиента.
Следовательно, агент для доставки, такой как 5-CNAC или его соли, может обеспечивать удовлетворительное или оптимальное микроокружение для удовлетворительной или оптимальной скорости растворения и/или абсорбции полиаминокислоты в качестве активного ингредиента.
Прежде всего, двунатриевая соль 5-CNAC обеспечивает удовлетворительное или оптимальное микроокружение для абсорбции кальцитонина лосося. Абсорбцию кальцитонина лосося оценивают, например, по концентрации в плазме.
В отдельном предпочтительном классе фармацевтических композиций в качестве агента для доставки используют 5-CNAC. 5-CNAC находится в свободной форме или в форме соли и необязательно содержит частицы различного размера в широком диапазоне, например средний размер частиц составляет от 50 до 5 мкм.
Предпочтительно агент для доставки находится в тонкоизмельченной форме.
Средний размер частиц тонкоизмельченного агента для доставки, например 5-CNAC, измеряют, например, измельчая крупные частицы 5-CNAC и периодически сравнивая полученные частицы с частицами известного размера до образования частиц с требуемым средним размером. Процесс измельчения 5-CNAC описан в заявке WO 2005/014031, включенной в данное описание в качестве ссылки, см. например, стр.10 и пример 1, в котором описано получение частиц 5-CNAC различного размера.
Содержание агента для доставки предпочтительно составляет от 5 мас.% до 80 мас.%, предпочтительно от 10 мас.% до 70 мас.%, бол