Композиции и способы снижения уровня h2s в ферментированных напитках
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Представлены варианты модифицированной клетки дрожжей. Каждый из вариантов продуцирует сероводород на сниженном уровне и включает экзогенный полинуклеотид, кодирующий полипептид MET10, который катализирует реакцию превращения сульфита в сульфид на сниженном уровне, где аминокислота в положении 662 полипептида MET10 представляет собой Аlа, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Gln, Arg, Val, Trp или Туr (SEQ ID NO:5). Описан экспрессирующий вектор, содержащий указанный экзогенный полинуклеотид. Описана культура указанных клеток. Предложен способ получения указанной клетки дрожжей, включающий замену эндогенного полинуклеотида, кодирующего сульфид-активный полипептид МЕТ10, на полинуклеотид, кодирующий МЕТ10 с указанной заменой в положении 662 SEQ ID NO:5, при этом родительская клетка дрожжей продуцирует сероводород. Описан способ снижения уровня H2S в среде брожения, включающий контакт среды брожения с указанной выше клеткой дрожжей. Представлены среда брожения и продукт брожения, содержащие указанную клетку или культуру клеток. Изобретение позволяет снизить уровень Н2S в ферментационной среде при производстве ферментированных напитков. 10 н. и 46 з.п. ф-лы, 8 ил., 11 табл., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение обеспечивает композиции и способы снижения уровня H2S в ферментированных напитках.
Уровень техники
Образование летучих соединений серы, таких как сероводород (H2S), в процессе спиртового брожения является проблемой, которая наносит ущерб производству пива и виноделию. Сероводород (H2S) представляет собой нежелательный побочный продукт метаболического пути восстановления сульфатов (фигура 1). Он образуется в дрожжах Saccharomyces cerevisiae в условиях брожения. Образование H2S штаммами S. cerevisiae колеблется от 0 мкг/л до 290 мкг/л, что значительно выше порога чувствительности для человека, составляющего 11 нг/л (Amoore and Hautala 1983). Это нежелательное свойство сероводорода связано с тем, что он привносит в вина запах тухлых яиц, и с тем, что, хотя H2S является летучим соединением и может быть удален путем аэрации, он потенциально способен к образованию меркаптанов и тиолов, которые сохраняются в вине благодаря низкому значению рН (Thoukis 1962). Сами меркаптаны и тиолы обнаруживаются в ароматах чеснока или в упакованных в банку овощах и там, где можно контролировать содержание летучего H2S, удаление других нежелательных соединений серы технически сложно и приводит к удалению из вина других ароматных соединений.
Образование сероводорода Saccharomyces cerevisiae - проблема производства вина, пива и сакэ, убедительно подтвержденная документальными доказательствами (Acree et al. 1972, Eschenbruch et al. 1978, Giudici and Kunkee 1994, Jiranek et al. 1995, Rauhut and Kurbel 1994, Walker and Simpson 1993). Факторы питания, например уровень азота, витаминов и кофакторов (Giudici and Kunkee 1994, Jiranek et al. 1995), и факторы окружающей среды, например температура, рН, уровень элементарной серы (Rauhut and Kurbel 1994), присутствие диоксида серы (Stratford and Rose 1985) и уровень органических соединений, содержащих серу (Acree et al. 1972), связаны с образованием летучих соединений серы в ферментированных (то есть полученных с помощью брожения) напитках. Разницу в образовании летучих соединений серы также приписывали различиям в метаболизме штаммов дрожжей (Acree et al. 1972, Spiropoulos et al. 2000).
Существует, по меньшей мере, шесть различных типов поведения дрожжевого штамма в отношении образования сероводорода: 1) повышенный уровень во всех условиях; 2) сниженный уровень во всех условиях; 3) повышенное образование в условиях, которые ниже и выше порогового содержания азота; пониженное образование в пределах «окна» для содержания азота и увеличение содержания сульфидов при уровне азота ниже или выше этого «окна»; 4) повышенное образование в ответ на лимитирующий уровень микроэлементов независимо от содержания азота; 5) повышенное образование сульфидов только при лимитирующем уровне и азота, и микроэлементов; и 6) повышенное образование сульфидов при повышенной скорости брожения, которое может быть связано со скоростью брожения и выделения двуокиси углерода или с другим фактором, например с повышенной продукцией тепла (Spiropoulos 2000, Jiranek 1995, Giudici 1994, Linderholm 2006).
Существующим методом удаления сульфидов из вина является осветление с помощью меди. Добавление меди может приводить к катализу повреждающих изменений состава, а также к повышению содержания отходов, производимых винными заводами, которые требуют специальной обработки, в конечном итоге приводящей к более высоким затратам виноделов на производство и к более высоким ценам для потребителя. Кроме того, использование меди в качестве осветляющего агента может приводить к высокому остаточному уровню меди в вине. Торгово-налоговое бюро (The Trade and Tax Bureau) допускает остаточное содержание меди в вине на уровне 0,5 мг/л (смотри, например, веб-сайт regulations.justia.com/view/89060/). Виноделы, использующие медь для удаления сероводорода, должны затем принимать меры для снижения уровня меди в вине. Принимая во внимание неблагоприятные воздействия на здоровье, связанные с избыточным поглощением меди с пищей, в частности неврологические расстройства, такие как болезнь Альцгеймера, Всемирная организация здравоохранения рекомендовала пищевые ограничения при потреблении этого соединения (смотри, например, веб-сайт who.int/water_sanitation_health/dwq/chemicals/copper.pdf). Наличие коммерческих штаммов дрожжей, которые не способны продуцировать сероводород или которые продуцируют пониженный уровень сероводорода, устранит необходимость обработки вин медью.
Таким образом, в этой области техники существует потребность в композициях и способах снижения уровня H2S в ферментированных напитках. Настоящее изобретение удовлетворяет эти и другие потребности.
Раскрытие изобретения
Настоящее изобретение предоставляет композиции и способы снижения уровня H2S в ферментированных напитках.
Один аспект изобретения обеспечивает способы снижения и устранения уровня H2S в продукте или среде брожения. В некоторых воплощениях способы включают контакт продукта или среды брожения со штаммом дрожжей, клеткой дрожжей или культурой клеток дрожжей, включающих полинуклеотид, кодирующий модифицированный полипептид МЕТ10, который не катализирует выделение свободного сероводорода из сульфита (то есть «сульфид-неактивный» полипептид МЕТ10), в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином. В некоторых воплощениях полинуклеотид кодирует полипептид МЕТ10 с последовательностью SEQ ID NO:3, где Х в положении 662 не является треонином. В некоторых воплощениях полинуклеотид включает SEQ ID NO:1.
Что касается воплощений сульфид-неактивного полипептида МЕТ10, то в некоторых воплощениях аминокислотный остаток в положении 662 полипептида МЕТ10 не является треонином или серином. В некоторых воплощениях аминокислотный остаток в положении 662 полипептида МЕТ10 является Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr (SEQ ID NO:3). В некоторых воплощениях аминокислотный остаток в положении 662 полипептида МЕТ10 является Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Val, Trp или Tyr (SEQ ID NO:5). В некоторых воплощениях аминокислотный остаток в положении 662 выбирают из группы, состоящей из Lys, Arg, His, Gln и Asn (SEQ ID NO:6). В некоторых воплощениях аминокислотный остаток в положении 662 представляет собой Lys (SEQ ID NO:7).
В некоторых воплощениях сульфид-неактивный полипептид МЕТ10 или полинуклеотид МЕТ10 является дрожжевым МЕТ10. В некоторых воплощениях сульфид-неактивный полипептид МЕТ10 идентичен, по меньшей мере, примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше последовательности МЕТ10 SEQ ID NO:3 или SEQ ID NO:4, где X в положении 662 был описан выше в этом документе. В некоторых воплощениях полинуклеотид, кодирующий сульфид-неактивный полипептид МЕТ10, идентичен, по меньшей мере, примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше последовательности SEQ ID NO: 1.
В некоторых воплощениях клетка дрожжей также не экспрессирует сульфид-активный полипептид МЕТ10, способный превращать сульфит в сульфид. В некоторых воплощениях продукт брожения представляет собой вино, пиво или шампанское. В некоторых воплощениях среду брожения можно выбирать из группы, состоящей из муста (например, виноградного муста) и сусла.
Что касается воплощений клеток дрожжей, то в некоторых воплощениях штамм дрожжей может быть штаммом Saccharomyces cerevisiae. В некоторых воплощениях штамм дрожжей может быть любым доступным в продаже штаммом, применяемым для производства пива или вина, как было описано в этом документе. Часто родительский штамм или исходный штамм является продуцентом сероводорода, который превращают в штамм, не являющийся продуцентом, путем замены нуклеиновой кислоты, кодирующей сульфид-активный полипептид МЕТ10, на нуклеиновую кислоту, кодирующую сульфид-неактивный полипептид МЕТ10. Примеры винных штаммов S. cerevisiae включают без ограничения Prise de Mousse, Premier Cuveé, French Red, Montachet, Lallemand K1, Bordeaux, UCD522, UCD940, Ba25, Ba126, Ba137, Ba220, Bb23, Bb25, Ba30, Bb32, Bb19 и Bb22. Дополнительные воплощения клеток дрожжей представлены клетками, описанными в этом документе.
Другой аспект изобретения обеспечивает изолированные полинуклеотиды, включающие последовательность нуклеиновой кислоты, которая кодирует полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином. В некоторых воплощениях аминокислота в положении 662 полипептида МЕТ10 не является треонином или серином (SEQ ID NO:5). Воплощения сульфид-неактивного полипептида МЕТ10, кодируемого полинуклеотидами, представлены воплощениями, описанными в этом документе. В некоторых воплощениях изолированный полинуклеотид, кодирующий сульфид-неактивный полипептид МЕТ10, идентичен, по меньшей мере, примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% последовательности SEQ ID NO:1. В некоторых воплощениях изолированный полинуклеотид включает последовательность нуклеиновой кислоты, представленную SEQ ID NO: 1, или последовательность, комплементарную ей.
В родственном аспекте изобретение обеспечивает экспрессионные кассеты и экспрессионные векторы, включающие полинуклеотид, кодирующий полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином (SEQ ID NO:3) и где полинуклеотид функционально связан с экспрессионной контролирующей последовательностью. Дополнительные воплощения сульфид-неактивного полипептида МЕТ10 представлены воплощениями, описанными в этом документе. Кроме того, предоставлены клетки хозяина, включающие экспрессионные векторы или экспрессионные кассеты. Клетки хозяина могут быть клетками дрожжей, например, клетками Saccharomyces cerevisiae. Дополнительные воплощения клеток дрожжей представлены клетками, описанными в этом документе. В некоторых воплощениях экспрессионная кассета или экспрессионный вектор включают промотор, который способствует экспрессии в клетке дрожжей.
В родственном аспекте изобретение обеспечивает улучшенные клетки дрожжей, которые не продуцируют сероводород в детектируемых количествах или вырабатывают сероводород на низком уровне, улучшенные клетки включают экзогенный полинуклеотид, кодирующий полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином (SEQ ID NO:3), где родительская клетка улучшенной клетки дрожжей продуцирует сероводород. В некоторых воплощениях аминокислота в положении 662 полипептида МЕТ10 не является треонином или серином (SEQ ID NO:5). Дополнительные воплощения сульфид-неактивных полипептидов МЕТ10 и клеток дрожжей представлены в этом документе.
В следующем аспекте изобретение обеспечивает улучшенные культуры клеток дрожжей, которые вырабатывают сероводород на низком уровне или не образуют сероводород в детектируемых количествах, улучшенная культура включает популяцию клеток дрожжей, включающих экзогенный полинуклеотид, кодирующий полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином (SEQ ID NO:3), где улучшенная культура клеток дрожжей не образует сероводорода или вырабатывает сероводород в сниженном количестве по сравнению с культурой родительских клеток. В некоторых воплощениях аминокислота в положении 662 полипептида МЕТ10 не является треонином или серином (SEQ ID NO:5). Дополнительные воплощения сульфид-неактивных полипептидов МЕТ10 и клеток дрожжей представлены в этом документе.
В другом аспекте изобретение обеспечивает способы получения улучшенной клетки дрожжей, которая не образуют сероводород в детектируемых количествах, способ включает замену эндогенной нуклеиновой кислоты, кодирующей сульфид-активный полипептид МЕТ10, на нуклеиновую кислоту, кодирующую сульфид-неактивный полипептид МЕТ10, путем введения в клетку, являющуюся родительской для улучшенной клетки дрожжей, экзогенного полинуклеотида, кодирующего сульфид-неактивный полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 сульфид-неактивного полипептида МЕТ10 не является треонином (SEQ ID NO:3), где клетка, являющаяся родительской для улучшенной клетки дрожжей, продуцирует сероводород. В некоторых воплощениях аминокислота в положении 662 полипептида МЕТ10 не является треонином или серином (SEQ ID NO: 5). В некоторых воплощениях нуклеиновую кислоту, кодирующую сульфид-неактивный полипептид МЕТ10, вводят рекомбинантным способом. В некоторых воплощениях нуклеиновую кислоту, кодирующую сульфид-неактивный полипептид МЕТ10, вводят с помощью возвратного скрещивания. Дополнительные воплощения сульфид-неактивных полипептидов МЕТ10 и клеток дрожжей представлены в этом документе.
В другом аспекте изобретение обеспечивает продукты брожения, например вино, пиво, шампанское, не содержащие сероводород в детектируемых количествах или содержащие сниженный уровень сероводорода или его остаточные количества, где продукты брожения получают в соответствии со способами, описанными в этом документе.
Следующий аспект изобретения обеспечивает изолированные полинуклеотиды, способные распознавать последовательности, предоставленные в SEQ ID NO: 1, или последовательности, комплементарные им, и нуклеиновую кислоту, кодирующую MET10 дикого типа, экспрессионные векторы, включающие полинуклеотиды, функционально связанные с экспрессионной контролирующей последовательностью, и клетки хозяина (например, клетки Saccharomyces cerevisiae), включающие экспрессионный вектор.
Следующий аспект изобретения обеспечивает изолированные полинуклеотиды, включающие одну или более замен (например, по меньшей мере, две, три, четыре или более замен) в SEQ ID NO: 1, где одну или более замен выбирают из: А→С в положении 404, А→G в положении 514, А→G в положении 1278 и С→Т в положении 1532, G→А в положении 1768 и А→С в положении 1985, экспрессионные векторы, включающие полинуклеотиды, функционально связанные с экспрессионной контролирующей последовательностью, и клетки хозяина (например, клетки Saccharomyces cerevisiae), включающие экспрессионный вектор.
Другое воплощение изобретения обеспечивает изолированные полинуклеотиды, включающие одну или более замен (например, по меньшей мере, две, три, четыре или более замен) в SEQ ID NO:2, где одну или более замен выбирают из группы, состоящей из: С→А в положении 404, G→А в положении 514, G→А в положении 1278 и Т→С в положении 1532, А→G в положении 1768 и С→А в положении 1985, экспрессионные векторы, включающие полинуклеотиды, функционально связанные с экспрессионной контролирующей последовательностью, и клетки хозяина (например, клетки Saccharomyces cerevisiae), включающие экспрессионный вектор.
Краткое описание фигур
Фигура 1 показывает метаболический путь восстановления сульфатов. Анализ последовательностей, проведенный для генов, выделен полужирным шрифтом, количество обнаруженных аллелей показано в скобках; аллели, обнаруженные в UCD932, подчеркнуты пунктирными линиями.
Фигуры 2A-2Z представляют выравнивание последовательности аллеля MET10 в различных штаммах Saccharomyces (SEQ ID NOS: 8, 9, 1, 10-14, 2, 15 и 16, соответственно). Выделены изменения в нуклеиновой кислоте, которые приводят к изменениям кодонов.
Фигура 3 иллюстрирует типичный метод обмена генов. MET10s = аллель S288C. MET10w = аллель винного штамма.
Фигура 4 иллюстрирует выравнивание аминокислотной последовательности гена МЕТ10 в различных штаммах Saccharomyces (S288C = SEQ ID NO: 17; UCD932 = SEQ ID NO: 18; UCD950 = SEQ ID NO: 19). Выделены различия в аминокислотах среди различных штаммов.
Фигура 5 иллюстрирует изменения в аминокислотах, окружающих остаток 662 в белке МЕТ10. Последовательности ДНК аллелей МЕТ10 из S288C (SEQ ID NO:20), UCD932 (SEQ ID NO:21) и UCD950 (SEQ ID NO:20), выровненные вблизи нуклеотида 1985 с ключевой мутацией, выделены цветом и полужирным шрифтом. Кодоны (SEQ ID NOS:22 и 23) и соответствующая аминокислотная последовательность (SEQ ID NO:24) (выделенная светло-серым цветом) показаны во вставке. Замена С на А приводит к соответствующей замене остатка треонина на лизин в положении 662 белка.
Фигура 6 иллюстрирует расположение аминокислотного остатка 662 по отношению к известным и предсказанным функциональным доменам белка МЕТ10. Изображена карта известных мотивов и доменов белка МЕТ10. Место измененного основания в положении 662 указано черной стрелкой. Мутация расположена в сульфитредуктазном домене белка. Данные из веб-сайта //db.yeastgenome.org/cgi- bin/protein/domainPage.pl?dbid=S000001926.
Фигура 7 иллюстрирует структурные особенности сульфитредуктазного домена и демонстрирует, как замена остатка треонина на лизин сказывается на структурных свойствах белка. Показаны структурные ленточные модели белка МЕТ10, основанные на предсказании структурной гомологии. Изображен только предсказанный сульфитредуктазный домен, расположенный от остатка лизина 633 до остатка тирозина 1035, с участком, находящимся вблизи остатка 662, увеличенным во вставке. В предсказанной структуре для UCD932 (фигура А) выделен лизин в положении 662, тогда как в предсказанной структуре для UCD950 (фигура В) выделен остаток треонина в положении 662.
Фигура 8 иллюстрирует выравнивание подпоследовательности белка МЕТ10 из некоторых видов дрожжей, важных для промышленного производства (UCD 932 МЕТ10 = SEQ ID NO:25; S288C МЕТ10 = SEQ ID NO:26; S. cerevisiae (carisbergensis) = SEQ ID NO:27; Kluyveromyces lactis = SEQ ID NO:28; Yarowwia lipolytica = SEQ ID NO:29; Schizosaccharomyces pombe = SEQ ID NO:30), для которых известны последовательности в сульфитредуктазном каталитическом участке. Консервативные аминокислотные остатки для всех выровненных видов показаны полужирным шрифтом. Аминокислотные остатки, консервативные в большинстве родственных видов, заштрихованы. Треонин в положении 662 или в мотиве (N/K)(R/K)R(V/L)TP(A/D/E)(D/N/E)Y(D/N)R(Y/N)IFH(I/V)EFD(I/L) (SEQ ID NO:31) консервативен в активном полипептиде МЕТ10 для всех выровненных видов дрожжей.
Краткое описание таблиц
В таблице 1 представлен перечень природных и промышленных штаммов дрожжей.
В таблице 2 представлен состав модифицированной среды Triple M (МММ).
В таблице 3 представлены результаты анализа природных изолятов дрожжей, выращенных на чашках с BiGGY и МММ.
В таблице 4 представлены дополнительные штаммы дрожжей.
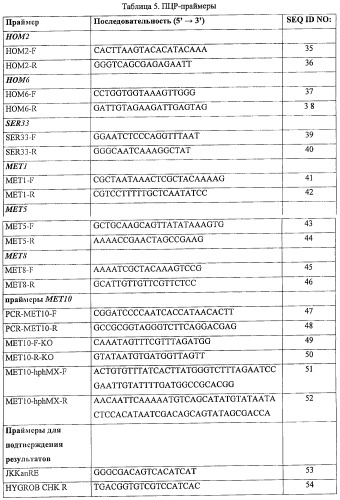
В таблице 5 представлены последовательности ПЦР-праймеров для амплификации, в частности, MET10.
В таблице 6 представлены последовательности праймеров для секвенирования, в частности, МЕТ10.
В таблице 7 представлены результаты, обобщающие образование H2S штаммами дрожжей, трансформированными МЕТ10.
В таблице 8 представлены различия аминокислот в аллелях МЕТ10.
В таблице 9 представлены результаты, обобщающие данные по образованию H2S дополнительными штаммами дрожжей, трансформированными МЕТ10.
В таблице 10 представлены результаты, обобщающие данные по образованию H2S штаммами дрожжей, трансформированными МЕТ10.
В таблице 11 представлены результаты, обобщающие данные по образованию H2S штаммами дрожжей, трансформированными аллелями МЕТ10.
Осуществление изобретения
I. Введение
Настоящее изобретение обеспечивает композиции и способы снижения уровня H2S в ферментированных напитках. Изобретение частично основано на открытии того, что полипептид МЕТ10 с остатком аминокислоты в положении 662, которая не является треонином, не катализирует превращение сульфита в свободный или высвобождаемый сероводород. Это подтверждается с помощью экспрессии сульфид-неактивного полипептида МЕТ10 из аллели МЕТ10 в штамме дрожжей UCD932, в котором единственная нуклеотидная замена в положении 1985 гена МЕТ10 приводит к замене аминокислотного остатка треонина в положении 662 на лизин в каталитическом домене белка MET10.
II. Определения
Если не указано иным образом, все технические и научные термины, используемые в этом документе, обычно имеют то же самое значение, обычно приписываемое им специалистами среднего звена в области техники, к которой принадлежит это изобретение. Обычно терминология, используемая в этом документе, и лабораторные методы культивирования клеток, молекулярной генетики, органической химии и химии нуклеиновых кислот и гибридизации, описанные ниже, хорошо известны и традиционно применяются в этой области техники. Для синтеза нуклеиновых кислот и пептидов используют стандартные методики. Обычно энзиматические реакции и стадии очистки выполняют в соответствии с инструкциями производителей. Методики и способы обычно осуществляют в соответствии с общепринятыми методами этой области техники и различными общими ссылками (Sambrook and Russell, Molecular Cloning, A Laboratory Manual (3d ed., Cold Spring Harbor Laboratory Press 2001); Ausubel, et al., eds., Current Protocols in Molecular Biology (John Wiley & Sons 1987-2008)), которые предоставлены по всему документу. Терминология, используемая в этом документе, и лабораторные методы аналитической химии и органического синтеза, описанные ниже, хорошо известны и обычно применяются в этой области техники. Для химических синтезов и химических анализов используют стандартные методики или их модификации.
Термины «среды для брожения» или «среда для брожения», используемые в этом документе, относятся к не подвергшейся брожению смеси до добавления в нее дрожжей. Среды для брожения включают, например, мусты и сусло. Среды для брожения могут, кроме того, включать дополнительный источник сахаров (например, мед, тростниковый сахар, свекловичный сахар, кукурузный сахар, фруктозу, сахарозу или глюкозу); кислоту (например, лимонную кислоту, яблочную кислоту, винную кислоту и их смеси) и питательные вещества для дрожжей (например, диаммония фосфат или другой источник азота, витамины и т.п.).
Термин «муст», используемый в этом документе, относится к не подвергшейся брожению смеси фруктового сока, фрагментов стеблей, фруктовой кожуры, семян и/или мякоти, которую получают при дроблении фрукта. Можно использовать любые фрукты, содержащие ферментируемый сахар, такие как, например, виноград, яблоки, вишня, персики, нектарины, сливы, абрикосы, груши, хурма, ананасы, манго, киви, клубника, малина, голубика, бузина, ежевика, клюква, инжир и мушмула. Фрукты могут быть сушеными, прокипяченными, отварными или переработанными перед дроблением каким-либо другим способом. Муст может включать два или более фруктов.
Термин «сусло», используемый в этом документе, относится к не подвергшейся брожению жидкости, полученной с помощью растертых зерен и/или зерновой шелухи. Можно использовать любые зерна, содержащие ферментируемый сахар, такие как, например, ячмень, пшеница, рожь, рис, кукуруза и овес. Зерна могут быть обжаренными, хлопьевидными или переработанными перед дроблением каким-либо другим способом. Сусло можно получать из смеси, включающей два или более вида зерен.
Термины «Met10» и «МЕТ10», используемые в этом документе, относятся к α-субъединице ассимилирующей сульфитредуктазы Saccharomyces. Функционально полипептид МЕТ10 катализирует превращение сульфита в сульфид. Структурно полипептиды МЕТ10, в частности дрожжевые полипептиды МЕТ10, уже охарактеризованы. Полипептиды МЕТ10 содержат консервативный каталитический домен сульфитредуктазы в С-концевой части, а также домены, связывающие FAD и NAD. Центральная часть полипептида содержит пируват:ферредоксин-оксидоредуктазный домен. В сульфид-активных полипептидах МЕТ10, которые способны катализировать превращение сульфита в свободный или высвобождающийся сероводород, аминокислотный остаток в положении 662 является консервативным и обычно это треонин или иногда серин, в частности у дрожжей. Идентифицированные домены полипептидов МЕТ10 изображены на фигуре 6.
Используемый в этом документе термин «МЕТ10» относится к нуклеиновым кислотам и полипептидным полиморфным вариантам, аллелям, мутантам и межвидовым гомологам, которые: (1) имеют аминокислотную последовательность, которая демонстрирует более чем 80% идентичности аминокислотной последовательности, например 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% или более 99% идентичности аминокислотной последовательности, предпочтительно в пределах участка, состоящего, меньшей мере, из 25, 50, 100, 200, 500, 1000 или более аминокислот, или в полноразмерной молекуле, с референсной аминокислотной последовательностью, кодируемой нуклеиновой кислотой МЕТ10 (последовательность нуклеиновой кислоты дрожжевого МЕТ10 можно найти, например, в SEQ ID NO: 1, фигура 2, и в представленных ниже кодах доступа в GenBank); (2) связываются с антителами, например с поликлональными антителами, индуцированных иммуногеном, включающим аминокислотную последовательность полипептида МЕТ10 (например, кодируемого SEQ ID NO: 1), и его консервативно модифицированных вариантов; (3) специфически гибридизуются в жестких условиях гибридизации с антисмысловой цепью, соответствующей последовательности нуклеиновой кислоты, кодирующей белок МЕТ10 и его консервативно модифицированные варианты; (4) имеют последовательность нуклеиновой кислоты, которая демонстрирует более чем примерно 95%, предпочтительно более чем примерно 96%, 97%, 98%, 99% или более 99% идентичности нуклеотидной последовательности, предпочтительно в пределах, по меньшей мере, около 25, 50, 100, 200, 500, 1000 или более нуклеотидов, или в составе полноразмерной молекулы, с референсной последовательностью нуклеиновой кислоты МЕТ10. Нуклеиновые кислоты и белки изобретения включают как встречающиеся в природе, так и рекомбинантные молекулы. В некоторых воплощениях полипептиды МЕТ10 и полинуклеотиды МЕТ10 происходят из дрожжей.
Типичные аминокислотные и нуклеотидные последовательности МЕТ10 представлены в базе данных Genbank под кодами доступа EF058164, EF058165, EF058166, EF058167, EF058168, EF058169, EF058170, EF058171, EF058172, EF058173.
Используемый в этом документе термин «сульфид-активный МЕТ10» относится к полипептиду, который способен катализировать превращение сульфита в сероводород. У дрожжей сульфид-активный полипептид МЕТ10 может иметь остаток серина или треонина в положении аминокислоты 662. В штаммах дрожжей аминокислота в положении 662 у S. cerevisiae является консервативной в виде треонина или серина и находится в соответствующем мотиве каталитического участка сульфитредуктазы: (N/K)(R/K)R(V/L)TP(AD/E)(D/N/E)Y(D/N)R(Y/N)IFH(I/V)EFD(I/L) (SEQ ID NO:31). См. фигуру 8.
Используемый в этом документе термин «сульфид-неактивный МЕТ10» относится к полипептиду, который не катализирует превращение сульфита в свободный или высвобождающийся сероводород. У дрожжей сульфид-неактивный полипептид МЕТ10 не имеет треонина в положении аминокислоты 662 или в составе мотива (N/K)(R/K)R(V/L)XP(A/D/E)(D/N/E)Y(D/N)R(Y/N)IFH(I/V)EFD(I/L) (SEQ ID NO:32), то есть, где Х не является Т. В некоторых воплощениях сульфид-неактивный полипептид МЕТ10 не будет иметь остаток треонина или серина в положении аминокислоты 662. В некоторых воплощениях сульфид-неактивный полипептид МЕТ10 будет иметь Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr в положении 662 (SEQ ID NO:3).
В некоторых воплощениях аминокислотный остаток в положении 662 в сульфид-неактивном полипептиде МЕТ10 не имеет гидроксильной группы, например не является Thr, Ser или Tyr (SEQ ID NO:33). В некоторых воплощениях аминокислотный остаток в положении 662 в сульфид-неактивном полипептиде МЕТ10 представляет собой крупную или объемную аминокислоту, например, Lys, Arg, His, Gln, Asn, Glu, Asp, Ile, Leu, Val, Phe, Tyr или Trp (SEQ ID NO:34). В некоторых воплощениях аминокислотный остаток в положении 662 в сульфид-неактивном полипептиде МЕТ10 представляет собой основную или положительно заряженную аминокислоту, например, Lys, Arg, His, Gln или Asn (SEQ ID NO:6). В некоторых воплощениях аминокислотный остаток в положении 662 является Lys (SEQ ID NO:7).
Используемую в этом документе «экзогенную» последовательность нуклеиновой кислоты МЕТ10 или аминокислотную последовательность вводят в родительскую клетку дрожжей или в родительский штамм дрожжей при участии человека. Введение в клетку дрожжей экзогенной последовательности нуклеиновой кислоты или экзогенной аминокислотной последовательности может происходить любыми способами, известными в этой области техники, включающими рекомбинантные способы или классические способы селекции дрожжей (например, возвратное скрещивание).
Термины «нуклеиновая кислота» и «полинуклеотид» используют в этом документе равноценно для обозначения дезоксирибонуклеотидов или рибонуклеотидов и их полимеров или в одноцепочечной, или двухцепочечной форме. Термин охватывает нуклеиновые кислоты, содержащие известные аналоги нуклеотидов или модифицированные остатки или связи, входящие в остов молекулы, которые являются синтетическими, встречающимися в природе и не встречающимися в природе, которые имеют сходные связывающие свойства, что и референсная нуклеиновая кислота, и которые метаболизируются сходно с референсными нуклеотидами. Примеры таких аналогов включают, без ограничения, фосфоротиоаты, фосфорамидаты, метилфосфонаты, хиральные метилфосфонаты, 2-O-метилрибонуклеотиды, пептид-нуклеиновые кислоты (PNAs).
Если не указано специально, специфическая последовательность нуклеиновой кислоты также охватывает ее консервативно модифицированные варианты (например, замены вырожденных кодонов) и комплементарные последовательности, а также точно указанную последовательность. В частности, замены вырожденных кодонов могут быть достигнуты с помощью создания последовательностей, в которых третье положение одного или нескольких выбираемых (или всех) кодонов заменяют смешанным основанием и/или остатками дезоксиинозина (Batzer et al., Nucleic acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)). Термин «нуклеиновая кислота» используют равноценно с геном, кДНК, мРНК, олигонуклеотидом и полинуклеотидом.
Нуклеиновая кислота, «способная к распознаванию» означает полинуклеотид(ы), которые (1) специфически гибридизуются в жестких условиях гибридизации с антисмысловой цепью, соответствующей последовательности нуклеиновой кислоты, кодирующей белок МЕТ10 и ее консервативно модифицированные варианты; или (2) имеют последовательность нуклеиновой кислоты, которая демонстрирует более чем примерно 80%, 85%, 90%, 95%, предпочтительно более чем примерно 96%, 97%, 98%, 99% или более 99% идентичности нуклеотидной последовательности, предпочтительно в пределах участка, составляющего, по меньшей мере, около 25, 50, 100, 200, 500, 1000 или более нуклеотидов, с нуклеиновой кислотой МЕТ10.
Фраза «жесткие условия гибридизации» относится к условиям, в которых образец будет гибридизоваться с его целевой подпоследовательностью, обычно в комплексной смеси нуклеиновой кислоты, но не с другими последовательностями. Жесткие условия зависят от последовательностей и будут различными в различных обстоятельствах. Длинные последовательности специфически гибридизуются при более высоких температурах. Исчерпывающее руководство по гибридизации нуклеиновых кислот представлено в книге Tijssen, Techniques in Biochemistry and Molecular Biology - Hybridization with Nucleic Probes, «Overview of principles of hybridization and the strategy of nucleic acid assays» (1993). Обычно жесткие условия выбирают так, чтобы температура была на 5-10°С ниже, чем температурная точка плавления I для специфической последовательности при определенной ионной силе Ph. Tm представляет собой температуру (при определенной ионной силе Ph и концентрации нуклеиновой кислоты), при которой 50% образца, комплементарного по отношению к мишени, в равновесии гибридизуется с целевой последовательностью (так как целевые последовательности присутствуют в избытке, при температуре, равной Tm, в равновесии заняты 50%).
Жесткими являются условия, в которых концентрация солей составляет величину меньше чем примерно 1,0 М концентрация натрий-иона, обычно примерно от 0,01 до 1,0 М концентрации натрий-иона (или других солей) при рН от 7,0 до 8,3, и температура составляет, по меньшей мере, около 30°С для коротких образцов (например, от 10 до 50 нуклеотидов) и, по меньшей мере, около 60°С для длинных образцов (например, превышающих 50 нуклеотидов). Жесткие условия также могут достигаться при помощи добавления дестабилизирующих агентов, таких как формамид. Для селективной или специфической гибридизации положительный сигнал составляет величину, по меньшей мере, в два раза превышающую фон гибридизации, необязательно превышающую фон гибридизации в десять раз. Типичными жесткими условиями гибридизации могут быть следующие условия: 50%-ный формамид, 5×SSC и 1%-ный SDS, инкубация при 42°С; или 5×SSC, 1%-ный SDS, инкубация при 65°С с промыванием в 0,2×SSC и 0,1%-ном SDS при 65°С.
Нуклеиновые кислоты, которые не гибридизуются друг с другом в жестких условиях все еще являются в значительной степени идентичными, если полипептиды, которые они кодируют, являются в значительной степени идентичными. Это происходит, например, если копия нуклеиновой кислоты образуется с помощью максимальной вырожденности кодонов, допускаемой генетическим кодом. В таких случаях нуклеиновые кислоты обычно гибридизуются в умеренно жестких условиях гибридизации. Обычно «умеренно жесткие условия гибридизации» включают гибридизацию в буфере, содержащем 40%-ный формамид, 1 М NaCl, 1%-ный SDS при 37°С, и промывку в 1×SSC при 45°С. Положительная гибридизация, по меньшей мере, в два раза превышает фон. Специалисты среднего звена в этой области техники легко согласятся с тем, что для того, чтобы обеспечить условия сходной жесткости, можно применять альтернативные условия гибридизации и промывки.
Термины «изолированный», «очищенный» или «биологически чистый» относятся к веществу, которое в значительной степени или практически очищено от компонентов, которые в норме сопровождают его, если оно находится в своем нативном состоянии. Чистоту и гомогенность обычно определяют с помощью методов аналитической химии, таких как электрофорез в полиакриламидном геле или высокоэффективная жидкостная хроматография. Белок, который преобладает в препарате, является в значительной степени очищенным. В частности, изолированную нуклеиновую кислоту MET10 отделяют от открытых рамок считывания, которые фланкируют ген MET10 и кодируют белки, которые не являются MET10. Термин «очищенный» означает, что нуклеиновая кислота или белок в основном дают одну полосу в геле для электрофореза. В частности, это означает, что нуклеиновая кислота или белок, по меньшей мере, имеет 85%-ную чистоту, более предпочтительно, по меньшей мере, 95%-ную чистоту и наиболее предпочтительно, по меньшей мере, 99%-ную чистоту.
Термин «гетерологичный», который применяют в отношении частей нуклеиновой кислоты, указывает на то, что нуклеиновая кислота включает две или более подпоследовательностей, которые являются дивергентными относительно друг друга, которые могут возникать естественным путем в популяции через спонтанные мутации или перестройку генома, или могут быть введены искусственным путем. Например, нуклеиновая кислота, обычно получаемая рекомбинантно, имеет две или более последовательностей от неродственных генов, расположенных таким образом, чтобы создать новую функциональную нуклеиновую кислоту, например промотор из одного источника и кодирующий участок из другого источника. Аналогичным образом гетерологичный белок означает, что белок включает две или более подпоследовательностей, которые являются дивергентными или которые не находятся в тех же самых взаимоотношениях относительно друг друга в природе (например, слитый белок).
«Экспрессионный вектор» представляет собой конструкцию нуклеиновой кислоты, созданную рекомбинантным или синтетическим путем, с применением группы специфических элементов нуклеиновых кислот, которые дают возможность транскрипции специфической нуклеиновой кислоты в клетке хозяина. Экспрессионный вектор может быть частью плазмиды, вируса или фрагмента нуклеиновой кислоты. Обычно экспрессионный вектор включает транскрибируемую нуклеиновую кислоту, функционально связанную с промотором.
Термины «полипептид», «пептид» и «белок» применяют в этом документе равноценно в отношении полимера, состоящего из аминокислотных остатков. Термины применяют в отношении полимеров аминокислот, в которых один или более аминокислотный остаток является искусственным химическим миметиком соответствующей природной аминокислоты, а также полимера из природных аминокислот и полимера из аминокислот, не встречающихся в природе.
Термин «аминокислота» относится к природным и синтетическим аминокислотам, а также к аналогам аминокислот и миметикам аминокислот, которые функционируют таким же образом, что и природные аминокислоты. К природным относятся аминокислоты, которые кодируются генетическим кодом, а также аминокислоты, которые впоследствии модифицируются, например гидроксипрол