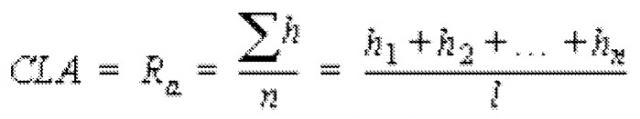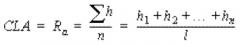Составы неопиоидных и ограниченных опиоидных аналгетиков
Иллюстрации
Показать всеНастоящее изобретение относится к медицине и описывает фармацевтические композиции, имеющие центральный и нецентральный слой, для доставки лекарственных средств, в частности вызывающих зависимость лекарственных средств, имеющих вызывающее зависимость лекарственное средство, по существу заключенное в центральную часть, и не вызывающее зависимость лекарственное средство в нецентральной части. Данные композиции имеют сниженный потенциал к зависимости. В композиции предпочтительно вызывающее зависимость лекарственное средство представляет собой опиоид, а не вызывающее зависимость лекарственное средство представляет собой ацетаминофен или ибупрофен. Более предпочтительно, опиоид представляет собой гидрокодон, и не вызывающий зависимость аналгетик представляет собой ацетаминофен, в определенных предпочтительных вариантах осуществления дозированные формы характеризуются устойчивостью к экстракции растворителем, сдавлению, дроблению или растиранию. Определенные варианты осуществления изобретения обеспечивают первоначальную волну высвобождения лекарственного средства с последующим длительным периодом контролируемого высвобождения лекарственного средства. 4 н. и 23 з.п. ф-лы, 38 табл., 14 пр., 7 ил.
Реферат
Настоящее изобретение относится к композициям для перорального введения. Предпочтительно изобретение относится по меньшей мере к одной не вызывающей зависимости композиции для доставки лекарственного средства, имеющего потенциал к вызыванию зависимости, к связанным с ними способам получения этих дозированных форм и к способам лечения пациента, нуждающегося в этом, включающим введение пациенту композиций по изобретению. Более предпочтительно, эти композиции включают по меньшей мере один неопиоидный аналгетик и по меньшей мере один ограниченный опиоидный аналгетик.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Зависимость от отпускаемых по рецепту лекарственных средств стала проблемой общественного здравоохранения во многих сообществах. Опиоиды являются одним из распространенных классов лекарственных средств, которые вызывают зависимость. Опиоиды являются основным классом аналгетиков, используемым для устранения от умеренной до тяжелой боли в США вследствие их эффективности, простоты титрования и благоприятного соотношения риска и пользы.
Одним из эффектов введения опиоидов является способность таких лекарственных средств у некоторых индивидов изменять настроение и ощущения таким образом, чтобы обеспечивалось желаемое ощущение "благополучия", отличающееся от терапевтических улучшающих эффектов. Повторяющееся незаконное применение средств, вызывающих зависимость, приводит у некоторых потребителей к пристрастию к опиоидам. Аналогично опиоидам, многие другие классы лекарственных средств также вызывают зависимость, хотя характер и эффекты зависимости варьируют.
Таким образом, в данной области описаны различные способы и составы для уменьшения или устранения зависимости различного характера, такой как зависимость, связанная со случайным или намеренным быстрым высвобождением в спирте, измельчением и вдыханием и т.д.
В патентной заявке США 11/625705 и заявке PCT PCT/US07/60864, поданной 22 января 2007 года, которые включены в настоящий документ в качестве ссылок в полном объеме для всех целей, описаны различные способы и композиции не вызывающих зависимости составов, имеющих вызывающие зависимость лекарственные средства. В этих патентных заявках использовали обширный скрининг составов для идентификации пригодных экструдируемых составов, проявляющих двухфазное растворение лекарственного средства in vitro (>30% через 1 ч, >80% через 8 ч) для наркотического лекарственного средства гидрокодона битартрата 2,5-гидрата. Однако было выявлено, что растворение второго лекарственного средства ацетаминофена, также известного как парацетамол или APAP, не удовлетворяло критерию двухфазного растворения лекарственного средства (с >30% через 1 ч, >80% через 8 ч). Хотя оба лекарственных средства, гидрокодон битартрат 2,5-гидрат и ацетаминофен, экструдировали и каландрировали из гомогенно перемешанной смеси твердых веществ, во всех исследованиях полученных дозированных форм было показано, что два активных ингредиента высвобождались с различными скоростями. Эти данные in vitro также были подтверждены в исследованиях на экспериментальных животных (карликовые свиньи) и в клинических испытаниях, проведенных с этими дозированными формами. Клиническое испытание также показало, что хотя требуемая кинетика достигалась для гидрокодона битартрата 2,5-гидрата, этого не происходило в случае ацетаминофена. Таким образом, необходимо было найти новые концепции изготовления составов для достижения требуемого двухфазного профиля растворения лекарственного средства также для ацетаминофена. Кроме того, также было выявлено, что в большинстве случаев каландрируемые экструдируемые таблетки, изготовленные в соответствии с патентными заявками US 11/625705 и PCT/US07/60864, имеют шероховатые поверхности и, таким образом, исходя из их внешнего вида, они не во всех случаях удовлетворяли критериям сбываемых на рынке таблеток. Таким образом, также понятна необходимость в усовершенствовании в этом отношении.
Хотя существует множество композиций, составов и способов, обращенных на зависимость от лекарственных средств, все композиции, составы и способы имеют ограничения в большей или меньшей степени. Таким образом, существует необходимость в предоставлении новых и/или усовершенствованных составов, композиций и способов для предотвращения зависимости от лекарственных средств, имеющих потенциал в отношении зависимости. Более конкретно, существует необходимость в разработке пероральных составов, которые удовлетворяли бы двухфазному профилю растворения лекарственного средства и также имели признаки, которые включают сдерживание от применения лекарственного средства и желательный внешний вид для удовлетворения критериям для сбываемых на рынке таблеток. Эта информация об уровне техники предоставлена для того, чтобы сделать известной некоторую информацию, которая, как полагают заявители, возможно имеет отношение к настоящему изобретению. Не подразумевается допущения, а также не следует истолковывать, что любая представленная информация составляет предшествующий уровень техники для настоящего изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Определенные предпочтительные варианты осуществления настоящего изобретения относятся к дозированным формам и способам для доставки лекарственных средств, в частности вызывающих зависимость лекарственных средств, характеризующимся устойчивостью к экстракции растворителем, сдавлению, дроблению или растиранию и обеспечивающим исходную волну высвобождения лекарственного средства с последующим длительным периодом контролируемого высвобождения лекарственного средства. Предпочтительно, дозированная форма включает по меньшей мере один неопиоидный аналгетик и по меньшей мере один ограниченный опиоидный аналгетик.
В одном предпочтительном варианте осуществления, настоящее изобретение относится к фармацевтической композиции, имеющей центральную часть и нецентральный слой, включающей: (a) гидрокодон, его фармацевтически приемлемую соль или гидрат и (b) ацетаминофен или ибупрофен. В этом варианте осуществления, по меньшей мере 75% от всего гидрокодона, его фармацевтически приемлемой соли или гидрата находится в центральной части, и ацетаминофен или ибупрофен находятся в нецентральном слое. Кроме того, эта композиция адаптирована так, чтобы она была пригодна для перорального введения человеку 3, 2 или 1 раз в сутки. Предпочтительно, более чем 90% гидрокодона, его фармацевтически приемлемой соли или гидрата находится в центральной части. Более предпочтительно, по существу весь гидрокодон, его фармацевтически приемлемая соль или гидрат находятся в центральной части. В другом варианте осуществления, центральная часть дополнительно содержит ацетаминофен или ибупрофен. Более предпочтительно, центральная часть дополнительно содержит ацетаминофен.
В определенных вариантах осуществления, предпочтительно проявляется представленный ниже фармакокинетический профиль, когда единичная доза содержит приблизительно 15 мг гидрокодона битартрата пентагемигидрата и приблизительно 500 мг ацетаминофена, при введении пациенту натощак. Предпочтительно при введении пациенту-человеку фармацевтическая композиция обеспечивает профиль в плазме, характеризующийся Cmax для гидрокодона от приблизительно 0,6 нг/мл/мг до приблизительно 1,4 нг/мл/мг и Cmax для ацетаминофена приблизительно от 2,8 нг/мл/мг до 7,9 нг/мл/мг, после однократной дозы. В другом варианте осуществления, фармацевтическая композиция обеспечивает профиль в плазме, характеризующийся Cmax для гидрокодона от приблизительно 0,4 нг/мл/мг до приблизительно 1,9 нг/мл/мг и Cmax для ацетаминофена от приблизительно 2,0 нг/мл/мг до приблизительно 10,4 нг/мл/мг, после однократной дозы. В другом варианте осуществления, фармацевтическая композиция обеспечивает профиль в плазме, характеризующийся Cmax для гидрокодона от приблизительно 0,6 нг/мл/мг до приблизительно 1,0 нг/мл/мг и Cmax для ацетаминофена от приблизительно 3,0 нг/мл/мг до приблизительно 5,2 нг/мл/мг, после однократной дозы. Другие варианты осуществления дозированной формы включают приблизительно 5-20 мг гидрокодона битартрата пентагемигидрата и приблизительно 400-600 мг ацетаминофена. Другой вариант осуществления дозированной формы включает 10-15 мг гидрокодона битартрата пентагемигидрата и приблизительно 500-600 мг ацетаминофена.
В определенных вариантах осуществления, предпочтительно проявляется представленный ниже фармакокинетический профиль, когда однократная доза содержит приблизительно 15 мг гидрокодона битартрата пентагемигидрата и приблизительно 500 мг ацетаминофена, при введении пациенту натощак. При введении пациенту-человеку дозированная форма обеспечивает AUC для гидрокодона от приблизительно 9,1 нг*ч/мл/мг до приблизительно 19,9 нг*ч/мл/мг и AUC для ацетаминофена от приблизительно 28,6 нг*ч/мл/мг до приблизительно 59,1 нг*ч/мл/мг. В другом варианте осуществления, дозированная форма обеспечивает AUC для гидрокодона от приблизительно 7,0 нг*ч/мл/мг до приблизительно 26,2 нг*ч/мл/мг и AUC для ацетаминофена от приблизительно 18,4 нг*ч/мл/мг до приблизительно 79,9 нг*ч/мл/мг. В другом варианте осуществления, дозированная форма обеспечивает AUC для гидрокодона от приблизительно 11,3 нг*ч/мл/мг до приблизительно 18,7 нг*ч/мл/мг и AUC для ацетаминофена от приблизительно 28,7 нг*ч/мл/мг до приблизительно 53,5 нг*ч/мл/мг. Предпочтительно в этом варианте осуществления, скорость высвобождения фармацевтической композиции in vitro имеет двухфазный профиль высвобождения, и где для каждой фазы скорость высвобождения in vitro имеет нулевой порядок или первый порядок для ацетаминофена и нулевой порядок или первый порядок для гидрокодона битартрата пентагемигидрата.
В определенных вариантах осуществления, предпочтительно проявляется представленный ниже фармакокинетический профиль, когда однократная доза содержит приблизительно 15 мг гидрокодона битартрата пентагемигидрата и приблизительно 500 мг ацетаминофена, при введении пациенту натощак. Дозированная форма обеспечивает концентрацию в плазме через 1 час (C1) для гидрокодона от приблизительно 0,18 нг/мл/мг до приблизительно 1,51 нг/мл/мг и концентрацию в плазме C1 через 1 час для ацетаминофена от приблизительно 2,34 нг/мл/мг до приблизительно 7,24 нг/мл/мг. В предпочтительных вариантах осуществления, таких как состав 15, дозированная форма обеспечивает C1 для гидрокодона от приблизительно 0,32 нг/мл/мг до приблизительно 1,51 нг/мл/мг и C1 для ацетаминофена от приблизительно 2,34 нг/мл/мг до приблизительно 5,50 нг/мл/мг.
В некоторых других вариантах осуществления, предпочтительно проявляется представленный ниже фармакокинетический профиль, когда однократная доза содержит приблизительно 15 мг гидрокодона битартрата пентагемигидрата и приблизительно 500 мг ацетаминофена, при введении пациенту натощак. Дозированная форма обеспечивает концентрацию в плазме через 1 час (C1) для гидрокодона от приблизительно 0,30 нг/мл/мг до приблизительно 1,06 нг/мл/мг и C1 для ацетаминофена от приблизительно 2,75 нг/мл/мг до приблизительно 5,57 нг/мл/мг. В предпочтительных вариантах осуществления, дозированная форма обеспечивает C1 для гидрокодона от приблизительно 0,45 нг/мл/мг до приблизительно 1,06 нг/мл/мг и C1 для ацетаминофена от приблизительно 2,75 нг/мл/мг до приблизительно 4,43 нг/мл/мг.
В других вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена от приблизительно 1,18 мкг/мл до приблизительно 3,63 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена натощак. В предпочтительных вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена от приблизительно 1,18 мкг/мл до приблизительно 2,76 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена.
В определенных вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена от приблизительно 1,38 мкг/мл до приблизительно 2,79 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена. В предпочтительных вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена от приблизительно 1,38 мкг/мл до приблизительно 2,23 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена.
В предпочтительных вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена 1,80±0,42 мкг/мл с 95% доверительным интервалом для среднего значения от приблизительно 1,61 мкг/мл до приблизительно 2,00 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена. 95% доверительный интервал для комбинированной C1 для гидрокодона и ацетаминофена в случае предпочтительных вариантов осуществления и контроля перекрывается. 95% доверительный интервал для среднего значения комбинированной C1 для гидрокодона и ацетаминофена для контроля находится в диапазоне приблизительно от 1,46 до 1,96 мкг/мл, после введения в качестве однократной дозы 15 мг гидрокодона и 500 мг ацетаминофена пациенту-человеку. Контроль обеспечивает достаточные уровни в плазме опиоидного и неопиоидного аналгетика для обеспечения снижения интенсивности боли в пределах приблизительно 1 часа после введения. При введении популяции здоровых северных американцев или западных европейцев, в частности, когда состав адаптирован, чтобы он был пригоден или предназначен для введения человеку каждые 12 часов при необходимости, приблизительно 20-45% гидрокодона высвобождается in vitro из фармацевтических композиций в течение приблизительно 1 часа и приблизительно 20-45% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение приблизительно 1 часа в 0,01 н. HCl при 50 об/мин при 37°C. В другом варианте осуществления, приблизительно 25-35% гидрокодона высвобождается in vitro из фармацевтических композиций в течение приблизительно 1 часа и приблизительно 25-35% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение приблизительно 1 часа в 0,01 н. HCl при 50 об/мин при 37°C. Кроме того, в другом варианте осуществления, по меньшей мере 90% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 8 часов до приблизительно 12 часов, и по меньшей мере от 60% до приблизительно 99% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 6 часов до приблизительно 8,5 часов. В другом варианте осуществления, по меньшей мере 90% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 8 часов до приблизительно 11 часов, и по меньшей мере 90% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 8 часов до приблизительно 11 часов. В другом варианте осуществления, по меньшей мере 95% гидрокодона высвобождается из фармацевтических композиций в течение от приблизительно 9 часов до приблизительно 12 часов, и по меньшей мере 95% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 9 часов до приблизительно 12 часов. В другом варианте осуществления, по меньшей мере 95% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 10 часов до приблизительно 12 часов, и по меньшей мере 95% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 10 часов до приблизительно 12 часов. В другом варианте осуществления, по меньшей мере 99% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 11 часов до приблизительно 12 часов, и по меньшей мере 99% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 11 часов до приблизительно 12 часов. В другом варианте осуществления, по меньшей мере 99% гидрокодона высвобождается из фармацевтической композиции в течение менее чем приблизительно 13 часов, и по меньшей мере 99% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение менее чем приблизительно 13 часов.
Однако, когда вариант с замедленным высвобождением состава адаптирован, чтобы он был пригоден или предназначен для введения человеку два раза в сутки, при необходимости, тогда по меньшей мере 90% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 18 часов до приблизительно 23 часов, и по меньшей мере 90% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 18 часов до приблизительно 23 часов. В другом варианте осуществления состава с замедленным высвобождением, по меньшей мере 95% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 20 часов до приблизительно 25 часов, и по меньшей мере 95% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 20 часов до приблизительно 25 часов. В другом варианте осуществления состава с замедленным высвобождением, по меньшей мере 95% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 21 часа до приблизительно 22 часов, и по меньшей мере 95% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 21 часа до приблизительно 22 часов. В другом варианте осуществления этого варианта осуществления с замедленным высвобождением, по меньшей мере 99% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 22 часов до приблизительно 26 часов, и по меньшей мере 99% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 22 часов до приблизительно 26 часов. В другом варианте осуществления состава с замедленным высвобождением, по меньшей мере 99% гидрокодона высвобождается из фармацевтической композиции в течение менее чем приблизительно 27 часов, и по меньшей мере 99% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение менее чем приблизительно 27 часов.
В предпочтительном варианте осуществления, настоящее изобретение относится к композиции, где центральный слой содержит эксципиент или смесь эксципиентов, способных контролировать высвобождение лекарственного средства, и нецентральный слой содержит эксципиент, способный немедленно высвобождать лекарственное средство. Кроме того, в предпочтительном варианте осуществления, центральный слой изготовлен путем экструдирования из расплава с последующим прямым приданием формы содержащему лекарственное средство расплаву, и нецентральный слой нанесен распылением на центральный слой. Наиболее предпочтительно, композиция содержит приблизительно 500 мг ацетаминофена и приблизительно 15 мг гидрокодона битартрата пентагемигидрата.
В другом иллюстративном варианте осуществления, настоящее изобретение относится к фармацевтической композиции, имеющей центральный и нецентральный слой, содержащей: (a) вызывающее зависимость лекарственное средство, его фармацевтически приемлемую соль или гидрат и не вызывающее зависимость лекарственное средство или его фармацевтически приемлемую соль в центральном слое, и (b) не вызывающее зависимость лекарственное средство, его фармацевтически приемлемую соль или гидрат в нецентральном слое. Предпочтительно, эта композиция характеризуется по меньшей мере одним из следующих признаков:
i) количество вызывающего зависимость лекарственного средства, которое экстрагируется из композиции 40% водным раствором этанола в течение одного часа при 37°C in vitro, является меньшим или равно количеству вызывающего зависимость лекарственного средства, которое экстрагируется 0,01 н. хлористо-водородной кислотой in vitro в течение одного часа при 37°C, умноженному на 1,5,
ii) композиция не разрушается при воздействии силы 150 Н, предпочтительно 300 Н, более предпочтительно 450 Н, более предпочтительно 500 Н при измерении с помощью устройства для испытания на твердость "Pharma Test PTB 501",
iii) композиция высвобождает по меньшей мере 20% вызывающего зависимость лекарственного средства и не более чем 45% вызывающего зависимость лекарственного средства в течение первого часа тестирования растворения in vitro и предпочтительно также в течение первого часа тестирования in vivo,
iv) композиция высвобождает терапевтически эффективную дозу не вызывающего зависимость лекарственного средства в течение от 1 до 2 часов после однократной дозы,
v) композиция высвобождает терапевтически эффективную дозу не вызывающего зависимость лекарственного средства и/или вызывающего зависимость лекарственного средства через 1 час и через 12 часов после однократной дозы,
vi) в композиции высвобождение вызывающего зависимость лекарственного средства при измельчении повышается менее чем в 2-3 раза, по сравнению с целой таблеткой, когда композицию измельчают в течение 1 минуты кофемолкой при 20000-50000 об/мин, в 40% водном растворе этанола в течение 1 часа при 37°C,
vii) измельченная композиция содержит частицы размером от приблизительно 2 см до приблизительно 355 микрометров для приблизительно 20% фракции, более чем приблизительно 63 микрометра и менее чем приблизительно 355 микрометров для приблизительно 66% фракции и менее чем приблизительно 63 микрометра для приблизительно 14% фракции, при измерении с помощью теста просеиванием, или
viii) композиция является по существу однородной, где среднее значение центральной линии (CLA) составляет от приблизительно 0,1 до приблизительно 0,6, предпочтительно от приблизительно 0,1 до приблизительно 0,4 и наиболее предпочтительно от приблизительно 0,1 до приблизительно 0,2.
В этой композиции, количество вызывающего зависимость лекарственного средства, которое экстрагируется из состава 40% водным раствором этанола в течение одного часа при 37°C, составляет от приблизительно 70% до приблизительно 130% от количества лекарственного средства, которое экстрагируется 0,01 н. хлористо-водородной кислотой в течение одного часа при 37°C. В другом варианте осуществления, количество вызывающего зависимость лекарственного средства, которое экстрагируется из состава 40% водным раствором этанола в течение одного часа при 37°C, составляет от приблизительно 70% до приблизительно 90% от количества лекарственного средства, которое экстрагируется 0,01 н. хлористо-водородной кислотой в течение одного часа при 37°C. В другом варианте осуществления, вызывающее зависимость лекарственное средство, которое экстрагируется из состава 40% водным раствором этанола в течение одного часа при 37°C, составляет от приблизительно 75% до приблизительно 90% от количества лекарственного средства, которое экстрагируется 0,01 н. хлористо-водородной кислотой в течение одного часа при 37°C.
Другой вариант осуществления настоящего изобретения относится к фармацевтической композиции, имеющей центральный слой и нецентральный слой. В этой композиции центральный слой содержит смесь (a) по меньшей мере одного опиоида и (b) по меньшей мере одного изменяющего скорость фармацевтически приемлемого полимера, сополимера или их сочетаний. Нецентральный слой содержит по меньшей мере один неопиоидный аналгетик. Кроме того, эти композиции адаптированы для того, чтобы они были пригодными для перорального введения человеку 3, 2 или 1 раз в сутки. Предпочтительно, центральный слой дополнительно содержит по меньшей мере один неопиоидный аналгетик. В предпочтительном варианте осуществления, композиция характеризуется по меньшей мере одним из следующих признаков:
i) количество вызывающего зависимость лекарственного средства, которое экстрагируется из композиции 40% водным раствором этанола в течение одного часа при 37°C in vitro, является меньшим или равно количеству вызывающего зависимость лекарственного средства, которое экстрагируется 0,01 н. хлористо-водородной кислотой in vitro в течение одного часа при 37°C, умноженному на 1,5,
ii) композиция не разрушается при воздействии силы 150 Н, предпочтительно 300 Н, более предпочтительно 450 Н, более предпочтительно 500 Н при измерении с помощью устройства для испытания на твердость "Pharma Test PTB 501",
iii) композиция высвобождает по меньшей мере 20% вызывающего зависимость лекарственного средства и не более чем 45% вызывающего зависимость лекарственного средства в течение первого часа тестирования растворения in vitro и предпочтительно также в течение первого часа тестирования in vivo,
iv) композиция высвобождает терапевтически эффективную дозу не вызывающего зависимость лекарственного средства в течение от 1 до 2 часов после однократной дозы,
v) композиция высвобождает терапевтически эффективную дозу не вызывающего зависимость лекарственного средства и/или вызывающего зависимость лекарственного средства через 1 час и через 12 часов после однократной дозы,
vi) в композиции высвобождение вызывающего зависимость лекарственного средства при измельчении повышается менее чем в 2-3 раза, по сравнению с целой таблеткой, когда композицию измельчают в течение 1 минуты кофемолкой при 20000-50000 об/мин, в 40% водном растворе этанола в течение 1 часа при 37°C,
vii) измельченная композиция содержит частицы размером от приблизительно 2 см до приблизительно 355 микрометров для приблизительно 20% фракции, более чем приблизительно 63 микрометра и менее чем приблизительно 355 микрометров для приблизительно 66% фракции и менее чем приблизительно 63 микрометра для приблизительно 14% фракции, при измерении с помощью теста просеиванием, или
viii) композиция является по существу однородной, где среднее значение центральной линии (CLA) составляет от приблизительно 0,1 до приблизительно 0,6, предпочтительно от приблизительно 0,1 до приблизительно 0,4 и наиболее предпочтительно от приблизительно 0,1 до приблизительно 0,2.
В одном варианте осуществления, опиоид выбран из группы, состоящей из альфентанила, аллилпродина, альфапродина, анилеридина, бензилморфина, безитрамида, бупренорфина, буторфанола, клонитазена, кодеина, циклазоцина, дезоморфина, декстроморамида, дезоцина, диампромида, дигидрокодеина, дигидроморфина, дименоксадола, димефептанола, диметилтиамбутена, диоксафетила бутирата, дипипанона, эптазоцина, этогептазина, этилметилтиамбутена, этилморфина, этонитазена, фентанила, героина, гидрокодона, гидроморфона, гидроксипетидина, изометадона, кетобемидона, леваллорфана, левофенацилморфана, леворфанола, лофентанила, меперидина, мептазинола, метазоцина, метадона, метопона, морфина, мирофина, налбуфина, нарцеина, никоморфина, норпипанона, опиума, оксикодона, оксиморфона, папвретума, пентазоцина, фенадоксона, феназоцина, феноморфана, феноперидина, pиминодина, пропирама, пропоксифена, суфентанила, тилидина, трамадола, их солей, гидратов и смесей.
Кроме того, неопиоидный аналгетик выбран из группы, состоящей из ацетаминофена, аспирина, фентанила, ибупрофена, индометацина, каторолака, напроксена, фенацетина, пироксикама, суфентанила, сунлиндака, интерферона альфа, их солей, гидратов и смесей. Предпочтительно, опиоид представляет собой гидрокодон, и неопиоидный аналгетик представляет собой ацетаминофен или ибупрофен. Более предпочтительно, опиоид представляет собой гидрокодон, и неопиоидный аналгетик представляет собой ацетаминофен.
В определенных вариантах осуществления, предпочтительно проявляется представленный ниже фармакокинетический профиль, когда однократная доза содержит приблизительно 15 мг гидрокодона битартрата пентагемигидрата и приблизительно 500 мг ацетаминофена, при введении пациенту натощак. Предпочтительно при введении пациенту-человеку фармацевтическая композиция обеспечивает профиль в плазме, характеризующийся Cmax для гидрокодона от приблизительно 0,6 нг/мл/мг до приблизительно 1,4 нг/мл/мг и Cmax для ацетаминофена от приблизительно 2,8 нг/мл/мг и 7,9 нг/мл/мг, после однократной дозы. В другом варианте осуществления, фармацевтическая композиция обеспечивает профиль в плазме, характеризующийся Cmax для гидрокодона от приблизительно 0,4 нг/мл/мг до приблизительно 1,9 нг/мл/мг и Cmax для ацетаминофена от приблизительно 2,0 нг/мл/мг до приблизительно 10,4 нг/мл/мг, после однократной дозы. В другом варианте осуществления, фармацевтическая композиция обеспечивает профиль в плазме, характеризующийся Cmax для гидрокодона от приблизительно 0,6 нг/мл/мг до приблизительно 1,0 нг/мл/мг и Cmax для ацетаминофена от приблизительно 3,0 нг/мл/мг до приблизительно 5,2 нг/мл/мг, после однократной дозы. В определенных вариантах осуществления, предпочтительно проявляется представленный ниже фармакокинетический профиль, когда однократная доза содержит приблизительно 15 мг гидрокодона битартрата пентагемигидрата и приблизительно 500 мг ацетаминофена, при введении пациенту натощак. При введении пациенту-человеку дозированная форма обеспечивает AUC для гидрокодона от приблизительно 9,1 нг*ч/мл/мг до приблизительно 19,9 нг*ч/мл/мг и AUC для ацетаминофена от приблизительно 28,6 нг*ч/мл/мг до приблизительно 59,1 нг*ч/мл/мг. В другом варианте осуществления, дозированная форма обеспечивает AUC для гидрокодона от приблизительно 7,0 нг*ч/мл/мг до приблизительно 26,2 нг*ч/мл/мг и AUC для ацетаминофена от приблизительно 18,4 нг*ч/мл/мг до приблизительно 79,9 нг*ч/мл/мг. В другом варианте осуществления, дозированная форма обеспечивает AUC для гидрокодона от приблизительно 11,3 нг*ч/мл/мг до приблизительно 18,7 нг*ч/мл/мг и AUC для ацетаминофена от приблизительно 28,7 нг*ч/мл/мг до приблизительно 53,5 нг*ч/мл/мг. Предпочтительно в этом варианте осуществления, скорость высвобождения фармацевтической композиции in vitro имеет двухфазный профиль высвобождения, и где для каждой фазы скорость высвобождения in vitro имеет нулевой порядок или первый порядок для ацетаминофена и нулевой порядок или первый порядок для гидрокодона битартрата пентагемигидрата.
В определенных вариантах осуществления, предпочтительно проявляется представленный ниже фармакокинетический профиль, когда однократная доза содержит приблизительно 15 мг гидрокодона битартрата пентагемигидрата и приблизительно 500 мг ацетаминофена, при введении пациенту натощак. Предпочтительно при введении пациенту-человеку фармацевтическая композиция обеспечивает концентрацию в плазме через 1 час (C1) для гидрокодона от приблизительно 0,18 нг/мл/мг до приблизительно 1,51 нг/мл/мг и концентрацию в плазме через 1 час C1 для ацетаминофена от приблизительно 2,34 нг/мл/мг до приблизительно 7,24 нг/мл/мг. В предпочтительных вариантах осуществления, таких как состав 15, дозированная форма обеспечивает C1 для гидрокодона от приблизительно 0,32 нг/мл/мг до приблизительно 1,51 нг/мл/мг и C1 для ацетаминофена от приблизительно 2,34 нг/мл/мг до приблизительно 5,50 нг/мл/мг.
В определенных вариантах осуществления, предпочтительно проявляется представленный ниже фармакокинетический профиль, когда однократная доза содержит приблизительно 15 мг гидрокодона битартрата пентагемигидрата и приблизительно 500 мг ацетаминофена, при введении пациенту натощак. Предпочтительно при введении пациенту-человеку фармацевтическая композиция обеспечивает концентрацию в плазме через 1 час (C1) для гидрокодона от приблизительно 0,30 нг/мл/мг до приблизительно 1,06 нг/мл/мг и C1 для ацетаминофена от приблизительно 2,75 нг/мл/мг до приблизительно 5,57 нг/мл/мг. В предпочтительных вариантах осуществления, дозированная форма обеспечивает C1 для гидрокодона от приблизительно 0,45 нг/мл/мг до приблизительно 1,06 нг/мл/мг и C1 для ацетаминофена от приблизительно 2,75 нг/мл/мг до приблизительно 4,43 нг/мл/мг.
В определенных вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена от приблизительно 1,18 мкг/мл до приблизительно 3,63 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена. В предпочтительных вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена от приблизительно 1,18 мкг/мл до приблизительно 2,76 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена.
В определенных вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена от приблизительно 1,38 мкг/мл до приблизительно 2,79 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена. В предпочтительных вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена от приблизительно 1,38 мкг/мл до приблизительно 2,23 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена.
В предпочтительных вариантах осуществления, дозированная форма обеспечивает комбинированную C1 для гидрокодона и ацетаминофена 1,80±0,42 мкг/мл с 95% доверительным интервалом для среднего значения от приблизительно 1,61 мкг/мл до приблизительно 2,00 мкг/мл, после однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена. 95% доверительный интервал для комбинированной C1 для гидрокодона и ацетаминофена в случае предпочтительных вариантов осуществления и контроля перекрывается. 95% доверительный интервал для среднего значения комбинированной C1 для гидрокодона и ацетаминофена для контроля находится в диапазоне приблизительно от 1,46 до 1,96 мкг/мл, после введения в качестве однократной дозы 15 мг гидрокодона битартрата пентагемигидрата и 500 мг ацетаминофена пациенту-человеку. Контроль обеспечивает достаточные уровни в плазме опиоидного и неопиоидного аналгетика для обеспечения снижения интенсивности боли в пределах приблизительно 1 часа после введения.
При введении популяции здоровых северных американцев или западных европейцев, в частности, когда состав адаптирован, чтобы он был пригоден или предназначен для введения человеку каждые 12 часов при необходимости, приблизительно 20-45% гидрокодона высвобождается in vitro из фармацевтических композиций в течение приблизительно 1 часа и приблизительно 20-45% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение приблизительно 1 часа в 0,01 н. HCl при 50 об/мин при 37°C. В другом варианте осуществления, приблизительно 25-35% гидрокодона высвобождается in vitro из фармацевтических композиций в течение приблизительно 1 часа и приблизительно 25-35% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение приблизительно 1 часа в 0,01 н. HCl при 50 об/мин при 37°C. Кроме того, в другом варианте осуществления, по меньшей мере 90% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 8 часов до приблизительно 12 часов, и по меньшей мере от 60% до приблизительно 99% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 6 часов до приблизительно 8,5 часов. В другом варианте осуществления, по меньшей мере 90% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 8 часов до приблизительно 11 часов, и по меньшей мере 90% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 8 часов до приблизительно 11 часов. В другом варианте осуществления, по меньшей мере 95% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 9 часов до приблизительно 12 часов, и по меньшей мере 95% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 9 часов до приблизительно 12 часов. В другом варианте осуществления, по меньшей мере 95% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 10 часов до приблизительно 12 часов, и по меньшей мере 95% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 10 часов до приблизительно 12 часов. В другом варианте осуществления, по меньшей мере 99% гидрокодона высвобождается из фармацевтической композиции в течение от приблизительно 11 часов до приблизительно 12 часов, и по меньшей мере 99% ацетаминофена высвобождается in vitro из фармацевтических композиций в течение от приблизительно 11 часов до приблизительно 12 часов. В другом варианте осуществления, по меньшей мере 99% гидрокодона высвобождается из фармацевтической композиции в течение менее чем приблизительно 13