Способы и промежуточные продукты для получения макроциклического ингибитора протеазы вируса гепатита с
Иллюстрации
Показать всеНастоящее изобретение относится к способам синтеза и промежуточным продуктам соединения формулы (XVII) и его солей. 6 н. и 26 з.п. ф-лы, 13 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к способам синтеза и промежуточным продуктам синтеза макроциклического ингибитора протеазы вируса гепатита С (HCV).
Предпосылки создания изобретения
Вирус гепатита С (HCV) является основной причиной распространенного во всем мире хронического заболевания печени. После первоначальной острой инфекции у большинства инфицированных индивидуумов развивается хронический гепатит, так как HCV предпочтительно реплицируется в гепатоцитах, но не является непосредственно цитопатическим. Хронический гепатит может прогрессировать до фиброза печени, приводя к циррозу печени, конечной стадии заболевания печени, и НСС (печеночно-клеточному раку), являющемуся основной причиной трансплантаций печени. Это и большое количество пораженных болезнью пациентов делает HCV средоточием значительного медицинского исследования. Репликация генома HCV опосредуется большим количеством ферментов, среди которых находятся NS3-серинпротеаза HCV и связанный с ней кофактор, NS4A, который опосредует большое количество протеолитических расщеплений HCV-полипротеина, получающегося в результате генерации ферментов репликации HCV. Считают, что NS3-серинпротеаза является необходимой для вирусной репликации и представляет собой представляющую интерес мишень для нахождения лекарственного средства.
Современная анти-HCV-терапия базируется на (пэгилированном) интерфероне-альфа (IFN-б) в комбинации с рибавирином. Результатом этой терапии является не только ограниченная эффективность, так как только часть пациентов успешно излечивается, но и также в случае этой терапии сталкиваются со значительными побочными эффектами и плохой переносимостью препаратов множеством пациентов. Следовательно, существует потребность в более эффективной, пригодной и с улучшенной толерантностью терапии. Существует необходимость в дальнейших ингибиторах HCV, которые позволяют преодолеть недостатки современной HCV-терапии, такие, как побочные эффекты, ограниченная эффективность, возникновение резистентности, а также соответствующие неблагоприятные исходы.
Описаны различные агенты, ингибирующие NS3-серинпротеазу HCV и связанный с ней кофактор, NS4A. В Международной заявке WO-05/073195 раскрываются линейные и макроциклические ингибиторы NS3-серинпротеазы с замещенным центральным пролиновым остатком, а в случае Международной заявки WO-05/073216 - с центральным циклопентильным остатком. Среди них представляющими интерес являются макроциклические производные, которые проявляют явную активность против HCV и имеют хороший фармакокинетический профиль.
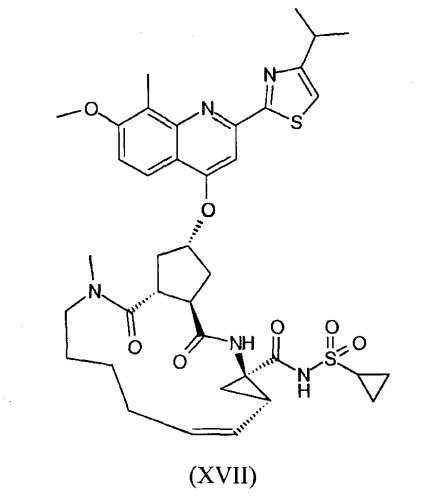
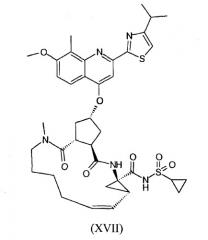
В настоящее время найдено, что конкретное макроциклическое соединение с центральным, замещенным хинолинилоксигруппой, циклопентильным остатком является особенно представляющим интерес с точки зрения эффективности, а также фармакокинетики. Оно представляет собой соединение формулы (XVII) со структурой, представленной ниже:
Соединение формулы (XVII) является очень эффективным ингибитором серинпротеазы вируса гепатита С (HCV) и описано в Международной заявке WO-2007/014926, опубликованной 8 февраля 2007 года. Вследствие его подходящих свойств, оно было выбрано в качестве потенциального «кандидата» для получения лекарственного средства против вируса гепатита С. Следовательно, существует необходимость получения больших количеств этого активного ингредиента на основе способов, которые обеспечивают получение продукта с высоким выходом и с высокой степенью чистоты.
Настоящее изобретение относится к способам получения соединения формулы (XVII) или его фармацевтически приемлемой соли, к получению промежуточных продуктов, используемых в этих способах, и к некоторым из этих промежуточных продуктов.
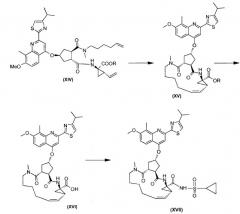
Соединение формулы (XVII) можно получать реакцией обмена, исходя из промежуточного продукта (XIV), который циклизуют для получения промежуточного продукта (XV), который затем гидролизуют до макроциклической кислоты (XVI). Последнюю связывают с сульфониламидом (XVII) посредством реакции образования амида, таким образом получая конечный продукт (XVII), как показано на следующей реакционной схеме:
Фармацевтически приемлемые солевые формы соединения формулы (XVII) можно получать путем введения во взаимодействие свободной формы этого соединения с кислотой или основанием.
В случае этой и последующих реакционных схем или представлениях индивидуальных соединений, например, в соединении (XIV), R означает С1-4-алкил, в особенности, R означает С1-3-алкил, более конкретно, R означает С1-2-алкил, или, в одном воплощении, R означает этил. Реакция превращения соединения (XV) в соединение (XVI) представляет собой реакцию гидролиза, которую предпочтительно проводят, используя основание, в водной среде, такой как смесь воды и растворимого в воде органического растворителя, такого, как тетрагидрофуран (ТГФ) или спирт, в особенности, спирт, из которого получают сложный эфир (XIV), или в смеси таких растворителей. Основание, которое используют, может представлять собой гидроксид щелочного металла, такой как, например, NaOH или KOH и, в особенности, он может представлять собой LiOH.
Промежуточный продукт (XIV) циклизуют реакцией обмена олефина в присутствии подходящего металлического катализатора, такого как, например, илиденовый катализатор на основе Ru, в особенности, необязательно замещенный акилиденовый или инденилиденовый катализатор, такой как бис(трициклогексилфосфин)-3-фенил-1Н-инден-1-илиденрутенийхлорид (Neolyst M1®) или бис(трициклогексилфосфин)[(фенилтио)метилен]-рутенийдихлорид. Другие катализаторы, которые можно использовать, представляют собой катализаторы первого и второго поколения Grubbs, т.е. бензилиденбис(трициклогексилфосфин)-дихлоррутений и (1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден)дихлор(фенилметилен)(трициклогексилфосфин)-рутений, соответственно. Особый интерес представляют катализаторы первого и второго поколения Hoveyda-Grubbs, которыми являются дихлор(о-изопропоксифенилметилен)-(трициклогексилфосфин)рутений(II) и 1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден)дихлор(о-изопропоксифенил-метилен)рутений, соответственно. Реакции обмена можно проводить в подходящем растворителе, таком как, например, простой эфир, например, ТГФ, диоксан; галогенированные углеводороды, например, дихлорметан, CHCl3, 1,2-дихлорэтан и т.п., углеводороды, например, толуол. В предпочтительном воплощении, реакцию обмена проводят в толуоле.
Промежуточный продукт (XVI) может быть связан с циклопропилсульфонамидом реакцией образования амида, как например при использовании любого из способов образования амидной связи. В частности, соединение (XVI) можно обрабатывать с помощью связующего агента, например, N,N'-карбонилдиимидазола (CDI), N-этоксикарбонил-2-этокси-1,2-дигидрохинолина (EEDQ), N-изобутилоксикарбонил-2-изобутилокси-1,2-дигидрохинолина (IIDQ), 1-этил-3-(3'-диметиламинопропил)карбодиимида (EDCI) или бензотриазол-1-илокситриспирролидинофосфонийгексафторфосфата (коммерчески доступен как PyBOP®), в растворителе, таком как простой эфир, например, ТГФ, или галогенированный углеводород, например, дихлорметан, хлороформ, дихлорэтан, и вводить во взаимодействие с циклопропилсульфонамидом, предпочтительно, после взаимодействия соединения (XVI) со связующим агентом. Реакции соединения (XVI) с циклопропилсульфонамидом предпочтительно проводят в присутствии основания, например, триалкиламина, такого как триэтиламин или диизопропилэтиламин, или 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU). Промежуточный продукт (XVI) также можно превращать в активированную форму, например, в активированную форму, такую как галогенангидрид кислоты, в особенности, хлорангидрид или бромангидрид кислоты, или в активный сложный эфир, например, в кислоту, этерифицированную с помощью арилоксигруппы, такой, как фенокси, п-нитрофенокси, пентафторфенокси, трихлорфенокси, пентахлорфенокси и т.п.; или путем превращения макроциклической кислоты (XVI) в смешанный ангидрид.
Промежуточные продукты (XIV) являются исходными веществами для получения соединений формулы (XVII) и, следовательно, существует необходимость в разработке способов получения этих промежуточных продуктов при крупномасштабном производстве, т.е., в многотоннажном масштабе, или больше. Эти способы должны приводить к конечному продукту с высоким выходом и чистотой. В особенности, присутствие различных хиральных центров в молекуле вызывает особые проблемы, так как хиральная чистота является необходимой для получения продукта, который пригоден для терапевтического применения. Следовательно, способы получения соединения (XIV) должны приводить в результате к продуктам с пригодной хиральной чистотой, без применения обременяющих операций очистки с потерей значительных количеств нежелательных стереоизомерных форм.
Один из аспектов данного изобретения относится к способам получения промежуточных продуктов (XIV) с высоким выходом и чистотой, которые пригодны для крупномасштабного промышленного применения.
Данное изобретение также относится к промежуточным продуктам, которые пригодны для получения соединений формулы (XVII). Ряд таких промежуточных продуктов представляет собой:
В соединениях, перечисленных в вышеприведенной таблице, R1 имеет значение, определенное ниже, и R имеет значение, как определено выше. В одном воплощении, R1 означает метил. В другом воплощении, R означает этил.
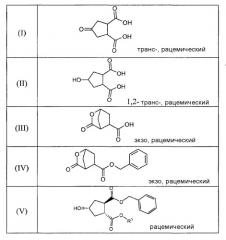
Honda и др., Tetrahedron Letters, том 22, № 28, сс.2679-2682, 1981, раскрывают синтез (±)-брефельдина А при использовании следующих исходных веществ:
Синтез согласно Honda и др. осуществляют, исходя из dl-транс-4-оксоциклопентан-1,2-дикарбоновой кислоты (2), которую этерифицируют с получением соответствующего метилового эфира (3) и восстанавливают при использовании никеля Ренея до спирта (4). Частичный гидролиз продукта 4 и бензилирование приводят к получению преимущественно одного диастереоизомера сложного эфира 5, т.е. такого диастереоизомера, где гидроксильная и карбоксильная группы находятся в цис-положении. Последний сложный эфир 5, согласно Honda и др., и соединение (V) оба являются рацематами, но диастереоизомеры у каждого являются другими, более точно, эпимерами относительно атома углерода №4, несущего гидроксильную группу. Соединение (Va) представляет собой один из двух энантиомеров, получаемых разделением рацемического соединения (V). Другой энантиомер является соединением (Vb).
В Международной заявке WO-2005/073195 описывается синтез энантиомерночистого бициклического лактона (8b), исходя из энантиомера 3,4-бис(метоксикарбонил)циклопентанона. Последний получают, как описано Rosenquist и др. в Acta Chemica Scandinavica, 46, 1127-1129 (1992). Транс-изомер (3R,4R)-3,4-бис(метоксикарбонил)циклопентанона превращают в бициклический лактон (8b):
В Международной заявке WO-2005/073195, кроме того, далее, описывается модификация лактона (8b) до сложного трет-бутилового эфира, раскрытие лактона и связывание с соответствующим образом защищенными аминокислотами, например, с этиловым эфиром (1R,2S)-1-амино-2-винилциклопропанкарбоновой кислоты, где, в последнем случае, получают:
Получение соединений формулы (XVII) неизбежно включает введение тиазолилзамещенного хинолинового остатка в циклопентильное кольцо посредством простой эфирной связи. Реакция Mitsunobu представляет собой «привлекательный» реакционный путь для получения ароматических простых алкилэфиров, где простой алкиловый эфир активируют и вводят во взаимодействие с ароматическим спиртом. Кроме того, реакции по Mitsunobu вообще являются более эффективными, чем реакции О-арилирования, которые требуют дополнительных стадий синтеза. В случае протекающей в мягких условиях этой реакции инвертируется стереохимия алкильной части. Реакция приводит к увеличению побочных продуктов, таких как R'OOC-NH-NH-COOR', где R' означает С1-4-алкил и, в частности, этил или изопропил, другие азотсодержащие соединения и трифенилфосфиноксиды, которые необходимо отделять от желательного конечного продукта.
Способы согласно настоящему изобретению являются преимущественными, так как они пригодны для крупномасштабного производства. Уменьшено количество трудоемких стадий очистки, в особенности, путем хроматографии.
Кроме того, выбор защитных групп бензила (Bn) и С1-4-алкила, в особенности метила (Ме), в соединениях (V), (Va) и (Vb) позволяет осуществлять селективное манипулирование с этими соединениями. Сложный бензиловый эфир или сложный С1-4-алкиловый эфир (и, в частности, метиловый эфир) можно селективно расщеплять за счет использования различных реакционных условий для удаления бензильной группы или С1-4-алкильной группы, в частности, метильной группы. Кроме того, остаток сложного бензилового эфира в соединении (IV), (V) или (Va) вносит преимущество в том, что он позволяет осуществлять эффективное разделение соединений (IV), (V) или (Va) с помощью хиральной хроматографии и облегчает анализ и обнаружение этих соединений, так как бензильный остаток является УФ-активным.
Описание данного изобретения
В одном аспекте, настоящее изобретение относится к способу получения соединения формулы (XIV), исходя из промежуточного продукта (XI), который гидролизуют до кислоты (XII), которую, в свою очередь, связывают с эфиром циклопропиламинокислоты (XIII), получая желательный конечный продукт (XIV), как показано на следующей реакционной схеме:
На вышеуказанной схеме, R имеет значение, как описано выше, т.е. С1-4-алкил, и R1, независимо от R, также означает С1-4-алкил. В одном воплощении, R означает этил. В другом воплощении, R1 означает метил. Представляет интерес способ, как показано выше, и промежуточные продукты формул (XI), (XIII) и (XIV), где R означает этил и R1 означает метил.
Промежуточный продукт (XI) является исходным веществом в вышеуказанном способе и его получение составляет дальнейший аспект данного изобретения. В соответствии с этим аспектом, изобретение относится к способу получения промежуточного продукта (XI), исходя из сложного гидроксициклопентилового бис-эфира формулы (Va), или
(а) путем введения во взаимодействие сложного гидроксициклопентилового бис-эфира формулы (Va) с тиазолилзамещенным хинолинолом (VIII) по реакции образования простого эфира, получая, таким образом, сложный хинолинилоксициклопентиловый бис-эфир формулы (IX), где сложноэфирную группу, которая находится в цис-положении по отношению к простой эфирной группе в сложном хинолинилоксициклопентиловом бис-эфире формулы (IX), селективно расщепляют до монокарбоновой кислоты (Х), которую, в свою очередь, связывают с алкениламином по реакции образования амида, получая, таким образом, желательный конечный продукт формулы (XI); или
(b) путем селективного превращения сложного гидроксициклопентилового бис-эфира формулы (Va) в монокарбоновую кислоту (VI), которую, в свою очередь, связывают с алкениламином по реакции образования амида для получения гидроксициклопентиламида (VII), который, в свою очередь, вводят во взаимодействие с тиазолилзамещенным хинолинолом (VIII), получая, таким образом, желательный конечный продукт формулы (XI);
как показано на следующей реакционной схеме:
Каждый R1 в способах, представленных на вышеуказанной схеме, и, в частности, в промежуточных продуктах (Va), (VI), (VII), (IX), (X) и (XI), имеет значение, как описано выше, и, предпочтительно, R1 означает метил. Bn означает бензил.
Промежуточный продукт (Va) является исходным веществом в вышеуказанном способе и его получение составляет дальнейший аспект данного изобретения. В соответствии с этим аспектом изобретение относится к способу получения промежуточного продукта (Va), исходя из 4-оксоциклопентил-1,2-бискарбоновой кислоты (I), путем восстановления кетогруппы до спирта, получая, таким образом, 4-гидроксициклопентил-1,2-бискарбоновую кислоту (II), которую, в свою очередь, циклизуют до бициклического лактона (III), где карбоксильную группу в бициклическом лактоне (III) этерифицируют с помощью бензилового спирта, получая, таким образом, бензиловый эфир лактона (IV), где лактон раскрывают и таким образом полученную карбоксильную группу этерифицируют с помощью С1-4-алканола, получая, таким образом, сложный гидроксициклопентиловый бис-эфир формулы (V), который, в свою очередь, разделяют на стереоизомеры (Vb) и (Va); как показано на следующей реакционной схеме:
Каждый R1 в способах, представленных на вышеуказанной схеме, и, в частности, в промежуточных продуктах (V), (Va) и (Vb), имеет значение, как описано выше, и, предпочтительно, R1 означает метил.
В одном воплощении, настоящее изобретение относится к применению соединений формул (I), (II), (III), (IV), (V), (Va), (Vb), (VI), (VII), (VIII), (IX), (X), (XI), (XII) или (XIV) в качестве промежуточных продуктов при получении соединения формулы (XVII) или его соли. Особый интерес представляют соединения формул (IX), (XI), (XII) и (XIV) и все промежуточные продукты, приводящие к образованию вышеуказанных соединений.
В другом воплощении, настоящее изобретение относится, по существу, к соединениям формул (II), (III), (IV), (V), (Va), (Vb), (VI), (VII), (IX), (X), (XI), (XII) или (XIV) и солям соединений формул (II), (III), (VI), (IX), (X) и (XII). Эти соединения могут быть в выделенной форме или в растворе. В особенности, соединения формул (VI), (IX), (X) или (XI) выделяют в твердой форме.
В одном воплощении, настоящее изобретение относится к способу получения соединения формулы (IX) или формулы (XI), где соединение формулы (Va), соответственно, формулы (VII), вводят во взаимодействие с соединением формулы (VIII) по реакции Mitsunobu. Эта реакция включает взаимодействие исходных веществ с азодикарбоксилатом формулы R'OOC-N=N-COOR', фосфином формулы R”3P, в инертном по отношению к реакции растворителе; где
R' означает этил или изопропил или трет-бутил;
R” означает, каждый, независимо, фенил, 2-пиридил, 3-пиридил или 4-пиридил.
Представленные в данном контексте реакции Mitsunobu представляют интерес в том, что они позволяют осуществлять пригодный способ получения соединений формул (XI) и (IX). Такое получение соединений формул (XI) и (IX), когда исходят из соединений (VII) и (Va), соответственно, включает инверсию стереохимии циклопентильного углерода, несущего гидроксильную группу или группу простого эфира.
Соединения формул (XI) и (IX) являются важными промежуточными продуктами, так как обнаружено, что оба соединения способны кристаллизоваться, в особенности, когда их смешивают со спиртовым растворителем, более конкретно, когда их смешивают с С1-4-алканолом. Кристаллизация соединений формул (XI) и (IX) представляет интерес в том, что она позволяет контролировать чистоту этих соединений, а также любых соединений, получаемых из них на последующих стадиях способа. В особенности, это дает возможность получать соединения формул (XI) и (IX) с более высокой энантиомерной чистотой.
Эта кристаллизация соединений формул (XI) и (IX) не только дает возможность удалять побочные продукты реакций Mitsunobu, по которым получают эти соединения, но также позволяет осуществлять последующее выделение соединений формул (XI) и (IX) из их соответствующих реакционных смесей простым путем. Это выделение без труда осуществляют путем замены растворителя, т.е. с помощью простого добавления спиртового растворителя к реакционной смеси, полученной по реакциям Mitsunobu, без проведения какой-либо дальнейшей манипуляции с реакционной смесью или любым ее компонентом.
Далее, так как соединения формул (XI) и (IX) нерастворимы в спиртовом растворителе, тогда как побочные продукты растворимы, это позволяет осуществлять непосредственную очистку соединений формул (XI) и (IX), выделяемых из реакционной смеси.
Способы, представленные в данном контексте, т.е. реакции Mitsunobu, с последующей заменой растворителя, обладают преимуществами в случае крупномасштабного производства. Другие способы выделения или очистки соединений формул (XI) и (IX), подобные хроматографии, гораздо меньше пригодны для крупномасштабного синтеза, требуют больше манипуляций и являются более дорогостоящими.
Как используется в вышеприведенном и нижеприводимом контексте, используют следующие определения, за исключением иначе указанного. Термин «галоген» является общим для фтора, хлора, брома и иода. Термин «С1-4-алкил» означает насыщенные углеводородные радикалы с линейной или разветвленной цепью, имеющие 1-4 атома углерода, такие как, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил. Интерес представляют С1-4-алкильные радикалы без 2-метил-1-пропила. Термин «С1-3-алкил» является общим для метила, этила, 1-пропила и 2-пропила. Термин «С1-3-алкил» является общим для метила и этила. Термин «С1-4-алканол» относится к спирту, производному от С1-4-алкильной группы.
Фармацевтически приемлемые соли, которые может образовывать соединение формулы (XVII), являются фармацевтически приемлемыми аддитивными солями кислот или аддитивными солями оснований.
Аддитивные соли кислот, как таковые, получают путем введения во взаимодействие основной формы соединения формулы (XVII) с соответствующей кислотой, такой как, например, неорганическая кислота, такая как галогенводородная кислота, например, соляная или бромоводородная кислота, серная кислота, гемисерная кислота, азотная кислота, фосфорная кислота и подобные кислоты; или органическая кислота, такая как, например, уксусная кислота, аспарагиновая кислота, додецилсерная кислота, гептановая кислота, гексановая кислота, никотиновая кислота, пропановая кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, цикламеновая кислота, салициловая кислота, п-аминосалициловая кислота, памоевая кислота и подобные кислоты. Наоборот, формы аддитивной соли кислоты можно превращать в форму свободного основания путем обработки с помощью подходящего основания. Аддитивные соли оснований образуются путем обработки с помощью соответствующих органических и неорганических оснований. Соответствующие формы аддитивных солей оснований включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например, соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например, соли бензатина, N-метил-D-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п.
Соединение формулы (XVII) имеет три хиральных центра и получение точной стереохимии в случае всех трех центров представляет собой важную задачу для любых способов синтеза, предназначенных для получения этого соединения. Для лучшего понимания стереохимии промежуточных продуктов, используемых в способах согласно настоящему изобретению, по причинам ясности приводятся следующие определения, хотя это известно в уровне техники.
Стереоизомерия представляет собой расположение атомов в молекулах, которые в отношении связности остаются теми же самыми, но их расположение в пространстве является различным в каждом изомере. Стереоизомеры можно разделять на две категории энантиомеров (зеркальные отображения) и диастереоизомеров (незеркальные отображения). Термин «энантиомер» относится к одной из пары молекул ненакладываемого зеркального отображения. Диастереомеры являются стереоизомерами, которые не являются энантиомерами или зеркальными отображениями друг друга. Диастереомеры могут иметь различные физические свойства и различную реакционную способность. Термин «рацемический» или «рацемат» относится к смеси равных количеств энантиомеров хиральной молекулы. Термин «эпимер» относится к стереоизомеру, который имеет другую конфигурацию только в случае одного из нескольких стереогенных центров. Таким образом, стереоизомеры различаются только по конфигурации в случае одного атома.
Общепринятая в настоящее время конвенция по номенклатуре стереохимических соединений является следующей:
- Если соединение изображено без стереосвязей, как изображено соединение формулы (III), тогда подразумевают, что соединение является рацемическим или конфигурация стереогенного(ых) центра(ов) не определена.
- Если соединение изображено со стереосвязями и, кроме того, указан один из дескрипторов «(±)», «rel» или «rac» в отношении химической структуры, тогда подразумевают, что соединение является рацемическим и стереохимия является относительной.
- Если соединение изображено со стереосвязями, но ни один из дескрипторов «(±)», «rel» или «rac» не указан в отношении структуры, тогда подразумевают, что соединение является оптически чистым соединением, иначе говоря, стереохимия является абсолютной.
Например, в ссылке Honda и др. обозначение «(±)», используют в заголовке статьи, подразумевая, что описывается рацемический синтез с рацемическими промежуточными продуктами. Однако вышеуказанной конвенции можно необязательно следовать во всех публикациях.
В одном воплощении, настоящее изобретение относится к применению соединения, выбираемого из соединений (I)-(XIV), перечисленных в вышеприведенной таблице, в качестве промежуточных продуктов для получения соединения формулы (XVII) или его солей.
В другом воплощении, настоящее изобретение относится к соединению формул (II), (III), (IV), (V), (Va), (Vb), (VI), (VII), (IX), (X), (XI), (XII) или (XIV) или к солям соединений формул (II), (III), (VI), (Х) и (XII), как указано в вышеприведенной таблице. Соединение может быть доступно в выделенной форме или в растворе.
Термин «выделенная форма», «выделенный», или любой его эквивалент, относится к твердому или жидкому состоянию, в котором соединение находится в чистой форме, т.е., по существу, свободно от других компонентов.
В другом воплощении, настоящее изобретение относится к соединению формул (VI), (IX), (X) или (XI), где соединение находится в твердой форме. Термин «твердая форма» включает как кристаллические, так и аморфные твердые формы, или любые их смеси.
Соединение формулы (I)
Соединение формулы (I) является коммерчески доступным или его можно получать в соответствии с методикой, описанной в примере 1.
Стадия (I) → (II)
Эта стадия относится к восстановлению кетогруппы в соединении формулы (I) до соответствующего спирта в соединении формулы (II). Последнее получают путем введения во взаимодействие соединения формулы (I) с водородом, в присутствии катализатора, необязательно в присутствии основания. Катализатор можно выбирать из катализаторов на основе благородных металлов, таких как родий-на-угле, родий-на-оксиде алюминия, платина-на-угле или платина-на-оксиде алюминия. Основание можно выбирать из гидроксида щелочного металла, в частности, гидроксида натрия, оксида алюминия или три-С1-4-алкиламина, такого как триэтиламин. По завершении взаимодействия, можно добавлять кислоту для превращения образовавшейся солевой формы обратно в свободную кислоту. Это может быть неорганическая кислота, такая как галогенводородная кислота, например, HCl, или серная кислота.
Стадия (II) → (III)
Эта стадия приводит к образованию лактона. Соединение формулы (III) или его соль получают путем введения во взаимодействие соединения формулы (II) или его соли с С1-4-алкилхлорформиатом формулы ClCOOR2, где R2 означает С1-4-алкил, в частности, метил, этил, пропил, изопропил, н-бутил или изобутил, и неорганическим основанием. В одном воплощении, можно выделять соединение формулы (III). Органическое основание может быть третичным амином, таким как три-С1-4-алкиламин, например, триэтиламин.
Стадия (III) → (IV)
Эта стадия приводит к образованию сложного бензилового эфира. Соединение формулы (IV) получают путем введения во взаимодействие соединения формулы (III) с бензиловым спиртом; исходное вещество (III) и бензиловый спирт могут взаимодействовать в присутствии агента образования сложного эфира, например, связующего агента. Или кислоту (III) можно превращать в активированную форму, как например путем введения во взаимодействие с хлорформиатом, в частности, с С1-4-алкилхлорформиатом формулы ClCOOR2, где R2 имеет значение, указанное выше, в присутствии органического основания.
Связующий агент можно выбирать из карбодиимидов, таких как EDCI, N,N'-дициклогексилкарбодиимид (DCC) или диизопропилкарбодиимид, или N,N'-карбонилдиимидазола (CDI), вместе с или без 4-диметиламинопиридина (DMAP), или этил/изопропил/изобутилхлорформиата. Органическое основание может быть третичным амином, таким как три-С1-4-алкиламин, например, триэтиламин.
Стадия (IV) → (V)
Стереоизомерную смесь (V) соединения формулы (Va) и соединения формулы (Vb) получают путем переэтерификации лактона в С1-4-алкиловый эфир. Применяемым растворителем предпочтительно является спирт, от которого происходит образующийся сложный эфир, т.е., если должен быть получен метиловый эфир, то реакцию проводят в метаноле. Это взаимодействие осуществляют в присутствии кислотного катализатора и с избытком спирта в качестве растворителя, как при проведении реакции в отношении образования сложного эфира. Кислотный катализатор может быть в виде неорганической кислоты, например, HCl, или в виде органической кислоты, такой как метансульфоновая кислота, или можно использовать кислые смолы, такие как Amberlyst 15™ (A15), которые можно без труда удалять путем фильтрации.
Стадия (V) → (Va) + (Vb)
Соединение формулы (Va) получают путем отделения его от соединения формулы (Vb), из смеси изомеров (Va) и (Vb), в частности, рацемической смеси соединений (Va) и (Vb). Это энантиомерное разделение можно осуществлять с помощью хроматографии на колонке с хиральной фазой или путем хиральной жидкостной хроматографии. Это включает использование хиральной стационарной фазы, например, стационарной фазы на основе полиамилозы или полицеллюлозы, такой как Chiralpak AD™.
Стадия (Va) → (VI)
Эта стадия включает расщепление сложного бензилового эфира до свободной кислоты. Соединение формулы (VI) получают из соединения формулы (Va) удалением бензиловой группы с помощью гидрирования. Это можно осуществлять путем использования водорода в присутствии катализатора. Катализатор можно выбирать из палладия-на-угле или соли палладия или гидроксида, как например ацетат палладия, хлорид палладия, гидроксид палладия или гидроксид палладия-на-угле.
Эту реакцию можно проводить в подходящем растворителе, который можно выбирать из простого эфира, в частности, из простого эфира, такого как метил-трет-бутиловый эфир (МВТЕ), или циклического простого эфира, такого как тетрагидрофуран (ТГФ), 2-метилтетрагидрофуран (МеТГФ); кетона, такого как ацетон, метилизобутилкетон; спирта, такого как С1-4-алканол, например, метанол, этанол, пропанол; диполярного апротонного растворителя, такого как диметилформамид (ДМФА), диметилацетамид (DMA); углеводорода, такого как толуол; или любой смеси таких растворителей. Реакционную смесь, содержащую соединение (Va), катализатор и растворитель, можно перемешивать в атмосфере водорода. Соединение формулы (VI) можно кристаллизовать удалением путем фильтрации катализатора из реакционной смеси, промывки и осуществления необходимых замен растворителя, например, путем замены части или всего растворителя простым эфиром, таким как МТВЕ, затем, далее, необязательно введения затравки при использовании затравочных кристаллов соединения формулы (VI), при необязательном охлаждении до температуры в диапазоне от примерно -15°С до примерно 5°С. Если желательно, соединение формулы (VI) можно получать в растворе, свободном от катализатора, и можно затем использовать в растворенной форме при получении соединения формулы (VII).
Другие возможные способы дебензилирования, которые можно альтернативно применять на этой стадии, можно осуществлять путем гидрирования с переносом, используя смесь муравьиная кислота - триэтиламин, формиат натрия или калия, или путем гидросилилирования, используя, например, Et3SiH (TES-H), PhSiH3, Ph2SiH2, поли(метилгидросилоксан) (PMHS) или (RO)3SiH.
Стадия (VI) → (VII)
Соединение формулы (VII) получают из соединения формулы (VI) и N-метилгекс-5-ениламина (NMHA, также называемого как N-метил-5-гексен-1-амин) путем реакции образования амида. Последний может быть любым из таковых, обычно используемых в случае пептидного синтеза. Может быть использован связующий агент или кислота может быть активирована путем превращения ее в смешанный ангидрид или активный эфир. Связующие агенты, которые можно использовать, можно выбирать из EEDQ, N,N,N',N'-тетраметил-О-(7-азабензотриазол-1-ил)уронийгексафторфосфата (HATU), IIDQ, бензотриазол-1-илокситриспирролидинофосфоний-гексафторфосфата (коммерчески доступный как PyBOP®), DCC, EDCI или 1,3-диизопропилкарбодиимида. Можно добавлять катализатор, например, 1-гидроксибензотриазол (HOBt). Это взаимодействие обычно проводят в присутствии основания, в частности, амина в качестве основания, такого как третичный амин, например, триэтиламин, N-метилморфолин, N,N-диизопропилэтиламин (последний также указан выше как основание Хенига, DIPEA или DIEA). При реакциях образования амида предпочтительно избегают использования веществ, таких как О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (HATU) или О-(1Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (HBTU), потому что существует риск взрывов в случае крупномасштабного производства.
Реакцию связывания обычно проводят в инертном по отношению к реакции растворителе, который можно выбирать из простого эфира, в частности, циклического простого эфира, такого как ТГФ или МеТГФ, диполярного апротонного растворителя, такого как ДМФА, гексаметилфосфорамид (НМРТ), DMA, ацетонитрил; углеводорода, такого как толуол; галогенированного углеводорода, такого как дихлорметан, хлороформ, 1,2-дихлорэтан; спирта, такого как С1-4-алканол, например, метанол, этанол, пропанол; воды; или любой смеси таких растворителей.
Реакции связывания обычно проводят с необязательным перемешиванием, при температуре в диапазоне от примерно -20°С до температуры кипения с обратным холодильником реакционной смеси.
Стадия (VII) + (VIII) → (XI)
Эта реакционная стадия включает образование простой эфирной связи между циклопентильным остатком в соединении (VII) и хинолинильным остатком в соединении (VIII). Эта простая эфирная связь предпочтительно образуется посредством реакции Mitsunobu. Согласно этой реакции соединение формулы (VII) вводят во взаимодействие с соединением формулы (VIII) в присутствии азодикарбоксилата формулы R'OOC-N=N-COOR', фосфина формулы R”3P и органического растворителя; где каждый R' представляет собой, независимо, С1-4-алкил, в частности, этил, изопропил или трет-бутил; и каждый R” представляет собой, независимо, фенил, 2-пиридил, 3-пиридил или 4-пиридил. Предпочтительными являются диэтилазодикарбоксилат (DEAD) или диизопропилазодикарбоксилат (DIAD), в присутствии трифенилфосфина.
Органический растворитель можно выбирать из галогенированного углеводорода, такого как дихлорметан, простого эфира, в частности, циклического простого эфира, такого как тетрагидрофуран (ТГФ), 2-метилтетрагидрофуран (МеТГФ), сложного эфира, такого как этилацетат, изопропилацетат, ароматического углеводорода, такого как толуол, или любой смеси таких растворителей.
Необязательно, начальную реакционную смесь, содержащую соединение формулы (VII), соединение формулы (VIII), фосфин формулы R”3P и органический растворитель, можно частично выпаривать, для того, чтобы удалить следы воды и/или спиртов. Эту начальную реакционную смесь можно охлаждать до темпер