Способ регулирования условий для сайт-специфического связывания полипептида и непептидильного полимера
Иллюстрации
Показать всеНастоящее изобретение предоставляет способ регулирования условий для сайт-специфического связывания полипептида и непептидильного полимера посредством регулирования рН и содержания спирта реакционной среды. Способ предназначен для предотвращения образования побочных конъюгатов, в которых непептидильный полимер связывается с физиологически важным аминокислотным остатком. 14 з.п. ф-лы, 36 ил., 2 табл., 25 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу получения сайт-специфического физиологически активного полипептидного конъюгата, более конкретно - к способу получения указанного конъюгата с высоким выходом посредством связывания физиологически активного полипептида с непептидильным полимером.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Пептиды легко денатурируются вследствие своей низкой стабильности, in vivo деградации протеазами и экскреции через почки вследствие своего относительно малого размера. В связи с этим, для того, чтобы поддерживать специфическую концентрацию в крови пептидного лекарственного средства в его активной форме необходимо часто вводить пептидное лекарственное средство пациенту. Однако пептидные лекарственные средства обычно вводятся в форме инъецируемых препаратов, и такое частое введение вызывает тяжелый дискомфорт у пациентов. Для решения этой проблемы был разработан ряд способов, например, способ переноса пептидного лекарственного средства посредством ротоглоточной или носоглоточной ингаляции путем увеличения проникновения пептидного лекарственного средства через биологические мембраны, способ модификации специфической аминокислотной последовательности, которая чувствительна к протеазам (например, аминокислотная последовательность GLP-1 для предотвращения утраты титров посредством дипептидил пептидазы), для того, чтобы стабилизировать пептид посредством ингибирования деградации ферментом, и способ химического присоединения непептидильного полимера с высокой растворимостью, такого как полиэтиленгликоль (PEG) к поверхности пептида.
PEG, который был использован как один из непептидильных полимеров, не специфически связывается со специфическим сайтом или множеством сайтов целевого полипептида для приобретения эффекта увеличения молекулярной массы пептида, полученный PEG-пептид препятствует выведению через почки и ферментативному гидролизу без каких-либо побочных эффектов. Например, в Международной Патентной Публикации № WO 2006/076471 описывается поддержание физиологической активности натрийуретического пептида B-типа (BNP), используемого как терапевтический агент при застойной сердечной недостаточности посредством связывания с ним PEG, и в Патенте США №6924264 описывается увеличение in vivo времени удержания лекарственного средства эксендина-4 путем связывания PEG с его лизиновым остатком.
Эти способы удлиняют in vivo время удержания пептидного лекарственного средства посредством увеличения молекулярной массы PEG, но по мере того, как молекулярная масса увеличивается, титр пептидного лекарственного средства значительно снижается. В дополнение не специфическое связывание PEG может защищать активный домен физиологически активного полипептида от значительного снижения активности полипептида.
Поэтому существует необходимость в разработке улучшенного способа получения конъюгата физиологически активного полипептида и непептидильного полимера, в котором полимер связан с пептидом сайт-специфическим образом, который не влияет на полипептидную активность.
Авторы настоящего изобретения разработали изобретение посредством подтверждения того, что физиологически активный полипептидный конъюгат, содержащий сайт-специфически связанный непептидильный полимер, может быть получен с высоким выходом посредством регулирования pH и содержания спирта реакционной среды.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В связи с этим целью настоящего изобретения является предоставление высокопродуктивного способа получения физиологически активного полипептидного конъюгата, в котором непептидильный полимер сайт-специфически связывается с физиологически активным полипептидом.
В соответствии с одним аспектом по настоящему изобретению предоставляется способ получения сайт-специфического физиологически активного полипептидного конъюгата, включающий стадии: i) проведения реакции физиологически активного полипептида и непептидильного полимера в реакционной среде, которая содержит специфическое количество спирта и имеет специфический pH, дающие возможность непептидильному полимеру связываться с целевым сайтом физиологически активного полипептида; и ii) выделения и очистки физиологически активного полипептидного конъюгата из реакционной смеси стадии (i) посредством ионообменной хроматографии с использованием спирта.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеуказанные и другие цели и признаки настоящего изобретения станут очевидными из следующего описания изобретения, которое представлено в связи с прилагаемыми чертежами, которые соответственно показывают:
Фиг.1: профиль очистки позиционных изомеров DA-эксендин-4-PEG с использованием колонки SOURCE S;
Фиг.2: профиль очистки позиционных изомеров CA-эксендин-4-PEG с использованием колонки SOURCE S;
Фиг.3: график, показывающий Lys27-пегилированные изомеры, полученные, когда CA-эксендин-4 пегилируется при варьирующем pH;
Фиг.4: график, показывающий Lys27-пегилированные изомеры, полученные, когда CA-эксендин-4 пегилируется при варьирующем pH и в 45% EtOH;
Фиг.5: график, показывающий Lys27-пегилированные изомеры, полученные, когда CA-эксендин-4 пегилируется при pH 7,5 и в варьирующем количестве (%) этанола;
Фиг.6: график, показывающий Lys27-пегилированные изомеры, полученные, когда CA-эксендин-4 пегилируется при pH 7,5 и в варьирующем количестве (%) изопропанола;
Фиг.7: анализ SDS-PAGE [электрофорез в полиакриламидном геле с додецилсульфатом натрия] CA-эксендин-4-PEG-Fc иммуноглобулин;
Фиг.8: анализ SDS-PAGE CA-эксендин-PEG Lys12 и Lys27;
Фиг.9: анализ профиля Lys12-пегилированных изомеров CA-эксендин-4 посредством пептидного картирования;
Фиг.10: анализ профиля Lys27-пегилированных изомеров CA-эксендин-4 посредством пептидного картирования;
Фиг.11: профиль очистки позиционных изомеров оксинтомодулин-PEG с использованием колонки SOURCE S;
Фиг.12: профиль очистки позиционных изомеров имидазоацетил оксинтомодулин-PEG с использованием колонки SOURCE S;
Фиг.13: анализ профиля Lys30-пегилированных изомеров оксинтомодулина посредством пептидного картирования;
Фиг.14: профиль очистки конъюгата имидазоацетил оксинтомодулин-PEG и Fc иммуноглобулина с использованием колонки SOURCE Q;
Фиг.15: анализ SDS-PAGE конъюгата имидазоацетил оксинтомодулин-PEG и Fc иммуноглобулина;
Фиг.16: профиль очистки позиционных изомеров аналога оксинтомодулина-PEG с использованием колонки SOURCE S;
Фиг.17: анализ профиля Lys27-пегилированных изомеров аналога оксинтомодулина посредством пептидного картирования;
Фиг.18: профиль очистки позиционных изомеров аналога имидазоацетил оксинтомодулин-PEG с использованием колонки SOURCE S;
Фиг.19: анализ профиля Lys27-пегилированных изомеров аналога имидазоацетил оксинтомодулина посредством пептидного картирования;
Фиг.20: профиль очистки конъюгата аналога имидазоацетил оксинтомодулин-PEG и Fc иммуноглобулина с использованием колонки SOURCE Q;
Фиг.21: анализ SDS-PAGE конъюгата аналога имидазоацетил оксинтомодулин-PEG и Fc иммуноглобулина;
Фиг.22: профиль очистки позиционных изомеров GLP-1-PEG с использованием колонки SOURCE S;
Фиг.23: анализ профиля Lys34-пегилированных изомеров GLP-1 посредством пептидного картирования;
Фиг.24: профиль очистки позиционных изомеров имидазоацетил GLP-1-PEG с использованием колонки SOURCE S;
Фиг.25: анализ профиля Lys34-пегилированных изомеров имидазоацетил GLP-1 посредством пептидного картирования;
Фиг.26: профиль очистки конъюгата имидазоацетил GLP-1-PEG и Fc иммуноглобулина с использованием колонки SOURCE Phe;
Фиг.27: анализ SDS-PAGE конъюгата имидазоацетил GLP-1-PEG и Fc иммуноглобулина;
Фиг.28: профиль очистки позиционных изомеров GLP-2-PEG с использованием колонки SOURCE S;
Фиг.29: анализ профиля Lys30-пегилированных изомеров GLP-2 посредством пептидного картирования;
Фиг.30: профиль очистки позиционных изомеров имидазоацетил GLP-2-PEG с использованием колонки SOURCE S;
Фиг.31: профиль очистки конъюгата имидазоацетил GLP-2-PEG и Fc иммуноглобулина с использованием колонки SOURCE Phe;
Фиг.32: анализ SDS-PAGE конъюгата имидазоацетил GLP-2-PEG и Fc иммуноглобулина;
Фиг.33: профиль очистки позиционных изомеров человеческого инсулин-PEG (B1F) с использованием колонки SOURCE S;
Фиг.34: профиль очистки позиционных изомеров человеческого инсулин-PEG (A1G) с использованием колонки SOURCE S;
Фиг.35: профиль очистки позиционных изомеров человеческого инсулин-PEG (B29K) с использованием колонки SOURCE S; и
Фиг.36: анализ профиля A1G-, B1F- или B29K-пегилированных изомеров человеческого инсулина человека посредством пептидного картирования.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В дальнейшем настоящее изобретение описывается подробно.
Настоящее изобретение предоставляет способ получения сайт-специфического физиологически активного полипептидного конъюгата, включающий стадии:
i) обработки физиологически активного полипептида непептидильным полимером в реакционной среде, которая содержит специфическое количество спирта и имеет специфический pH, дающие возможность связыванию непептидильного полимера с целевым сайтом физиологически активного полипептида; и
ii) выделения и очистки физиологически активного полипептидного конъюгата из реакционной смеси стадии (i) посредством ионообменной хроматографии с использованием спирта.
Физиологически активный полипептидный конъюгат в соответствии с настоящим изобретением относится к веществу, в котором физиологически активный полипептид и конец непептидильного полимера ковалентно связаны друг с другом, и настоящее изобретение отличается связыванием полипептида с полимером при специфических условиях и выделением полученного полипептидного конъюгата, содержащего полимер, связанный с его целевым сайтом.
Термин «физиологически активный полипептид или пептид», как использовано в данном описании, относится к пептиду, который может проявлять физиологическую активность in vivo, например, может быть выбран из группы, состоящей из инсулинотропного пептида, фактора крови, пищеварительного гормона, адренокортикотропного гормона, гормона щитовидной железы, кишечного гормона, цитокина, фермента, фактора роста, нейропептида, гипофизеотропного гормона, гипофизиотропного гормона, пептида против ожирения, противовирусного пептида и неприродных пептидных производных, сохраняющих физиологически активное свойство, но не ограничиваясь ими. Более конкретно- физиологически активный полипептид или пептид выбран из группы, состоящей из эритропоэтина, GM-CSF (колониестимулирующий фактор гранулоцитов-макрофагов), амилина, глюкагона, инсулина, соматостатина, PYY (пептид YY), NPY (нейропептид Y), GLP-1, GLP-2, эксендина-4, оксинтомодулина, грелина, ангиотензина, брадикинина, кальцитонина, кортикотропина, эледоисина, гастрина, лептина, окситоцина, вазопрессина, LH (лютеинизирующий гормон), пролактина, FSH (фолликулостимулирующий гормон), PTH (паратиреоидный гормон, [гормон паращитовидных желез]), секретина, серморелина, hGH (гормон роста человека), высвобождающего гормон роста пептида, G-CSF (колониестимулирующий фактор гранулоцитов), интерферонов, интерлейкинов, высвобождающего пролактин пептида, орексина, пептида тиролиберина, холецистокинина, ингибирующего гастрин пептида, кальмодулина, высвобождающего гастрин пептида, мотилина, вазоактивного кишечного пептида, ANP (предсердный натрийуретический пептид), BNP (натрийуретический пептид головного мозга), CNP (натрийуретический пептид C-типа), нейрокинина A, нейромедина, ренина, эндотелина, пептида сарафотоксина, пептида карсоморфина, дерморфина, динорфина, эндорфина, энкефалина, T-клеточного фактора, фактора некроза опухоли, рецептора фактора некроза опухоли, урокиназного рецептора, опухоль ингибирующего фактора, коллагеназного ингибитора, тимопоэтина, тимулина, тимопентина, тимозина, гуморального фактора тимуса, адреномодуллина, аллатостатина, фрагмента белка бета-амилоида, противомикробного пептида, антиоксидантного пептида, бомбезина, остеокальцина, CART пептида, E-селектина, ICAM-1, VCAM-1, лейкокина, [белка с доменом] kringle-5, ламинина, ингибина, галанина, фибронектина, панкреастатина и фузеона. В дополнение, физиологически активный полипептид включает предшественник, производное, фрагмент или его вариант.
Предпочтительный физиологически активный полипептид, используемый в настоящем изобретении, представляет собой эксендин, инсулин, GLP-1, GLP-2, оксинтомодулин, грелин, ангиотензин, брадикинин, кальцитонин или его производное. Его производное может быть получено, например, посредством химического замещения (например, альфа-метилирование или альфа-гидроксилирование), делеции (например, дезаминирование или углеродная делеция) или модификации (например, N-метилирование) любых групп на аминокислотном остатке, и конкретнее - получение производного эксендина описано подробно в Патентной заявке Кореи №2008-69234.
При этом термин «непептидильный полимер», как использовано в данном описании, относится к биосовместимому полимеру, включающему две или более повторяющихся единиц, связанных друг с другом ковалентной связью, исключая пептидную связь.
Непептидильный полимер, который может быть использован в настоящем изобретении, может быть выбран из группы, состоящей из: полиэтиленгликоля, полипропиленгликоля, сополимеров этиленгликоля и полипропиленгликоля, полиоксиэтилированных полиолов, поливинилового спирта, полисахаридов, декстрана, простого поливинилэтилового эфира, биодеградируемых полимеров, таких как PLA (поли(молочная кислота)) и PLGA (полимолочная-гликолевая кислота), липидных полимеров, хитинов, гиалуроновой кислоты и их комбинаций, и предпочтительно представляет собой полиэтиленгликоль. Его производное, которое известно в данной области или которое легко получить специалисту в данной области, также включается в объем настоящего изобретения. Непептидильный полимер, который может быть использован в настоящем изобретении, служит для увеличения молекулярной массы физиологически активного полипептида с предотвращением выведения конъюгата через почки. Любой непептидильный полимер, если он резистентен к in vivo протеазе, может быть использован без какого-либо ограничения. Молекулярная масса непептидильного полимера может находиться в диапазоне от 0,5 до 100 кД, предпочтительно от 0,5 до 20 кД и приемлемое молярное отношение физиологически активного полипептида и непептидильного полимера может быть выбрано в диапазоне от 1:1 до 1:50.
Непептидильный полимер, использованный в настоящем изобретении, содержит реакционноспособную группу на одном конце или на обоих концах. В случае, если непептидильный полимер содержит реакционноспособную группу на обоих концах, он может связываться с физиологически активным носителем и белковым лекарственным средством, которые способствуют функционированию в качестве длительно действующего состава.
Реакционноспособная группа на одном конце или на обоих концах непептидильного полимера предпочтительно выбирается из группы, состоящей из реакционноспособной альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы и сукцинимидной группы. Примеры сукцинимидной группы включают сукцинимидил пропионат, сукцинимидил бутаноат, гидрокси сукцинимидил, сукцинимидил карбоксиметил или сукцинимидил карбонат. В частности, когда непептидильный полимер содержит реакционноспособную альдегидную группу или реакционноспособную сукцинимидильную группу на одном конце, он является эффективным при связывании на обоих концах с физиологически активным полипептидом и иммуноглобулином с минимальными неспецифическими реакциями. Альдегидная реакционноспособная группа селективно связывается с N-концом при низком pH и может связываться с лизиновым остатком с образованием аминной связи при высоком pH, таком как pH 9,0. В добавление сукцинимидильная реакционноспособная группа может образовывать стабильную амидную связь с N-концом или лизиновым остатком при pH 7,0~9,0.
Далее реакционноспособные группы на обоих концах непептидильного полимера могут быть одинаковыми или различными. В случае, если полиэтиленгликоль, содержащий реакционноспособную гидроксильную группу на своих обоих концах, используется как непептидильный полимер, гидроксильная группа может быть активирована в различные реакционноспособные группы посредством известных химических реакций, или может быть использован коммерчески пригодный полиэтиленгликоль, содержащий модифицированную реакционноспособную группу.
Стадия (i) настоящего изобретения состоит в получении физиологически активного полипептидного конъюгата посредством сайт-специфического связывания непептидильного полимера с физиологически активным полипептидом в приемлемой реакционной среде.
Термин «сайт-специфический» или «сайт-специфически», как использовано в данном описании, относится к связыванию непептидильного полимера со специфическим целевым аминокислотным сайтом физиологически активного полипептида, предпочтительно амином лизинового остатка или N-концом. Сайт-специфическое связывание или связь может предотвращать образование побочных конъюгатов, в которых непептидильный полимер связывается с физиологически важным аминокислотным остатком. Например, когда непептидильный полимер связывается с N-концом эксендина-4, in vitro активность эксендина-4 снижается, но когда непептидильный полимер связывается с лизиновым остатком, in vitro активность сохраняется. В частности, когда непептидильный полимер связывается с 27-м лизиновым остатком скорее, чем с 12-м лизиновым остатком, наблюдалась значительно более высокая in vitro активность (см. пример 10 и таблицу 2).
Авторы настоящего изобретения обнаружили, что присутствие спирта в реакционной среде и pH реакций среды на стадии (i) являются критическими факторами сайт-специфической связи непептидильного полимера и физиологически активного полипептида. Соответственно на стадии (i) настоящего изобретения непептидильный полимер связывается со специфическим сайтом физиологически активного полипептида с использованием реакционной среды, содержащей специфическое содержание спирта и имеющей специфический pH.
В специфическом варианте осуществления настоящего изобретения отношение специфического позиционного изомера полипептидного конъюгата может варьироваться на основе pH реакционной среды или на основе концентрации (%) спирта при таком же pH. Поэтому возможно связывание непептидильного полимера с желательной аминокислотой физиологически активного полипептида сайт-специфическим образом.
То есть стадия (i) настоящего изобретения выполняется при специфическом pH, давая возможность непептидильному полимеру связываться с желательным (или целевым) сайтом, то есть эта доза не влияет на полипептидную активность. Диапазон pH может зависеть от типов физиологически активного полипептида. Например, в случае инсулинотропного пептида (например, эксендин-4) изомер, в котором полимер связан с 12-м лизином, в высокой степени наблюдался при низком pH реакционной среды, тогда как изомер, в котором полимер связан с 27-м лизином, который не влияет на инсулинотропную активность, в высокой степени наблюдался при высоком pH реакционной среды. (см. пример 3 и фиг.3). Соответственно стадия (i) предпочтительно выполняется при pH от 7,5 до 9,0, так что непептидильный полимер селективно связывается с 27-м лизином.
Далее стадия (i) настоящего изобретения выполняется в реакционной среде, содержащей спирт, с тем, чтобы непептидильный полимер мог связываться с сайтом, который не влияет на полипептидную активность. Примеры спирта включают первичный, вторичный и третичный спирт, предпочтительно спирт, содержащий число атомов углерода от одного до десяти, более предпочтительно- этанол или изопропанол. В случае инсулинотропного пептида (например, эксендин-4) спирт может находиться в реакционной среде в количестве, изменяющемся от 0,1% до 100% по объему, предпочтительно от 25% до 90%, более предпочтительно от 35% до 60% на основе общего объема реакционной среды, для того, чтобы дать возможность непептидильному полимеру связываться с 27-м лизином, который не влияет на инсулинотропную активность.
В варианте настоящего изобретения, когда физиологически активный полипептид представляет собой эксендин-4 или его производное, pH, применяемый на стадии (i), может быть от 7,0 до 10,0, для того, чтобы увеличить отношение связывания непептидильного полимера с Lys27. В другом варианте настоящего изобретения, когда физиологически активный полипептид представляет собой кальцитонин, pH, применяемый на стадии (i), может быть от 4,0 до 6,0, для того, чтобы увеличить отношение связывания непептидильного полимера с N-концом. В еще одном варианте осуществления настоящего изобретения, когда физиологически активный полипептид представляет собой оксинтомодулин или его производное, pH, применяемый на стадии (i), может быть от 7,0 до 10,0, для того, чтобы увеличить отношение связывания непептидильного полимера с Lys27 или Lys30. В еще одном варианте осуществления настоящего изобретения когда физиологически активный полипептид представляет собой инсулин человека или его производное, pH, применяемый на стадии (i), может быть от 4,0 до 6,0, для того, чтобы увеличить отношение связывания непептидильного полимера с Phe1 (1-й фенилаланин) N-конца в B цепи. В еще одном варианте осуществления настоящего изобретения, когда физиологически активный полипептид представляет собой инсулин человека или его производное, pH применяемый на стадии (i), может быть от 7,0 до 10,0, для того, чтобы увеличить отношение связывания непептидильного полимера с Gly1 (1-й глицин) N-конца в A цепи или с Lys29 (29-й лизин) в B цепи. В еще одном варианте осуществления настоящего изобретения, когда физиологически активный полипептид представляет собой GLP-1 или его производное, pH, применяемый на стадии (i), может быть от 7,0 до 10,0, для того, чтобы увеличить отношение связывания непептидильного полимера с Lys34. В еще одном варианте осуществления настоящего изобретения, когда физиологически активный полипептид представляет собой GLP-2 или его производное, pH, применяемый на стадии (i), может быть от 7,0 до 10,0, для того, чтобы увеличить отношение связывания непептидильного полимера с Lys30.
Соответственно предпочтительный сайт-специфический физиологически активный полипептидный конъюгат представляет собой конъюгат эксендина-4, в котором PEG связан с Lys27, конъюгат кальцитонина, в котором PEG связан с N-концом, конъюгат оксинтомодулина или его аналога, в котором PEG связан с Lys27 или Lys30, конъюгат инсулина человека или его аналога, в котором PEG связан с Phe1 N-конца в B цепи, Gly1 N-конца в A цепи или с Lys29 в B цепи, или конъюгат GLP-1 или GLP-2, в котором PEG связан с Lys34 или Lys30.
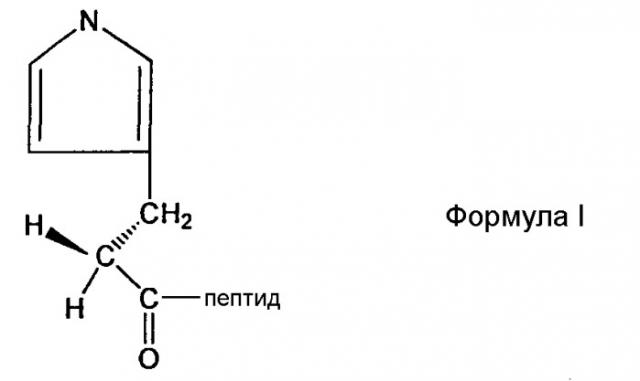
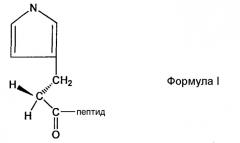
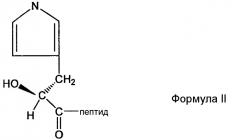
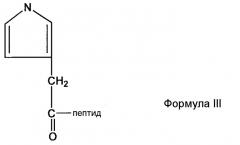
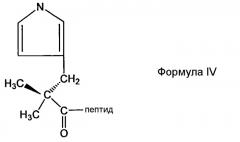
В предпочтительном аспекте настоящего изобретения пептидное производное (или аналог) могут быть использованы для облегчения сайт-специфической связи между непептидильным полимером и физиологически активным полипептидом. Производное представляет собой пептид, содержащий любой из других не целевых аминокислотных сайтов, делетированных или защищенных для того, чтобы предотвратить нежелательное связывание. Например, в случае инсулинотропного пептида, такого как эксендин, могут быть использованы различные производные эксендина, такие как Des-аминогистидил (DA)-эксендин-4 формулы (I), Бета-гидроксиимидазопропионил(HY)-эксендин-4 формулы (II), Имидазоацетил(CA)-эксендин-4 формулы (III) и Диметил-гистидил(DM)-эксендин-4 формулы (IV), которые получены с использованием способов, в которых альфа аминогруппа N-концевой аминокислоты гистидина делетирована, N-концевая аминогруппа замещена гидроксильной группой, N-концевая альфа аминогруппа гистидина модифицирована с использованием двух метильных групп или альфа углерод N-концевого гистидина и аминогруппа, связанная с ним, делетированы для удаления имидазоацетильной группы, но не ограничиваясь ими. Структуры таких примерных эксендиновых производных и способы их получения описаны в Корейской нерассмотренной патентной публикации №2009-0008151, которая включена в объем настоящего изобретения посредством ссылок.
Аналогично оксинтомодулин, GLP-1 и GLP-2, содержащие гистидин как 1-ю аминокислоту, могут быть также использованы как производное, имеющее любую структуру, выбранную из формул (I)-(IV).
В конкретном варианте осуществления настоящего изобретения авторы настоящего изобретения исследовали эффекты pH и содержания спирта (%) реакционной среды на аспект сайт-специфического связывания непептидильного полимера и подтвердили, что отношение конъюгатов инсулинотропного пептида, содержащих полимер, связанный с 12-м лизином/27-м лизином, варьируется в зависимости от изменения pH и количества этанола или изопропанола, в частности. В частности, более предпочтительный изомер, содержащий непептидильный полимер, связанный с 27-м лизиновым остатком, преимущественно получали, когда от 35% до 55%, предпочтительно примерно 45% этанола или изопропанола используется при pH 7,5.
После увеличения отношения желательный непептидильный полимер-физиологически активный полипептидный конъюгат посредством регулирования специфического pH и содержания спирта на стадии (i), желательный конъюгат может быть выделен и очищен посредством ионообменной хроматографии с использованием спирта на стадии (ii).
Спирт, используемый на стадии (ii), присутствует в очищенном растворе и его специфические примеры такие же, как определены на стадии (i). Однако спирт стадии (i) применяется для цели увеличения полипептидной реакционной способности и сайт-специфичности посредством модификации его вторичной или третичной структуры, тогда как спирт стадии (ii) применяется с целью облегчения высокопроизводительного выделения и очистки сайт-специфического физиологически активного полипептидного конъюгата посредством снижения неспецифической связи между ионообменной колонкой и конъюгатом. Выделение и очистка могут быть выполнены посредством использования различных методов, известных специалисту в данной области, предпочтительно посредством ионообменной хроматографии, более предпочтительно- посредством ионообменной хроматографии при высоком давлении.
При этом для облегчения выделения и очистки позиционного изомера ионообменная хроматография может быть выполнена при специфическом pH. pH приемлемо регулировался для увеличения сайт-специфичности конъюгата на стадии (i), тогда как повторно регулировался для связывания конъюгата и удаления его из ионообменной колонки в очищающем растворе, содержащем спирт стадии (ii). Приемлемый pH, применяемый на стадии (ii), может находиться в диапазоне от примерно 2,0 до примерно 6,0.
Кроме того, физиологически активный полипептид по настоящему изобретению может быть далее связан с физиологически активным носителем. В этом случае непептидильный полимер должен представлять собой непептидильный полимер с обоими концами, для того, чтобы связываться с физиологически активным носителем. То есть физиологический активный носитель ковалентно связывается с концом непептидильного полимера, который не ковалентно связан с физиологически активным полипептидом, и, таким образом, может быть получен конъюгат, в котором оба конца непептидильного полимера связаны с физиологически активным полипептидом и физиологически активным носителем.
Как описано выше, физиологически активный полипептидный конъюгат, полученный на стадии (ii), может далее связываться с физиологически активным носителем, и полученный в результате конъюгат полипептид-полимер-носитель проявляет совершенно различные свойства по сравнению с конъюгатом полипептид-полимер, т.е. выдающиеся физиологические свойства, такие как превосходное пролонгированное действие фармакологических эффектов физиологически активного полипептида, нацеленного на специфическую область, такую как повреждение, для лечения или индукции некроза.
Термин «физиологически активный носитель», как использован в данном описании, относится к физиологически активному веществу, проявляющему дополнительные свойства, отличающиеся от природной физиологической активности полипептида, которые могут поддерживать физиологическую активность полипептида, такую как фармакологические эффекты или индукция нацеливания на специфическую область или [область] некроза посредством связывания с непептидильным полипептидом совместно с физиологически активным полипептидом.
Физиологически активный носитель, используемый в настоящем изобретении, включает вещество, имеющее вышеупомянутые свойства без любого ограничения, например, альбумин, Fc область иммуноглобулина, трансферрин, аптамер, токсин, коллаген, декстран, полисахариды, жирные кислоты, фибриноген и подобное. Предпочтительно физиологически активный носитель может быть выбран из альбумина, Fc области иммуноглобулина и трансферрина, более предпочтительно Fc области иммуноглобулина.
Fc область иммуноглобулина по настоящему изобретению относится к константной области 2 тяжелой цепи (CH2) и константной области 3 тяжелой цепи (CH3) иммуноглобулина, исключая вариабельные области тяжелой и легкой цепей, константную область 1 тяжелой цепи (CH1) и константную область 1 легкой цепи (CL1). Она может далее включать шарнирную область константной области тяжелой цепи. Также Fc область иммуноглобулина по настоящему изобретению может представлять собой удлиненную форму, содержащую часть или всю Fc область, включающую константную область 1 тяжелой цепи (CH1) и/или константную область 1 легкой цепи (CL1), за исключением вариабельных областей тяжелой и легкой цепей до тех пор, пока она проявляет физиологическую функцию, существенно сходную или более лучшую, чем [физиологическая функция] природной Fc [области] иммуноглобулина, и может включать области Fc иммуноглобулина, модифицированные посредством фосфорилирования, сульфатирования, акрилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования, амидирования и подобное. Область Fc иммуноглобулина, способ ее получения и способ ковалентного связывания Fc иммуноглобулина с конъюгатом- непептидильный полимер-физиологически активный полипептид раскрыты в Корейском патенте №№775343, 725314, 725315 и 824505, которые включены в объем настоящего изобретения посредством ссылок.
В соответствии со способом по настоящему изобретению желательный полипептидный конъюгат, имеющий превосходную физиологическую активность, может быть получен с высоким выходом посредством сайт-специфического связывания непептидильного полимера со специфической аминокислотой физиологически активного полипептида, который минимизирует образование дополнительных конъюгатов.
Следующие примеры предназначены для дальнейшей иллюстрации настоящего изобретения без ограничения его объема.
Пример 1: Получение и выделение конъюгата пегилированный DA-эксендин-4 (Lys27)
<1-1> Получение конъюгата пегилированный DA-эксендин-4 (Lys27)
Для того чтобы получить пегилированный пептидный конъюгат посредством ковалентного связывания Lys в пептиде с PEG des-амино-гистидил-эксендин-4 (DA-эксендин-4, AP, США) и 3.4K PropionALD(2) PEG (PEG, имеющий две пропиональдегидные группы, IDB Inc., Корея) подвергали реакции при 4°C в течение 12 часов в молярном отношении 1:30 с пептидной концентрацией 3 мг/мл. В это время 100 мМ HEPES буфер (pH 7,5), содержащий 45% изопропанол, использовали в качестве реакционной среды, и 20 мМ NaCNBH3 как восстанавливающий агент добавляли в нее.
<1-2> Выделение позиционного изомера
Моно-пегилированный пептид сначала очищали из реакционной смеси примера <1-1> посредством использования SOURCE Q ионообменной хроматографии (XK 16 мл, GE healthcare, Корея) при следующих условиях, и позиционные изомеры выделяли посредством использования SOURCE S ионообменной хроматографии (XK 16 мл GE healthcare, Корея) при следующих условиях. В этом процессе этанол использовали для облегчения выделения изомеров посредством включения его в очищающий раствор. Пегилированные сайты подтверждали по элюированным пикам посредством метода пептидного картирования.
Колонка: SOURCE Q
Скорость потока: 2,0 мл/мин
Элюирующий раствор: A (20 мМ Трис, pH 8,5) и B (A+0,5М NaCl); градиент A 0→40%, 80 мин
Колонка:SOURCE S
Скорость потока: 2,0 мл/мин
Элюирующий раствор: A (20 мМ лимонная кислота, pH 3,0+45% этанол) и B (A+45% этанол+0,5М KCl); градиент A 0→100%, 45 мин
Из анализа профиля очистки позиционных изомеров обнаружили, что пик Lys12-пегилированный DA-эксендин-4 элюировался раньше, и затем Lys27-пегилированный пик элюировался в последней порции (фиг.1).
Пример 2: Получение и выделение конъюгата пегилированный CA-эксендин-4 (Lys27)
Процедуру примера 1 повторяли за исключением использования имидазоацетил-эксендин-4 (CA-эксендин-4, Bachem, США) вместо DA-эксендина-4 в примере 1 с получением конъюгата пегилированный CA-эксендин-4 (Lys27). Из анализа профиля очистки позиционных изомеров обнаружили, что пик Lys12-пегилированного CA-эксендин-4 элюировался раньше, и затем Lys27-пегилированного пик элюировался с последней порцией (фиг.2).
Пример 3: Изменение в отношении конъюгата пегилированный CA-эксендин-4 (Lys27) в соответствии с pH реакционной среды
Для исследования изменения в отношении полипептида, пегилированного в специфическом сайте посредством pH, CA-эксендин-4 и 3.4K PropionALD(2) PEG подвергали пегилированию посредством реакции пептида и PEG при 4°C в течение 12 часов в молярном отношении 1:30 с пептидной концентрацией 3 мг/мл. В это время 100 мМ лимонной кислоты (pH 3,0), 100 мМ NaOAc (pH 4,5), 100 мМ Na-P (pH 7,5), 100 мМ Na-P (pH 8,5), 100 мМ HEPES (pH 8,0) и 100 мМ Na-бората (pH 9,2) буферы использовали в качестве реакционной среды соответственно и добавляли в нее 20 мМ NaCNBH3 как восстанавливающий агент. Каждую реакционную смесь очищали посредством метода, описанного в примере 1, с последующим анализом отношения Lys27-пегилированного конъюгата. Как показано на фиг.3, отношение Lys27-пегилированного конъюгата увеличивалось на основе увеличения pH и подтвердили, что оптимальный pH составляет от 7,0 до 10,0.
Пример 4: Изменение в отношении конъюгата пегилированный CA-эксендин-4 (Lys27) в соответствии с pH реакционной среды, содержащей этанол
Для исследования изменения в отношении полипептида, пегилированного в специфическом сайте посредством этанола и pH, CA-эксендин-4 и 3.4K PropionALD(2) PEG подвергали пегилированию посредством реакции пептида и PEG при 4°C в течение 12 часов в молярном отношении 1:30 с пептидной концентрацией 3 мг/мл. В это время 100 мМ лимонной кислоты (pH 3,0)/45% этанол, 100 мМ NaOAc (pH 4,5)/45% этанол, 100 мМ Na-P (pH 7,5)/45% этанол, 100 мМ HEPES (pH 8,0)/45% этанол и 100 мМ Na-P (pH 8,5)/45% этанол буферы использовали в качестве реакционной среды, соответственно, и 20 мМ NaCNBH3 как восстанавливающий агент добавляли к ней. Каждую реакционную смесь очищали посредством метода, описанного в примере 1, с последующим анализом отношения Lys27-пегилированного конъюгата. Как показано на фиг.4, отношение Lys27-пегилированного конъюгата увеличивалось на основе увеличения pH в 45% EtOH-содержащей реакционной среде и подтвердили, что оптимальный pH составляет от 7,0 до 9,0.
Пример 5: Изменение в отношении конъюгата пегилированный CA-эксендин-4 (Lys27) в соответствии с концентрацией этанола в реакционной среде
Для исследования изменения в отношении полипептида, пегилированного в специфическом сайте посредством концентрации этанола в реакционной среде, CA-эксендин-4 и 3.4K PropionALD(2) PEG подвергали пегилированию посредством реакции пептида и PEG при 4°C в течение 12 часов в молярном отношении 1:30 с пептидной концентрацией 3 мг/мл. В это время 100 мМ HEPES (pH 7,5)/0% этанол, 100 мМ HEPES (pH 7,5)/25% этанол, 100 мМ HEPES (pH 7,5)/35% этанол, 100 мМ HEPES (pH 7,5)/45% этанол, 100 мМ HEPES (pH 7,5)/55% этанол, 100 мМ HEPES (pH 7,5)/75% этанол и 100 мМ HEPES (pH 7,5)/90% этанол буферы использовали в реакционной среде, соответственно, и 20 мМ NaCNBH3 как восстанавливающий агент добавляли в нее. Каждую реакционную смесь очищали посредством метода, описанного в примере 1, с последующим анализом отношения Lys27-пегилированного конъюгата. Как показано на фиг.5, отношение Lys27-пегилированного конъюгата увеличивалось до тех пор, пока количество этанола достигало примерно 50%, в то время как снижалось при более чем 50% этанола и подтверди