Способ лечения вирусного гепатита с
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к гастроэнтерологии, и может быть использована для лечения вирусного гепатита C. Для этого пациенту вводят эффективное количество глутарилгистамина или его фармацевтически приемлемой соли. Данное средство может также вводиться в комбинации с пэгилированным интерфероном и рибавирином. Группа изобретений также относится к фармацевтической композиции для лечения вирусного гепатита C. Посредством данной группы изобретений выявлено новое лекарственное средство, обладающее выраженным противовирусным действием и эффективное в лечении вирусного гепатита C. Разработана эффективная комбинация лекарственных средств для лечения вирусного гепатита С, позволяющая существенно снизить частоту побочных эффектов противовирусной терапии. 7 н. и 32 з.п. ф-лы, 3 пр., 22 табл.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к медицине и касается применения глутарилгистамина или его фармацевтически приемлемой соли для лечения вирусного гепатита C.
Уровень техники
Вирусный гепатит C остается одной из самых актуальных проблем здравоохранения в мире. Большое число инфицированных (почти 200 млн. человек), высокий риск развития хронической инфекции (60-80%), что является причиной цирроза печени или гепатоцеллюлярной карциномы (в 15-25% случаев), развитие системных внепеченочных поражений органов и тканей человека, отсутствие вакцины для профилактики развития и распространения инфекции обуславливают необходимость разработки эффективного лечения гепатита C [Абдурахманов Д.Т. Перспективы в лечении хронического гепатита C. Клиническая гепатология 2010; 3:3-11].
Современная терапия гепатита C пэгилированными интерферонами α2a или α2b в сочетании с рибавирином позволяет достичь устойчивый вирусологический ответ (УВО) в 54-73% случаев [Ивашкин В.Т., Лобзин Ю.В., Сторожаков Г.И. и др]. Эффективность и безопасность 48-ми недельной терапии пэгилированным интерфероном α2a и рибавирином показаны у первичных больных хроническим гепатитом C. Клин. фармакол. тера., 2007, 16(1), 1-5.]. При инфицировании субтипом 1b вируса гепатита C (ВГС), который превалирует в циркуляции на территории России, процент эффективности терапии значительно снижается и составляет 40-50%.
Таким образом, существует необходимость в разработке более эффективных, доступных и экономически целесообразных средств и схем лечения гепатита C, которые обладают меньшими побочными эффектами.
Авторами настоящего изобретения неожиданно было выявлено, что для лечения гепатита С может быть использован глутарилгистамин. При этом глутарилгистамин обладает противовирусным действием в отношении вируса гепатита C как в отдельности, так и в комбинации с пэгилированным интерфероном и рибавирином.
Ранее не предполагалось применение глутарилгистамина для лечения вирусных гепатитов. Более того, ранее не была известна комбинация глутарилгистамина с пэгилированным интерфероном и рибавирином.
Таким образом, задачей данного изобретения является предоставление нового средства для лечения гепатита C, а также предоставление комбинации лекарственных средств, которая обладает повышенной эффективностью в лечении вирусного гепатита C, в сравнении с наиболее эффективной комбинацией препаратов, которая использовалась до создания данного изобретения.
Раскрытие изобретения
Вышеприведенные задачи изобретения решаются посредством объектов изобретения, приведенных в прилагаемой формуле.
Данное изобретение относится к медицине и включает способ лечения вирусного гепатита C, предусматривающий введение пациенту эффективного количества глутарилгистамина или его фармацевтически приемлемой соли.
Дополнительно, изобретение относится к способу достижения устойчивого вирусологического ответа при лечении вирусного гепатита C, включающему введение пациенту эффективного количества пэгилированного интерферона, рибавирина и глутарилгистамина или его фармацевтически приемлемой соли.
В предпочтительном варианте осуществления изобретения, глутарилгистамин вводится в составе препарата дикарбамин. Доза глутарилгистамина или его фармацевтически приемлемой соли составляет 0,1-10 мг/кг массы тела. Разовая доза глутарилгистамина может составлять 100 мг. Длительность приема глутарилгистамина может составлять от 3 недель до 12 месяцев. При лечении гепатита C обеспечивается уменьшение побочных эффектов противовирусной терапии, таких как гриппоподобный синдром, артралгия, миалгия, обострение хронического панкреатита, депрессия, выпадение волос, лейкопения или нейтропения.
Изобретение также относится к способу лечения вирусного гепатита C, предусматривающему введение пациенту эффективного количества пэгилированного интерферона, рибавирина и глутарилгистамина или его фармацевтически приемлемой соли.
Структурная формула глутарилгистамина является следующей:
Кроме того, изобретение представляет собой фармацевтическую композицию для лечения гепатита C, содержащую эффективное количество глутарилгистамина или его фармацевтически приемлемой соли. Эффективное количество глутарилгистамина или его фармацевтически приемлемой соли может составлять 0,1-10 мг/кг массы тела.
Изобретение также включает фармацевтическую комбинацию для лечения гепатита C, включающую пэгилированный интерферон, рибавирин и глутарилгистамин или его фармацевтически приемлемую соль.
Далее, изобретение относится к набору для лечения гепатита C, включающему пэгилированный интерферон, рибавирин, глутарилгистамин или его фармацевтически приемлемую соль, и инструкцию по применению.
Изобретение также относится к применению глутарилгистамина или его фармацевтически приемлемой соли для производства фармацевтической композиции для лечения вирусного гепатита C.
Дополнительно, изобретение включает применение глутарилгистамина или его фармацевтически приемлемой соли в комбинации с пэгилированным интерфероном и рибавирином для лечения гепатита C.
Вирусный гепатит C, который лечат в соответствии с изобретением, может представлять собой острый или хронический гепатит C.
Способ лечения гепатита C, в соответствии с изобретением, обеспечивает уменьшение побочных эффектов противовирусной терапии. Данные побочные эффекты противовирусной терапии могут представлять собой гриппоподобный синдром, артралгии, миалгии, обострение хронического панкреатита, депрессию и/или выпадение волос.
Предпочтительно, глутарилгистамин вводится в составе препарата дикарбамин. Доза глутарилгистамина или его фармацевтически приемлемой соли составляет 0,1-10 мг/кг массы тела.
Пэгилированный интерферон, используемый в сочетании с глутарилгистамином и рибавирином, может представлять собой пэгилированный интерферон α2a или пэгилированный интерферон α2b.
В предпочтительном варианте осуществления изобретения, доза глутарилгистамина составляет 100 мг при введении 1 раз в день; доза пэгилированного интерферона составляет 100 мкг при введении 1 раз в неделю; доза рибавирина составляет 1000 мг в сутки при введении ежедневно.
Длительность приема глутарилгистамина, предпочтительно, составляет от 3 недель до 12 месяцев.
Глутарилгистамин может использоваться в виде фармацевтически приемлемых солей, полученных путем взаимодействия, например, с гидроксидом натрия, гидроксидом калия, карбонатом магния, гидроксидом лития, карбонатом кальция рутинными способами, широко описанными в литературе.
Положительные эффекты, достигаемые при осуществлении изобретения, являются следующими. Неожиданно выявлено новое лекарственное средство для лечения гепатита C, обладающее выраженным противовирусным действием. Кроме того, разработана эффективная комбинация лекарственных средств для лечения вирусного гепатита C. Также неожиданно были получены значительные улучшения важнейших показателей эффективности противовирусной терапии, таких как быстрый вирусологический ответ (отсутствие РНК вируса гепатита C в сыворотке крови при исследовании чувствительной тест-системой через 4 недели после начала лечения), ранний вирусологический ответ (отсутствие РНК вируса гепатита C в сыворотке крови при исследовании чувствительной тест-системой через 12 недель после начала лечения), непосредственный вирусологический ответ (отсутствие РНК вируса гепатита C в сыворотке крови при исследовании чувствительной тест-системой через 24 и 48 недель после начала лечения) и устойчивый вирусологический ответ у больных хроническим гепатитом C (отсутствие РНК вируса гепатита C в сыворотке крови при исследовании чувствительной тест-системой через 24 недели после окончания лечения).
Дополнительно, при проведении лечения ВГС по изобретению достигнуто существенное снижение частоты побочных эффектов противовирусной терапии, таких как лейкопения, нейтропения, гриппоподобный синдром, артралгии, миалгии, обострение хронического панкреатита, депрессия, выпадение волос.
Осуществление изобретения
До сих пор непреодолимой трудностью было проведение скрининга лекарственных средств на экспериментальных моделях инфекции, вызванной вирусом гепатита C.
Для этой цели была разработана экспериментальная модель инфекции, вызванной вирусом гепатита C in vitro, в культурах первичных и перевиваемых клеток, чувствительных к репликации вируса гепатита C. В результате были выделены и идентифицированы цитопатогенные варианты ВГС, относящиеся к разным генотипам, в том числе, и к наиболее распространенному в РФ, наиболее патогенному, инфекции которым трудно поддаются лечению интерфероном, генотипу 1b. Воспроизведены острая и хроническая инфекция, вызванные вирусом гепатита C в культурах клеток различного происхождения. Таким образом, в отношении гепатита C появилась уникальная возможность не только для скрининга соединений, но и для доклинической оценки противовирусной активности препаратов.
Пример 1
Задача настоящего исследования заключалась в оценке противовирусной активности глутарилгистамина на экспериментальной модели инфекции, вызванной вирусом гепатита C в культурах клеток.
В работе использовали цитопатогенный штамм вируса гепатита C (ВГС), относящийся к генотипу 1b. Штамм был выделен из сыворотки крови больной хроническим вирусным гепатитом C, идентифицирован как вирус гепатита C. В работе использовали инфекционные дозы ВГС, равные 10,0 тканевых цитопатогенных доз (ТЦД50)/20 мкл.
Были использованы высокочувствительные к цитопатогенному действию ВГС первичные фибробласты, полученные после трипсинизации 9-дневных куриных эмбрионов (ФЭК), а также культуры клеток почки эмбриона свиньи (СПЭВ), полученные из коллекции клеточных культур НИИ вирусологии РАМН. Их использовали в виде однодневного монослоя клеток, выращенного в 24-луночных пластиковых панелях. Культуры клеток СПЭВ и ФЭК выращивали на среде 199 с 10% сыворотки эмбриона телят, с добавлением глютамина и антибиотиков (100 ЕД/мл).
В работе использовали раствор глутарилгистамина, который делали на питательной среде, используемой для выращивания инфицированных культур клеток. Для изучения противовирусной активности препарата, его раствор в объеме 50 мкл в различных разведениях вносили в культуры ФЭК в момент заражения, за 24 часа до заражения и через 24 часа после заражения вирусом клеток.
Инфекционную активность ВГС учитывали по результатам титрования на культурах клеток СПЭВ проб культуральной жидкости, отобранной из инфицированных ВГС культур ФЭК или СПЭВ на 2 и 5 дни после заражения. Результаты учитывали, как правило, на 6-7 день после инфекции, когда развивалось максимальное цитопатогенное действие вируса, используя формулу Рида и Менча для подсчета титра вируса гепатита C.
Полученные результаты приведены в таблицах 1-4.
| Таблица 1 | |||||||
| Противовирусная активность глутарилгистамина на модели инфекции ВГС в культурах ФЭК. Исследование проб на 2-й день после инфекции и обработки клеток препаратом. | |||||||
| Время обработки глутарилгистамином | Титры вируса гепатита С (lg ТЦД50 для культур клеток СПЭВ) в пробах среды, отобранных из культур ФЭК, на 2-й день после инфекции и обработки глутарилгистамином в концентрациях (мкг/мл): | ||||||
| 500,0 | 50,0 | 5,0 | 0,5 | 0,05 | 0,005 | Контроль вируса | |
| В момент инфекции | 5,5 | 6,2 | 6,5 | 6,0 | 5,0 | 5,5 | 6,5 |
| За 24 часа до инфекции | 4,5 | 4,5 | 4,5 | 4,5 | 4,5 | 5,0 | 6,5 |
| 24 часа после инфекции | 0 | 2,5 | 0 | 0 | 1,8 | 0 | 6,5 |
| Таблица 2 | |||||||
| Противовирусная активность глутарилгистамина на модели инфекции ВГС, вызванной в культурах клеток почки эмбриона свиньи (СПЭВ). Исследование проб на 3-й день после инфекции и обработки клеток препаратом. | |||||||
| Время обработки глутарилгистамином | Титры вируса гепатита С (lg ТЦД50 для культур клеток СПЭВ) в пробах среды, отобранных на 3-й день после инфекции и обработки глутарилгистамином в концентрациях (мкг/мл): | ||||||
| 500,0 | 50,0 | 5,0 | 0,5 | 0,05 | 0,005 | Контроль вируса | |
| В момент инфекции | 3,0 | 3,5 | 2,3 | 3,3 | 3,3 | 3,3 | 3,3 |
| За 24 часа до инфекции | 3,5 | 3,5 | 3,5 | 3,2 | 3,2 | 3,0 | 3,3 |
| 24 часа после инфекции | 0 | 1,25 | 0 | 0 | <1,0 | 0 | 3,3 |
| Таблица 3 | |||||||
| Противовирусная активность глутарилгистамина на модели инфекции ВГС, вызванной в культурах клеток почки эмбриона свиньи (СПЭВ). Исследование проб на 4-й день после инфекции и обработки клеток препаратом. | |||||||
| Время обработки глутарилгистамином | Титры вируса гепатита С (lg ТЦД50 для культур клеток СПЭВ) в пробах среды, отобранных на 4-й день после инфекции и обработки глутарилгистамином в концентрациях (мкг/мл): | ||||||
| 500,0 | 50,0 | 5,0 | 0,5 | 0,05 | 0,005 | Контроль вируса | |
| В момент инфекции | 4,2 | 5,0 | 5,5 | 4,1 | 4,4 | 4,1 | 4,6 |
| За 24 часа до инфекции | 3,8 | 3,8 | 3,4 | 3,8 | 3,0 | 3,4 | 4,6 |
| 24 часа после инфекции | 0 | 2,6 | 0 | 0 | 1,3 | 0 | 4,6 |
| Таблица 4 | |||||||
| Противовирусная активность глутарилгистамина на модели инфекции ВГС, вызванной в культурах клеток почки эмбриона свиньи (СПЭВ). Исследование проб на 5-й день после инфекции и обработки клеток препаратом. | |||||||
| Время обработки глутарилгистамином | Титры вируса гепатита С (lg ТЦД50 для культур клеток СПЭВ) в пробах среды, отобранных на 5-й день после инфекции и обработки глутарилгистамином в концентрациях (мкг/мл): | ||||||
| 500,0 | 50,0 | 5,0 | 0,5 | 0,05 | 0,005 | Контроль вируса | |
| В момент инфекции | 5,5 | 7,0 | 5,5 | 5,5 | 5,0 | 5,5 | 6,7 |
| За 24 часа до инфекции | 6,0 | 4,5 | 4,5 | 4,5 | 4,5 | 4,5 | 6,7 |
| 24 часа после инфекции | 0 | 2,8 | 0 | 0 | 1,8 | 0 | 6,7 |
Показано, что в ранние сроки после обработки клеток ФЭК глутарилгистамином, наиболее выраженными противовирусными свойствами он обладает в случае внесения его в культуры ФЭК через 24 часа после инфекции. Как было показано при исследовании проб культуральной жидкости, отобранных через 48 часов после заражения клеток, в этих условиях глутарилгистамин полностью подавлял инфекционную активность ВГС в культурах ФЭК. В контрольных, необработанных глутарилгистамином ФЭК титры ВГС в этот период достигали 6,5 lg ТЦД50/20 мкл. Внесение глутарилгистамина непосредственно сразу после инфекции также приводило к снижению титров ВГС на 1,0-1,5 lg. На 2,0 lg титры ВГС снижались при условии обработки клеток глутарилгистамином за 24 часа до инфекции.
Культуры клеток СПЭВ (линия клеток почки эмбриона свиньи) заражали цитопатогенным вариантом ВГС - С-13 и обрабатывали глутарилгистамином за 24 часа до инфекции, непосредственно сразу после заражения культур и через 24 часа после заражения. Пробы культуральной среды отбирали на 3-й, 4-й и 5-е дни после инфекции и титровали на свежих культурах клеток СПЭВ.
Полученные результаты приведены в таблицах 2-4. Из данных таблиц видно, что глутарилгистамин, как и в культурах клеток ФЭК, инфицированных ВГС, существенно подавляет репликацию ВГС в культурах клеток СПЭВ в случае его добавления в культуры через 24 часа после заражения клеток. Эти результаты оставались стабильными независимо от срока взятия проб культуральной жидкости из культур клеток СПЭВ, обработанных препаратом. На 5-й день после инфекции и одновременной обработки клеток препаратом была обнаружена способность глутарилгистамина подавлять инфекционную активность ВГС на 2,2-2,7 lg ТЦД50/20 мкл. В пробах среды, отобранных через 5 дней после инфекции, было отмечено значительное подавление продукции ВГС под влиянием глутарилгистамина по сравнению с контролем: на 2,2 lg ТЦД50/20 мкл.
Таким образом, глутарилгистамин обладает способностью подавлять репликацию вируса гепатита С в инфицированных культурах фибробластов 9-дневных куриных эмбрионов, приводя к существенному снижению титров инфекционной активности вируса. Показано, что противовирусная эффективность глутарилгистамина не снижается при использовании инфицированных ВГС культур клеток иного происхождения - линии клеток СПЭВ-ВГС. На модели инфекции культур клеток СПЭВ-ВГС показано, что глутарилгистамин эффективно подавляет инфекцию ВГС не только при добавлении его в культуры через 24 часа после заражения, но и за 24 часа до заражения клеток вирусом. Полученные результаты свидетельствуют о значительной противовирусной активности глутарилгистамина при инфекции, вызванной вирусом гепатита C.
Пример 2
Проведенное исследование направлено на изучение клинической и лабораторной эффективности глутарилгистамина у пациентов с вирусным гепатитом С при проведении комбинированной противовирусной терапии (ПВТ) пэгилированными интерферонами в сочетании с рибавирином.
Критериями включения явились: 1) наличия у больного признаков ВГС-инфекции - выявление антител к ВГС методом ИФА; наличие в сыворотке крови РНК ВГС (количественный тест), 1b генотип; 2) содержание лейкоцитов в общем анализе крови от 3,9 до 3,0×109/л, количество нейтрофилов от 2,0 до 1,5×109/л; 3) отсутствие поверхностного антигена вируса гепатита B; 4) отсутствие антител к вирусу иммунодефицита человека; 5) отсутствие других клинически значимых заболеваний печени (алкогольная болезнь печени, прием гепатотоксичных лекарственных препаратов, аутоиммунный хронический гепатит, гемахроматоз); 6) отсутствие цирроза печени.
Пациенты получали пэгинтерферон-α2b подкожно в дозе 100 мкг 1 раз в неделю и рибавирин 1000 мг в сутки, ежедневно в течение 48 недель. В период лечения проводился ежемесячный клинический и биохимический мониторинг. РНК ВГС определяли через 1 месяц от начала терапии, затем каждые три месяца лечения. Всем пациентам проводили ультразвуковое трансабдоминальное сканирование органов брюшной полости до начала терапии, далее каждые 6 месяцев. Проведенное исследование было одобрено Этическим комитетом, и все пациенты давали информированное согласие на участие в исследовании.
В соответствии с рандомизацией (проводилась с применением «метода конвертов») все пациенты были разделены на две группы, сопоставимые по полу и возрасту в зависимости от схемы лечения: 1-я группа (n=52) получала пэгинтерферон-α2b+рибавирин, 2-я группа (n=58) - пэгинтерферон-α2b+рибавирин+дикарбамин 100 мг 1 раз в день, курсом 21 день от начала ПВТ. В последующем дикарбамин назначался по аналогичной схеме каждые три месяца терапии.
Статистическая обработка и графическая визуализация данных производилась в соответствии с технологией современного компьютерного анализа на IBM-совместимом персональном компьютере с использованием приложений Microsoft Excel пакета Office 2007 и Statistica (StatSoft) версии 6.0, функционировавших в операционной среде Microsoft Windows 7 Professional.
Результаты исследования и их обсуждения. Под наблюдением находилось 110 пациентов, из них - 69 мужчин (63%) и 41 женщина (37%) с гепатитом C в возрасте от 19 до 52 лет (средний возраст 32,2±5,1 лет). Средняя масса тела составила 76,4±8,1 (от 55 до 84 кг). Давность инфицирования, которую определяли от момента появления хотя бы одного фактора риска, составила от 2,5 до 8 лет (табл.5). Достоверных межгрупповых различий зарегистрировано не было.
| Таблица 5 | ||
| Характеристика наблюдаемых пациентов (М±m) | ||
| Показатели | 1-я группа | 2-я группа |
| Количество пациентов, чел. | 52 | 58 |
| Мужчины, чел. | 34 | 35 |
| Женщины, чел. | 18 | 23 |
| Средний возраст, лет | 30,1±4,2 | 31,4±3,1 |
| Масса тела, кг | 73,4±3,2 | 72,8±2,9 |
| Длительность заболевания, лет | 4,5±1,7 | 3,9±2,2 |
| Исходная активность АЛАТ, Ед/л | 115,21±7,24 | 112,41±8,04 |
| Исходная активность щелочной фосфатазы, Ед/л | 247,24±12,5 | 257,34±16,3 |
| Тимоловая проба, ед. | 5,8±0,9 | 6,1±1,1 |
| Общий билирубин, мкмоль/л | 23,94±0,82 | 24,01±0,71 |
| Альбумины, % | 51,98±0,87 | 52,01±0,74 |
| Гамма-глобулины, % | 23,69±0,71 | 23,45±0,84 |
| Количество лейкоцитов × 109/л | 3,4±0,08 | 3,3±0,17 |
| Количество нейтрофилов × 109/л | 1,9±0,11 | 1,8±0,14 |
Ведущими синдромами у всех пациентов, страдающих гепатитом С, были астеновегетативный (нарушение сна, утомляемость, потливость, снижение аппетита, эмоциональная лабильность), зарегистрированный у 75 (67,95%) пациентов; диспепсический (тошнота, отрыжка, чувство распирания, тяжесть в эпигастрии и в правом подреберье, запор и/или понос) имел место у 62 (56,3%) пациентов. Самым частым клиническим проявлением заболевания было увеличение печени у 94 (85,2%) пациентов. Спленомегалия зарегистрирована у 35 (31,95%) пациентов. Частота встречаемости основных клинических синдромов в разных группах больных представлена в табл.6. Как видно из данных табл.6, до начала терапии достоверных различий между пациентами 1-й и 2-й групп зарегистрировано не было.
| Таблица 6 | |||
| Встречаемость основных клинических синдромов у наблюдаемых пациентов до начала терапии, % | |||
| Симптомы | 1 группа | 2 группа | р |
| Диспепсический | 54,2 | 58,4 | 0,701 |
| Астеновегетативныи | 66,2 | 69,7 | 0,839 |
| Гепатомегалия | 80,8 | 89,6 | 0,279 |
| Спленомегалия | 29, 5 | 34,4 | 0,546 |
| Иктеричность кожи и склер | 14,5 | 20,2 | 0,622 |
Гиперферментемия регистрировалась у 38% пациентов и превышала норму в 3-4 раза, что соответствовало малой и умеренной активности трансаминаз, у остальных пациентов уровень АЛАТ был повышен в 1,5-2 раза или не превышал норму. В ряде случаев отмечалась небольшая гипербилирубинемия с повышением уровня билирубина до 2-х норм преимущественно за счет неконъюгированной фракции. Значимых различий по указанным показателям у пациентов сравниваемых групп не было. Диспротеинемия с гипергаммаглобулинемией отмечалась у 34-36% больных.
По полу, возрасту, условиям питания, быта и трудовой деятельности, а также по месту проживания, группы наблюдаемых пациентов были однородны.
Пациенты 1-й группы наблюдения переносили лечение хуже, побочные реакции регистрировались чаще, чем у пациентов 2-й группы данные представлены в табл.7.
| Таблица 7 | |||
| Частота выявления побочных эффектов противовирусной терапии в % | |||
| Побочные эффекты | 1 группа | 2 группа | p |
| Гриппоподобный синдром | 72,4 | 50,3 | 0,019 |
| Артралгии | 62,1 | 44,6 | 0,089 |
| Миалгии | 58,3 | 32,4 | 0,012 |
| Обострение хронического панкреатита | 6,2 | 3 | 0,666 |
| Депрессия | 36,1 | 12,4 | 0,003 |
| Выпадение волос | 38,4 | 14,1 | 0,004 |
| Цитопенический синдром | 63,8 | 25,9 | 0,045 |
| Снижение веса | 44,8 | 34,8 | 0,332 |
У пациентов второй группы побочные эффекты в виде гриппоподобного синдрома, частоте появления миалгии, депрессии, выпадению волос и цитопеническому синдрому были зарегистрированы в меньшем проценте случаев по сравнению с пациентами 1-й группы (p<0,05).
При этом наблюдение показало, что у 62,2% пациентов, получавших комбинированную противовирусную терапию + дикарбамин, зарегистрировано субъективное улучшение самочувствия (повышение работоспособности и исчезновение слабости) по сравнению с 1-й группой - 15,4%, p<0,05.
При проведении комбинированной противовирусной терапии были выявлены следующие побочные явления в виде снижения общего числа лейкоцитов и нейтрофилов (табл.8). В 1-й группе в период ПВТ лейкопения наблюдалась с ранних сроков (4 нед. терапии) у 71% пациентов, и нейтропения у 69% пациентов, данные показатели сохранялись достоверно сниженными в течение всего курса лечения по сравнению с 2-й группой (p<0,05). У пациентов второй группы лейкопения отмечена в 35% случаев, нейтропения зарегистрирована у 4 6% пациентов. Резко сниженных показателей лейкоцитов и нейтрофилов, которые могли бы стать причиной коррекции дозы или отмены ПВТ в данной группе пациентов зарегистрировано не было.
| Таблица 8 | |||
| Гематологические показатели на фоне лечения (М±m) | |||
| Показатели | 1 группа | 2 группа | |
| лейкоциты × 109/л | До начала лечения | 3,4±0,08 | 3,3±0,17 |
| Через 1 мес. терапии | 2,3±0,12 | 3,1±0,14* | |
| Через 2 мес. терапии | 2,4±0,16 | 4,0±0,18* | |
| Через 3 мес. терапии | 2,3±0,11 | 3,8±0,16* | |
| Через 6 мес. терапии | 2,7±0,14 | 4,1±0,21* | |
| Через 12 мес. терапии | 3,0±0,10 | 3,7±0,18* | |
| нейтрофилы × 109/л | До начала лечения | 1,9±0,11 | 1,8±0,14 |
| Через 1 мес. терапии | 1,2±0,08 | 2,0±0,07* | |
| Через 2 мес. терапии | 1,1±0,06 | 2,3±0,05* | |
| Через 3 мес. терапии | 1,0±0,05 | 2,0±0,04* | |
| Через 6 мес. терапии | 1,2±0,06 | 2,3±0,05* | |
| Через 12 мес. терапии | 1,5±0,04 | 2,1±0,06* | |
| Примечание: здесь и далее * - достоверность отличий между показателями 1-й и 2-й гр., p<0,05. |
Оценивая эффективность применения дикарбамина в комплексной терапии пациентов ХГС авторы изучили его влияния на биохимические показатели и вирусологический ответ.Наиболее значимые данные представлены в табл.9 и 10).
| Таблица 9 | |||
| Показатели метаболизма печени при лечении больных ХГС (М±m) | |||
| Показатели | 1 группа | 2 группа | |
| АЛАТ, Ед/л | Через 1 мес. терапии | 68,24±4,37 | 49,21±3,78* |
| Через 3 мес. терапии | 89,47±5,34 | 56,21±4,34* | |
| Через 6 мес. терапии | 64,73±5,43 | 50,38±4,78* | |
| Через 12 мес. терапии | 49,34±4,38 | 41,34±3,52* | |
| ЩФ, Ед/л | Через 1 мес. терапии | 221,41±10,21 | 200,04±12,43* |
| Через 3 мес. терапии | 205,24±8,73 | 161,02±5,02* |
| Через 6 мес. терапии | 197,36±5,64 | 154,23±4,73* | |
| Через 12 мес. терапии | 195,48±4,03 | 155,03±3,72 | |
| ТП, ед. | Через 1 мес. терапии | 5,03±0,01 | 4,24±0,41* |
| Через 3 мес. терапии | 4,94±0,03 | 3,84±0,04* | |
| Через 6 мес. терапии | 4,79±0,09 | 3,90±0,03* | |
| Через 12 мес. терапии | 5,04±0,08 | 4,03±0,02* | |
| билирубин, мкмоль/л | Через 1 мес. терапии | 22,48±0,94 | 18,47±0,08* |
| Через 3 мес. терапии | 21,79±0,74 | 16,24±0,17 | |
| Через 6 мес. терапии | 20,73±0,54 | 17,13±0,21 | |
| Через 12 мес. терапии | 21,36±0,98 | 17,04±0,09* | |
| Альбумин, % | Через 1 мес. терапии | 52,04±1,19 | 54,09±1,23 |
| Через 3 мес. терапии | 53,74±1,41 | 55,47±1,62 | |
| Через 6 мес. терапии | 55,03±2,38 | 56,43±2,05 | |
| Через 12 мес. терапии | 54,16±1,17 | 55,36±1,64 | |
| γ-глобулин, % | Через 1 мес. терапии | 23,47±0,84 | 21,02±0,34* |
| Через 3 мес. терапии | 22,98±0,97 | 19,91±0,23* | |
| Через 6 мес. терапии | 23,04±0,88 | 20,01±0,31* | |
| Через 12 мес. терапии | 22,76±0,11 | 21,32±0,08* |
Как видно из данных, представленных в табл.9, в 2-й группе пациентов было достигнуто более выраженное улучшение показателей цитолиза и холестаза.
Непосредственный вирусологический ответ (снижение РНК ВГС до неопределяемого уровня) был зарегистрирован у 79,3% пациентов 2-й группы, дополнительно принимавших дикарбамин, что явилось статистически значимым в сравнении с результатами пациентов 1-й группы (p=0,035) получавших только комбинированную
противовирусную терапию, данные представлены в табл.10. Как видно из табл.10, ранний вирусологический ответ также достоверно чаще регистрировался у пациентов 2-й группы (p<0,05).
| Таблица 10 | |||
| Эффективность противовирусной терапии, % | |||
| Вариант ответа | 1-я группа | 2-я группа | p |
| Быстрый вирусологический ответ | 82, 9 | 89,7 | 0,405 |
| Ранний вирусологический ответ | 65,9 | 86,2 | 0,013 |
| Непосредственный вирусологический ответ | 60,3 | 79,3 | 0,035 |
Таким образом, применение комбинированной терапии • для лечения больных гепатитом C, включающей в себя пэгинтерферон, рибавирин и глутарилгистамин (в составе дикарбамина), является более эффективным для лечения гепатита C. Отмечена хорошая переносимость противовирусной терапии у пациентов с гепатитом С при применении предложенной схемы лечения.
Пример 3.
Целью исследования являлось изучение влияния глутарилгистамина (дикарбамина) на эффективность противовирусной терапии у больных с lb генотипом вируса хронического гепатита C с исходно сниженным количеством лейкоцитов и нейтрофилов.
Под наблюдением находилось 86 пациентов ХГС (анти HCV «+», РНК HCV «+», генотип 1b) в возрасте от 20 до 52 лет (средний возраст - 32±1,2 года). Мужчин - 46 (53,5%), женщин - 40 (46,5%).
Для реализации поставленной цели все пациенты были разделены на две группы, сопоставимые по полу и возрасту в зависимости от схемы лечения: 1-я группа (n=44) получала пэгинтерферон-α2b+рибавирин, 2-я группа (n=42) пэгинтерферон-α2b+рибавирин+дикарбамин. Пэгинтерферон- α2b назначался подкожно в дозе 100 мкг 1 раз в неделю, рибавирин 1000 мг в сутки, ежедневно, курсом 48 недель. В соответствии с рандомизацией (проводилась с применением «метода конвертов»), дикарбамин назначался по 100 мг 1 раз в день, курсом 9 недель от начала противовирусной терапии, далее - за 9 недель перед ее окончанием.
Эффективность лечения оценивалась по устойчивому вирусологическому ответу на 24 неделе наблюдения после завершения ПВТ. Изучение уровня лейкоцитов и нейтрофилов в крови проводилось до лечения и на этапах контроля ПВТ (4, 8, 12, 24, 36, 48 недели). Достоверных межгрупповых различий зарегистрировано не было. Перед началом проведения двойной ПВТ у всех больных отмечались лабораторные признаки лейко- и нейтропении (содержание лейкоцитов в общем анализе крови от 3,5 до 3,0×109/л, количество нейтрофилов от 2,0 до 1,5×109/л). Проведенное исследование было одобрено Этическим комитетом, и все пациенты давали информированное согласие на участие в исследовании.
Статистическая обработка и графическая визуализация данных производилась в соответствии с технологией современного компьютерного анализа на IBM-совместимом персональном компьютере с использованием приложений Microsoft Excel пакета Office 2007 и Statistica (StatSoft) версии 6.0, функционировавших в операционной среде Microsoft Windows 7 Professional.
В таблице 11 представлена характеристика наблюдаемых пациентов ХГС разных групп до начала ПВТ.
| Таблица 11 | ||
| Характеристика наблюдаемых пациентов (М±m) | ||
| Показатели | 1-я группа | 2-я группа |
| Количество пациентов, чел. | 44 | 42 |
| Мужчины, чел. | 22 | 24 |
| Женщины, чел. | 22 | 18 |
| Средний возраст, лет | 31,1±2,02 | 32,4±2,01 |
| Масса тела, кг | 70,4±1,2 | 69,8±2,9 |
| Длительность заболевания, лет | 6,8±1,7 | 7,1±1,1 |
| Исходная активность АЛАТ, Ед/л | 125,21±7,11 | 122,13±8,15 |
| Исходная активность щелочной фосфатазы, Ед/л | 267,44±14,6 | 271,34±15,2 |
| Тимоловая проба, ед. | 6,8±0,9 | 6,9±1,1 |
| Общий билирубин, мкмоль/л | 23,81±1,81 | 24,04±1,78 |
| Альбумины, % | 52,23±0,51 | 52,01±0,54 |
| Гамма-глобулины, % | 24,22±0,41 | 24,78±0,39 |
| Количество лейкоцитов × 109/л | 3,1±0,16 | 3,2±0,12 |
| Количество нейтрофилов × 109/л | 1,8±0,13 | 1,7±0,12 |
| Количество РНК HCV | 3,8×106 | 3,7×106 |
У всех пациентов ХГС зарегистрированы следующие основные синдромы: у 98% астеновегетативный синдром (повышенная утомляемость, раздражительность, расстройство сна, снижение работоспособности и общая слабость, недомогание, неустойчивость настроения, головная боль), у 90,9% диспепсический синдром (снижение аппетита, неприятные ощущения в животе, тошнота, метеоризм, отрыжка, а у отдельных больных рвота). У 81% отмечалась тяжесть и/или боль в эпигастрии и/или в правом подреберье (синдром правого подреберья), имевшая преимущественно тупой, ноющий характер. Гепатомегалия регистрировалась у 81% пациентов данной группы, увеличение печени сопровождалось уплотнением ее консистенции и умеренной болезненностью при пальпации. Эти ведущие синдромы у большинства пациентов (88,2%) регистрировались одновременно. Частота встречаемости основных клинических синдромов в разных группах больных представлена в таблице 12. До начала терапии достоверных различий между пациентами 1-й и 2-й групп зарегистрировано не было.
| Таблица 12 | |||
| Встречаемость основных клинических синдромов у наблюдаемых пациентов до начала терапии, % | |||
| Симптомы | 1 группа | 2 группа | p |
| Астеновегетативный | 75,6 | 76,2 | 0,852 |
| Диспепсический | 58,8 | 57,9 | 0,720 |
| Гепатомегалия | 86,8 | 88,1 | 0,226 |
| Спленомегалия | 34,4 | 35,1 | 0,525 |
| Синдром «правого подреберья» | 92,8 | 93,4 | 0,651 |
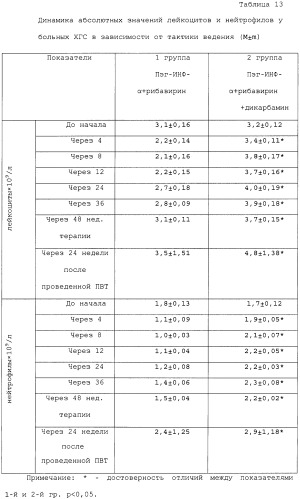
При оценки динамики содержания лейкоцитов и нейтрофилов в крови у пациентов ХГС на фоне ПВТ без учета варианта лечения установлено, что доля лиц с I степенью лейко- и нейтропении перед началом лечения составляла 83,7% человек. По мере продолжения ПВТ закономерно нарастало число пациентов со снижением количества лейкоцитов и нейтрофилов в зависимости от выбранной тактики лечения. В таблице 13 представлена динамика абсолютных значений лейкоцитов и нейтрофилов у больных в зависимости от тактики лечения. Сравнивая различные варианты терапии, авторы установили, что применение пэгинтерферона-α2b в сочетании с рибавирином вызвало достоверно более выраженное снижение исследуемых показателей по сравнению с группой пациентов, которая получала дикарбамин. Так, в 1-й группе пациентов минимальное значение лейкоцитов составило 2,1±0,16×109/л, нейтрофилов - 1,0±0,03×109/л, тогда как во 2-й группе - 3,4±0,11×109/л; 1,9±0,05×109/л соответственно (p<0,05).
Проведенный анализ данных по эффективности противовирусной терапии показал достоверно лучшие результаты лечения у пациентов 2-й группы по сравнению с 1-й (p<0,05), данные представлены в табл.14.
| Таблица 14 | |||
| Эффективность противовирусной терапии, % | |||
| Вариант ответа | 1-я группа | 2-я группа | p |
| Быстрый вирусологический ответ | 80,7 | 88,5 | 0,405 |
| Ранний вирусологический ответ | 66,2 | 85,8 | 0,013 |
| Непосредственный вирусологический ответ | 61,1 | 73,7 | 0,035 |
| Устойчивый вирусологический ответ | 44,8 | 65,5 | 0,028 |
Таким образом, можно предположить возможность потенцирования противовирусного эффекта препаратом дикарбамин при назначении его в комбинации с ПВТ. Это свойство препарата дикарбамин было зарегистрировано при изучении отдаленных результатов проведенного лечения, а именно устойчивого вирусологического ответа.
Также была проведена сравнительная характеристика основных биохимических показателей в 2-х группах у пациентов ХГС до ПВТ и через 24 недели после окончания ПВТ. Наиболее значимые данные представлены в табл.15.
| Таблица 15 | ||||
| Показатели метаболизма печени больных ХГС до лечения и через 24 недели после окончания ПВТ (М±m) | ||||
| Показатели | 1 группа | 2 группа | ||
| До ПВТ | Через 24 недели после ПВТ | До ПВТ | Через 24 недели после ПВТ | |
| АЛАТ, Ед/л | 125,21±7,11 | 56,85±8,56 | 122,13±8,15 | 39,42±6,39* |
| ЩФ, Ед/л | 267,44±14,6 | 228±17,11 | 271,34±15,2 | 169±12,45* |
| Тимоловая проба, Ед/л | 6,8±0,9 | 6,6±0,81 | 6,9±1,1 | 5,8±0,92 |
| Альбумин, % | 52,23±0,51 | 51,23±0,11 | 52,01±0,54 | 54,01±0,26* |
| Гамма-глобулин, % | 24,22±0,41 | 23,67±0,51 | 24,78±0,39 | 20,56±0,42* |
| Примечание: * - достоверность отличий между показателями 1-й и 2-й |