Глюкокортикоиды, присоединенные посредством ароматического линкера в положении 21 к нитроэфирам, и их применение в офтальмологии
Иллюстрации
Показать всеИзобретение относится к соединениям формулы (I), их солям и стереоизомерам, а также к их применению для лечения глазных заболеваний, таких как диабетический отек желтого пятна, диабетическая ретинопатия, дегенерация желтого пятна, возрастная дегенерация желтого пятна и других заболеваний сетчатки и желтого пятна.
В общей формуле (I)
,
, или ,
R1 и R2 взятые вместе являются группой формулы (II), R3 представляет атом водорода или F и R4 представляет F; R1, R2, R3 и R4 присоединены к 17, 16, 6 и 9 углеродным атомам стероидной структуры в положении α или β; R представляет (III) или (IV), остальные значения радикалов указаны в описании. 2 н. и 9 з.п. ф-лы, 4 ил., 5 табл., 11 пр.
Реферат
Изобретение касается нитрооксипроизводных стероидов, способов их получения, фармацевтических композиций, содержащих эти соединения, и способов применения этих соединений и композиций для лечения глазных заболеваний, в особенности диабетического отека желтого пятна, диабетической ретинопатии, дегенерации желтого пятна, возрастной дегенерации желтого пятна и других заболеваний сетчатки и желтого пятна. Сетчатка представляет собой область глаза, которая чувствительна к свету. Желтое пятно является областью сетчатки, которая позволяет нам читать и распознавать лица. Заболевания желтого пятна, такие как возрастная дегенерация желтого пятна и диабетический отек желтого пятна, являются главной причиной слепоты.
Для лечения этих заболеваний было исследовано множество лекарственных средств по их воздействию на расстройства, вызывающие слепоту. В настоящее время эти лекарственные средства доставляются в желтое пятно и сетчатку хирургическими методами, такими как интравитреальные (в стекловидное тело) или периорбитальные инъекции, или системными путями введения.
Хирургические методы часто требуют повторных инъекций и могут привести к серьезным глазным осложнениям, включая эндофтальмиты, отслойку сетчатки и кровоизлияние в стекловидное тело. Аналогично, системное введение связано со множеством потенциальных системных побочных эффектов и с трудностью достижения терапевтического уровня лекарственных средств в сетчатке.
За последнее время было много сообщений об эффективности интравитреального триамцинолона ацетонида для лечения диффузного отека желтого пятна, невосприимчивого к лазерной терапии. Однако, интравитреальные инъекции триамцинолона связаны со множеством глазных осложнений. Осложнения от интравитреальной терапии триамцинолоном включают вызванное стероидом повышение внутриглазного давления, катарактогенез, послеоперационные инфекции, неинфекционный эндефтальмит и псевдо-эндефтальмит.
В настоящее время в симптоматической терапии в качестве основных эффективных лекарственных средства используются химиотерапия, стероиды и ингибиторы карбоангидразы, но их эффективность не доказана и их применение в течение длительного времени приводит к возникновению побочных эффектов, таких как катаракта, вызванное стероидами повышение внутриглазного давления, глаукома и инфекции, и непрерывное применение этих лекарственные средств при хронических заболеваниях, таких как сахарный диабет, является затруднительным.
В ЕР 0929565 описаны соединения общей формулы B-X1-NO2, где В содержит остаток стероида, в частности гидрокортизон, и X1 - двухвалентный связывающий мостик, который представляет собой бензильное кольцо, алкильную цепь или эфир. Соединения могут использоваться при лечении глазных расстройств.
ЕР 1475386 описывает соединения формулы A-B-C-NO2, где А содержит остаток стероида и В-С представляет собой двухвалентный связующий мостик, который содержит остаток антиоксиданта. Соединения могут использоваться для лечения окислительного стресса и/или эндотелиальных дисфункций. В описанных соединениях антиоксидантный линкер соединен с группой 21-ОН стероида через карбоксильную группу, образующую эфирную связь.
В WO 03/64443 описаны соединения общей формулы B-X1-NO2, где В содержит остаток стероида и X1 представляет собой двухвалентный связующий мостик, который является бензильным кольцом или гетероциклическим линкером. Соединения могут использоваться для лечения глазных заболеваний.
WO 07/025632 раскрывает соединения формулы R-Z-X-ONO2, где R-X содержит остаток триамцинолона ацетонида, валерианата бетаметазона или этилкарбоната преднизолона, и X1 - двухвалентный связующий мостик, который представляет собой ароматическое кольцо, алкильную цепь, эфир, феруловую кислоту, ванилиновую кислоту или гетероциклическое кольцо. Соединения могут использоваться для лечения кожных заболеваний или заболеваний слизистой оболочки мембран, в особенности для лечения атопического дерматита, контактного дерматита и псориаза.
F. Galassi et al., Br J Ophtalmolory 2006, 90, 1414-1419 описывает действие дексаметазон 21-[(4-нитрооксиметил)] бензоата на модели экспериментальной глаукомы у кролика, вызванной кортикостероидом. Высвобождающий NO дексаметазон вводили местно два раза в день; результаты показывают, что соединение может предотвращать повышение внутриглазного давления, снижать ретро бульбарное кровообращение и морфологические изменения в ресничных (цилиарных) телах, возможно вызванных местным лечением кортикостероидами.
Объектом настоящего изобретения является разработка нитрооксипроизводных стероидов для лечения воспалительных заболеваний. Другим объектом настоящего изобретения является разработка нитрооксипроизводных стероидов для предотвращения или лечения глазных болезней, в особенности диабетической дегенерации желтого пятна, диабетической ретинопатии, возрастной дегенерации желтого пятна и других заболеваний сетчатки и желтого пятна. В одном аспекте настоящего изобретения одно или более этих соединений снижают побочные эффекты, связанные со стандартной терапией стероидами. В другом воплощении изобретения одно или более этих соединений обладают улучшенной фармакологической активностью по сравнению с обычной стандартной терапией.
Объектом данного изобретения является соединение формулы (I), или его соль, или стереоизомер
,
где
R1 и R2 взятые вместе являются группой формулы (II)
,
R3 представляет атом водорода или F и R4 представляет F,
R1, R2, R3 и R4 присоединены к 17, 16, 6 и 9 углеродным атомам стероидной структуры в положении α или β;
R представляет:
или
где Y выбран из:
1) -R5-CH(ONO2)R6
2) -R5-CH(ONO2)-(CR7R8)n-CH(ONO2)R9
или
3) - [(CH2)o-X]p-(CH2)q-CH(ONO2)R9
где R5 - прямой или разветвленный С1-С1Оалкилен;
R6, R7, R8 и R9 каждый представляет Н;
n - целое число от 0 до 6;
о - целое число от 1 до 6;
р - целое число от 1 до 6;
q - целое число от 0 до 6;
X представляет О, S или NR10, где R10 - Н или С1-С4 алкил; предпочтительно X представляет О;
за исключением соединений формулы (I), где R1 и R2, взятые вместе, являются группой формулы (II)
,
R4 представляет F и R3 является атомом водорода, и R является соединением формулы (III), где Y представляет - R5 -CH(ONO2)R6 и R6 - Н.
В другом воплощении изобретения описываются соединения формулы (I)
,
где
R4 - F, R3 - F, и
R1 и R2, взятые вместе, являются группой формулы (II)
R1, R2, R3 и R4 присоединены к 17, 16, 6 и 9 углеродным атомам стероидной структуры в положении α;
R представляет:
или
,
где
где Y представляет
1) -R5-CH(ONO2)R6
где R5 прямой С1-С5алкилен и R6 - Н;
или
2) -R5-CH(ONO2)-(CR7R8)n-CH(ONO2)R9, где
R5 - прямой C1-С6алкилен, R9, R7 и R8 представляют Н и n=0 или 1;
или
3) - [(CH2)o-X]p-(CH2)q-CH(ONO2)R9, где
R9 представляет Н,
о - целое число от 2 до 4;
р - целое число от 1 до 4;
q - целое число от 0 до 4;
X представляет О. В другом воплощении изобретения описываются соединения формулы (I)
,
где
R1 и R2, взятые вместе, являются группой формулы (II)
где R4 представляет F и R3 представляет атом водорода;
R1, R2, R3 и R4 присоединены к 17, 16, 6 и 9 углеродным атомам стероидной структуры в положении α;
R представляет:
или
,
где
где Y представляет
1) -R5-CH(ONO2)-(CR7R8)n-CH(ONO2)R9, где
R5 - прямой С1-С6алкилен, R9, R7 и R8 представляют Н; n=0 или 1; или
2) -[(CH2)o-X]p-(CH2)q-CH(ONO2)R9, где
R9 представляет Н,
о - целое число от 2 до 4;
р - целое число от 1 до 4;
q - целое число от 0 до 4 и X представляет О.
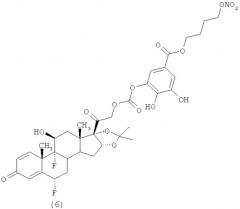
В другом воплощении изобретения описываются соединения, выбранные из следующей группы:
о - целое число от 1 до 6; предпочтительно о - целое число от 2 до 4, более предпочтительно о равно 2;
р - целое число от 1 до 6; предпочтительно р - целое число от 1 до 4; более предпочтительно р равно 1 или 2;
q - целое число от 0 до 6; предпочтительно q от 0 до 4, более предпочтительно О или 1;
Х представляет О, S или NR10, где R10 - Н или C1-C4алкил; предпочтительно Х представляет О.
Предпочтительными R являются:
,
,
,
,
,
В другом воплощении изобретения описываются соединения, выбранные из следующей группы:
В другом воплощении изобретения описываются соединения формулы (I) для лечения воспалительных заболеваний.
В другом воплощении изобретения описываются соединения формулы (I) для лечения глазных заболеваний, в особенности диабетического отека желтого пятна, диабетической ретинопатии, дегенерации желтого пятна, возрастной дегенерации желтого пятна и других заболеваний сетчатки и желтого пятна. Предпочтительным соединением является описанное выше соединение формулы (I).
В другом воплощении изобретения описываются соединения формулы (I), включая соединения формулы (I), где R1 и R2, взятые вместе, являются группой формулы (II)
,
где R4 представляет F и R3 - атом водорода, и R является соединением формулы (III), где Y представляет - R5-СН(ONO2)R6 и R6 представляет Н, для применения при лечении или предотвращения диабетического отека желтого пятна, диабетической ретинопатии, дегенерации желтого пятна, возрастной дегенерации желтого пятна и других заболеваний сетчатки и желтого пятна, в особенности диабетического отека желтого пятна. Предпочтительным соединением является соединение формулы (18).
В еще одном воплощении изобретения описывается фармацевтическая композиция, включающая фармацевтически эффективное количество соединения формулы (I) и/или его соли или стереоизомера и офтальмоголически приемлемый эксципиент в подходящей для интравитреального или периорбитального введения форме.
Термин "эксципиент" использован здесь для обозначения любого компонента, отличного от соединения(ий) настоящего изобретения. Выбор эксципиента в большой степени зависит от таких факторов, как способ введения, влияние эксципиента на стабильность и тип лекарственной формы.
Еще в одном другом воплощении изобретения описывается фармацевтическая композиция, где соединение настоящего изобретения вводят в виде суспензии или эмульсии в офтальмологически приемлемом носителе.
Соединения настоящего изобретения, предназначенные для фармацевтического использования, можно вводить в виде кристаллических или аморфных продуктов. Соединения настоящего изобретения, предназначенные для фармацевтического использования, могут вводиться по одному или в комбинации с одним или более другими соединении настоящего изобретения.
Полезность соединений настоящего изобретения как лекарственных средств для лечения или профилактики диабетического отека желтого пятна, диабетической ретинопатии, дегенерации желтого пятна, возрастной дегенерации желтого пятна и других заболеваний сетчатки и желтого пятна продемонстрирована путем определения активности этих соединений обычными методами испытаний.
Способ синтеза
1) Соединение общей формулы (I), где R1, R2, R3 и R4 как указано выше, радикал R как указано в формулах III и IV, где Y, как указано выше, может быть получено:
1.1) Реакцией соединения формулы (V),
где R1, R2, R3, R4 - как указано выше, W представляет Н или С(O)Cl, с соединением формулы (VII) или (VIII)
,
где Y как указано выше и
W1 представляет Н, когда W представляет -С(O)Cl, или
W1 представляет -С(O)Cl или -CO-O-Ra, когда W представляет Н, где Ra представляет пентафторфенил или 4-нитрофенил, P1 - защитные для диола группы, такие как ацеталь, р-метоксибензилиден, бутилиден, и группы, описанные в Т. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980, 2nd edition.
1.1.a) Реакцию соединения формулы (V), где W представляет Н, с соединением формулы (VII) или (VIII), где W1 представляет - С(O)Cl, или реакцию соединения формулы (V), где W представляет - С(O)Cl, с соединением формулы (VII) или (VIII), где W1 - Н, может быть проведена в присутствии органического основания, такого как N,N-диметиламинопиридин (DMAP), триэиламин, пиридин. Реакцию проводят в инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от -20°С и до 40°С. Реакция заканчивается в диапазоне от 30 минут до 36 часов.
1.1.b) Реакцию соединения формулы (V), где W является Н, с соединением формулы (VII) или (VIII), где W1 представляет -C(O)-Ra, где Ra как указано выше, можно проводить в присутствии катализатора, такого как DMAP, или в присутствии DMAP и кислоты Льюиса, такой как Sc(OTf)3 или Bi(OTf)3. Реакцию проводят в инертном органическом растворителе, таком как N,N′-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от -20°С и до 40°С. Реакция заканчивается в диапазоне от 30 минут до 36 часов;
1.2) с необязательным снятием с полученных на стадии 1.1.a) или 1.1.b) соединений защитных групп согласно методам, описанным в Т.W.Greene "Protective groups in organic synthesis". Harvard University Press, 1980, 2nd edition. Для удаления защитной ацетальной группы предпочтительно используют соляную кислоту в тетрагидрофуране.
Получение соединений формулы (V)
2) Соединения формулы (V), где:
- W представляет Н и R1 представляет ОН, R2 представляет СН3, R3 - атом водорода, R4 - F или Cl;
- или W - Н, R3 - атом водорода или F, R4 - F и R1 и R2, взятые вместе, являются группой формулы (11)
,
являются коммерчески доступными.
2.1) Соединения формулы (V), где W представляет -С(O)Cl или -CORa и R1, R2, R3 и R4 - как указано выше, могут быть получены из соответствующих коммерчески доступных соединений формулы (V), где W представляет Н, используя известные из литературы методы.
Получение соединений формулы (VII) или (УПГ)
3) Соединения формулы (VII) или (VIII), где W1-Н, P1 как указано выше и Y представляет:
-R5-CH(ONO2)R6
-[(CH2)o-X]p-(CH2)q-CH(ONO2)R9,
где R5, R6, R9, о, р и q - как указано выше, могут быть получены следующим образом:
3.1.а) Реакцией соединения формулы (IX) или (X),
, ,
где Р - защищающая гидроксил группа, такая как силильная эфирная группа, например триметилсилил, третбутил-диметилсилил, или тритил, и которые описаны в Т.W. Greene "Protective groups in organic synthesis". Harvard University Press, 1980, 2nd edition, P1 - как указано выше,
с соединением формулы (XI) или (XII)
или
,
где R5, R6, R9, о, р и q как указано выше, и Q представляет ONO2 или Q1, где Q1 представляет атом хлора, атом брома, атом иода, мезильную группу или тозильную группу,
в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид (DCC), N′-(3-диметиламинопропил)-N-этилкарбодиимид гидрохлорид (EDAC), N,N′-карбонилдиимидазол (CDI), необязательно в присутствии основания, например DMAP.
Реакцию проводят в сухом инертном органическом растворителе, таком как N,N′-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от -20°С и до 50°С. Реакция заканчивается в пределах от 30 минут до 36 часов;
3.1.b) Реакцией указанного выше соединения формулы (IX) или (X) с соединением формулы (XIII) или (XIV)
или
,
где R5, R6, R9, о, р, q и Q как указано выше, и W3 - Cl, Br, I,
в присутствии органического основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), N,N-диизопропилэтиламин, диизопропиламин, или неорганического основания, такого как карбонат или гидроксид щелочноземельного металла, карбонат калия, карбонат цезия, в инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, ацетон, метилэтилкетон, ацетонитрил, полигалогенированный алифатический углеводород, при температуре от -20°С и до 40°С, преимущественно от 5°С до 25°С. Реакция заканчивается в пределах диапазона времени от 1 до 8 часов. Когда W3 выбран из хлора или брома, реакцию ведут в присутствии йодистой соли, такой как KI;
3.1.с) Реакцией соединения формулы (IXa) или (Ха)
, ,
где Р и P1 как указано выше, и Rb - пентафторфенил, 4-нитрофенил или - (N-сукцимидил),
с соединением формулы (XI) или (XII)
или
,
где R5, R6, R9, o, p, q и Q как указано выше,
в присутствии катализатора, такого как DMAP или в присутствии DMAP и кислоты Льюиса, такой как Sc(OTf)3 или Bi(OTf)3. Реакцию ведут в инертном органическом растворителе, таком как N,N′-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от -20°С до 40°С. Реакция заканчивается в пределах от 30 мин до 36 часов;
3.1.d) Реакцией соединения формулы (IXb) или (Xb)
, ?
с соединением формулы (XI) или (XII)
или
,
где R5, R6, R9, о, p, q и Q как указано выше, в присутствии органического основания, такого как N,N-диметиламинопиридин (DMAP), триэтиламин, пиридин. Реакцию проводят в инертном органическом растворителе, таком как N,N′-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от -20°С до 40°С. Реакция заканчивается в пределах диапазона времени от 30 мин до 36 часов;
3.2) Реакцией соединения, полученного на стадиях 3.1.а) - 3.1.d), где Q представляет Q1, с источником нитрогруппы, таким как нитрат серебра, нитрат лития, нитрат натрия, нитрат калия, нитрат магния, нитрат кальция, нитрат железа, нитрат цинка или нитрат тетраалкиламмония (где алкил представляет C1-С10 алкил) в подходящем органическом растворителе, таком как ацетонитрил, тетрагидрофуран, метилэтилкетон, этилацетат, ДФА, в темноте при температуре от комнатной температуры до температуры кипения растворителя.
Альтернативно реакция с ArNO3 может проводиться под воздействием микроволнового излучения в растворителе, таком как ацетонитрил или ТГФ, при температуре приблизительно 100-180°С в течение приблизительно 1-60 минут. Предпочтительным источником нитрогруппы является нитрат серебра;
3.3) С необязательным удалением защищающей гидроксил защитной группы Р согласно методам, описанным в Т.W.Greene "Protective Groups in organic synthesis", Harvard University Press, 1980, 2nd edition. Для удаления силильной эфирной группы предпочтительным является ион фторида.
4) Соединения формулы (VII) или (VIII), где W1 - Н, P1 как указано выше, и Y представляет
- R5-CH(ONO2)-(CR7R8)n-CH(ONO2)R9
-[(CH2)o-X]p-(CH2)q-CH(ONO2)-(CR7R8)n-CH(ONO2)R9,
где R5, R9, R7, R8, о, р и q как указано выше, и n - 0, могут быть получены следующим образом:
4.1.а) Реакцией указанного выше соединения формулы (IX) или (X) с соединением формулы (XV) или (XVI)
,
где R5, о, р, q, Х и R9 как указано выше, согласно методу, описанному в 3.1.а);
4.1.b) Реакцией указанного выше соединения формулы (IX) или (X) с соединением формулы (XVII) или (XVII)
,
где R5, о, р, q, Х и R9 как указано выше, и W3 - Cl, Br, I,
согласно методу, описанному в 3.1. b);
4.1.с) Реакцией указанного выше соединения формулы (IXa) или (Ха) с соединением формулы (XV) или (XVI)
,
где R5, о, р, q, Х и R9 как указано выше, согласно методу, описанному в 3.1.с);
4.1.d) Реакцией указанного выше соединения формулы (IXb) или (ХЬ) с соединением формулы (XV) или (XVI)
,
где R5, о, р, q, Х и R9 как указано выше, согласно методу, описанному в 3.1. d):
4.2.а) Реакцией соединения формулы (VIIA) или (VIIIA)
,
где Р и P1 как указано выше,
и Y′ представляет:
-R5-CH=CH-R9
-[(CH2)O-X]p-(CH2)q-CH=CH-R9,
где R5, о, р, q и R9 указано как выше, с источником нитрогруппы, таким как нитрат серебра, в присутствии иода в подходящем органическом растворителе, таком как ацетонитрил, тетрагидрофуран, метилэтилкетон, этилацетат, ДФА, в темноте при температуре от -20°С до температуры кипения растворителя. Альтернативно реакцию можно проводить под воздействием микроволнового излучения в растворителях, таких как ацетонитрил или ТГФ, при температуре в диапазоне приблизительно 100-180°С в течение приблизительно 1-60 минут; или
4.2.b) Дигидроксилированием двойной связи указанного выше соединения формулы (VIIA) или (VIIIA) с получением соединения (VIIB) или (VIIIB)
,
где Р и P1 как указано выше,
и Y′′ представляет:
-R5-CH(OH)-CH(OH)-R9
-[(CH2)O-X]p-(CH2)q-CH(OH)-CH(OH)-R9,
где R5, о, р, q и R9 как указано выше,
реагентом для асимметричного дигидроксилирования по Шарплессу, таким как AD-смесь альфа или AD-смесь бета, в смеси вода/трет-бутанол при температуре от -20°С до 30°С, предпочтительно от -5°С до 5°С. Реакция заканчивается через 1-24 часа.
4.3) Реакцией соединения, полученного на стадиях 4.2.b), с азотной кислотой и уксусным ангидридом в подходящем органическом растворителе, таком как метиленхлорид, в диапазоне температур от -50°С до 0°С согласно известным из литературы методам.
4.4) С необязательным снятием защиты с полученных на стадии 4.2. а) или 4.3) соединений как описано в Т.W.Greene "Protective groups in organic synthesis", Harvard University Press, 1980, 2 ^edition. Для удаления защитной силильной эфирной группы предпочтительным является ион фторида.
5) Соединения формулы (VII) или (VIII), где W1 - Н, P1 - как указано выше и Y представляет
-R5-CH(ONO2)-(CR7R8)n-CH(ONO2)R9
-[(CH2)o-X]p-(CH2)q-CH(ONO2)-(CR7R8)n-CH(ONO2)R9, где R5, R9, R7, R8, о, р и q как указано выше, и n - целое число от 1 до 6,
могут быть получены следующим образом:
5.1) Реакцией указанного выше соединения формулы (IX) или (X) с соединением формулы (XIX) или (XX)
или
где R5, R9, R7, R8, n, о, р и q как указано выше, Q2 представляет ONO2 или ОН и W3 - Cl, Br, I, согласно методу, описанному в 3.1b);
5.2) Реакцией соединения, полученного на стадиях 5.1), где Q представляет ОН, с источником нитро группы согласно методу, описанному в 4.3).
5.3) С необязательным удалением защищающей гидроксил группы Р согласно методу, описанному в 3.3).
Получение соединений (IX), (IXa), (IXb), (X), (Ха) и (Xb)
5) Соединения формулы (IX), (IXa), (IXb), (X), (Ха) и (Xb), где Р, P1 и Pb как указано выше, могут быть получены, исходя из коммерчески доступной ванилиновой кислоты или галлиевой кислоты согласно известному в литературе методу.
Получение соединений (XI)-(XX)
6.1) Соединения формулы (XI)-(XIV), где R5, R6, R9, о, р, q и W3 как указано выше, и Q представляет Q1, где Q1 как указано выше, являются коммерчески доступными или могут быть получены согласно известным в литературе методам.
6.2) Соединения формулы (XI)-(XIV), где R5, R6, R9, о, р, q и W3 как указано выше, и Q представляет группу ONO2, могут быть получены из соответствующих соединений, где Q представляет Q1, реакцией с источником нитрогруппы как описано выше.
6.3) Соединения формулы (XV)-(XX), где W3, R5, R9, R7, R8, n, о, р и q как указано выше, являются коммерчески доступными или могут быть получены согласно известным в литературе методам.
Пример 1 - (Соединение (1))
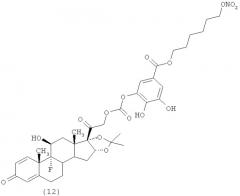
Синтез 4-(нитроокси) бутил 4-((2-((6S,9R,10S,11S,13S,16R,17S)-6,9-дтфтор-11-гидрокси-16,17-16,17-(1-метилэтилиденбис(окси))-10,13-диметил-3-оксо-6,7,8,9,10,11,12,13,14,15,16,17-додекагидро-3Н-циклопента[а]фенантрен-17-ил)-2-оксоэтокси)карбонилокси)-3-метоксибензоата.
А) 4-(Нитроокси)бутил 4-гидрокси-3-метоксибензоат.
К раствору ванилиновой кислоты (5,0 г, 29,73 ммол) в N,N-диметилформамиде (50 мл) добавляют карбонат цезия (9,68 г, 29,73 ммол). Реакционную смесь охлаждают до 0°С и добавляют 20% раствор 1-бром-4-(нитроокси)бутана в дихлорметане (29,45 г). Реакционную массу перемешивают при комнатной температуре в течение 69 часов. Смесь вливают в 5% водный раствор NaH2PO4 и экстрагируют диэтиловым эфиром (3×70 мл). Органические слои промывают водой (70 мл), сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью флеш-хроматографии (Biotage System, Cartridge column FLASH 65+MTMKP-Sil, элюент: градиент н-гексан/этилацетат 95/5 (500 мл) до н-гексан/этилацетат 1/1 при 4000 мл, н-гексан/этилацетат 1/1 (500 мл)). Получают 5,88 г продукта.
В) 4-(Нитроокси)бутил-3-метокси-4-((4-нитрофенокси)карбонилокси) бензоат.
К охлажденному до 0°С раствору соединения А (2,94 г, 10,30 ммол) в дихлорметане (50 мл) добавляют пиридин (1,01 мл, 10,30 ммол) и р-нитрофенил хлорформиат (2,07 мл, 10,30 ммол). Реакционную массу перемешивают при комнатной температуре в течение 16 часов. Смесь промывают 1М водным раствором HCl (2×50 мл), органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью флеш-хроматографии (Biotage System, Cartridge column FLASH 65+M™ KP-Sil, элюент: градиент н-гексан/этилацетат 93/7 (500 мл) до н-гексан/этилацетат 1/1 при 4000 мл, н-гексан/этилацетат 1/1 (500 мл)). Получают 3,50 г продукта.
С) 4-(Нитроокси)бутил 4-((2-((6S,9R,10S,11S,13S,16R,17S)-6,9-дифтор-11-гидрокси-16,17-16,17-(1-метилэтилиденбис(окси))-10,13-диметил-3-оксо-6,7,8,9,10,11,12,13,14,15,16,17-додекагидро-3Н-циклопента[а]фенантрен-17-ил)-2-оксоэтокси)карбонилокси)-3-метоксибензоат.
К раствору соединения В (1,00 г, 2,28 ммол) в хлороформе (30 мл) добавляют трифлат скандия (0,10 г, 0,22 ммол) и DMAP (0,54 г, 4,56 ммол). Реакционную смесь охлаждают до 0°С и добавляют флуоцинолон ацетонид (0,99 г, 2,28 ммол). Реакционную массу перемешивают при комнатной температуре в течение 28 часов. Смесь разбавляют дихлорметаном, промывают 5%-ым NaH2PO4 и затем насыщенным водным раствором карбоната натрия. Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью флеш-хроматографии (Biotage System, Cartridge column FLASH 40+M™ KP-Sil, элюент: градиент н-гексан/этилацетат 9/1 (500 мл) до н-гексан/этилацетат 3/7 при 2000 мл, н-гексан/этилацетат 3/7 (500 мл)). Получают 0,29 г продукта.
Продукт кристаллизуют из смеси н-гексан/этилацетат.
Т.Пл.=199-200°С
1H-NMR: (DMSO), δ: 7.65 (2Н, d); 7.38 (1Н, d); 7.27 (1H, d); 5.60 (1H, dm); 5.50 (1H, s); 5.35 (2H, m); 4.60 (2H, t); 4.35 (2H, t); 4.20 (1H, m); 3.89 (3H, s); 2.75-2.50 (2H, m); 2.25 (1H, m); 2.00 (2H, m); 1.90-1.30 (13H, m); 1.15 (3H, s); 0.83 (3H, s).
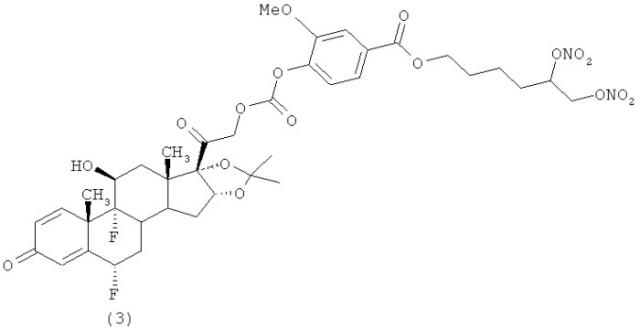
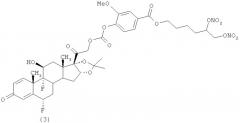
Пример 2 - (Соединение (3))
Синтез 5, 6-бис(нитроокси)гексил 4-((2-((6S,9R,10S,11S,13S,16R,17S)-6,9-диор-11-гидрокси-16,17-((1-метилэтилиден)бис(окси))-10,13-диметил-3-оксо-6,7,8,9,10,11,12,13,14,15,16,17-додекагидро-3Н-циклопента[а]фенантрен-17-ил)-2-оксоэтокси)карбонилокси)-3-метоксибензоата.
D) Гекс-5-енил 4-гидрокси-3-метоксибензоат
К раствору ванилиновой кислоты (0,6 г, 3,56 ммол) в N,N-диметилформамиде (7 мл) добавляют диизопропилэтиламин (0,93 г, 5,35 ммол) и 6-бромгекс-1-ен (0,71 мл, 5,35 ммол). Реакционную смесь перемешивают при 50°С в течение 8 часов. Растворитель упаривают под вакуумом. Остаток очищают с помощью флеш-хроматографии (Biotage System, Cartridge column FLASH 40+M™ KP-Sil, элюент: градиент н-гексан/этилацетат 95/5 (200 мл) до н-гексан/этилацетат 7/3 при 2000 мл, н-гексан/этилацетат 3/7 (400 мл)). Получают 0,59 г продукта.
Е) Гекс-5-енил 4-(трет-бутилдиметилсилилокси)-3-метоксибензоат
К раствору соединения D (1,16 г, 4,64 ммол) в N,N-диметилформамиде (30 мл) добавляют имидазол (1,18 г, 17,40 ммол) и третбутилдиметилхлорсилан (1,31 г, 8,7 ммол). Реакционную массу перемешивают при комнатной температуре в течение 12 часов. Смесь вливают в водный раствор (50 мл) и экстрагируют диэтиловым эфиром (3×50 мл). Органические слои сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью флеш-хроматографии (Biotage System, Cartridge column FLASH 40+M™ KP-Sil, элюент: н-гексан/этилацетат 95/5. Получают 1,56 г продукта.
F) 5,6 Бис(нитроокси)гексил-4-(третбутилдиметилсилилокси)-3-метоксибензоат
К раствору соединения Е (1,4 г, 3,97 ммол) в ацетонитриле (30 мл) добавляют нитрат серебра (0,8 г, 4,77 ммол). Реакционную смесь охлаждают до -15°С и добавляют иод (1,21 г, 4,77 ммол). Реакционную массу перемешивают при -15°С в течение 20 минут. Повышают температуру до 25°С и добавляют иод (2,7 г, 15,9 ммол). Реакционную смесь нагревают до 100°С в течение 60 минут под воздействием микроволнового излучения. Полученную смесь охлаждают, фильтруют и удаляют растворитель при пониженном давлении. Остаток очищают с помощью флеш-хроматографии (Biotage System, Cartridge column FLASH 40+M™ KP-Sil, элюент: градиент н-гексан/этилацетат 9/1 (400 мл) до н-гексан/этилацетат 7/3 при 2000 мл, н-гексан/этилацетат 7/3 (400 мл)). Получают 1,19 г продукта.
G) 5,6 Бис(нитроокси)гексил 4-гидрокси-3-метоксибензоат
К охлажденному до О С раствору соединения F (1,19 г, 2,43 ммол) в тетрагидрофуране (40 мл) добавляют 1М раствор тетрабутиламмоний фторида в тетрагидрофуране (2/43 мл, 2,43 ммол). Реакционную массу перемешивают при 0°С в течение 20 минут. Смесь вливают в 5% водный раствор NaH2PO4 и экстрагируют этилацетатом (3×50 мл). Органические слои промывают водой (50 мл), сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью флеш-хроматографии (Biotage System, Cartridge column FLASH 40+M™ KP-Sil, элюент: градиент н-гексан/этилацетат 9/1 (200 мл) до н-гексан/этилацетат 1/1 при 1000 мл, н-гексан/этилацетат 1/1 (200 мл)), до п-гексан/этилацетат 4/6 при 200 мл, п-гексан/этилацетат 4/6 (400 мл)). Получают 0,9 г продукта.
H) 2-((6S,9R,10S,11S,13S,16R,17S)-6,9-Дифтор-11-гидрокси-16,17-((1-метилэтилиден)бис(окси))-10,13-диметил-3-оксо-6,7,8,9,10,11,12,13,14,15,16,17-додекагидро-3Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил карбонохлоридат.
К охлажденному до 0°C раствору флуоцинолон ацетонида (1,2 г, 2,65 ммол) в тетрагидрофуране (24 мл) добавляют в атмосфере N2 20% раствор фосгена в толуоле (5,58 мл, 10,6 ммол). Реакционную смесь перемешивают при 0°С в течение 30 минут и при комнатной температуре в течение 12 часов. Избыток фосгена удаляют нагреванием при 40°С в течение 45 минут. Растворитель упаривают под вакуумом. Сырой продукт используют на следующих стадиях без очистки.
I) 5,6 Бис(нитроокси)гексил 4-((2-((6S,9R,10S,11S,13S,16R,17S)-6,9-дифтор-11-гидрокси-16,17-((1-метилэтилиден)бис(окси))-10,13-диметил-3-оксо-6,7,8,9,10,11,12,13,14,15,16,17-додекагидро-3Н-циклопента[а]фенантрен-17-ил)-2-оксоэтокси)карбонилокси)-3-метоксибензоат.
К раствору соединения Н (0,56 г, 1,09 ммол) в дихлорметане (24 мл) добавляют диизопропилэтиламин (0,21 мл, 1,2 ммол). Реакционную смесь охлаждают до 0°С и добавляют раствор соединения G (0.45 г, 1,2 ммол) в дихлорметане (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 12 часов. Растворитель упаривают под вакуумом. Остаток очищают с помощью флеш-хроматографии (Biotage System, Cartridge column FLASH 40+M™ KP-Sil, элюент: градиент н-гексан/этилацетат 8/2 (200 мл) до н-гексан/этилацетат 2/8 при 2400 мл, н-гексан/этилацетат 2/8 (400 мл)). Получают 0,67 г продукта.
1H-NMR: (CDCl3), δ: 7.70 (2Н, d); 7.30 (1H, d); 7.07 (1H, d); 6.45 (1H, s); 6.38 (1H, dd); 5.52-5.28 (2H, m); 5.16-4.91 (2H, dd); 5.04 (1H, d); 4.74 (1H, dd); 4.50 (1H, m); 4.43-4.35 (3H, m); 3.95 (3H, s); 2.60-2.10 (4H, m); 1.90-1.47 (16H, m); 1.25 (3Н, s); 0.95 (3Н, s).
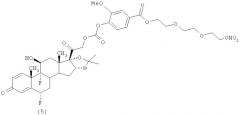
Пример 3 (Соединение (5))
Синтез 2-(2-(2-(нитроокси)этокси)этокси)этил 4-((2-((6S,9R,10S,11S,13S,16R,17S)-6,9-дифтор-11-гидрокси-16,17-((1-метилэтилиден)бис(окси))-10,13-диметил-3-оксо-6,7,8,9,10,11,12,13,14,15,16,17-додекагидро-ЗН-циклопента[а]фенантрен-17-ил)-2-окс