Фармацевтическая композиция, содержащая микрочастицы с поверхностным покрытием
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтике и заключается в обеспечении фармацевтической композиции, которую можно использовать для эффективного введения низкомолекулярных лекарственных веществ и полимерных соединений, таких как пептиды и белки, способом, отличным от инъекции, и способа производства данной композиции. Фармацевтическая композиция для чресслизистого введения включает (a) лекарственное вещество, имеющее положительный или отрицательный заряд при pH композиции после получения, (b) фармацевтически приемлемую малую частицу размером не менее 1 нм и не более 50 мкм и (c) фармацевтически приемлемый полимер поверхностного покрытия, имеющий заряд со знаком, противоположным заряду лекарственного вещества при указанном pH, при этом поверхность частицы покрыта полимером поверхностного покрытия, лекарственное вещество зафиксировано на поверхности данной частицы с помощью полимера поверхностного покрытия и комплекс образован в результате нековалентного взаимодействия между данной малой частицей и полимером поверхностного покрытия и конкурирующего электростатического взаимодействия между полимером поверхностного покрытия и лекарственным веществом. Группа изобретений обеспечивает более высокую стабильность, а также контроль чресслизистого всасывания данного лекарственного вещества. 4 н. и 13 з.п. ф-лы, 8 пр., 13 табл., 10 ил.
Реферат
Область техники
Настоящее изобретение относится к фармацевтической композиции для чресслизистого введения и способу ее получения. Конкретнее, настоящее изобретение относится к новой фармацевтической композиции для чресслизистого введения, включающей комплекс, состоящий из лекарственного средства, малой частицы и полимера поверхностного покрытия, где поверхность малой частицы покрыта полимером поверхностного покрытия, лекарственное вещество закреплено на поверхности малой частицы посредством полимера поверхностного покрытия, и данный комплекс образован в результате нековалентного взаимодействия между малой частицей и полимером поверхностного покрытия, и конкурирующего электростатического взаимодействия между полимером поверхностного покрытия и лекарственным веществом; и способу ее получения.
Предпосылки создания изобретения
Достижения в области биотехнологии сделали возможным обнаружение большого числа терапевтических соединений, таких как пептиды, белки, полисахариды, полинуклеиновые кислоты, siRNA (малые интерферирующие РНК), РНК, антитела, антигены, низкомолекулярные лекарственные вещества и тому подобное. Однако многие из этих соединений из-за их физико-химических свойств сложно вводить в организм посредством способов, отличных от инъекций (например, большой молекулярный вес, гидрофильность, нестабильность и тому подобное). Для некоторых из этих соединений требуется многократное ежедневное дозированное введение посредством инъекции. Особой проблемой, однако, является то, что пациенты молодого возраста не всегда соблюдают этот режим дозированного введения данных соединений (непатентные документы 1 и 2).
Когда введение происходит перорально или посредством других чресслизистых путей введения через слизистую оболочку, например, легких, ротовой полости, влагалища, носа и тому подобного, всасывание этих лекарственных веществ затруднено из-за их физического размера и гидрофильности. Более того, эти лекарственные вещества имеют склонность к разрушению под действием ферментов, таких как пептидазы и протеазы, что представляет собой проблему особенно в желудочно-кишечном тракте. Для того чтобы усовершенствовать транспорт этих лекарственных веществ через слизистые поверхности, лекарственные формы, содержащие усилители всасывания, применяли с некоторым успехом, особенно при доставке через трансназальный путь или пульмональный путь введения. Тем не менее, существует потребность в разработке эффективных способов и композиций для осуществления транспорта соединений, имеющих более высокий молекулярный вес, через поверхности слизистых оболочек.
Системы, использующие малые частицы, такие как наночастицы, были широко изучены в качестве средства транспорта полимерных лекарственных веществ, таких как пептиды и белки, через поверхности слизистых оболочек (непатентные документы 3-5)). В случае использования пептидных или белковых лекарственных средств было предположено, что их стабильность является низкой, если данное лекарственное средство не инкапсулировано в матриксе наночастицы. Однако инкапсулирование этих соединений внутрь наночастиц представляет собой сложность из-за большого размера этих соединений и обычно гидрофобной среды в матриксе наночастицы, и это в результате приводит к очень низкой нагрузочной способности и, следовательно, необходимости введения больших количеств наночастиц на поверхность слизистой оболочки. Более того, в публикации было разъяснено, что транспорт наночастиц через слизистую оболочку не является легко достижимым (непатентный документ 6).
Ссылки на уже известный уровень техники
Непатентные документы
Непатентный документ 1: Drug Discovery Today, Vol.7, pp.1184-1189 (2002)
Непатентный документ 2: J. Control. Rel., Vol.87, pp.187-198 (2003)
Непатентный документ 3: J. Pharm. Sci., Vol.96, pp.473-483 (2007)
Непатентный документ 4: Biomaterials, Vol.23, pp.3193-3201 (2002)
Непатентный документ 5: Int. J. Pharm., Vol.342, pp.240-249 (2007)
Непатентный документ 6: J. Pharm. Sci., Vol.96, pp.473-483 (2007)
Краткое описание изобретения
Проблемы, которые будут решены посредством данного изобретения
Задача настоящего изобретения состоит в обеспечении фармацевтической композиции, которую можно использовать для эффективного применения низкомолекулярных лекарственных соединений и полимерных соединений, таких как пептиды и белки, способами, отличными от инъекции. Конкретнее, задачей настоящего изобретения является обеспечение фармацевтической композиции, включающей малые частицы для эффективного применения низкомолекулярных лекарственных соединений и полимерных лекарственных соединений, таких как пептиды и белки, посредством доставки через слизистую оболочку, такую как слизистая оболочка носа и тому подобное, где данная композиция имеет превосходную степень нагрузки лекарственным веществом и нагрузочную способность, по сравнению с общепринятыми композициями малых частиц для чресслизистого введения, и имеет повышенную стабильность лекарственного вещества. Также задачей настоящего изобретения является обеспечение способа получения данной фармацевтической композиции.
Способы решения проблем
Авторы настоящего изобретения сосредоточили свое внимание на чресслизистом введении с использованием системы малых частиц, таких как наночастицы, в качестве метода эффективного применения лекарственных соединений (например, пептида, белка, ДНК, РНК, siRNA, полисахарида, анититела, антигена, низкомолекулярного соединения и тому подобного) способами, отличными от инъекции, и провели тщательные исследования. В итоге, авторы настоящего изобретения обнаружили, что стабильность лекарственного вещества была заметно улучшена по сравнению с растворами композиций того же самого лекарственного вещества, в результате получения композиции, включающей комплекс, где комплекс лекарственное вещество-полимер поверхностного покрытия, который был сформирован в результате электростатического взаимодействия между лекарственным веществом и полимером поверхностного покрытия (а именно, полимера, который присоединен к поверхности малых частиц), был зафиксирован на поверхности малой частицы в результате нековалентного взаимодействия между данной малой частицей и данным полимером поверхностного покрытия. Более того, авторы настоящего изобретения обнаружили, что данная композиция имела превосходную нагрузочную способность лекарственным веществом по сравнению с композициями малых частиц типа, где лекарственное вещество инкапсулировано. На основании этих полученных данных авторы настоящего изобретения пришли к заключению, что система доставки лекарственного вещества, превосходящая общепринятые методы, может быть обеспечена с использованием данной композиции, что привело в результате к доработке настоящего изобретения.
Соответственно, настоящее изобретение представляет собой следующее.
[1] Фармацевтическая композиция для чресслизистого введения, включающая (a) лекарственное вещество, имеющее положительный или отрицательный заряд при предопределенном значении рН, (b) фармацевтически приемлемая малая частица и (c) фармацевтически приемлемый полимер поверхностного покрытия, допускающий наличие электрического заряда при данном значении рН, где поверхность данной малой частицы покрыта полимером поверхностного покрытия, данное лекарственное вещество зафиксировано на поверхности данной малой частицы посредством данного полимера поверхностного покрытия, и комплекс сформирован в результате нековалентного взаимодействия между данной малой частицей и полимером поверхностного покрытия, и конкурирующего электростатического взаимодействия между данным полимером поверхностного покрытия и данным лекарственным веществом.
[2] Композиция по вышеприведенному пункту [1], где данное нековалентное взаимодействие между данной малой частицей и полимером поверхностного покрытия представляет собой электростатическое взаимодействие.
[3] Композиция по вышеприведенным пунктам [1] или [2], где данное предопределенное значение рН представляет собой физиологическое значение рН в области введения.
[4] Композиция по любому из вышеприведенных пунктов [1]-[3], где данное лекарственное вещество выбрано из группы, состоящей из пептида, белка, ДНК, РНК, siRNA, полисахарида, антигена и низкомолекулярного лекарственного вещества.
[5] Композиция по любому из вышеприведенных пунктов [1]-[4], где данное лекарственное вещество представляет собой лекарственное вещество, способное обеспечить лечебный или вакцинный эффект.
[6] Композиция по вышеприведенному пункту [4], где данным лекарственным веществом является инсулин.
[7] Композиция по вышеприведенному пункту [4], где данное лекарственное вещество представляет собой по меньшей мере одно лекарственное вещество, выбранное из группы, состоящей из бромгексина, золмитриптана и их солей.
[8] Композиция по любому из вышеприведенных пунктов [1]-[7], где данный полимер поверхностного покрытия является сам по себе слабо растворимым в воде при предопределенном значении рН.
[9] Композиция по любому из вышеприведенных пунктов [1]-[8], где данный полимер поверхностного покрытия представляет собой по меньшей мере один полимер, выбранный из группы, состоящей из хитозана, полиаргинина, полиакриловой кислоты, поли-гамма-глутаминовой кислоты и их солей.
[10] Композиция по любому из вышеприведенных пунктов [1]-[9], где данный полимер поверхностного покрытия является мукоадгезивным и/или действует как стимулятор чресслизистого всасывания.
[11] Композиция по любому из вышеприведенных пунктов [1]-[10], где данная малая частица содержит полимер, имеющий карбоксильную группу или аминогруппу.
[12] Композиция по любому из вышеприведенных пунктов [1]-[11], где данная малая частица состоит из сополимера поли(молочная кислота - гликолевая кислота).
[13] Композиция по любому из вышеприведенных пунктов [1]-[12], где средний размер частиц комлекса при предопределенном значении рН составляет не менее 10 нм и не более 50 мкм.
[14] Способ получения композиции по вышеприведенному пункту [8], включающий
(a) смешивание лекарственного вещества, малой частицы и полимера поверхностного покрытия при значении рН, при котором полимер поверхностного покрытия легко растворим в воде, и
(b) доведение значения рН данной смеси до предопределенного значения рН.
[15] Способ получения композиции по любому из вышеприведенных пунктов [1]-[13], включающий
(a) смешивание лекарственного вещества, полимера поверхностного покрытия и малой частицы в условиях рН, при которых данное лекарственное вещество и данный полимер поверхностного покрытия имеют один и тот же знак заряда, и затем
(b) доведение значения рН данной смеси до значения рН, при котором знак заряда лекарственного вещества меняется на противоположный знак, и где данное лекарственное вещество представляет собой амфотерное лекарственное вещество.
[16] Способ получения по вышеприведенному пункту [15], где данная малая частица имеет заряд, противоположный знаком заряду данного лекарственного вещества и заряду полимера поверхностного покрытия в условиях рН на этапе (a).
[17] Способ получения композиции по любому из вышеприведенных пунктов [1]-[13], включающий
(a) добавление по капле раствора органического растворителя вещества данной малой частицы в водный раствор данного полимера поверхностного покрытия,
(b) испарение данного органического растворителя,
(c) добавление лекарственного вещества и перемешивание данной смеси и
(d) доведение значения рН данной смеси до предопределенного значения рН.
Эффективность данного изобретения
Применение композиции по настоящему изобретению делает возможным эффективное чресслизистое введение низкомолекулярных лекарственных веществ и полимерных лекарственных соединений, таких как пептиды и белки, которые до настоящего времени было сложно применять способом, отличным от инъекции. Данное лекарственное вещество, содержащееся в композиции по настоящему изобретению, формирует комплекс с полимером поверхностного покрытия с противоположным зарядом, и малой частицей, и таким образом имеет более высокую стабильность (например, стабильность в отношении ферментов, сохраняющая стабильность), чем когда содержится в композиции раствора, а также более высокую нагрузочную способность лекарственным веществом по сравнению с малой частицей, в которой лекарственное вещество инкапсулировано в матриксе данной малой частицы. Более того, возможно обеспечить замедленное высвобождение или быстрое высвобождение лекарственного вещества и контроль чресслизистого всасывания данного лекарственного вещества в зависимости от типа полимера поверхностного покрытия, который формирует комплекс с данным лекарственным веществом на поверхности данной малой частицы.
Краткое описание чертежей
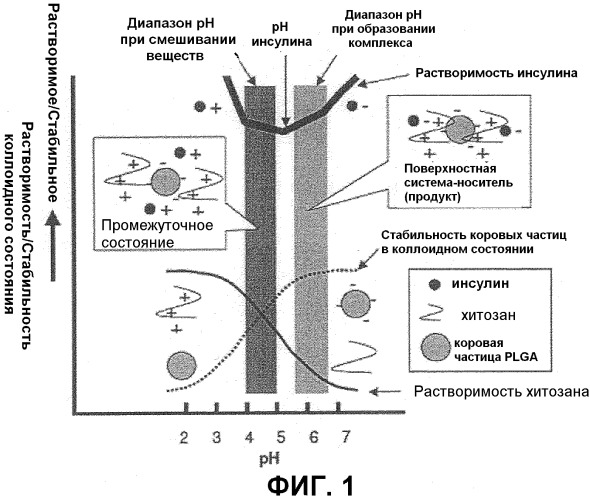
На Фиг.1 показан механизм получения малых частиц с поверхностным покрытием (поверхностная система-носитель), включающая коровые частицы PLGA с поверхностным покрытием из комплекса инсулин-хитозан.
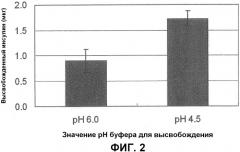
На Фиг.2 представлены результаты образования комплекса инсулин-хитозан на поверхности малых частиц PLGA, где на левой гистограмме изображено высвобождение инсулина в буфере, имеющем рН 6,0, на правой гистограмме представлено высвобождение инсулина в буфере, имеющем рН 4,5, и вертикальная ось изображает количество (мкг) высвобожденного инсулина.
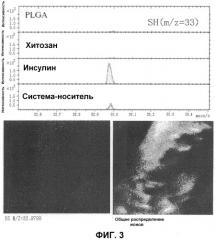
На Фиг.3 представлены результаты анализа время-пролетной масс-спектрометрии вторичных ионов (ToF-SIMS) коровых частиц PLGA с поверхностным покрытием комплексом инсулин-хитозан, где на верхней панели представлены результаты обнаружения пика m/z=33 в каждом образце (PLGA, хитозан (Хитозан), инсулин (Инсулин) и малые частицы с поверхностным покрытием (система-носитель)) (горизонтальная ось: m/z; вертикальная ось: интенсивность детекции), и на нижней панели представлено изображение распределения (слева) пика m/z=33 малых частиц с поверхностным покрытием и изображение общего распределения ионов (справа) в поле наблюдения.
На Фиг.4 представлено соотношение (%) нераспавшегося инсулина, оставшегося в растворе химотрипсина после культивирования, где верхний прямоугольник изображает раствор свободного инсулина и нижний прямоугольник соответствует малым частицам с поверхностным покрытием PLGA/хитозан/инсулин.
На Фиг.5 представлена принципиальная схема, объясняющая метод, используемый для исследования переноса инсулина через мембрану слизистой оболочки носа свиньи.
На Фиг.6 представлены результаты исследования переноса инсулина через мембрану слизистой оболочки носа свиньи, где горизонтальная ось изображает время (мин) после начала исследования переноса, а вертикальная ось отображает количество инсулина (нг/см2), которое было перенесено через дыхательную мембрану слизистой оболочки носа свиньи в данное время.
На Фиг.7 представлены результаты измерения размера частиц малых частиц с поверхностным покрытием или смеси хитозан/инсулин, где (а) изображает распределение по размерам малых частиц с поверхностным покрытием (имеющих коровые частицы; PLGA100/хитозан/инсулин=1250/900/200 мкг/мл), (b) изображает распределение частиц по размерам в смеси хитозан/инсулин (без коровых частиц; хитозан/инсулин=900/200 мкг/мл), горизонтальная ось отображает радиус частиц (нм) и вертикальная ось отображает интенсивность.
На Фиг.8 представлены результаты измерения размера малых частиц с поверхностным покрытием (PLGA100/хитозан/инсулин=250/180/40 мкг/мл) до лиофилизации и после лиофилизации и ресуспендирования, где (a) изображает распределение по размерам малых частиц с поверхностным покрытием до лиофилизации, и (b) изображает распределение по размерам малых частиц после лиофилизации и ресуспендирования, горизонтальная ось отображает радиус частиц (нм), а вертикальная ось отображает интенсивность.
На Фиг.9 представлен уровень глюкозы крови после назального введения крысам образца из Примера 7, или контрольного образца, где данные результаты демонстрируют относительное снижение уровня глюкозы (%) по сравнению с таковым до введения образца как 100%, среднее значение ± среднеквадратическая ошибка.
На Фиг.10 представлены результаты теста высвобождения in vitro с использованием образца из Примера 8 (N=3) (5 мМ изотонический буфер MES (pH 6), 37°C).
Описание вариантов осуществления
Настоящее изобретение обеспечивает фармацевтическую композицию для чресслизистого введения, содержащую (a) лекарственное вещество, имеющее положительный или отрицательный заряд при предопределенном значении рН, (b) фармацевтически приемлемую малую частицу и (c) фармацевтически приемлемый полимер поверхностного покрытия, способный иметь электрический заряд при данном значении рН. В данной композиции данная малая частица покрыта данным полимером поверхностного покрытия, данное лекарственное вещество зафиксировано на поверхности данной малой частицы посредством данного полимера поверхностного покрытия, и комплекс (в дальнейшем также упоминаемый как «малая частица с поверхностным покрытием») сформирован в результате нековалентного взаимодействия между данной малой частицей и полимером поверхностного покрытия, и конкурирующего электростатического взаимодействия между данным полимером поверхностного покрытия и данным лекарственным веществом.
«Фармацевтическая композиция для чресслизистого введения» означает фармацевтическую композицию, которая наносится на слизистую оболочку субъекта, нуждающегося в такой обработке и/или лечении, используя подходящий способ, такой как нанесение покрытия, разбрызгивание, распыление, наложение и тому подобное, когда данное лекарственное вещество может быть доставлено в ткань слизистой оболочки, или в кровеносную систему, или иммунную систему, через ткань слизистой оболочки для выработки лечебного или вакцинного эффекта. Данная фармацевтическая композиция может быть, например, абсорбирована через слизистую оболочку для системной доставки. В качестве примеров слизистых оболочек можно упомянуть такие слизистые оболочки, как слизистые легких, ротовой полости, глаза, влагалища, желудочно-кишечного тракта, носа и тому подобное. С точки зрения удобства применения предпочтительной является слизистая оболочка носа.
Фармацевтически приемлемый полимер поверхностного покрытия, упомянутый в пункте (с), из которого состоит поверхностный слой малой частицы, покрывает поверхность малых частиц, как указано выше. «Покрытие» здесь просто обозначает, что полимер поверхностного покрытия закреплен на поверхности, а не внутри малой частицы в результате нековалентного взаимодействия между данной малой частицей и данным полимером поверхностного покрытия, и необязательно означает, что вся поверхность данной малой частицы покрыта данным полимером поверхностного покрытия.
Полимер поверхностного покрытия предпочтительно является биологически совместимым. Используемый здесь термин «биологическая совместимость» означает, что вещество и продукты его разложения не имеют токсического или опасного эффекта на ткани тела или системы организма (например, систему кровообращения, нервную систему, иммунную систему и тому подобное). Данный биосовместимый полимер является подходящим для введения в организм человека или других животных. Дополнительно, полимер поверхностного покрытия более предпочтительно является биоразлагаемым. Используемый здесь термин «биоразлагаемость» означает, что вещество разлагается внутри живого организма в результате ферментативного, химического или физического процесса или тому подобного в течение приемлемого промежутка времени для формирования более малых химических соединений. Способы оценки биосовместимости и биоразлагаемости хорошо известны в области данного изобретения.
Данный полимер поверхностного покрытия может представлять собой природный полимер или синтетический полимер. Поскольку данный полимер поверхностного покрытия образует ионную связь с лекарственным веществом на поверхности малой частицы при предопределенном значении рН, необходимо, чтобы данный полимер имел заряд со знаком, противоположным заряду лекарственного вещества при предопределенном значении рН. При необходимости, более одного полимера поверхностного покрытия можно использовать в комбинации для данного полимера поверхностного покрытия, при условии, что они способны иметь заряды с тем же знаком при предопределенном значении рН.
Фармацевтическую композицию по настоящему изобретению можно получить, например, посредством нижеупомянутого способа получения; когда композиция получена данным способом получения, даже если полимер поверхностного покрытия сам по себе слабо растворим в воде при предопределенном значении рН, данная композиция может быть получена посредством смешивания данного полимера поверхностного покрытия с данным лекарственным веществом и данными малыми частицами при значении рН, при котором данный полимер поверхностного покрытия с легкостью растворяется в воде, а затем доводя значение рН данной смеси до предопределенного значения рН. Следовательно, для данного полимера поверхностного покрытия можно использовать не только полимеры, которые легко растворимы в воде при предопределенном значении рН, но также полимеры, которые слабо растворимы в воде при предопределенном значении рН.
Полимеры, которые можно использовать в качестве полимера поверхностного покрытия, могут быть выбраны, но неограничены ими, из полианионных или поликатионных полисахаридов, полиаминокислот или других заряженных полимеров. Данный полимер выбран соответствующим образом, исходя из типа используемого лекарственного вещества, заряда данного полимера поверхностного покрытия и данного лекарственного вещества, и тому подобного.
Полианионные полисахариды, которые можно использовать в настоящем изобретении, означают полисахарид, который имеет одну или несколько кислотных полярных групп, таких как карбоксильная группа, сернокислая группа или фосфорнокислая группа, в составном звене. Примеры таких полианионных полисахаридов включают, но не ограничиваются ими, хондроитинсульфат, сернокислый декстран, карбоксиметилцеллюлозу, альгиновую кислоту, пектин, гиалуроновую кислоту, их производные и соли, и тому подобное.
Поликатионные полисахариды, которые можно использовать в настоящем изобретении, означают полисахариды, которые имеют одну или несколько основных полярных групп, таких как аминогруппа, в составном звене. Примеры таких поликатионных полисахаридов включают, но не ограничивают ими, хитин, хитозан, их производные и соли, и тому подобное. Хитозан и производные хитозана могут быть выбраны из тех, которые имеют различные молекулярные массы, степени деацетилирования и, для производных хитозана, степени замещения.
Полианионные полиаминокислоты, которые можно использовать в настоящем изобретении, означают полиаминокислоту, чья изоэлектрическая точка находится в кислотной части физиологического рН; примеры их включают, но не ограничиваются ими, полиглутаминовую кислоту, полиаспарагиновую кислоту, их производные и соли, и тому подобное.
Поликатионные полиаминокислоты, которые можно использовать в настоящем изобретении, означают полиаминокислоту, чья изоэлектрическая точка находится в основной части физиологического рН; примеры их включают, но не ограничиваются ими, полилизин, полиаргинин, их производные и соли, и тому подобное.
Примеры полимеров, которые можно использовать в качестве полимера поверхностного покрытия, отличающиеся от вышеупомянутых полисахаридов и полиаминокислот, включают полиэтиленимин, полиакриловую кислоту, их производные и соли, и тому подобное.
Полимер поверхностного покрытия может быть полиэтиленгликолированным (ПЭГилированный) и/или гликозилированным.
Полимер поверхностного покрытия дополнительно может быть мукоадгезивным и/или действовать в качестве стимулятора чресслизистого всасывания. Примеры мукоадгезивных полимеров включают хитозан, полиакриловую кислоту, альгинат натрия, карбоксиметилцеллюлозу и тому подобное, а также их ПЭГилированные полимеры, и тому подобное. Примеры полимеров, которые действуют в качестве стимуляторов чресслизистого всасывания, включают хитозан, полиакриловую кислоту, полиаргинин, их соли и производные, и тому подобное.
Специалист, обладающий обычными навыками в данной области техники, может определить молекулярную массу полимера поверхностного покрытия, принимая во внимание такие факторы, как скорость деградации, механическая прочность, растворимость, лекарственное вещество какого типа будет образовывать комплекс с данным полимером поверхностного покрытия, и тому подобное. Обычно, средневесовая молекулярная масса данного полимера поверхностного покрытия должна быть, предпочтительно, не менее 1000 Да, и более предпочтительно, не менее 2000 Да; предпочтительно, не более 1000000 Да, и более предпочтительно, не более 500000 Да, как определено с помощью гель-проникающей хромотографии. Соответственно, обычно, средневесовая молекулярная масса данного полимера поверхностного покрытия составляет, предпочтительно, между 1000-100000 Да, и более предпочтительно, между 2000-500000 Да. Например, средневесовая молекулярная масса хитина или хитозана может составлять между 1000-1000000 Да, и степень деацетилирования хитина или хитозана может составлять между 20-100%.
Композиция по настоящему изобретению обеспечивает возможность контроля скорости высвобождения лекарственного вещества как композиция с замедленным высвобождением или с быстрым высвобождением, и регуляции чресслизистого всасывания лекарственного вещества, на основании выбора данного полимера поверхностного покрытия. Специалист, обладающий обычными навыками в данной области техники, может должным образом выбрать полимер поверхностного покрытия таким образом, чтобы обеспечить необходимое фармакокинетическое свойство данной композиции.
Лекарственное вещество, используемое в данной композиции по настоящему изобретению, выбрано в соответствии с предполагаемым применением. В данной композиции по настоящему изобретению, поскольку лекарственное вещество связывается ионной связью с соответствующим полимером поверхностного покрытия на поверхности данной малой частицы, лекарственное вещество, которое можно использовать в этой композиции, должно иметь положительный или отрицательный заряд (а именно, иметь заряд противоположного знака с полимером поверхностного покрытия) при предопределенном значении рН. До тех пор пока выполняется это условие, любое лекарственное вещество можно использовать в композиции по настоящему изобретению. При необходимости можно использовать более одного лекарственного вещества в комбинации, при условии, что они способны иметь заряды одинакового знака при предопределенном значении рН.
Данным лекарственным веществом может быть, без ограничений, пептид, белок, ДНК, РНК, siRNA, полисахарид, антитело, антиген, низкомолекулярное соединение и тому подобное. Данная фармацевтическая композиция по настоящему изобретению может быть получена, например, посредством нижеупомянутого способа получения. В случае когда данная композиция получена нижеупомянутым способом получения, лекарственное вещество, допускающее изменение заряда (знака и интенсивности), исходя из изменения рН во время процесса изготовления, может быть чрезвычайно предпочтительно, поскольку возможно достаточное смешивание данного лекарственного вещества и полимера поверхностного покрытия в условиях степени заряженности, свободных от электростатического взаимодействия между данным лекарственным веществом и данным полимером поверхностного покрытия, а затем формирование ионной связи между ними посредством изменения рН. Примеры таких лекарственных веществ включают амфотерические лекарственные вещества, такие как пептиды и белки, которые могут быть положительно или отрицательно заряжены в зависимости от рН, лекарственные вещества, имеющие такую константу кислотной диссоциации (рКа) или константу диссоциации оснований (pKb), которая заметно меняет интенсивность заряда между процессом производства и в данной композиции, и низкомолекулярные лекарственные вещества в форме солей, таких как гидрохлорид, сульфат, ацетат и тому подобное, которые способны растворяться в воде и имеют заряд, который в меньшей степени зависим от значения рН.
Примеры лекарственных средств включают, но не ограничены ими, антигипертензивное средство, антигипотензивное средство, болеутоляющее средство, нейролептическое средство, антидепрессант, противоманиакальное средство, анксиолитическое средство, седативное средство, снотворное средство, противоэпилептическое средство, опиоидные агонисты, терапевтическое средство для лечения астмы, анестетическое средство, противоаритмическое средство, терапевтическое средство для лечения артрита, противосудорожное средство, ингибитор АПФ, противозастойное средство, антибиотик, антиангиальное средство, мочегонное средство, противопаркинсонное средство, бронхорасширяющее средство, средство, стимулирующее родовую деятельность, антидиуретическое средство, антилипемическое средство, иммунодепрессивное средство, регулятор иммунитета, противорвотное средство, противоинфекционное средство, противоопухолевое средство, противогрибковое средство, противовирусное средство, противодиабетическое средство, противоаллергическое средство, жаропонижающее средство, противоопухолевое средство, средство против подагры, антигистаминное средство, противозудное средство, регулятор остеогенеза, сердечно-сосудистое средство, гипохолестеринемическое средство, противомалярийное средство, фармацевтическое средство для прекращения курения, противокашлевое средство, отхаркивающее средство, муколитическое средство, средство против заложенности носа, агонист допамина, фармацевтическое средство для желудочно-кишечного тракта, миорелаксант, блокатор нервно-мышечного проведения, парасимпатолитическое средство, простагландин, стимулирующее лекарственное средство, анорексигенное средство, тиреоидное средство или антитиреоидное средство, гормон, средство против мигрени, средство против ожирения, противовоспалительное средство и тому подобное. Данное лекарственное средство может быть выбрано из различных пептидов, белков, полисахаридов, антигенов, антител, ДНК, РНК, siRNA, низкомолекулярных лекарственных соединений и тому подобного, которые предназначены для профилактической вакцинации, иммунотерапии, терапии антителами, генотерапии, супрессии экспрессии генов и тому подобного.
Конкретные примеры лекарственного средства включают, но не ограничиваются ими, инсулин, глюкагон, лейпролид, гормоны роста, паратиреоидный гормон, кальцитонин, фактор роста эндотелия сосудов, эритропоэтин, гепарин, циклоспорин, окситоцин, тирозин, энкефалин, тиреотропин-высвобождающий гормон, фолликулостимулирующий гормон, лютеинизирующий гормон, вазопрессин, аналоги вазопрессина, каталазу, супероксиддисмутазу, интерлейкин II, интерфероны, колониестимулирующий фактор, фактор некроза опухоли, меланоцитстимулирующий гормон, глюкагоноподобный пептид-1, глюкагоноподобный пептид-2, катакальцин, холецистокенин-12, холецистокенин-8, эксендин, гонадолиберин-ассоциированный пептид, инсулиноподобный белок, лейцин-энкефалин, метионин-энкефалин, леуморфин, нейрофизин, копептин, нейропептид Y, нейропептид AF, PACAP-ассоциированный пептид, гормон поджелудочной железы, пептид YY, уротензин, интестинальный пептид, адренокортикотропный пептид, эпидермальный фактор роста, пролактин, гормон, высвобождающий лютеинизирующий гормон (LHRH), агонист LHRH, фактор, высвобождающий гормон роста, соматостатин, гастрин, тетрагастрин, пентагастрин, эндорфины, ангиотензины, тиреотропин-релизинг гормон, гранулоцитарный колониестимулирующий фактор, гранулоцитарно-моноцитарный колониестимулирующий фактор, гепариназу, антигены на вакцину гриппа, столбнячные токсины, пептиды для противораковой вакцины, β-амилоид, иммуноглобулины, siRNA для лечения цирроза, siRNA для лечения рака, низкомолекулярные лекарственные средства, такие как бромгексин, гранисетрон, золмитриптан, суматриптан и тому подобное, и их фармацевтически приемлемые соли и тому подобное.
Как указано выше, данное лекарственное соединение и данный полимер поверхностного покрытия связываются друг с другом в результате электростатического взаимодействия на поверхности данной малой частицы, для образования комплекса лекарственное средство - полимер поверхностного покрытия. Относительно комбинации данного лекарственного средства и данного полимера поверхностного покрытия, формирующих комплекс, это может быть комбинация, в которой данное лекарственное средство положительно заряжено и данный полимер поверхностного покрытия отрицательно заряжен при предопределенном значении рН, или комбинация, в которой данное лекарственное средство отрицательно заряжено и данный полимер поверхностного покрытия положительно заряжен при предопределенном значении рН.
Вышеупомянутая фармацевтически приемлемая малая частица (несмотря на то, что термин «малая частица» в настоящем описании означает вышеупомянутую малую частицу (b), данная малая частица, иногда, может быть названа «малая коровая частица», с тем чтобы провести четкое различие между этим термином и «малой частицей с поверхностным покрытием») предпочтительно состоит из биосовместимого полимера(ов). Данный полимер может быть биоразлагаемым или бионеразлагаемым; с точки зрения безопасности для живого организма, биоразлагаемый полимер является предпочтительным. Данный полимер может представлять собой природный полимер или синтетический полимер.
Примеры биосовместимых и биоразлагаемых полимеров, которые можно использовать для малой частицы, включают, но не ограничиваются ими, полиэтиленгликоль (PEG), полимолочную кислоту (PLA), поли(гликолевую кислоту) (PGA), сополимер поли(молочная кислота - гликолевая кислота) (PLGA), блок-сополимеры PEG и PLGA (PEG-PLGA), полиангидриды, поли(ε-капролактон), полигидроксибутират, полиаминокислоты, полиортоэфиры, полифосфоэфиры, полидиаксанон, полиамидоэфиры, полифосфаген, полицианоакрилат, хитозан, производные хитозана, крахмал, производные крахмала, альбумин, фибрин, фибриноген, целлюлозу, коллаген, гиалуроновую кислоту, смеси и сополимеры этих веществ, и тому подобное.
Примеры биосовместимых и бионеразлагаемых полимеров, которые можно использовать для малой частицы, включают, но не ограничиваются ими, полиакрилат, полиакриловые эфиры, полоксамер, тетроновые кислоты, полиэтилен, полиметилметакрилат, эфиры полиметилметакрилата, полистирол, этиленвинилацетат, ацилированная ацетат-целлюлоза, полиуретан, поливинилхлорид, смеси и сополимеры этих веществ, и тому подобное.
Данная малая частица может быть гидрофильной или гидрофобной. Поскольку форму и размер данной малой частицы можно с легкостью поддерживать в процессе подготовки данной малой частицы и процессе подготовки малой частицы с поверхностным покрытием в водной системе, предпочтительной является гидрофобная малая частица. В качестве предпочтительных образцов, для малой частицы можно использовать гидрофобные полимеры, имеющие карбоксильную группу, или первичную, вторичную или третичную аминогруппу.
Специалист, обладающий обычными навыками в данной области техники, может определить молекулярную массу полимера для малой частицы, принимая во внимание такие факторы, как скорость деградации, механическая прочность и растворимость. Обычно средневесовая молекулярная масса данного полимера, как определено посредством гель-проникающей хроматографии, предпочтительно составляет не менее 1000 Да (Дальтон), и более предпочтительно, не менее 2000 Да; предпочтительно, не более 1000000 Да, и более предпочтительно, не более 500000 Да. Соответственно, средневесовая молекулярная масса данного полимера обычно составляет между 1000-1000000 Да, и более предпочтительно, между 2000-500000 Да.
Относительно размера данной малой коровой частицы, можно упомянуть частицу, имеющую средн