Кристаллические формы соединения 3-карбоксипропил-аминотетралина
Иллюстрации
Показать всеИзобретение обеспечивает кристаллическую твердую форму (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты или кристаллический гидрохлорид (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты. Изобретение относится к фармацевтической композиции, обладающей антагонистической активностью в отношении мю-опиоидного рецептора, содержащей терапевтически эффективное количество кристаллической твердой формы. Изобретение также обеспечивает способы применения таких кристаллических твердых форм в лечении заболеваний, связанных с активностью мю-опиоидных рецепторов, и способы получения таких кристаллических твердых форм. 14 н. и 13 з.п. ф-лы, 9 ил., 17 пр.
Реферат
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Изобретение относится к кристаллическим формам соединения 3-карбоксипропил-аминотетралина, которое является полезным в качестве антагонистов мю-опиоидных рецепторов. Изобретение также относится к фармацевтическим композициям, содержащим такие кристаллические соединения, к способам применения таких соединений для лечения или улучшения медицинских состояний, обусловленных активностью мю-опиоидных рецепторов, и к способам, полезным в приготовлении таких соединений.
Существующий уровень техники
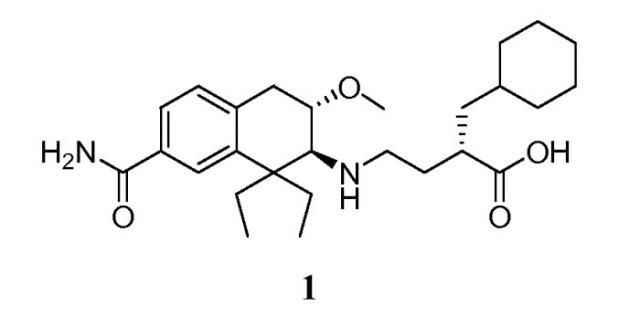
Антагонисты мю-опиоидных рецепторов, как ожидают, являются полезными для лечения или улучшения медицинских состояний, обусловленных активностью мю-опиоидных рецепторов. В частности, периферически действующие селективные антагонисты мю-опиоидных рецепторов, как полагают, являются полезными для лечения таких состояний, как вызванная опиоидами дисфункция кишечника и послеоперационная кишечная непроходимость. Принадлежащие одному и тому же правообладателю предварительные заявки США: одна - U.S. Provisional Application Nos. 61/007220, поданная 11 декабря 2007 г., и другая - 61/049219, поданная 30 апреля 2008 г., и заявка США: U.S. Application No. 12/331659, поданная 10 декабря 2008 г., раскрывают соединения 3-карбоксипропил-аминотетралина. В частности, соединение (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляная кислота (соединение 1):
конкретно раскрыто в этих заявках в качестве демонстрации антагонистической активности в отношении мю-опиоидных рецепторов.
Для эффективного применения этого соединения в качестве терапевтического средства было бы желательно иметь лекарственную форму в твердом состоянии, которая может быть легко изготовлена и которая имеет приемлемые химическую и физическую стабильность. Например, было бы весьма желательно иметь физическую форму, которая является термически стабильной, например, при температурах, превышающих приблизительно 160°С, или при температуре приблизительно 180°С и не расплывается за счет поглощения влаги, в связи с чем облегчается переработка и хранение вещества. Кристаллические твердые вещества, как правило, являются предпочтительными в сравнении с аморфными формами, поскольку усиливают степень чистоты и стабильность изготовленного продукта.
О кристаллических формах соединения 1 прежде сообщений не было. В соответствии с вышеизложенным существует необходимость в стабильной кристаллической форме соединения 1, которая не расплывается за счет поглощения влаги и проявляет благоприятную термическую стабильность.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает две различающиеся кристаллические твердые формы (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты (1) и кристаллический гидрохлорид соединения 1.
Неожиданно, одна форма кристаллического соединения 1, как было обнаружено, не проявляет значительных термических явлений при температуре ниже приблизительно 162°С и проявляет изменение массы менее чем приблизительно на 2,5% при подвергании воздействию относительной влажности в диапазоне от приблизительно 2% до приблизительно 90% при комнатной температуре. Кроме того, ни кристаллическое соединение 1, ни кристаллический гидрохлорид соединения 1 не расплывается за счет поглощения влаги при подвергании воздействию относительной влажности вплоть до приблизительно 90% при комнатной температуре.
Среди прочих применений кристаллические твердые формы изобретения, как полагают, являются полезными в изготовлении фармацевтических композиций для лечения или улучшения медицинских состояний, обусловленных активностью мю-опиоидного рецептора. В связи с этим в еще одном из его аспектов, касающихся композиции, изобретение обеспечивает фармацевтическую композицию, содержащую фармацевтически приемлемый носитель и кристаллическую (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляную кислоту или кристаллический гидрохлорид соединения 1 настоящего изобретения.
Настоящее изобретение также обеспечивает способ лечения или уменьшения симптомов заболевания или состояния, улучшаемого лечением посредством антагониста мю-опиоидного рецептора, например расстройства, связанного со сниженной моторикой желудочно-кишечного тракта, где способ включает введение млекопитающему терапевтически эффективного количества кристаллической (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты (1) или кристаллического гидрохлорида соединения 1.
Изобретение дополнительно обеспечивает способ лечения вызванной опиоидами дисфункции кишечника или послеоперационной кишечной непроходимости, включающий введение млекопитающему, терапевтически эффективного количества кристаллической (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты (1) или кристаллического гидрохлорида соединения 1.
В другом аспекте способа изобретение обеспечивает способ получения кристаллического соединения 1 в Форме I, где способ включает диспергирование (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты (1) в полярном разбавителе, содержащем от приблизительно 3% до приблизительно 20% воды, с получением смеси для кристаллизационного процесса; выдерживание технологической смеси в течение, по меньшей мере, 12 часов; и выделение получающихся в результате кристаллов из технологической смеси.
В еще одном аспекте способа изобретение обеспечивает способ получения кристаллического соединения 1 в Форме I, включающий снятие защитных групп с промежуточного соединения, имеющего защитные группы, бензилового сложного эфира (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты, с помощью каталитического гидрогенолиза в присутствии полярного разбавителя, содержащего от приблизительно 10% до приблизительно 20% воды с получением кристаллического соединения 1.
В родственных аспектах, касающихся композиции, изобретение обеспечивает бензиловый сложный эфир (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты и бисульфитный аддукт, (S)-3-бензилоксикарбонил-4-циклогексил-1-гидрокси-бутан-1-сульфонат натрия, который является полезным в получении вышеупомянутого имеющего защитные группы вещества-предшественника соединения 1.
Изобретение также обеспечивает кристаллические твердые формы изобретения, которые описаны в этом документе, для применения в терапии или в качестве лекарственного препарата, а также применение кристаллической твердой формы изобретения в изготовлении лекарственного препарата, в особенности в изготовлении лекарственного препарата для лечения расстройства, связанного с активностью мю-опиоидных рецепторов, у млекопитающего.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Различные аспекты настоящего изобретения проиллюстрированы со ссылкой на прилагаемые чертежи.
Фигура 1 показывает порошковую (XRPD) рентгенограмму кристаллической Формы I (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты изобретения.
Фигура 2 показывает кривую, полученную методом дифференциальной сканирующей калориметрии (DSC) (вертикальная ось с правой стороны), и кривую, полученную методом термогравиметрического анализа (TGA) (вертикальная ось с левой стороны), для кристаллической Формы I (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты изобретения.
Фигура 3 показывает кривую динамической сорбции влаги (DMS) для кристаллической Формы I (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты изобретения.
Фигура 4 показывает порошковую ((XRPD)) рентгенограмму кристаллической Формы II (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты изобретения.
Фигура 5 показывает кривую, полученную методом дифференциальной сканирующей калориметрии (DSC), для кристаллической Формы II (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты изобретения.
Фигура 6 показывает порошковую (XRPD) рентгенограмму кристаллического гидрохлорида (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты изобретения.
Фигура 7 показывает кривую, полученную методом дифференциальной сканирующей калориметрии (DSC) (вертикальная ось с правой стороны), и кривую, полученную методом термогравиметрического анализа (TGA) (вертикальная ось с левой стороны), для кристаллического гидрохлорида (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты изобретения.
Фигура 8 показывает порошковую (XRPD) рентгенограмму кристаллического гидрохлорида бензилового сложного эфира (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты изобретения.
Фигура 9 показывает кривую, полученную методом дифференциальной сканирующей калориметрии (DSC), для кристаллического гидрохлорида бензилового сложного эфира (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение обеспечивает кристаллические твердые формы (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты (1).
Определения
В том случае, когда описывают соединения, композиции и способы изобретения, следующие термины имеют следующие значения, если не указано иное.
Термин «терапевтически эффективное количество» означает количество, достаточное для того, чтобы оказывать влияние на лечение при введении пациенту, нуждающемуся в лечении.
Термин «лечение», который используют в этом документе, означает лечение заболевания, расстройства или медицинского состояния у пациента, такого как млекопитающее (в особенности, человек), которое включает один или более из следующих видов деятельности:
(а) предупреждение возникновения заболевания, расстройства, или медицинского состояния, то есть профилактическое лечение пациента;
(b) уменьшение интенсивности симптомов заболевания, расстройства, или медицинского состояния, то есть исключение или вызывание ремиссии (ослабление симптома) заболевания, расстройства, или медицинского состояния, у пациента, включая противодействующие/нейтрализующие эффекты других терапевтических средств;
(с) подавление развития заболевания, расстройства, или медицинского состояния, то есть замедление или прекращение развития заболевания, расстройства, или медицинского состояния у пациента; или
(d) частичное снятие симптомов заболевания, расстройства, или медицинского состояния у пациента.
Следует отметить, что использованные в описании изобретения и в прилагаемых пунктах формулы, формы единственного числа могут включать ссылки на формы множественного числа, если контекст не предписывает ясно иное.
Способ наименования
Соединение 1 названо (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляная кислота в соответствии с соглашениями IUPAC, которые выполнены в программном обеспечении AutoNom, (MDL Information Systems, GmbH, Frankfurt, Germany). Бициклическая 1,2,3,4-тетрагидронафталин-2-иламиногруппа альтернативно известна под общим названием, «аминотетралин».
Кристаллические формы изобретения
В одном аспекте изобретение обеспечивает кристаллическую (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляную кислоту (1) в двух различающихся формах.
В одном аспекте кристаллическое соединение 1 в Форме I охарактеризовано посредством порошковой (XRPD) рентгенограммы, имеющей дифракционные максимумы пиков при значениях 2θ, составляющих 6,92±0,20 и 15,34±0,20, и два или более дифракционных максимума, включая три или более и четыре или более дифракционных максимума, при значениях 2θ, выбранных из 10,24±0,20, 11,48±0,20, 12,32±0,20, 13,46±0,20, 14,04±0,20, 17,30±0,20, 18,06±0,20, 20,30±0,20, 21,42±0,20, 23,48±0,20, 25,54±0,20, 26,96±0,20, 29,30±0,20 и 30,72±0,20. В частности, в этом аспекте Форма I охарактеризована посредством порошковой рентгенограммы, имеющей три или более дифракционных максимума, включая четыре или более дифракционных максимума, при значениях 2θ, выбранных из 6,92±0,20, 10,24±0,20, 13,46±0,20, 15,34±0,20, 18,06±0,20 и 21,42±0,20. Кристаллическая Форма I дополнительно охарактеризована посредством порошковой рентгенограммы, имеющей дифракционные максимумы пиков при значениях 2θ, составляющих 6,92±0,20, 10,24±0,20, 13,46±0,20, 15,34±0,20, 18,06±0,20 и 21,42±0,20.
Как хорошо известно в области рентгеновской порошковой дифрактометрии, положения максимумов пиков на порошковых рентгенограммах являются относительно менее чувствительными к нюансам эксперимента, таким как детали приготовления образца и геометрия измерительного прибора, чем относительные высоты максимумов. Таким образом, в одном аспекте Форма I кристаллического соединения 1 охарактеризована порошковой рентгенограммой, в которой положения максимумов в значительной мере соответствуют положениям максимумов, показанным на Фигуре 1.
Структура кристаллической Формы I дополнительно охарактеризована посредством рентгеноструктурного анализа с обеспечением следующих параметров решетки: элементарная ячейка является орторомбической с размерностями: а=7,546 Å, b=17,003 Å, с=20,628 Å, объем ячейки (V) составляет 2646,7 Å3; вычисленная плотность составляет 1,151 г/см3; группа симметрии кристаллической решетки представляет собой Р212121. Получающаяся в результате молекулярная структура подтверждает, что асимметричная элементарная ячейка не содержит молекул воды или молекул других растворителей и согласуется со стереохимией, которая обрисована выше. Расстояния связей С-О карбоксильной группы, а также длины связей и углы связей вокруг азота аминогруппы совпадают с соединением 1 в кристаллической Форме I, являющейся цвиттер-ионной молекулой, в которой протон перенесен от карбоксильной группы к азоту аминогруппы, что представлено схематично ниже:
Максимумы порошковой рентгенограммы, ожидаемые из полученных атомных положений, превосходно согласуются с наблюдаемой порошковой (XRPD) рентгенограммой.
В другом аспекте кристаллическая Форма I охарактеризована посредством ее поведения при подвергании воздействию высокой температуры. Как продемонстрировано на Фигуре 2, кривая, полученная методом дифференциальной сканирующей калориметрии (DSC), показывает пик в эндотермическом тепловом потоке, определяемый как фазовый переход кристалл-расплав, в диапазоне от приблизительно 162°С до приблизительно 170°С, в том числе от приблизительно 164°С до приблизительно 168°С. Кривая, полученная методом термогравиметрического анализа (TGA), показывает незначительную потерю массы при температурах ниже температуры плавления и профиль перехода, соответствующий потере 1 моль воды на моль соединения 1 при температуре около температуры плавления. Высвобождение воды может быть объяснено химической реакцией разложения.
Кристаллическая Форма I, как продемонстрировано, имеет обратимый профиль сорбция/десорбция с небольшой тенденцией к гигроскопичности. Форма I продемонстрировала увеличение массы, составляющее менее чем приблизительно 2,5% в диапазоне влажности 2%-90% относительной влажности при комнатной температуре, что показано на Фигуре 3. В частности, Форма I продемонстрировала увеличение массы, составляющее менее чем приблизительно 1% в диапазоне влажности 40%-75% относительной влажности, диапазоне влажности, в котором обычно изготавливают составы для перорального введения.
В другом аспекте изобретение обеспечивает соединение 1 в кристаллической Форме II. Кристаллическая Форма II определена посредством порошковой (XRPD) рентгенограммы, показанной на Фигуре 4, и с помощью профиля, полученного методом дифференциальной сканирующей калориметрии, показанного на Фигуре 5. В одном аспекте кристаллическая Форма II охарактеризована посредством порошковой (XRPD) рентгенограммы, имеющей дифракционные максимумы пиков при значениях 2θ, составляющих 9,05±0,20 и 16,52±0,20, и имеющей два или более дифракционных максимума, включая три или более и четыре или более дифракционных максимума, при значениях 2θ, выбранных из 9,80±0,20, 12,44±0,20, 12,92±0,20, 14,21±0,20, 15,62±0,20, 17,27±0,20, 19,04±0,20, 19,85±0,20, 21,29±0,20, 22,43±0,20, 23,48±0,20, 23,99±0,20 и 26,09±0,20. В частности в этом аспекте Форма II охарактеризована посредством порошковой рентгенограммы, имеющей два или более дифракционных максимума, включая три или более и четыре или более дифракционных максимума, при значениях 2θ, выбранных из 9,05±0,20, 9,80±0,20, 12,44±0,20, 12,92±0,20, 16,52±0,20, 23,99±0,20 и 26,09±0,20. Форма II также дополнительно охарактеризована посредством порошковой рентгенограммы, имеющей дифракционные максимумы пиков при значениях 2θ, составляющих 9,05±0,20, 9,80±0,20, 12,44±0,20, 12,92±0,20, 16,52±0,20, 23,99±0,20 и 26,09±0,20. В еще одном аспекте кристаллическая Форма II охарактеризована посредством порошковой рентгенограммы, в которой положения максимумов пиков в значительной мере соответствуют положениям максимумов пиков, показанным на Фигуре 4.
Термическое поведение, показанное на Фигуре 5, согласуется с определением кристаллической Формы II как метастабильной формы, которая подвергается превращению при температуре около 114°С-115°С и имеет температуру плавления, сопровождающегося химическим разложением, около 157°С.
В еще одном аспекте изобретение обеспечивает кристаллический гидрохлорид соединения 1.
В одном аспекте кристаллический гидрохлорид настоящего изобретения охарактеризован посредством порошковой (XRPD) рентгенограммы, имеющей два или более дифракционных максимума, включая три или более и четыре или более дифракционных максимума, при значениях 2θ, выбранных из 6,80±0,20, 9,80±0,20, 12,71±0,20, 13,31±0,20, 15,14±0,20, 19,97±0,20, 21,44±0,20, 22,64±0,20, 23,27±0,20, 24,44±0,20 и 25,37±0,20. В еще одном аспекте кристаллический гидрохлорид соединения 1 охарактеризован посредством порошковой рентгенограммы, в которой положения максимумов пиков в значительной мере соответствуют положениям максимумов пиков, показанным на Фигуре 6.
Кристаллический гидрохлорид также охарактеризован посредством кривой, полученной для нее методом дифференциальной сканирующей калориметрии (DSC), которая показывает первый максимум в эндотермическом тепловом потоке в диапазоне от приблизительно 185°С до приблизительно 193°, определяемый как фазовый переход кристалл-расплав, и второй максимум в диапазоне от приблизительно 220°С до приблизительно 140°С, который, как понимают, соответствует явлению разложения, что проиллюстрировано на Фигуре 7. Образцы кристаллического гидрохлорида, полученного в Примерах 8, 9 и 10, сохранили свой внешний вид и сыпучесть при подвергании воздействию относительной влажности в диапазоне от приблизительно 2% относительной влажности до приблизительно 90% относительной влажности при комнатной температуре.
Эти свойства кристаллических форм этого изобретения дополнительно проиллюстрированы в Примерах, которые следуют ниже.
Методики синтеза и промежуточные соединения
Соединение 1, (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляная кислота может быть получена из легко доступных исходных веществ в твердой аморфной форме с использованием методик, описанных в Примерах, приведенных ниже, или с использованием методик, описанных в принадлежащих одному и тому же правообладателю заявках США, приведенных в разделе 'Предпосылки Создания Изобретения' этой заявки.
В одном способе получения кристаллическую Форму I изобретения получают растворением аморфного соединения 1 в полярном разбавителе с образованием технологической смеси для кристаллизации и выдерживанием технологической смеси в течение от приблизительно 12 часов до приблизительно 4 дней. Обычно процесс кристаллизации проводят при температуре, приблизительно равной температуре окружающей среды. Подходящие разбавители включают метанол, изопропанол, 1-пропанол и ацетонитрил и смеси одного или более разбавителей из предыдущих разбавителей с водой. Типичные иллюстративные системы разбавителей включают смесь ацетонитрила, метанола и воды, например, состоящую из приблизительно 69% ацетонитрила, приблизительно 21% метанола и приблизительно 10% воды; смесь 1-пропанола, ацетонитрила, и воды, в частности, состоящую из от приблизительно 95% до приблизительно 97% (1-пропанол:ацетонитрил (2:1)) и от приблизительно 5% до приблизительно 3% воды; смесь метанола и воды, например, состоящую из приблизительно 90% метанола и приблизительно 10% воды; и смесь ацетонитрила и воды, например, состоящую из приблизительно 84% ацетонитрила и приблизительно 16% воды. Соединение 1 обычно присутствует в технологической смеси в концентрации от приблизительно 150 мг/мл до приблизительно 700 мг/мл.
В том случае, когда в системе разбавителей вода не присутствует, полезно выдерживать технологическую смесь в течение периода времени на верхней границе установленного диапазона (Смотри, Пример 4 ниже, где кристаллизации дают протекать в течение 4 дней). Следовательно, полезный способ получения кристаллической Формы I включает растворение соединения 1 в разбавителе, содержащем полярный разбавитель и от приблизительно 3% до приблизительно 20% воды с образованием технологической смеси; выдерживание технологической смеси в течение, по меньшей мере, приблизительно 12 часов; и извлечение (выделение) получающихся в результате кристаллов.
По завершении реакции кристаллическую Форму I выделяют из технологической смеси с использованием традиционного средства, такого как фильтрация, концентрирование, центрифугирование и тому подобное.
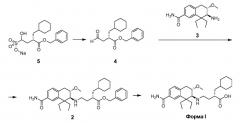
В другом способе получения кристаллическую Форму I преимущественно получают непосредственно из имеющего защитные группы вещества-предшественника 2 соединения 1 в соответствии со следующей схемой процесса:
Как обобщено в Схеме А, имеющий бензильные защитные группы альдегид 4 подвергают реакции с аминотетралиновым промежуточным соединением 3 с получением вещества-предшественника 2, имеющего бензильные защитные группы, с которого снимают защитные группы с получением соединения 1 в кристаллической Форме I. Альдегидный реагент 4 традиционно получают in situ из соответствующего бисульфитного аддукта 5.
В типичном процессе раствор с между приблизительно 1 и приблизительно 1,5 эквивалентами альдегида 4 в инертном разбавителе получают путем обработки бисульфитного аддукта 5 равным количеством эквивалентов гидроксида натрия. Альдегид 4 затем приводят в контакт с аминотетралином 3 и с между приблизительно 1 и приблизительно 3 эквивалентами восстанавливающего вещества, такого как триацетоксиборгидрид натрия. Аминотетралин 3 может быть получен в виде соли кислоты, обычно гидрохлорида. Реакцию обычно проводят при температуре приблизительно между 0°С и приблизительно 30°С в течение между приблизительно 2 и приблизительно 24 часами или до тех пор, пока реакция по существу не завершится. Имеющее защитные группы промежуточное соединение 2 обычно выделяют в твердой форме в виде кристаллического гидрохлорида.
Наконец, промежуточное соединение 2 дебензилируют посредством каталитического гидрогенолиза, обычно с использованием катализатора на основе переходного металла, например палладия или платины, с получением кристаллической Формы II. В том случае, когда промежуточное соединение 2 получают в солевой форме, сначала посредством обработки основанием получают in situ нейтральную форму промежуточного соединения. Реакцию проводят в разбавителе, выбранном так, чтобы он отвечал требованиям гидрогенолиза и приводил к кристаллизации. Смеси, содержащие воду и другой полярный разбавитель, такой как метанол, изопропанол, 1-пропанол, ацетонитрил и/или диметилформамид, являются подходящими для этой реакции. Смеси, содержащие от приблизительно 10% до приблизительно 20% воды, например смесь ацетонитрила и от приблизительно 10% до приблизительно 20% воды, преимущественно используют в реакции дебензилирования. Продукт реакции, кристаллическая Форма I, может быть выделена традиционным способом, таким как фильтрация.
В связи с вышеизложенным в аспекте, касающемся способа, среди прочих способов изобретение обеспечивает способ получения кристаллической Формы I соединения 1, включающий снятие защитных групп с промежуточного соединения 2, имеющего бензильные защитные группы, каталитическим гидрогенолизом в присутствии полярного разбавителя, содержащего от приблизительно 10% до приблизительно 20% воды, с получением кристаллической Формы I.
В дополнительном аспекте способа изобретение обеспечивает способ получения кристаллической Формы I соединения 1, включающий (а) взаимодействие имеющего защитные группы альдегида 4 с аминотетралином 3 с получением имеющего защитные группы промежуточного соединения 2, и (b) снятие защитных групп с промежуточного соединения 2, имеющего бензильные защитные группы, каталитическим гидрогенолизом в присутствии полярного разбавителя, содержащего от приблизительно 10% до приблизительно 20% воды, с получением кристаллической Формы I.
Снятие защитных групп с промежуточного соединения 2 в разбавителе, который отвечает условиям гидрогенолиза, но не способствует кристаллизации, в таком как этилацетат, тетрагидрофуран или метил-тетрагидрофуран, приводит к получению соединения 1, хоть и необязательно в кристаллической форме. В еще одном аспекте, касающемся способа, изобретение обеспечивает способ получения соединения 1, включающий (а) взаимодействие имеющего защитные группы альдегида 4 с аминотетралином 3 с получением имеющего защитные группы промежуточного соединения 2, и (b) снятие защитных групп с промежуточного соединения 2, имеющего бензильные защитные группы, каталитическим гидрогенолизом с получением соединения 1.
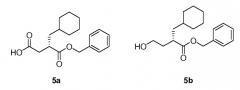
Кроме того, в аспекте, касающемся композиции, изобретение обеспечивает имеющий защитные группы альдегид 4, бензиловый сложный эфир (S)-2-циклогексилметил-4-оксо-масляной кислоты и бисульфитный аддукт 5, (S)-3-бензилоксикарбонил-4-циклогексил-1-гидрокси-бутан-1-сульфонат натрия, полезные в получении соединения 1. Как описано в разделе 'Получение 8', имеющий бензильные защитные группы бисульфитный аддукт 5 может быть получен из метилового сложноэфирного бисульфита, (S)-4-циклогексил-1-гидрокси-3-метоксикарбонил-бутан-1-сульфоната натрия, синтез которого описан в разделе 'Получение 7'. Альтернативно бисульфитный аддукт 5 мог быть получен способами, аналогичными способам, описанным в разделе 'Получение 7', через аналогичные имеющие бензильные защитные группы промежуточные соединения на основе карбоновой кислоты (5а) и спирта (5b):
В еще одном аспекте, касающемся композиции, изобретение обеспечивает имеющее бензильные защитные группы вещество-предшественник 2, бензиловый сложный эфир (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-циклогексилметил-масляной кислоты и его гидрохлорид. Кристаллический гидрохлорид соединения охарактеризован посредством порошковой (XRPD) рентгенограммы, показанной на Фигуре 8, и посредством профиля, полученного с помощью дифференциальной сканирующей калориметрии (DSC), показанного на Фигуре 9, который имеет максимум в эндотермическом тепловом потоке, совпадающий с температурой плавления, при температуре от приблизительно 205°С до приблизительно 210°С. Фармацевтические промежуточные соединения в кристаллической форме являются желательными как в связи с обычным очищением, которое происходит в результате кристаллизации, так и по причине ожидаемой большей стабильности при хранении по сравнению с некристаллическим материалом.
Как описано в Примерах, которые следуют ниже, кристаллическую Форму II получают путем растворения аморфного соединения 1 в полярном разбавителе, состоящем из спирта, например из изопропанола или из изопропанола и ацетонитрила, при концентрации от приблизительно 150 мг/мл до приблизительно 700 мг/мл с образованием технологической смеси кристаллизации и путем выдерживания технологической смеси в течение менее приблизительно одного дня. Необязательно, для содействия кристаллизации из раствора перед периодом выдерживания в технологическую смесь может быть добавлен антирастворитель, например смесь ацетонитрил: этилацетат (1:1).
Кристаллический гидрохлорид настоящего изобретения преимущественно получают из аморфного гидрохлорида соединения 1. Аморфную соль соединения 1 диспергируют в умеренно полярном растворителе, таком как этилацетат или диметиловый эфир диэтиленгликоля, при концентрации от приблизительно 20 мг/мл до приблизительно 350 мг/мл, необязательно при нагревании с последующим медленным охлаждением и затем выдерживают в течение периода от приблизительно 3 дней до приблизительно 12 дней. Получающиеся в результате кристаллы могут быть выделены общепринятым способом.
Фармацевтические композиции
Кристаллические твердые формы изобретения обычно вводят пациенту в форме фармацевтической композиции или состава. Такие фармацевтические композиции могут быть введены пациенту любым приемлемым путем введения, включающим пероральный, ректальный, вагинальный, назальный, ингаляционный, местный (в том числе трансдермальный) и парентеральный способы введения, но не ограниченного этим.
В связи с вышеизложенным в одном из аспектов, касающихся его композиций, изобретение направлено на фармацевтическую композицию, содержащую фармацевтически приемлемый носитель или эксципиент и терапевтически эффективное количество кристаллической твердой формы соединения 1 или кристаллического гидрохлорида соединения 1. Необязательно, такие фармацевтические композиции могут содержать другое терапевтическое средство и/или вещества, содействующие приготовлению состава, если это желательно. Когда рассматривают композиции, понятно, что термин «твердая форма изобретения» включает кристаллические Формы I и II соединения 1, а также кристаллический гидрохлорид соединения 1.
Фармацевтические композиции изобретения обычно содержат терапевтически эффективное количество активного вещества. Однако специалистам в данной области будет ясно, что фармацевтическая композиция может содержать активное вещество в количестве, большем, чем терапевтически эффективное количество, то есть может представлять собой балк-композицию в многодозовой упаковке или может содержать активное вещество в количестве, меньшем, чем терапевтически эффективное количество, то есть может представлять собой отдельные унифицированные дозы для многократного введения для достижения терапевтически эффективного количества.
Обычно такие фармацевтические композиции содержат от приблизительно 0,1% до приблизительно 95% по массе активного вещества; предпочтительно от приблизительно 5 до приблизительно 70% по массе и более предпочтительно от приблизительно 10 до приблизительно 60% по массе активного вещества.
Любой традиционный носитель или эксципиент может быть использован в фармацевтических композициях изобретения. Выбор конкретного носителя или эксципиента или комбинаций носителей или эксципиентов, будут зависеть от способа введения, используемого для лечения конкретного пациента, или от типа медицинского состояния, или от стадии заболевания. В этом отношении приготовление подходящей фармацевтической композиции для конкретного способа введения хорошо входит в компетенцию специалистов в фармацевтической области. Кроме того, носители или эксципиенты, используемые в фармацевтических композициях этого изобретения, являются коммерчески доступными. В целях дополнительной иллюстрации общепринятые методы приготовления составов описаны в публикации: Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, Maryland (2000); and H.C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Edition, Lippincott Williams & White, Baltimore, Maryland (1999).
Репрезентативные примеры веществ, которые могут быть использованы в качестве фармацевтически приемлемых носителей, включают следующее: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу, такую как микрокристаллическая целлюлоза и ее производные, например карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетатцеллюлозы; порошковую трагакантовую камедь; ржаной солод; желатин; тальк; эксципиенты, такие как масло какао и воски для основы суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннитол и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический раствор; раствор Рингера; этиловый спирт; фосфатно-буферные растворы; и другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях, но не ограничиваются этим.
Фармацевтические композиции обычно получают путем тщательного и равномерного смешения или смешивания активного вещества с фармацевтически приемлемым носителем и одним или более необязательными ингредиентами. Получающейся в результате равномерного смешения смеси затем может быть придана форма таблеток, капсул, пилюль и тому подобного, или она может быть введена в таблетки, капсулы, пилюли и тому подобное с использованием общепринятых методик и оборудования.
Фармацевтические композиции изобретения предпочтительно расфасовывают в виде стандартных лекарственных форм. Термин «стандартная лекарственная форма» относится к физически дискретной единице, подходящей для введения пациенту активного вещества определенными дозами, как такового или в комбинации с одной или более дополнительными единицами, где каждая единица содержит заданное количество активного вещества, вычисленное для получения желательного терапевтического эффекта. Например, такие стандартные лекарственные формы могут представлять собой капсулы, таблетки, пилюли и тому подобное или упаковки, содержащие лекарственное средство в дозах на один прием, подходящие для парентерального введения.
В одном варианте осуществления фармацевтические композиции изобретения подходят для перорального введения. Подходящие фармацевтические композиции для перорального введения могут находиться в форме капсул, таблеток, пилюль, лекарственных леденцов, крахмальных капсул, драже, порошков, гранул; или в виде раствора или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии типа 'масло-в-воде' или 'вода-в-масле'; или в виде эликсира или сиропа и тому подобного; где каждая форма содержит заданное количество соединения настоящего изобретения в качестве активного ингредиента.
В том случае, когда предназначены для перорального введения в твердой лекарственной форме (то есть в форме капсул, таблеток, пилюль и тому подобного), фармацевтические композиции изобретения обычно будут содержать активное вещество и один или более фармацевтически приемлемых носителей, таких как цитрат натрия или дикальцийфосфат. Необязательно или альтернативно, такие твердые лекарственные формы также могу