Энантиоселективный синтез производных гамма-амино-альфа, бета-ненасыщенных карбоновых кислот
Иллюстрации
Показать всеИзобретение относится к способу энантиоселективного аллильного аминирования производных α,β-ненасыщенных карбоновых кислот с получением энантиомерно обогащенных производных, описываемых формулами II, III, VII и VIII. Способ осуществляют путем взаимодействия рацемической смеси производного карбоновой кислоты с хиральным лигандом на катализаторе [Pd(аллил)Cl]2 в присутствии нуклеофильного реагента, выбранного из фталимида калия или амина формулы R1R2NH, где R1 представляет собой бензильную, н-бутильную или циклогексильную группу, R2 представляет собой водород или бензильную группу. Технический результат - энантиоселективное катализируемое палладием аллильное аминирование производных α,β-ненасыщенных карбоновых кислот с получением продуктов с увеличенным энантиомерным избытком. 2 н. и 8 з.п. ф-лы, 6 ил., 3 табл., 48 пр.
Реферат
Настоящее изобретение относится к проводимому при катализе палладием энантиоселективному способу получения производных γ-амино-α,β-ненасыщенных карбоновых кислот и промежуточных продуктов, а также производных γ-аминокислот.
Уровень техники
Рацемические варианты получения производных γ-амино-α,β-ненасыщенных карбоновых кислот и их α-замещенных аналогов с помощью катализируемого палладием аллильного аминирования описаны в публикации Tanikaga et al., J. Chem. Soc., Chem. Commun., p.386-387 (1987). В способе, описанном в публикации Tanikaga et al., используют субстраты, содержащие классические отщепляющиеся группы, такие как хлорацетаты и карбонаты, и получают рацемические продукты.
В публикации Mellegaard-Waetzig, et al., Synlett, p.2759-2762 (2005) описано аллильное замещение карбаматными отщепляющимися группами, в котором карбаматная отщепляющаяся группа также является источником амина. Однако до настоящего изобретения не была известна методика энантиоселективного катализируемого палладием аллильного аминирования производных α,β-ненасыщенных карбоновых кислот.
Краткое изложение сущности изобретения
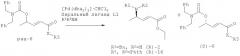
Настоящее изобретение относится к способу катализируемого палладием энантиоселективного аллильного аминирования производных α,β-ненасыщенных карбоновых кислот. В одном объекте настоящего изобретения способ включает реакцию рацемической смеси производного карбоновой кислоты, описывающегося структурной формулой I:
с хиральным лигандом и палладиевым катализатором в присутствии нуклеофильного реагента с получением энантиомерно обогащенных производных α,β-ненасыщенных карбоновых кислот, описывающихся формулой II и III:
причем в формуле I, II и III R1 обозначает бензильную группу, н-бутильную группу или циклогексильную группу; R2 обозначает бензильную группу или водород; XR3 обозначает этоксигруппу, амидную группу или трет-бутоксигруппу. В формуле II NR1R2 также могут образовать фталимидный заместитель.
Другим объектом настоящего изобретения является катализируемого палладием энантиоселективного аллильного аминирования производных α,β-ненасыщенных карбоновых кислот, указанный способ включает реакцию рацемической смеси производного карбоновой кислоты, описывающегося формулой VI
с хиральным лигандом и палладиевым катализатором в присутствии нуклеофильного реагента с получением энантиомерно обогащенных производных α,β-ненасыщенных карбоновых кислот, описывающихся формулой VII и VIII:
причем в формуле VI и VII R2 обозначает алкильную группу и в формуле VIII R1 обозначает бензильную группу или ПМФ (ПМФ=4-метоксифенил). Предпочтительно, если R2 обозначает этильную или метильную группу.
Образовавшийся аллиламин и непрореагировавший карбамат можно разделить с получением чистых соединений.
В литературе описаны многочисленные методики восстановления двойной связи производных α,β-ненасыщенных карбоновых кислот. Поэтому продукты, предлагаемые в настоящем изобретении, можно легко превратить в соответствующие производные γ-аминокислот путем восстановления двойной связи.
Подробное описание изобретения
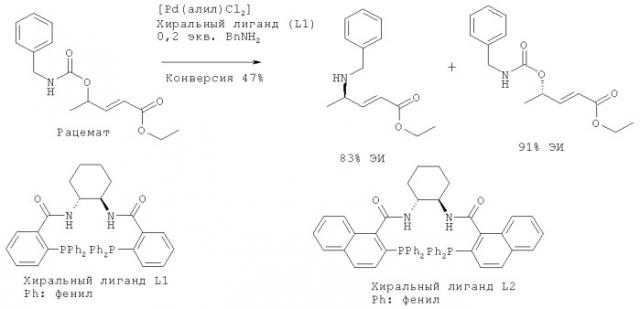
В контексте настоящего изобретения катализируемое палладием энантиоселективное аллильное аминирование производных α,β-ненасыщенных карбоновых кислот включает субстраты с карбаматными отщепляющимися группами, в которых карбаматная отщепляющаяся группа также является источником амина, приводит к увеличенному энантиомерному избытку продуктов, как показано на схеме I.
Таким образом, настоящее изобретение относится к энантиоселективному способу получения производных γ-амино-α,β-ненасыщенных карбоновых кислот и промежуточных продуктов, а также производных γ-аминокислот.
Схема 1
Примечательно, что непрореагировавшее исходное вещество характеризуется сходным энантиомерным избытком при степени превращения, доставляющей примерно 50%, что указывает на кинетическое оптическое расщепление. Эксперименты, которые были проведены при степени превращения >90% и с получением почти рацемических продуктов, подтверждают наличие кинетического оптического расщепления.
При разработке настоящего изобретения эксперименты по аллильному аминированию с использованием субстратов, содержащих классические отщепляющиеся группы, таких как хлорацетаты и карбонаты, привели к получению продуктов со средним энантиомерным избытком. В случае карбонатных отщепляющихся групп, как показано на схеме 2, наблюдается образование соответствующего карбамата в качестве побочного продукта. Карбаматный побочный продукт характеризуется наибольшим энантиомерными избытками в смеси продукт/побочный продукт/исходное вещество.
Схема 2
В контексте настоящего изобретения улучшенные энантиоселективности обеспечиваются при использовании карбаматов в качестве отщепляющихся групп, как показано на схеме 3 и в таблице 1. Энантиоселективности, приведенные в таблице 1, рассчитаны по отношениям содержаний отдельных энантиомеров в реакционных смесях (ВЭЖХ).
Схема 3
| Таблица 1 | |||||||||
| Субст-рат | Продукт | R1 | R2 | XR3 | Экв. R1R2NH | T/°C | C/% | ЭИS a)/% | ЭИP a)/% |
| 3 | 2 | Bn | H | OEt | 0,2 | 25 | 47 | 91(S) | 83(R) |
| 4 | 10 | nBu | H | OEt | 2,0 | 25 | 52 | 85(S) | 80(R) |
| 5 | 11 | Су | H | OEt | 0,2 | 40 | 57 | >96(S) | 74(R) |
| 6 | 12 | Bn | Bn | OEt | 2,0 | 25 | 51 | 90(S) | 72(R) |
| 7 | 13 | Bn | H | OtBu | 0,2 | 25 | 50 | 91(A) | 76(R) |
| 8 | 14 | Bn | H | N(H)Et | 0,2 | 25 | 50 | 76 | 68 |
| 9 | 15 | Bn | H | NEt2 | 1,0 | 25 | 42 | - | 38 |
| Bn = бензил, nBu = н-бутил, Bu = трет-бутил, C = степень превращения. Cy = циклогексил, ЭИS a) = энантиомерный избыток субстрата, ЭИP = энантиомерный избыток продукта, Et = этил, T = температура, а) Абсолютные конфигурации соединений 2, 3 и 12 определены путем сопоставления с энантиомерно чистыми соединениями. Другие установлены по аналогичной схеме. |
Наибольшие энантиоселективности обеспечиваются при использовании рац-6 в качестве субстрата и бензиламина или фталимида калия (KPhTh) в качестве нуклеофильного реагента. Эти нуклеофильные реагенты взаимодействуют намного быстрее, чем образовавшийся in situ дибензиламин, и в обоих случаях образуются лишь небольшие количества (<4%) замещенного дибензиламином побочного продукта 12 (схема 4, таблица 2).
Схема 4
| Таблица 2 | ||||||
| Продукт | R1R2NH (экв.) | Растворитель | Добавка | C/% | ЭИS a)/% | ЭИP a)/% |
| 2 | BnNH2 | CH2Cl2 | ||||
| (2,0) | - | 39 | 81 | 84 | ||
| 16 | KPhthb) (1,0) | CH2Cl2:H2O9:1 | 18-краун-6эфир (50 мол.%) | 50 | 80 | 89 |
| a) Абсолютная конфигурация 2 определена путем сопоставления с энантиомерно соединениями. Другие установлены по аналогичной схеме. | ||||||
| b) KPhth: фталимид калия |
Превращение карбаматов сильно зависит от состава палладиевого катализатора: при использовании [Pd(аллил)Cl]2 один из энантиомеров промежуточного карбамата предпочтительно превращается непосредственно в соответствующий аллиламин, а другой энантиомер остается в основном неизмененным. В этом случае карбаматный фрагмент одновременно выступает и в качестве отщепляющейся группы, и в качестве источника амина и получают смесь аллиламина и соответствующего, непрореагировавшего карбамата (схема 3). Однако с использованием [Pd2(dba)3]-CHCl3 в качестве источника палладия превращение карбаматов в амины не происходит. При использовании карбонатов в качестве отщепляющихся групп с этим источником катализатора и хиральным лигандом L1 наблюдается предпочтительное превращение одного энантиомера субстрата в соответствующий карбамат, а другой энантиомер субстрата остается в основном неизмененным (схема 5). Абсолютные конфигурации соединений 1 и 3 определены путем сопоставления с энантиомерно чистыми соединениями.
Схема 5
Эти результаты представляют собой первое катализируемое палладием энантиоселективное превращение аллилкарбоната в соответствующий аллилкарбамат.
Введение α-метильного заместителя снижает реакционную способность субстратов. Отщепляющиеся группы, такие как ацетаты, карбонаты и карбаматы, не вступают в реакцию. Искомый продукт замещения получают только при использовании более реакционноспособной фосфатной отщепляющейся группы (схема 6).
Схема 6
| Таблица 3 | |||||
| Продукт | R | Экв. RNH2 | С/% | ЭИS/% | ЭИP/% |
| 18 | Bn | 2 | 57 | 43 | 43 |
| 19 | ПМФ | 1 | 56 | 48 | 43 |
ПМФ: 4-Метоксифенил
В контексте настоящего изобретения энантиомерный избыток производных γ-амино-α,β-ненасыщенных карбоновых кислот и промежуточных продуктов обеспечивается с помощью реакции, представленной на схеме 3, и субстратов, приведенных в таблице 1.
Примеры субстратов, пригодных для практического осуществления способов, предлагаемых в настоящем изобретении, включают, например, рац-этил-(2E)-4-(бензиламинокарбонилокси)пент-2-еноат, рац-этил-(2E)-4-(бутиламинокарбонилокси)пент-2-еноат, рац-этил-(2E)-4-(циклогексиламинокарбонилокси)пент-2-еноат, рац-этил-(2Е)-4-(дибензиламинокарбонилокси)пент-2-еноат и рац-трет-бутил-(2E)-4-(бензиламинокарбонилокси)пент-2-еноат, приведенные в качестве субстратов 3-7 соответственно в столбце 1 таблицы 1. В качестве субстрата предпочтительно используют рац-6 (рац-этил-(2Е)-4-(дибензиламинокарбонилокси)пент-2-еноат).
Также в контексте настоящего изобретения энантиомерное обогащение производных γ-амино-α,β-ненасыщенных карбоновых кислот и промежуточных продуктов обеспечивается по реакции, представленной на схеме 6, и с использованием субстратов, приведенных в таблице 3, с учетом того, что субстратом, представленным на схеме 6, может быть любая альфа-алкилзамещенная карбоновая кислота. При использовании в настоящем описании алкил, если специально не указано иное, означает обладающий линейной или разветвленной цепью алкил, содержащий от 1 до 4 атомов углерода, такой как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил. Предпочтительно, если алкильным заместителем является метил или этил.
"Энантиомерно обогащенное" означает производное карбоновой кислоты, которое всегда содержит от не менее примерно 40% до не менее примерно 96% одного энантиомера этого производного карбоновой кислоты. Например, энантиомерно обогащенный может означать, что один энантиомер конкретного производного составляет не менее примерно 40%, не менее примерно 43%, не менее примерно 45%, не менее примерно 48%, не менее примерно 50%, не менее примерно 65%, не менее примерно 70%, не менее примерно 72%, не менее примерно 74%, не менее примерно 76%, не менее примерно 80%, не менее примерно 82%, не менее примерно 84%, не менее примерно 85%, не менее примерно 89%, не менее примерно 90%, не менее примерно 91%, не менее примерно 93%, не менее примерно 95% или не менее примерно 96% в пересчете на энантиомеры производного карбоновой кислоты.
При использовании в настоящем изобретении термин "энантиоселективная" означает химическую реакцию, которая приводит к предпочтительному образованию одного энантиомера по сравнению с другим энантиомером, например, дает продукт, в котором искомый энантиомер содержится в количестве, составляющем от не менее примерно 40% до не менее примерно 96%. Например, энантиоселективная может означать реакцию, которая дает продукт, в котором искомый энантиомер содержится в количестве, составляющем не менее примерно 40%, не менее примерно 43%, не менее примерно 45%, не менее примерно 48%, не менее примерно 50%, не менее примерно 65%, не менее примерно 70%, не менее примерно 72%, не менее примерно 74%, не менее примерно 76%, не менее примерно 80%, не менее примерно 82%, не менее примерно 84%, не менее примерно 85%, не менее примерно 89%, не менее примерно 90%, не менее примерно 91%, не менее примерно 93%, не менее примерно 95% или не менее примерно 96%.
Примеры нуклеофильных реагентов, пригодных для практического осуществления способов, предлагаемых в настоящем изобретении, включают, например, бензиламин, н-бутиламин, циклогексиламин, дибензиламин и фталимид калия. В качестве нуклеофильного реагента предпочтительно используют бензиламин или фталимид калия. Предпочтительные нуклеофильные реагенты взаимодействуют намного быстрее с использованием рац-6, чем с использованием образовавшегося in situ дибензиламина и в обоих случаях образуются лишь небольшие количества (<4%) замещенного дибензиламином побочного продукта 12 (рац-этил-(2E)-N,N-дибензил-4-аминопент-2-еноата), как показано на схеме IV и в таблице II.
Примеры хиральных лигандов, пригодных для практического осуществления способов, предлагаемых в настоящем изобретении, включают любые хиральные лиганды, использующиеся в литературе для катализируемой палладием реакции аллильного замещения. В способах, предлагаемых в настоящем изобретении, предпочтительно используют хиральный лиганд L1, описывающийся структурной формулой:
или хиральный лиганд L2, описывающийся структурной формулой:
Примеры палладиевых катализаторов, которые можно использовать в контексте настоящего изобретения, включают, например, [Pd2(dba)3]·CHCl3. Предпочтительно палладиевым катализатором является [Pd(аллил)Cl]2. Например, при использовании [Pd(аллил)Cl]2 один энантиомер промежуточного карбамата предпочтительно превращается непосредственно в соответствующий аллиламин, тогда как другой энантиомер остается в основном неизмененным. В этом случае карбаматный фрагмент одновременно выступает и в качестве отщепляющейся группы, и в качестве источника амина и получают смесь аллиламина и соответствующего непрореагировавшего карбамата, как показано на схеме 3. Образовавшийся аллиламин и непрореагировавший карбамат легко разделяются с помощью хроматографии на силикагеле с получением чистых соединений.
Примеры диапазонов температуры, пригодных для практического осуществления способов, предлагаемых в настоящем изобретении, включают составляющие от примерно 25 до примерно 40°С. Предпочтительно, если температура реакции превращения 3 (рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноата) в 2 (рац-этил-(2Е)-N-бензил-4-аминопент-2-еноат) равна 25°С. Температура реакции превращения 4 (рац-этил-(2Е)-4-(бутиламинокарбонилокси)пент-2-еноата) в (рац-этил-(2E)-N-бутил-4-аминопент-2-еноат) предпочтительно равна 25°С. Предпочтительно, если температура реакции 5 (рац-этил-(2E)-4-(циклогексиламинокарбонилокси)пент-2-еноат)-с образованием 11 (рац-этил-(2E)-N-циклогексил-4-аминопент-2-еноата) равна 40°С. Реакцию 6 (рац-этил-(2E)-4-(дибензиламинокарбонилокси)пент-2-еноата) с образованием 12 (рац-этил-(2E)-N,N-дибензил-4-аминопент-2-еноата) предпочтительно проводят при 25°С. Предпочтительно, если температура реакции 7 (рац-трет-бутил-(2E)-4-(бензиламинокарбонилокси)пент-2-еноата) с образованием 13 (рац-трет-бутил-(2E)-N-бензил-4-аминопент-2-еноата) равна 25°С.
Ниже в качестве примера приведено неограничивающее описание.
ПРИМЕР 1
Общая методика синтеза субстратов, включая субстраты 3-5 и 7-9, приведенная на схеме III и в таблице I, включает растворение соответствующего спирта (например, (рац-этил-(2Е)-4-гидроксипент-2-еноата), соединение 21) и изоцианата в толуоле и перемешивания реакционной смеси при кипячении с обратным холодильником до полного превращения спирта. Затем реакционную смесь выпаривают при пониженном давлении при температуре около 40°С и дополнительно очищают, например, с помощью флэш-хроматографии или перекристаллизации.
ПРИМЕР 2
Общая методика синтеза продуктов рацемического аллильного аминирования, включая продукты рацемического аллильного аминирования 2 и 10-15, приведенные на схеме III и в таблице I, включает растворение [Pd2((dba)3]·CHCl3 и PPh3 в соотношении, составляющем примерно от 1:4 до 1:5, в дегазированном растворителе и перемешивание реакционной смеси при температуре реакции, указанной в таблице 1, в течение примерно 10-30 мин. Затем добавляют субстрат и амин и реакционную смесь перемешивают, пока исходное вещество полностью не подвергнется превращению. Затем реакционную смесь предпочтительно фильтруют через SiO2 с использованием tBuOMe и очищают с помощью хроматографии.
ПРИМЕР 3
Общая методика синтеза (R)-2, (R)-10-13 и соединений 14, 15, 18, 19 представлена на схеме III и в таблице 1.
В сосуд, такой как пробирка Шленка, помещают [Pd] (8 мол.%) и лиганд (12 мол.%), если не указано иное. Затем в приборе создают атмосферу инертного газа, такого как аргон (три цикла откачка/заполнение аргоном). Катализатор растворяют в CH2Cl2 (1,25 мл) при перемешивании (в течение не менее 10 мин). Затем микролитровым шприцем (Hamilton Gaslight, воздух удален) добавляют внутренний стандарт (аббревиатура: ВС, фенилгексан nHexPh ~ 15 мкл или дифениловый эфир Ph2O ~ 11 мкл) и субстрат (0,125 ммоля) и отбирают образец. При использовании бифенила (PhPh) в качестве ВС (~14 мг) и твердых или вязких субстратов их добавляют вместе с предварительным катализатором и лигандом. После добавления смеси амин/нуклеофильный реагент можно отбирать следующие образцы.
Приготовление образцов:
SP1: Образец реакционной смеси (20 мкл) фильтруют через SiO2 (0,1 г, кондиционирован с помощью 1 мл н-гексана) с использованием tВuОМе (1 мл). Для определения степени превращения фильтрат анализируют с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) (LC). Для определения энантиомерного избытка растворитель выпаривают в токе n2 и смесь растворяют в элюенте для соответствующей методики ВЭЖХ (CLC).
SP2: Вариант SP1; SiO2 кондиционируют с помощью 25 мкл Et3N и 1 мл н-гексана.
SP3: Вариант SP1: Фильтрование с использованием ТГФ (тетрагидрофуран) (1 мл, нестабилизированный, пероксиды удаляют фильтрованием через Al2O3)
SP4: Вариант SP3: SiO2 кондиционируют с помощью 25 мкл Et3N и 1 мл н-гексан.
Методики ВЭЖХ:
Колонка: Supeico Hypersil MOS-2 3 мкм, 100×4,6 мм. Скорость потока: 1,5 мл/мин-1. Температура колонки: 40°С. Длина волны детектирования: 210 нм.
LC1: Элюенты: 0,01 М (NH4)2HPO4, MeCN; 30%→80% (16 мин), 80%→30% (1 мин), 30% (2 мин)
LC2: Элюенты: 0,01 М KH2PO4, MeCN; 30%→80% (16 мин), 80%→30% (1 мин), 30% (2 мин)
Времена удерживания t приведены в минутах. Времена удерживания для ВС в случае LC1 и LC2: t(PhPh)=8,6, t(Ph20)=8,7, t(nHexPh)=12,8
Методики разделения с помощью хиральной ВЭЖХ:
Ниже приведены составы элюентов в объемных отношениях. Отношения для элюирование в градиентном режиме указаны для органических растворителей. Времена удерживания t приведены в минутах.
CLC1: н-гексан:МеОН 97,5:2,5
CLC2: н-гексан:МеОН:iPrOH 99:0,5:0,5
CLC3: н-гексан:МеОН:iPrOH 98,75:0,75:0,5
CLC4: H-гексан:tPrOH:MeOH:Et2NH 93:5:2:0,01
CLC5: н-гексан:МеОН 99,5:0,5
CLC6: 30°С; Элюенты: значение pH 0,01 М раствора K2HPO4 доводят до 6,5 с помощью H3PO4, МеОН; 60%→84% (30 мин), 84% (5 мин), 84%→60% (5 мин), 60% (10 мин)
CLC7: 40°С; Элюенты: значение pH 0,01 М раствора K2HPO4 доводят до 6,5 с помощью Н3РO4, МеОН; 60%→88% (35 мин), 88% (10 мин), 88%→60% (5 мин), 60% (10 мин)
CLC1-5: Колонка: Chiralpak AD-H, 4,6×250 мм с форколонкой 4,6×10 мм. Скорость потока: 1,0 мл/мин. Температура колонки: 30°С. Длина волны детектирования: 210 нм.
CLC6/7: Колонка: Chiralpak AD-RH, 4,6×150 мм. Скорость потока: 0,5 мл/мин-1. Длина волны детектирования: 210 нм.
ПРИМЕР 4
Получение рац-этил-(2E)-4-(метоксикарбонилокси)пент-2-еноата (1)
Рац-этил-(2Е)-4-гидроксипент-2-еноат (21) (10,09 г, 70 ммолей), ДМАП (4-N,N-диметиламинопиридин) (1,71 г, 14 ммолей) и пиридин (17 мл, 210 ммолей) растворяют в ТГФ (400 мл). Раствор охлаждают до 1°С. Затем в течение 3 ч при перемешивании при 1°С по каплям добавляют метилхлорформиат (16,1 мл, 210 ммолей) в ТГФ (50 мл). Через 2 ч четырьмя порциями по каплям добавляют метилхлорформиат (199 мл, 2,50 моля) в ТГФ (150 мл). После добавления каждой порции реакционную смесь перемешивают в течение 5 ч при 1°С. Реакцию останавливают с помощью 10% HCl (0,5 л) и экстрагируют с помощью tBuOMe (1,5 и 0,5 л). Органические фазы промывают с помощью 10% HCl (0,5 л) насыщенным раствором NaHCO3 (0,3 л) и рассолом (2×0,2 л) последовательно. Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (tBuOMe:ракция гептана от 15:85 до 25:75) и получают 1 (рац-этил-(2Е)-4-(метоксикарбонилокси)пент-2-еноат) (8,64 г, 61%) в виде желтоватого масла.
Rf(tBuOMe: фракция гептана 40:60)=0,40.
1Н-ЯМР (300 МГц, CDCl3): δ 1,29 (t, 3Н, J=7,2 Гц), 1,43 (d, 3H, J=6,8 Гц), 3,80 (s, 3Н), 4,21 (q, 2H, J=7,0 Гц), 5,30-5,39 (m, 1H), 6,01 (dd, 1H, J=15,7, 1,6 Гц), 6,88 (dd, 1H, J=15,7, 5,2 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ 13,7, 19,2, 54,3, 60,0, 72,2, 120,7, 144,4, 153,9, 164,9.
ИК (инфракрасный спектр) (пленка): см-1 2985w, 1752s, 1723m, 1665w, 1266s, 979w.
MC-BP (масс-спектрометрия высокого разрешения): m/z [M+Na]+ рассчитано 225,0733, найдено 225,0734.
ПРИМЕР 5
Получение этил-(2Е,4S)-4-(метоксикарбонилокси)пент-2-еноата [(S)-1]
ДМАП (14,7 мг, 0,12 ммоля) и Et3N (0,5 мл, 3,6 ммоля) растворяют в пиридине (5 мл). Добавляют 3-(метоксикарбонил)-1H-бензотриазол-3-ий-1-олат [Р. G. M. Wuts, et al., Org. Lett., p.1483 (2003)] (1,74 г, 9,0 ммоля) и (S)-21 (рац-этил-(2E)-4-гидроксипент-2-еноат) (865 мг, 6,0 ммоля) и полученную суспензию перемешивают в течение 2,5 ч при комнатной температуре. Реакционную смесь выливают в Н2О (50 мл) и экстрагируют с помощью tBuOMe (150 и 50 мл). Органические фазы последовательно промывают с помощью 1 M HCl (50 мл), Н2О (25 мл), насыщенным раствором NaHCO3 (25 мл) и Н2О (25 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (tBuOMe:фракция гептана от 20:80 до 30:70) и получают 1 (этил-(2E,4S)-4-(метоксикарбонилокси)пент-2-еноат) (0,97 г, 79%) в виде желтоватого масла. Rf(BuOMe:фракция гептана 30:70)=0,34.
ВЭЖХ: 98,4% ЭИ (энантиомерный избыток)-(CLC1, t(S)-1=8,2, t(R)-1=13,2). [ α ] D 25 = − 30.8 ( c = 0,83, Т Г Ф ) .
1Н-ЯМР и ВЭЖХ соответствуют данным для полностью охарактеризованного рацемического соединения.
ПРИМЕР 6
Получение рац-этил-(2E)-N-бензил-4-аминопент-2-еноата (2)
Реакцию 30 (рац-этил-(2E)-4-(хлорацетокси)пент-2-еноата) (983 мг, 4,0 ммоля) с BnNH2 (943 мг, 8,8 ммоля) и 6 мол.% [Pd] в толуоле (80 мл) проводят при 40°С по общей методике, описанной в примере 2. Флэш-хроматография (SiO2, инактивированный с помощью 1,1% Et3N, tBuOMe:фракция гептана от 20:80 до 30:70) дает 2 (рац-этил-(2E)-N-бензил-4-аминопент-2-еноат) (760 мг, 81%) в виде желтого масла. Rf(AcOEt:фракция гептана 30:70)=0,14.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 1,22 (d, 3H, J=6,5 Гц), 1,30 (t, 3H, J=7,2 Гц), 1,48 (s br., 1H), 3,35-3,42 (m, 1H), 3,68 (d, 1H, J=13,1 Гц), 3,80 (d, 1H, J=13,3 Гц), 4,21 (q, 2H, J=7,1 Гц), 5,94 (dd, 1H, J=15,6, 1,0 Гц), 6,84 (dd, 1H, J=15,7, 7,4 Гц), 7,22-7,28 (m, 1 H), 7,30-7,32 (m, 4H).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,3, 21,1, 51,5, 54,0, 60,4, 121,0, 127,0, 128,1, 128,5, 140,1, 151,7, 166,6.
ИК (пленка): см-1 3326w, 3063w, 3028w, 2978m, 2931w, 1717s, 1653m, 1604w, 1495w, 1454m, 1269m, 1179m, 1037m, 984m, 699m.
MC-BP: m/z [M+H]+ рассчитано 234,1489, найдено 234,1488.
ПРИМЕР 7
Получение этил-(2Е,4S)-N-бензил-4-аминопент-2-еноата [(S)-2] и этил-(2Е,4S)-N,N-дибензил-4-аминопент-2-еноата [(S)-12]
(S)-37 (Этил-(2E,4S)-4-аммонийпент-2-еноаттрифлат), полученный в примере 44, растворяют в CH2Cl2 (25 мл) и охлаждают до 0°С. При 0°С добавляют BnBr (891 мкл, 7,5 ммоля) и Cs2CO3 (4,89 г, 15,0 ммоля). Полученную суспензию перемешивают при 0°С в течение 14 ч и при комнатной температуре в течение 33 ч. Затем охлажденную реакционную смесь выливают в воду со льдом (25 мл) и экстрагируют с помощью CH2Cl2 (50 и 2×25 мл). Объединенные органические фазы промывают рассолом (25 мл), сушат над Na2SO4 и выпаривают при пониженном давлении при 30°С. Остаток трижды очищают с помощью флэш-хроматографии (CH2Cl2: фракция гептана 50:50,
МеОН:СН2С12:фракция гептана от 1:49,5:49,5 до 5:47,5:47,5, MeOH:CH2Cl2 от 0,25:99,75 до 2:98) и получают (S)-2 (этил-(2E,4,S)-N-бензил-4-аминопент-2-еноат) (378 мг, 32%) и (S)-12 (этил-(2E,4S)-N,N-дибензил-4-аминопент-2-еноат) (684 мг, 42%) в виде желтых масел.
Rf[(S)-2, МеОН: CH2Cl2:фракция гептана 10:45:45]=0,34
Rf[(S)-12, МеОН: CH2Cl2:фракция гептана 10:45:45]=0,69
(S)-2: ВЭЖХ CLC1: 82% ЭИ, t(S)-2=13,2, t(R)-2=8,7
(S)-12: ВЭЖХ CLC7: 78% ЭИ, t(S)-12=5,9, t(R)-12=4,7
(S)-12: ( 78 % И Э ) : [ α ] D 25 = − 30.8 ( c = 0,83, Т Г Ф )
1Н-ЯМР и ВЭЖХ обоих продуктов соответствуют данным для полностью охарактеризованных рацемических соединений.
ПРИМЕР 8
Получение рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноата (3)
Реакцию 21 (рац-этил-(2E)-4-гидроксипент-2-еноата) (1,44 г, 10 ммолей) с бензилизоцианатом (1,73 г, 13 ммолей) в толуоле (8 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOiPr:фракция гептана 25:75) дает 3 (рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноат) (2,49 г, 90%) в виде белого твердого вещества.
Rf(AcOiPr:фракция гептана 35:65)=0,26.
1Н-ЯМР (400 МГц, CDCl3): част./млн δ 1,29 (t, 3Н, J=7,2 Гц), 1,36 (d, 3H, J=6,8 Гц), 4,19 (q, 2 H, J=7,2 Гц), 4,32-4,41 (m, 2H), 5,00 (s br, 0,18H, поворотный изомер), 5,14 (s br, 0,87H), 5,42-5,47 (m, 1H), 5,86 (d br, 0,15H, J=15,8, поворотный изомер), 5,96 (d, 0,85H, J=15,8), 6,89 (dd, 1H, J=15,6, 4,8 Гц), 7,25-7,29 (m, 3H), 7,32-7,35 (m, 2H).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,2, 19,9, 45,1, 60,5, 69,5, 120,7, 127,6, 128,6, 1,28,7, 138,3, 147,0, 155,5, 166,2.
ИК (пленка): см-1 3347m, 3032w, 2982w, 1718s, 1662m, 1455m, 1531m, 1258m, 1043m, 979w, 741w, 700m.
MC-BP: m/z [M+Na]+ рассчитано 300,1206, найдено 300,1206; [М+K]+ рассчитано 316,0946, найдено 316,0946.
ПРИМЕР 9
Получение этил-(2Е,4S)-4-(бензиламинокарбонилокси)пент-2-еноата [(S)-3]
Реакцию (S)-21 (этил-(2Е,4S)-4-гидроксипент-2-еноата) (1,44 г, 10 ммолей) с бензилизоцианатом (1,04 г, 7,8 ммоля) в толуоле (8 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии
(tBuOMe:фракция гептана 30:70) дает (S)-3 (этил-(2E,4S)-4-(бензиламинокарбонилокси)пент-2-еноат) (1,50 г, 90%) в виде белого твердого вещества.
Rf(BuOMe:фракция гептана 50:50)=0,37
ВЭЖХ: 98,5% ЭИ (CLC1, t(S)-3=90, t(R)-3=43)
[ α ] D 25 = + 30.8 ( c = 0,91, Т Г Ф )
1Н-ЯМР и ВЭЖХ соответствуют данным для полностью охарактеризованного рацемического соединения.
ПРИМЕР 10
Получение рац-этил-(2E)-4-(бутиламинокарбонилокси)пент-2-еноата (4)
Реакцию 21 (рац-этил-(2Е)-4-гидроксипент-2-еноата) (1,44 г, 10 ммолей) с н-бутилизоцианатом (1,46 мл, 13 ммолей) в толуоле (8 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOiPr:фракция гептана от 15:85 до 25:75) дает 4 (рац-этил-(2Е)-4-(бутиламинокарбонилокси)пент-2-еноат) (2,31 г, 95%) в виде желтого масла.
Rf(AcOiPr: фракция гептана 30:70)=0,26.
1Н-ЯМР (400 МГц, CDCl3): δ част./млн 0,93 (t, 3Н, J=7,3 Гц), 1,29 (t, 3H, J=7,2 Гц), 1,32-1,41 (m, 5H), 1,45-1,53 (m, 2H), 3,17-3,19 (m, 2H), 4,20 (q, 2H, J=7,3 Гц), 4,74 (s br, 1H), 5,35-5,48 (m, 1H), 5,95 (dd, 1H, J=15,7, 1,6 Гц), 6,89 (dd, 1Н, J=15,7, 4,6 Гц)
13С{1H}-ЯМР (100,6 МГц, CDCl3); δ част./млн 13,7, 14,2, 19,9, 20,0, 32,0, 40,8, 60,5, 69,1, 120,6, 147,2, 155,5, 166,2.
ИК (пленка): см-1 3352m, 2961m, 2935m, 1720s, 1662m, 1533m, 1267m, 1250m, 1184m, 978m.
MC-BP: m/z [M+Na]+ рассчитано 266,1363, найдено 266,1362; [М+K]+ рассчитано 282,1102, найдено 282,1102.
ПРИМЕР 11
Получение рац-этил-(2Е)-4-(циклогексиламинокарбонилокси)пент-2-еноата (5)
Реакцию 21 (рац-этил-(2E)-4-гидроксипент-2-еноата) (1,44 г, 10 ммолей) с циклогексилизоцианатом (2,53 мл, 20 ммолей) в толуоле (8 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOiPr:фракция гептана от 15:85 до 25:75) дает 5 (рац-этил-(2Е)-4-(циклогексиламинокарбонилокси)пент-2-еноат) (2,29 г, 85%) в виде желтоватого твердого вещества.
Rf(AcOiPr:фракция гептана 30:70)=0,30.
1Н-ЯМР (400 МГц, CDCl3): δ част./млн 1,09-1,40 (m, 5Н), 1,29 (t, 3H, J=7,2 Гц), 1,35 (d, J=6,8 Гц, 3H), 1,58-1,63 (m, 1H), 1,68-1,73 (m, 2H), 1,92-1,95 (m, 2H), 3,47-3,49 (m, 1H), 4,20 (q, 2H, J=7,1 Гц), 4,61 (s br, 1H), 5,39-5,41 (m, 1H), 5,95 (dd, 1H, J=15,7, 1,6 Гц), 6,89 (dd, 1H J=15,7, 4,6 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,2, 20,0, 24,8, 25,5, 33,4, 49,9, 60,5, 69,0, 120,6, 147,3, 154,6, 166,3.
ИК (CH2Cl2): см-1 3436w, 2958w, 2937m, 2857w, 1716s, 1663m, 1508m, 1218m, 1186m, 1048m, 979m.
MC-BP: m/z [M+H]+ рассчитано 270,1700, найдено 270,1699; [M+Na]+ рассчитано 292,1519, найдено 292,1519.
ПРИМЕР 12
Получение рац-этил-(2Е)-4-(дибензиламинокарбонилокси)пент-2-еноата (6)
21 (Рац-этил-(2Е)-4-гидроксипент-2-еноата) (1,47 г, 10 ммолей), ди-(N-сукцинимидил)карбонат (4,04 г, 15 ммолей) и Et3N (4,2 мл, 30 ммолей) растворяют в MeCN (40 мл). Полученный раствор перемешивают при комнатной температуре в течение 5 ч. Затем Bn2NH (2,3 мл, 12 ммолей) в MeCN (5 мл) добавляют в течение 15 мин. После дополнительного перемешивания в течение 2,5 ч реакционную смесь выпаривают при пониженном давлении при 40°С. Остаток растворяют в смеси н-гексан: BuOMe 90:10 (4×25 мл) и раствор выпаривают при пониженном давлении при 40°С. Флэш-хроматография (BuOMe:фракция гептана 20:80) дает 6 (рац-этил-(2E)-4-(дибензиламинокарбонилокси)пент-2-еноат) (3,00 г, 82%) в виде бесцветного масла.
Rf(tBuOMe: фракция гептана 30:70)=0,32.
1Н-ЯМР (500 МГц, CDCl3): δ част./млн 1,29 (t, 3Н, J=7,1 Гц), 1,39 (d, 3H, J=6,7 Гц), 4,19 (q, 2H, J=7,2 Гц), 4,34-4,53 (m, 4H), 5,53-5,58 (m, 1H), 5,90 (dd, 1H, J=15,8, 1,3 Гц), 6,92 (dd, 1H, J=15,7, 4,7 Гц), 7,18-7,25 (m, 4H), 7,25-7,30 (m, 2H), 7,33-7,35 (m, 4 H).
13C{1H}-ЯМР (125,8 МГц, CDCl3): δ част./млн 14,2, 20,0, 49,0, 49,7, 60,5, 70,3, 120,6, 127,4, 127,5, 128,1, 128,6, 137,2, 146,9, 155,7, 166,2.
ИК (пленка): см-1 3088m, 3064m, 3031m, 2981m, 2933m, l701s, 1663m, 1605w, 1496w, 1454s, 1233s, 1181s, 1114s, 977m, 700m.
MC-BP: m/z [M+Na]+ рассчитано 390,1676, найдено 390,1672; [М+K]+ рассчитано 406,1415, найдено 406,1415; [М+Н]+ рассчитано 368,1856, найдено 368,1856.
ПРИМЕР 13
Получение рац-трет-бутил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноата (8)
Реакцию 23 (рац-трет-бутил-(2E)-4-гидроксипент-2-еноата) (1,03 г, 6,0 ммоля) с бензилизоцианатом (1,04 г, 7,8 ммоля) в толуоле (5 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOEt: фракция гептана 15:85) дает 8 (рац-трет-бутил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноат) (1,65 г, 90%) в виде желтого масла. Rf(AcOEt: фракция гептана 25:75)=0,29.
1Н-ЯМР (400 МГц, ДМСО-d6 (диметилсульфоксид)): δ част./млн 1,28 (d, 3H, J=6,5 Гц), 1,43 (s, 9H), 4,19 (d, 2H, J=6,0 Гц), 5,26-5,31 (m, 1H), 5,85 (dd, 1H, J=15,6, 1,5 Гц), 6,77 (dd, 1H, J=15,8, 4,5 Гц), 7,21-7,33 (m, 5H), 7,82 (t, 1H, J=6,0 Гц).
13С{1H}-ЯМР (100,6 МГц, ДМСО-d6): δ част./млн 19,6, 27,7, 43,7, 68,4, 80,0, 121,1, 126,7, 126,9, 128,2, 139,6, 147,2, 155,5, 164,7.
ИК (пленка): см-1 3345m, 3032w; 2980m, 1713m, 1661m, 1531m, 1456m, 1386m, 1256s, 1152s, 974m, 741m, 700m.
MC-BP: m/z [M+Na]+ рассчитано 328,1519, найдено 328,1519; [М+K]+ рассчитано 344,1259, найдено 344,1259.
ПРИМЕР 14
Получение рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-енамида (8)
Реакцию 25 (рац-этил-(2E)-4-гидроксипент-2-енамида) (591 мг, 4,0 ммоля) с бензилизоцианатом (789 мкл, 6,4 ммоля) в толуоле (3,5 мл) проводят в соответствии с примером 1. Очистка путем перекристаллизации из толуола дает 8 (рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-енамид) (637 мг, 57%) в виде сероватого твердого вещества.
mp=149-150°С.
1H-ЯМР (600 МГц, ДМСО-d6): δ част./млн 1,01 (t, 3Н, J=7,2 Гц), 1,18 (s br, 0,34H), 1,26 (d, 2,7Н, J=6,6), 3,09-3,14 (m, 2Н), 4,14-4,21 (m, 2Н), 5,24-5,28 (m, 1H), 5,98 (d, 1H, J=15,5), 6,56 (dd, 1H, J=15,5, 5,1 Гц), 7,21-7,24 (m, 3H), 7,29-7,32 (m, 2H), 7,41 (s br, 0,17H), 7,77-7,79 (m, 0,89H), 8,01 (s br, 0,12H), 8,08-8,10 (m, 0,89H).
13С{1H}-ЯМР (150,9 МГц, ДМСО-d6): δ част./млн 14,7, 20,0, 33,4, 43,8, 68,7, 123,7, 126,8, 127,0, 128,3, 139,7, 141,4, 155,7, 164,1.
ИК (пленка): см-1 3310s, 3088w, 3029w, 2971w, 2930w, 1686s, 1628s, 1534m, 1253m, 1047w, 966w, 753w, 697w.
MC-BP: m/z [M+Na]+ рассчитано 299,1366, найдено 299,1366; [М+K]+ рассчитано 315,1106, найдено 315,1105; [2М+Са]2+ рассчитано 296,1281, найдено 296,1281; [М+Н]+ рассчитано 277,1547, найдено 277,1546.
ПРИМЕР 15
Получение рац-диэтил-(2E)-4-(бензиламинокарбонилокси)пент-2-енамида (9)
Реакцию 27 (рац-диэтил-(2E)-4-гидроксипент-2-енамида) (847 мг, 5,0 ммоля) с бензилизоцианатом (801 мкл, 6,5 ммоля) в толуоле (4 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOEt: фракция гептана от 50:50 до 60:40) дает 9 (рац-диэтил-(2E)-4-(бензиламинокарбонилокси)пент-2-енамид) (1,40 г, 92%) в виде вязкого светло-желтого масла.
Rf(AcOEt: фракция гептана 60:40)=0,22.
1Н-ЯМР (600 МГц, ДМСО-d6): δ част./млн 1,01 (t, 3Н, J=7,0 Гц), 1,05 (t, 3H, J=7,1 Гц), 1,22 (s br, 0,3H), 1,28 (d, 2,7H, J=6,6 Гц), 3,19 (s br, 0,3H), 3,26-3,31 (m, 3H), 4,14-4,21 (m, 2H), 5,27-5,31 (m, 1H), 6,24 (d, 0,1H, J=15,2), 6,42 (d, 0,9H, J=15,1), 6,57 (s br, 0,1H), 6,62 (s br, 0,9H, J=15,2, 5,1 Гц), 7,21-7,24 (m, 3H), 7,29-7,31 (m, 2H), 7,45 (s br, 0,1H), 7,83 (t, 0,9H, J=6,1 Гц).
13С{1H}-ЯМР (150,9 МГц, ДМСО-d6): δ част./млн 13,1, 14,9, 20,1, 40,1, 41,5, 43,7,69,1, 120,0, 126,8, 126,9, 128,3, 139,7, 143,9, 155,7, 164,0.
ИК (пленка): см-1 3300m, 3064w, 3032w, 2978m, 2934m, 1720s, 1665s, 1613s, 1537m, 1454m, 1254s, 1043m, 974w, 745w, 700m.
MC-BP: m/z [M+Na]+ рассчитано 327,1679, найдено 327,1679; [М+Н]+ рассчитано 305,1860, найдено 305,1859.
ПРИМЕР 16
Получение рац-этил-(2Е)-N-бутил-4-аминопент-2-еноата (10)
Реакцию 31 (рац-этил-(2Е)-4-(диэтоксифосфинилокси)пент-2-еноата) (280 мг, 1,0 ммоля) с nBuNH2 (198 мкл, 2,0 ммоля) и 8 мол.% [Pd] в CH2Cl2 (10 мл) при комнатной температуре проводят в соответствии с примером 2. Флэш-хроматография (AcOEt: фракция гептана от 50:50 до 55:45) дает 10 (рац-этил-(2Е)-N-бутил-4-аминопент-2-еноат) (130 мг, 65%) в виде желтого масла.
Rf(кондиционирование с помощью NH3, AcOEt:фракция гептана от 60:40)=0,15.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 0,91 (t, 3H, J=7,3 Гц), 1,22 (d, 3H, J=6,5 Гц), 1,29 (t, 3H, J=7,2 Гц), 1,32-1,40 (m, 2H), 1,41-1,52 (m, 2H), 2,47-2,62 (m, 2H), 3,31-3,40 (m, 1H), 4,20 (q, 2H, J=7,3 Гц), 5,90 (dd, 1H, J=15,8, 1,0 Гц), 6,80 (dd, 1H, J=15,8, 7,5 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,0, 14,3, 20,5, 21,1, 32,3, 47,3, 54,9,60,4, 120,9, 151,8, 166,6.
ИК (пленка): см-1 3323w, 2961s, 2931s, 2873m, 1719s, 1655m, 1465m, 1269m, 1182m, 1037m, 984m.
MC-BP: m/z [M+H]+ рассчитано 200,1645, найдено 200,1644.
ПРИМЕР 17
Получение рац-этил-(2Е)-N-циклогексил-4-аминопент-2-еноата (11)
Реакцию 31 (рац-этил-(2E)-4-(диэтоксифосфинилокси)пент-2-еноата) (280 мг, 1,0 ммоля) с CyNH2 (228 мкл, 2,0 ммоля) и 5 мол.% [Pd] в CH2Cl2 (8 мл) при комнатной температуре проводят в соответствии с примером 2. Флэш-хроматография (SiO2, инактивированный с помощью 1,4% NH3, AcOEt: фракция гептана от 30:70) дает 11 (рац-этил-(2E)-N-циклогексил-4-аминопент-2-еноат) (169 мг, 75%) в виде желтого масла.
Rf(кондиционирование с помощью NH3, AcOEt: фракция гептана 50:50)=0,16.
1Н-ЯМР (400 МГц, CDCl3): δ част./млн 0,93-1,28 (m, 5Н), 1,18 (d, J=6,5 Гц, 3H), 1,30 (t, 3H, J=7,2 Гц), 1,58-1,61 (m, 1H), 1,69-1,79 (m, 3H), 1,88-1,91 (m, 1H), 2,39-2,46 (m, 1H), 3,49-3,55 (m, 1H), 4,20 (q, 2H, J=7,0 Гц), 5,88 (dd, 1H, J=15,7, 0,9 Гц), 6,79 (dd, 1H, J=15,6, 7,5 Гц).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,2, 21,7, 24,9, 25,1, 26,1, 29,7, 33,3, 34,5, 51,2, 53,8, 60,3, 120,3, 152,7, 166,7.
ИК (пленка): см-1 3317w, 2977m, 2928s, 2854m, 1719s, 1653w, 1449m, 1268m, 1176m, 1038m, 981m.
MC-BP: m/z [M+H]+ рассчитано 226,1802, найдено 226,1801.
ПРИМЕР 18
Получение рац-этил-(2Е)-N,N-дибензил-4-аминопент-2-еноата (12)
Реакцию 30 (рац-этил-(2Е)-4-(хлорацетокси)пент-2-еноата) (221 мг, 1,0 ммоля) с Bn2NH (383 мкл, 2,0 ммоля) и 8 мол.% [Pd] в CH2Cl2 (10 мл) при комнатной температуре проводят в соответствии с примером 2. Флэш-хроматография (AcOEt:фракция гептана 5:95) дает 12 (рац-этил-(2Е)-N,N-дибензил-4-аминопент-2-еноат) (227 мг, 70%) в виде бесцветного масла.
Rf(AcOEt:фракция гептана 20:80)=0,47.
1Н-ЯМР (300 МГц, CDCl3): δ част./млн 1,23 (d, 3H, J=7,0 Гц), 1,31 (t, 3 H, J=7,1 Гц), 3,43-3,52 (m, 1H), 3,55-3,66 (m, 4H), 4,21 (q, 2H, J=7,2 Гц), 5,90 (dd, 1H, J=15,9, 1,6 Гц), 7,05 (dd, 1H, J=15,9, 5,9 Гц), 7,19-7,24 (m, 2H), 7,28-7,33 (m, 4H), 7,37-7,39 (m, 4H).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,3, 14,5, 53,8, 60,4, 121,7, 126,7, 128,1, 128,3, 139,7, 150,0, 166,2.
ИК (пленка): см-1 3063w, 3028w, 2975m, 2930w, 2804w, 1719s, 1651w, 1598w, 1493s, 1453m, 1269m, 1183s, 1030m, 983w, 699m.
MC-BP: m/z