Способы определения эффективности лиганда натрий-протонного антипортера
Иллюстрации
Показать всеИзобретение относится к способам определения эффективности лиганда ионного канала. Ex vivo способ определения эффективности лиганда ионного канала in vivo в зависимости от присутствия плазмы, включает стадии:
a) приведение клетки, экспрессирующей ионный канал, в контакт с
i) плазмой животного и
ii) лигандом ионного канала и
b) определение эффекта лиганда ионного канала на клетку,
или
a) приведение клетки, экспрессирующей ионный канал, в контакт с
i) плазмой животного и
ii) соединением, которое определяют как лиганд ионного канала, и
b) определение эффекта соединения на клетку,
или
a) приведение клетки, экспрессирующей ионный канал, в контакт с плазмой животного, которому был введен лиганд ионного канала, и
b) определение эффекта лиганда ионного канала на клетку. Способ по изобретению может использоваться для скрининга лекарственного препарата для предупреждения и/или лечения заболевания, затрагивающего дисфункцию ионного канала, особенно для предупреждения и/или лечения сердечно-сосудистого заболевания или рака. Изобретение обеспечивает повышение эффективности способа и снижение затрат на скрининг лекарственных препаратов. 13 з.п.ф-лы, 4 табл., 2 пр., 3 ил.
Реферат
Настоящее изобретение относится к способам определения эффективности лиганда ионного канала.
Семейство Na+/H+-антипортеров или натрий-протонных антипортеров (NHE) мембранных транспортеров использует Na+-градиент, направленный извне внутрь клетки, для управления утечкой H+ из клеток. Существенными функциями, осуществляемыми этими группами транспортеров (или ионных каналов), являются регулирование объема клетки и pH, разрешающая роль в клеточной пролиферации и трансэпителиальный транспорт Na+. NHE млекопитающих представляет собой интегральный мембранный белок, чья функция состоит в обмене одного внутриклеточного протона на один внеклеточный ион натрия. Путем своей причастности к ионным потокам NHE служит для регулирования внутриклеточного pH и объема клетки и для инициирования изменений в росте или функциональном статусе клеток. Кроме своей физиологической роли NHE играет важные роли в патологии человека. Обусловленный NHE транспорт играет основную роль в повреждении, наносимом миокарду человека во время и после инфаркта миокарда, и это, как полагают, представляет ключевой шаг в канцерогенной трансформации злокачественных клеток. Вследствие этого в течение многих лет NHE являлись целью в сердечно-сосудистых и онкологических исследованиях, и тысячи соединений были проверены на предмет ингибирования и избирательности NHE.
Стандартным способом определения эффективности антагонистов NHE является анализ in vitro, описанный Schwark с сотрудниками (Schwark et al., 1998, Pflügers Arch., 336(5):797-800) и Wiemann с сотрудниками (Wiemann et al., 1999, Pflügers Arch., 436(3):255-262). После определения IC50 лиганда на выбранном NHE избирательность в отношении других NHE может быть определена при помощи того же теста. Как правило, эффективные лиганды с хорошей избирательностью отбирали для дальнейшего исследования путем определения фармакокинетики, проверки лиганда in vivo и т.д. Тем не менее, некоторые очень эффективные соединения демонстрировали лишь слабые эффекты в исследованиях in vivo. Причинами могло быть сильное связывание белка, низкое бионакопление или другие воздействия, уменьшающие эффективную концентрацию соединений в плазме крови. Желательно очень рано исключать эти соединения в процессе разработки лекарственного средства, чтобы экономить время и ресурсы.
Из-за несоответствия между IC50 in vitro и фармакологической действенностью (эффективностью) некоторых соединений существовала потребность разработки способа определения или моделирования эффективности лигандов NHE или лигандов других ионных каналов в организме.
Соответственно, первым предметом настоящего изобретения является предоставление способа определения эффективности лиганда ионного канала. Предпочтительно, этот тест должен быть эффективным в плане временных и стоимостных затрат. В контексте этого применения термин «ионный канал», как подразумевается, включает пассивные ионные каналы, так же как и активные ионные каналы (транспортеры ионов).
Было с удивлением обнаружено, что эффективность лигандов ионных каналов, особенно антагонистов NHE, можно определить путем контактирования клетки, экспрессирующей ионный канал, с плазмой животного и лигандом ионного канала. В этом тесте было возможно определять эффект лиганда ионного канала на клетку, где этот эффект отражает эффективность лиганда in vivo.
Соответственно, первый аспект настоящего изобретения предоставляет способ определения эффективности лиганда ионного канала, включающего стадии:
a) контактирование клетки, экспрессирующей ионный канал, с
i) плазмой животного и
ii) лигандом ионного канала;
и
b) определение эффекта лиганда ионного канала на клетку.
Коротко, способ может быть произведен следующим образом: Подходящие клетки, экспрессирующие рассматриваемый ионный канал, поддерживают (например, культивируют) при подходящих условиях и подвергают контактированию (инкубируют) с плазмой животного и лигандом ионного канала. Оба компонента могут быть добавлены одновременно или совместно. Через некоторое время, достаточное для обеспечения эффекта на клетку, определяют эффект на клетку. После контактирования или одновременно с ним наблюдают эффект (сигнал), где обнаружение эффекта является индикацией действия лиганда ионного канала на клетку.
Термин «эффективность лиганда ионного канала» в контексте настоящего изобретения относится к фармакологической эффективности лиганда ионного канала. В отличие от теста in vitro в отсутствие плазмы способ по изобретению, выполненный в присутствии плазмы, учитывает количество связанного белка, степень и скорость поглощения, распределение, метаболизм и экскрецию пригодности лиганда и/или других эффектов, уменьшающих эффективную концентрацию соединений в плазме крови. В случае, когда лиганд вводили животному и от животного брали плазму, способ также учитывает степень и скорость поглощения, распределения, метаболизма и выделения лиганда. Эти эффекты могут зависеть, в качестве не ограничивающих примеров, от физических свойств препарата (гидрофобность, pKa, растворимость), состава препарата, введения во время приема пищи или натощак, суточных особенностей и/или взаимодействия с другими препаратами, пищей или эндогенными веществами (например, ферментами). Соответственно, термин «эффективность лиганда ионного канала» имеет отношение не только к связыванию лиганда с ионным каналом и индукции последующей трансдукции сигнала, но также учитывает вышеупомянутые эффекты лиганда в плазме и/или живущем животном. Это делает возможным более удобную идентификацию подходящих препаратов-кандидатов, например, для терапии in vivo и/или исключения соединений с низкой эффективностью in vivo.
Действие лиганда на клетку может представлять собой любой эффект на клетку, включая, в качестве не ограничивающих примеров, измененную морфологию, жизнеспособность или композицию внутриклеточных соединений. Эффект может иметь место на любом уровне трансдукции сигнала ионного канала, включая связывание лиганда с ионным каналом, поток ионов, связывание соответствующего иона с мишенью, такой как внутриклеточная мишень, определение количества клеточного соединения, такого как вторичный мессенджер (например, цАМФ, цГМФ, Са2+, IP3, диацилглицерол и т.д.), определение состояния активации внутриклеточного белка, такого как протеинкиназа A, протеинкиназа C или МАР-киназа, определение количества мРНК или белка, любая измененная клеточная функция (такая как индукция апоптоза или арест клеточного цикла) и т.д.
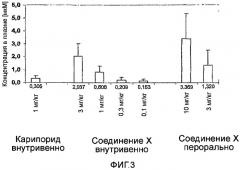
Этот способ может использоваться для определения или моделирования эффективности лиганда ионного канала in vivo. Примеры диапазона применения способа включают следующее: Во-первых, может быть измерена эффективная концентрация лигандов ионного канала в образце плазмы, полученном из животных, которым вводили лиганды ионного канала (см., например, Пример 2). Если лиганд вводится животному, низкие концентрации лиганда в плазме по сравнению с введенным количеством лиганда можно интерпретировать как низкое бионакопление (например, из-за малого времени полужизни в плазме).
Во-вторых, можно определять эффект лиганда ионного канала в плазме, такой как человеческая плазма (см., например, Пример 2). Из сравнения с IC50 для проб, не содержащих плазмы (как известно в данной области), можно сделать вывод о связывании в плазме и пригодности лиганда in vivo. Соединения с очень высоким различием в IC50 и эффективности в плазме могут быть заранее исключены, что эффективно для уменьшения стоимости при разработке лекарственного средства. В настоящее время эти соединения могут быть исключены только после экспериментов in vivo.
Ионный канал представляет собой белок, как правило, образующий поры, который помогает установлению и контролированию потока ионов через плазматическую мембрану. Он является интегральным белком или, более типично, ансамблем нескольких белков. Такие ансамбли из нескольких субъединиц обычно включают круговую конфигурацию идентичных или гомологичных белков, плотно упакованных вокруг заполненной водой поры через плазматическую мембрану. Несмотря на то что некоторые каналы допускают прохождение ионов исключительно по заряду, архетипическая канальная пора составляет в ширину в самом узком месте только один или два атома. Она проводит определенную разновидность ионов, таких как натрий или калий, и транспортирует их через мембрану. В некоторых ионных каналах прохождение через пору регулируется «воротами», которые могут открываться или закрываться химическими или электрическими сигналами, температурой или механическими усилиями, в зависимости от разновидности ионного канала.
Как правило, ионные каналы характеризуются в зависимости от открытия мембранного канала, разновидностей ионов, проходящих через эти ворота, и числа пор.
Если классифицировать по открытию мембранного канала, то каналы разделяют на два класса, ионные каналы с потенциал-зависимыми воротами (активация/инактивация в зависимости от градиента потенциала через мембрану) и ионные каналы с лиганд-зависимыми воротами (активация/инактивация в зависимости от связывания лиганда с каналом). Примеры каналов с потенциал-зависимыми воротами включают натриевые каналы с потенциал-зависимыми воротами, кальциевые каналы с потенциал-зависимыми воротами, калиевые каналы с потенциал-зависимыми воротами, некоторые временные рецепторные потенциальные каналы, активизирующиеся гиперполяризацией каналы с зависимыми от циклических нуклеотидов воротами и протонные каналы с потенциал-зависимыми воротами. Примеры каналов с лиганд-зависимыми воротами включают калиевые каналы, такие как внутренние ректифицированные калиевые каналы, активизируемые кальцием калиевые каналы и калиевые каналы с двумя поровыми областями, каналы со светозависимыми воротами, такими как канал родопсина и каналы с воротами, зависимыми от циклических нуклеотидов. В случае классифицирования по ионам, проходящим через каналы, ионные каналы, как правило, классифицируют следующим образом:
хлорные каналы, калиевые каналы, такие как калиевые каналы с потенциал-зависимыми воротами, кальций-активируемые калиевые каналы, внутренние ректифицированные калиевые каналы и калиевые каналы с двумя поровыми областями, натриевые каналы, кальциевые каналы, протонные каналы, такие как протонные каналы с потенциал-зависимыми воротами и общие ионные каналы, являющиеся относительно неспецифическими к ионам, включая большинство неустойчивых рецепторных потенциальных каналов.
Некоторые ионные каналы влияют на внутриклеточный pH, наподобие натрий-бикарбонатного котранспортера и натрий-протонного антипортера (NHE). На активность ионных каналов могут оказывать влияние натуральные или отсутствующие в природе лиганды, которые связываются с рассматриваемыми ионными каналами. Известные примеры таковых включают блокируемые тетродотоксином, сакситоксином, лидокаином и новокаином каналы ионов натрия, а также блокируемые дендротоксином, ибериотоксином и гетероподатоксином калиевые каналы.
В соответствии с этим лиганд ионного канала представляет собой любое химическое вещество, которое специфически связывается с ионным каналом. «Специфически связывающийся с ионным каналом» по настоящему изобретению включает, в качестве не ограничивающих примеров, связывающийся с константой диссоциации KD, не превышающей 10-4 моль/л, предпочтительно, не превышающей 10-5 моль/л. Константу диссоциации KD можно определить, например, в экспериментах по конкурентному связыванию, как известно специалисту в данной области, в соответствии со следующим уравнением:
B[L] = [L]/{[L] + K DL (1+[L * ]/K DL* },
где [L] и [L*] представляют концентрацию рассматриваемого лиганда ионного канала и концентрацию детектируемого (например, меченого) лиганда ионного канала, такого как радиолиганд для ионного канала, соответственно. KDL и KDL* представляют собой константы диссоциации рассматриваемого лиганда ионного канала и детектируемого лиганда, соответственно, а B[L] (от 0% до 100%) представляет собой связывание при определенной концентрации лиганда ионного канала.
В предпочтительном варианте осуществления изобретения идентифицируемый лиганд является агонистом или антагонистом. Агонисты связываются с ионным каналом и активизируют его (например, вызывая конформационное изменение). Антагонисты или блокаторы также связываются с ионным каналом и инактивируют его. Активация и инактивация могут привести к обнаружимому сигналу, если состояние (активное или неактивное) ионного канала изменяется лигандом. Предпочтительно, лиганд является антагонистом, инактивирующим рассматриваемый ионный канал. Лиганд, характеризуемый способом по изобретению, может использоваться в качестве потенциального препарата, пригодного для лечения и предупреждения связанных с ионным каналом расстройств или заболеваний.
В предпочтительном варианте осуществления изобретения ионный канал представляет собой натрий-протонный антипортер (NHE) или натрий-бикарбонатный котранспортер. Так как структура белка, такого как фермент, функционирование которого в клетках в значительной степени зависит от pH, существует оптимальный pH для функции белка. По этой причине поддержание и регулирование внутриклеточного pH чрезвычайно важны для клеток для поддерживающего гомеостаза клеточной функции. NHE, так же как и натрий-бикарбонатный котранспортер, вовлечены в регулирование pH клетки. Натрий-бикарбонатный котранспортер управляется концентрационным градиентом Na+ внутри и снаружи клеточной мембраны и забирает один Na+ в клетку вместе с одним или несколькими ионами HCO3 -. Поскольку натрий-бикарбонатный котранспортер находится в мембране клетки и HCO3 -, попавший в клетку за счет натрий-бикарбонатного котранспортера, нейтрализует H+ в цитоплазме, это играет важную роль в регулировании внутриклеточного pH.
NHE также играют важную роль в регулировании внутриклеточного pH. До настоящего времени было идентифицировано девять изоформ (от NHE1 до NHE9) в пределах семейства NHE млекопитающих. Изоформы обладают приблизительно 25-75%-й идентичностью последовательности, с рассчитанными относительными молекулярными массами в пределах от приблизительно 74000 до 93000. Структурный анализ антипортеров позволяет предположить, что они обладают сходными мембранными топологиями, с аминоконцевым мембранным доменом, состоящим из двенадцати трансмембранных сегментов, и более дивергентным карбоксиконцевым цитоплазматическим доменом.
В течение длительного времени было известно, что NHE важен для роста опухоли, поскольку клетки опухоли, дефектные по Na+/H+- обменивающей активности, были либо неспособны к опухолевому росту, либо демонстрировали сильную задержку роста при имплантировании в мышей с иммунным дефицитом. Теперь очевидно, что NHE1 вызывает реверсирование градиента pH во многих типах трансформированных и/или злокачественных клеток таким образом, что внутриклеточная среда становится щелочной, а внеклеточная окружающая среда становится кислой. Этот «злокачественный ацидоз», как полагают, представляет ключевую стадию канцерогенной трансформации и необходим для развития и поддержания измененного фенотипа.
Кроме того, NHE, особенно NHE1, был вовлечен в физиологию некоторых заболеваний, с большинством исследований, сконцентрированных на роли NHE1 в заболеваниях сердца и раке. В миокарде при нормальных условиях NHE1 удаляет лишнюю внутриклеточную кислоту в обмен на внеклеточный натрий. Увеличенный внутриклеточный натрий удаляется регуляторными мембранными белками, включая Na+/K+-АТФазу и Na+/Ca2+-антипортер. В миокарде проблемы возникают при увеличенном производстве протонов, которое происходит в миокарде человека во время и после инфаркта миокарда.
Изоформа NHE1 представляет собой изоформу «домашнего хозяйства» антипортера и экспрессируется повсеместно в плазматической мембране фактически всех тканей. Это первоначальная изоформа NHE, обнаруженная в плазматической мембране миокарда. Изоформы от NHE2 до NHE5 также локализованы в плазматической мембране, однако обладают более ограниченными распределениями по тканям. NHE2 и NHE3 преимущественно расположены в апикальной мембране эпителия и сильно экспрессируются в почках и кишечнике. В противоположность этому NHE4 наиболее сильно представлена в желудке, но также экспрессируется в кишечнике, почках, мозге, матке и скелетных мышцах, тогда как NHE5 преобладающе экспрессируется в мозге (но может также присутствовать на низких уровнях в других неэпителиальных тканях, включая селезенку, семенники и скелетные мышцы). Изоформы от NHE6 до NHE9 экспрессируются повсеместно и присутствуют во внутриклеточных компартментах. Эти присутствующие в мембранах органелл NHE, как предполагают, регулируют люминальный pH и концентрацию катионов внутриклеточных компартментов. Экспрессия NHE6 является самым высокой в сердце, мозге и скелетных мышцах, и она локализована в ранних рециркулирующих эндосомах. Изоформа NHE7 локализована преимущественно в транс-Гольджи-аппарате и отличается от других NHE-изоформ тем, что она опосредует приток либо Na+, либо K + в обмен на H+. Наиболее высокая экспрессия NHE8 обнаружена в скелетных мышцах и почках, и эта изоформа локализуется, главным образом, в области от срединных до транс компартментов Гольджи. Было обнаружено, что недавно идентифицированная изоформа NHE9 локализована в поздних рециркулирующих эндосомах.
NHE являются мишенями для ингибирования диуретическим соединением амилоридом и его аналогами и производными бензоилгуанидина. Сравнения различных изоформ NHE показывают, что они обладают различными аффинностями к этим ингибиторам, со следующим порядком чувствительности при сходных экспериментальных условиях: NHE1≥NHE2>NHE5>NHE3>NHE4. Поскольку NHE1 представляет собой изоформу, которая является наиболее чувствительной к ингибированию и, как представляется, самой важной изоформой, присутствующей в плазматической мембране миокарда, селективные свойства этих ингибиторов можно использовать в терапевтических целях.
В предпочтительном варианте осуществления настоящего изобретения ионный канал представляет собой NHE, такой как NHE1, NHE2, NHE3, NHE4, NHE5, NHE6, NHE7, NHE8 или NHE9, предпочтительно NHE1, NHE2, NHE3 или NHE5, в особенности NHE1 или NHE3, особенно NHE1.
Изоформа NHE1 представляет собой наиболее охарактеризованную изоформу семейства NHE. NHE1 составляет 815 аминокислот в длину, с остатками с 1 по 500, представляющими мембранный домен, и остатками с 501 по 815, представляющими цитоплазматический хвост. Мембранный домен NHE1 является как необходимым, так и достаточным для ионного транспорта, тогда как цитозольная область вовлечена в регулирование активности антипортера. Ионный поток через антипортер управляется трансмембранным градиентом Na+ и, по-видимому, не требует никакого непосредственного метаболического прихода энергии.
Как подробно рассказано выше, лиганд ионного канала предпочтительно является агонистом или антагонистом. Однако, вследствие клинической значимости NHE, лиганд представляет собой предпочтительно агонист NHE, более предпочтительно антагонист NHE. Если рассматриваемый ионный канал является неактивным в отсутствие лиганда, может возникнуть необходимость контролировать эффект антагониста в присутствии агониста. В этом случае эффект антагониста представляет собой инактивацию активизированного агонистом ионного канала.
В соответствии с настоящим изобретением клетка инкубируется с лигандом и плазмой. Клетка может представлять собой любую подходящую клетку, экспрессирующую рассматриваемый ионный канал. Клетки, экспрессирующие рассматриваемый ионный канал, могут являться клетками, которые естественно экспрессируют ионный канал. Альтернативно, клетки могут быть генетически модифицированы, чтобы экспрессировать ионный канал.
Клетку можно выделять (произвольно генетически модифицировать), поддерживать и культивировать, как известно специалисту в данной области. Кроме температуры и газовой смеси, наиболее часто изменяемым фактором в системах клеточных культур является среда для роста. Прописи для сред роста могут варьировать по pH, концентрации глюкозы, фактору роста и присутствию других питательных компонентов среди прочих. Факторы роста, используемые в качестве добавок к среде, часто получают из крови животных, такой как сыворотка теленка. Генетически модифицированные клетки могут быть получены путем встраивания полноразмерной кодирующей последовательности ионного канала, как известно специалисту. Специалисту в данной области известно, как получить последовательность нуклеиновых кислот, кодирующую белок ионного канала, и как выделять или продуцировать такую последовательность нуклеиновых кислот с использованием стандартных способов молекулярной биологии. Это можно осуществлять, например, путем использования и комбинирования существующих последовательностей, используя ферменты рестрикции. Нуклеиновую кислоту можно комбинировать с другими элементами, например, промотором и началом транскрипции и сигналом остановки и началом трансляции и сигналом остановки, чтобы обеспечить экспрессию последовательности ионного канала. Образующаяся последовательность нуклеиновой кислоты может быть введена в клетки, например, с использованием вируса в качестве носителя, или трансфекции, включая, например, электропорацию, тепловой шок, магнетофекцию, нуклеофекцию и использование агентов трансфекции.
Необязательно, клетка может быть частью ткани; однако способ по изобретению представляет собой способ ex vivo. В предпочтительном варианте осуществления изобретения клетка представляет собой клетку из клеточной линии (многие из которых хорошо охарактеризованы и предусматривают постоянные условия и подходящее обращение), в особенности линия клеток млекопитающего, конкретнее, линия клеток человека или клеточная линия мыши, особенно линия LTK-клеток мыши LAP1 (Franchi et al., 1986, Proc Natl Acad Sci USA 83(24): 9388- 9392). Примеры подходящих клеточных линий включают, в качестве не ограничивающих примеров, HEK 293, 745-A, A-431, BxPC3, C5N, Caco-2, Capan-1, CC531, CFPAC, CHO, CHO K1, COS-1, COS-7, CV-1, EAHY, EAHY 926, F98, GH3, H-295 R, H-4-II-E, HACAT, HACAT A131, HEK, HEL, HeLa, Hep G2, High Five, Hs 766T, HT29, HUV-EC R24, HUV-EC-C, IEC 17, IEC 18, Jurkat, K 562, KARPAS-299, L 929, LIN 175, MAt-LYLU, MCF-7, MNEL, MRC-5, MT4, N64, NCTC 2544, NDCK II, Neuro 2A, NIH 3T3, NT2/D1, P19, SF9, SK-UT-1, ST, SW 480, SWU-2 OS, U-373, U-937 и Y-1. Другие подходящие клетки представляют собой клетки, известные специалисту в данной области.
Предпочтительными клеточными линиями являются клетки HEK 293 (первичные эмбриональные клетки почек человека), клетки 3T3 (эмбриональные фибробласты крысы), клетки CHO (яичник китайского хомяка), клетки COS-7 (клеточная линия африканской зеленой мартышки), клетки HeLa (эпителиоидная цервикальная карцинома человека), клетки JURKAT (T-клеточная лейкемия человека), клетки BHK 21 (нормальная почка хомяка, фибробласт) и клетки MCF-7 (рак молочной железы человека), особенно LTK-клеточная линия мыши LAP1.
В пределах способа по изобретению клетка (как определено выше) инкубируется с плазмой животного. Животное может быть позвоночным животным, в частности млекопитающее, особенно крыса, мышь, кролик, морская свинка или кошка, которые предусматривают безопасное и удобное обращение в лаборатории.
Для получения наиболее значительных результатов для медицины человека плазма может быть получена также от человека. Для этого венозную кровь можно получить венопункцией от человеческого донора, где, как правило, достаточно лишь небольшого образца крови, например, образец от 5 мл до 25 мл, для способа по настоящему изобретению (см. Примеры). Кровь обычно получают из срединной локтевой вены, на переднем предплечье (сторона в пределах сгиба локтя). Эта вена проходит вблизи от поверхности кожи, где нет сильной иннервации. В промышленно развитых странах взятие крови в основном осуществляют при помощи системы дренажных трубок, состоящей из пластмассового центра, шприца для подкожных инъекций и вакуумной трубки.
В соответствии со способом по изобретению определяют эффективность лиганда ионного канала. Эффективность определяют путем выявления эффекта лиганда ионного канала на клетку в присутствии плазмы. Как в подробностях описано выше, действие лиганда на клетку можно оценивать на каждом уровне трансдукции сигнала, включая связывание лиганда с ионным каналом, связывание соответствующего иона с мишенью, определение количества клеточного соединения, такого как вторичный мессенджер, определение количества мРНК или белка, любую измененную функцию клетки (такую как индукция апоптоза или ареста клеточного цикла) и т.д. Способы определения связывания лиганда с мишенью хорошо известны специалистам и включают способы, определенные здесь. Способы определения количества мРНК или белка также известны специалистам. Способы наблюдения измененной клеточной функции в значительной степени зависят от типа клеточной функции и также известны квалифицированному практику.
Способы определения эффекта лиганда ионного канала на клетку могут включать гетерогенный или гомогенный анализ. Как используется здесь, гетерогенный анализ представляет собой анализ, который включает одну или несколько стадий отмывки, тогда как в гомогенном анализе такие стадии отмывки не являются необходимыми. Только смешивают реактивы и соединения и проводят определение. Способ по изобретению также может включать антитела, специфичные для сигнала, действующего ниже по течению, чем ионный канал. Анализ может представлять собой ELISA (иммуносорбентный анализ с применением фиксированных ферментов), DELFIA (лантанидфтороиммунный анализ с усиленной диссоциацией), SPA (сцинтилляционный неконтактный анализ), анализ «вспышки в плашке», анализ FRET (резонансный перенос энергии флуоресценции), анализ TR-FRET (резонансный перенос энергии флуоресценции с временным разрешением), анализ FP (флюоресцентная поляризация), ALPHA (усиленный люминесцентный неконтактный гомогенный анализ), анализ EFC (комплементация фрагментом фермента), двугибридный анализ или коиммунопреципитационный анализ.
В другом варианте осуществления изобретения способ определения эффективности может включать измерение одного или нескольких вторичных мессенджеров, таких как цАМФ или фосфолипид(ы), предпочтительно фосфатидилинозитолфосфат. Измерение может включать определение концентрации одного или нескольких вторичных мессенджеров. Средства и способы определения концентрации одного или нескольких вторичных мессенджеров известны специалистам и включают такие вовлечения, например, меченые предшественники, предпочтительно меченые предшественники вторичных мессенджеров (например, 32P-ATP или 3H-инозитол), включая очистку, например, при помощи хроматографии на колонках или масс-спектрометрии. Изменение фосфолипидов, как правило, особенно обосновано для кальциевых каналов.
Если рассматриваемый ионный канал, например, NHE или натрий-бикарбонатный котранспортер, оказывает воздействие на значение pH, эффект, определенный способом по настоящему изобретению, представляет собой изменение значения pH, предпочтительно, изменение внутриклеточного значения pH.
В предпочтительном варианте осуществления изобретения эффект лиганда ионного канала на рассматриваемый ионный канал, например, NHE или натрий-бикарбонатный котранспортер, определяют путем флюоресценции.
Флюоресценция представляет собой оптическое явление, при котором молекулярное поглощение фотона вызывает эмиссию другого фотона с большей длиной волны. Разница энергий между поглощенными и испускаемыми фотонами выделяется в виде молекулярных колебаний или тепла. Как правило, поглощенный фотон находится в ультрафиолетовом диапазоне, а излучаемый свет находится в видимом диапазоне, однако это зависит от адсорбционной кривой и стоксова сдвига частоты конкретного флуорофора. Число применений флюоресценции растет в биомедицинских, биологических и связанных с этим науках. Также увеличивается число способов анализа в этих областях, хотя со все более и более неудачной номенклатурой в форме акронимов, таких как: FLIM, FLI, FLIP, CALI, FLIE, FRET, FRAP, FCS, PFRAP, smFRET, FIONA, FRIPS, SHREK, SHRIMP, TIRF. Большинство этих способов основано на использовании флюоресцентных микроскопов. В таких микроскопах используют источники света высокой интенсивности, обычно ртутные или ксеноновые лампы, светодиоды или лазеры, для возбуждения флюоресценции в образцах при наблюдении. Оптические фильтры затем отделяют возбуждающий свет от испускаемой флюоресценции для детектирования глазом или камерой на приборах с зарядовой связью или другими светодетекторами (фотоэлектронные умножители, спектрографы и т.д.).
Как правило, для обнаружения эффекта рассматриваемого сигнала (здесь эффект лиганда ионного канала) используется флуоресцентный краситель, или маркер, или лейбл. Флуоресцентный краситель включает флуорофор. Флуорофор, по аналогии с хромофором, является компонентом молекулы, которая заставляет молекулу быть флуоресцентной. Он представляет собой функциональную группу в молекуле, которая поглощает излучение определенной длины волны и повторно испускает излучение с отличной (но строго определенной) длиной волны. Количество и длина волны испускаемого излучения зависят как от флуорофора, так и от химической среды, окружающей флуорофор. Флюоресцеинизотиоцианат, реактивная производная флюоресцеина, являлся одним из самых общераспространенных флуорофоров, химически присоединяемая к другим нефлуоресцентным молекулам для образования новых и флуоресцентных молекул для множества применений. Другие исторически общераспространенные флуорофоры представляют собой производные родамина, кумарина и цианина. Примеры флуоресцентных красителей включают, в качестве не ограничивающих примеров, 7-аминоактиномицин D, акридиновый оранжевый, акридиновый желтый, Alexa Fluor, AnaSpec, аурамин O, родамин-аураминовый краситель, бензантрон, 9,10-бис(фенилэтинил)антрацен, 5,12-бис(фенилэтинил)нафтацен, CFDA-SE, CFSE, кальцеин, карбоксифлуоросцеин, 1-хлоро-9,10-бис(фенилэтинил)антрацен, 2-хлоро-9,10-бис(фенилэтинил)антрацен, кумарин, цианин, ДАПИ, Dioc6, DyLight Fluor, этидиумбромид, флюоресцеин, фторурацил-2, фторурацил-2-ацетоксиметиловый эфир, зеленый флуоресцентный белок, Hilyte Fluor, краситель Hoechst, индийский желтый, Indo-1, люциферин, перилен, фикобилин, фикоэритрин, фикоэритробилин, пропидиумиодид, пирамин, родамин, RiboGreen, рубрен, рутений(II)трис(батофенантролиндисульфонат), SYBR Green, стильбен, сульфородамин 101, TSQ, Texas Red, умбеллиферон, желтый флуоресцентный белок или BCECF.
В соответствии с предпочтительным вариантом осуществления используется BCECF. BCECF (2',7'-бис-(карбоксиэтил)-5(6)-карбоксифлуоресцеин, C27H20011), М 520,45 г/мол, CAS-Nr.: 85138-49-4, хранение: 2-8°C, в защищенном от света месте), BCECF является аналогом карбоксифлуоресцеина с улучшенными характеристиками для определения pH в лимфоцитах вследствие его усиленного удерживания внутри клеток. Для эффективного накопления в неповрежденных клетках BCECF может использоваться в форме ацетоксиметилового эфира BCECF/AM, который расщепляется внутри клеток с образованием более непроникающего BCECF. Максимум возбудимости для 70 нМ-ного раствора BCECF соответствует 500 нм. Интенсивность флюоресценции BCECF может находиться под воздействием нескольких веществ, например: глицерина, сахарозы, полиэтиленгликоля или поливинилпирролидона. Подходящей концентрацией BCECF является 5 мкМ (конечная концентрация).
В контексте настоящего изобретения флуоресцентный краситель является чувствительным к действию лиганда ионного канала на ионный канал. Эффект может представлять собой прямое воздействие непосредственно на канал (например, конформационное изменение, изменение особенностей связывания и т.д.) или изменение в сигнальном пути вниз по течению рассматриваемого ионного канала, особенно в случае внутриклеточной концентрации иона, транспортируемого рассматриваемым ионным каналом. Ион может представлять собой, например, H+, HCO3 -, K+, Na+, Cl- или Ca2+. Подходящие зависимые от pH флуоресцентные маркеры (для H+ и HCO3 -) включают, в качестве не ограничивающих примеров, H+-селективный флуоресцентный хромоионофор ETH 5294, S NAFL, SNARF, HPTS, флюоресцеины, карбофлюоресцеины, BCECF (2',7'-бис(2-карбоксиэтил) 5 (и 6) карбоксифлюоресцеин) и BCPCF (2',7'-бис(2-карбоксипропил) 5 (и 6) карбоксифлюоресцеин). Ионы кальция можно детектировать с использованием экворина (первый выделенный фотобелок), кальмодулина, маркированного Alexa-488 или photina (Axxam SpA, Милан, Италия), Fluo4 (Глицин, N-[4-[6-[(ацетилокси)метокси]-2,7-дифтор-3-оксо-3H-ксантен-9-ил]-2-[2-[2-[бис[2-[(ацетилокси)метокси]-2-этоксил]амино]-5-метилфенокси]этокси]фенил]-N-[2-[(ацетилокси)метокси]-2-этоксил]-(ацетилокси) метиловый эфир, C51H50F2N2O23), М=1096,95 г/мол CAS-Nr.: 273221-67-3, хранение: 2-8°C, в защищенном от света месте), или Fura2 (5-Оксоазолекарбоксиловая кислота,2-(6-(бис(2-((ацетилокси)метокси)-2-оксоэтил)амино)-5-(2-(2-(бис(2-((ацетилокси)метокси)-2-оксоэтил)амино)-5-метилфенокси)этокси)-2-бензофуранил)-(ацетилокси) метиловый эфир, C44H47N3O24), М=1001,86 г/мол CAS-Nr.: 108964-32-5, хранение: -20°C, в защищенном от света месте). Для обнаружения ионов натрия и калия можно использовать ионофор X и ионофор BME-44.
Такие способы могут быть выполнены следующим образом, где следующее приводится только в иллюстративных целях. Специалист поймет, что одна или несколько стадий могут быть выполнены другим образом (например, как подробно представлено в настоящем описании изобретения):
Для культуры ex vivo клетки могут быть получены путем выделения из тканей. Например, кусочки ткани могут быть помещены в среду роста, и клетки, которые вырастают, доступны для культивирования. Этот способ известен как эксплантатная культура. Альтернативно может использоваться клеточная линия (например, традиционная или бессмертная клеточная линия). Существуют многочисленные образцы традиционных клеточных линий специфических типов клеток (также см., выше).
Клетки можно культивировать в подходящей среде (например, коммерчески доступная среда, содержащая сыворотку и антибиотики). Клетки обычно культивируют при подходящей атмосфере (например, 5%-ый CO2), относительной влажности (например, 90%) и температуре (например, в 37°C). Для масштабного скрининга и/или надлежащего обращения клетки можно выращивать в многолуночных планшетах, таких как 96-луночные планшеты, 24-луночные планшеты и т.д.
Как подробно описано выше, изменение внутриклеточного pH можно определить с использованием флуоресцентных маркеров. Подходящие маркеры включают SNARF-1, BCECF и CMFDA. Возбуждение и эмиссия составляют Exc 485, Em 590 нм для carboxyS ARF-1; Exc 500, Em 538 нм для BCECF; и Exc 485, Em 538 нм для CMFDA. Ширина полос возбуждения и эмиссии могут составлять 20 нм и 25 нм, соответственно. Подходящим устройством для определения внутриклеточного pH является, например, флюорометрический ридер многолуночных планшетов FLUOstar 97 (BMG LabTechnologies, Inc, Дарем, Северная Каролина) или устройство, описанное в Примерах.
По одному варианту осуществления используется флуоресцентный краситель BCECF (2',7'-бис-(карбоксиэтил)-5-(6)-карбоксифлюоресцеин, C27H20O11), М=520,45 г/мол CAS-Nr.: 85138-49-4, хранение: 2-8°C, в защищенном от света месте), BCECF - аналог карбоксифлюоресцеина с улучшенными характеристиками для определения pH в лимфоцитах вследствие его усиленного задерживания внутри клеток. Для эффективного проникновения в неповрежденные клетки BCECF может использоваться в форме ацетоксиметилового эфира BCECF/AM, который расщепляется в клетках с образованием более непроницаемого BCECF. Максимум возбудимости для 70 нМ раствора BCECF приходится на 500 нм. Интенсивность флюоресценции BCECF может находиться под влиянием нескольких агентов, например: глицерин, сахароза, полиэтиленгликоль или поливинилпирролидон. Подходящая концентрация BCECF составляет 5 мкМ (конечная концентрация).
Далее следует одна типичная процедура для подготовки клеток для внутриклеточного определения pH: Клетки можно вырастить, например, до 90%-й конфлюэнтности, собрать, например, с использов