Комбинации ингибиторов фосфоинозитид 3-киназы и химиотерапевтических агентов и способы применения
Иллюстрации
Показать всеПредложена группа изобретений, включающая способ лечения гиперпролиферативного расстройства введением млекопитающему терапевтической комбинации в виде комбинированной композиции или путем чередования, при этом терапевтическая комбинация содержит терапевтически эффективное количество соединения формулы Ia 4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолина, или формулы Ib (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-он, или их стереоизомеры, геометрические изомеры, таутомеры, или их соли и терапевтически эффективное количество химиотерапевтического агента, выбранного из эрлотиниба, доцетаксела, 5-FU, гемцитабина, PD-0325901, цисплатина, карбоплатина, паклитаксела, бевацизумаба, трастузумаба, пертузумаба, темозоломида, тамоксифена, доксорубицина, Akti-1/2, HPPD, рапамицина и лапатиниба; фармацевтическую композицию того же назначения и состава, применение указанной терапевтической комбинации для изготовления лекарства для лечения рака, выбранного из рака молочной железы, цервикального рака, рака толстой кишки, эндометрия, глиомы, рака легкого, меланомы, рака яичников, поджелудочной железы и предстательной железы, изделие для лечения гиперпролиферативного расстройства, включающее указанную комбинацию и инструкцию и продукт, содержащий указанную комбинацию для раздельного, одновременного или последовательного применения при лечения гиперпролиферативного расстройства. Технический результат: синергизм подавления пролиферации клеток и регрессия вышеперечисленных форм рака. 5 н. и 40 з.п. ф-лы, 52 ил.
Реферат
ОТСЫЛКИ К РОДСТВЕННЫМ ЗАЯВКАМ
В данной безусловной заявке, поданной согласно 37 CFR §1.53(b), преимущество приоритета заявлено согласно 35 USC §119(е) в отношении предварительной заявки США с серийным №60/971773, поданной 12 сентября 2007 г., которая включена во всей своей полноте путем ссылки. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение в целом относится к фармацевтическим комбинациям соединений, обладающих активностью против гиперпролиферативных расстройств, таких как рак, и включающих соединения, которые ингибируют активность Р13-киназы. Изобретение также относится к способам применения соединений для in vitro, in situ и in vivo диагностики или лечения клеток млекопитающих или ассоциированных патологических состояний.
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
Фосфатидилинозит является одним из ряда фосфолипидов, обнаруженных в клеточных мембранах и принимающих участие во внутриклеточной передаче сигнала. Передача сигнала клетками, опосредованная 3'-фосфорилированными фосфоинозитидами, вовлечена в ряд клеточных процессов, например, малигнизацию, передачу сигнала через ростовые факторы, воспаление и иммунитет (Rameh et al. (1999) J. Biol. Chem. 274: 8347-8350). Фермент, ответственный за образование таких фосфорилированных продуктов при передаче сигнала, фосфатидилинозитол-3-киназу (также обозначаемую как PI 3-киназа или Pl3K), изначально идентифицировали по активности, ассоциированной с вирусными онкобелками и тирозинкиназами - рецепторами ростовых факторов, которые фосфорилируют фосфатид ил инозит (PI) и его фосфорилированные производные по 3'-гидроксилу кольца инозита (Panayotou et al. (1992) Trends Cell Biol. 2: 358-60). Фосфоинозитид-3-киназы (Pl3K) представляют собой липидкиназы, которые фосфорилируют липиды по 3-гидроксильному остатку кольца инозита (Whitman et al. (1988) Nature, 332: 664). 3-Фосфорилированные фосфолипиды (PIP3), образованные с помощью Р13-киназ, действуют в качестве вторичных мессенджеров, вовлекающих киназы с липид-связывающими доменами (включая плекстрин-гомологичные (РН) участки), такие как Akt и PDK1, фосфоинозитидзависимая киназа-1 (Vivanco et al. (2002) Nature Rev. Cancer 2: 489; Phillips et al. (1998) Cancer 83: 41).
Семейство Pl3-киназ содержит по меньшей мере 15 разных ферментов, систематизированных по структурной гомологии и разделенных на 3 класса на основе гомологии последовательностей и продукта, образующегося в результате ферментативного катализа. Pl3-киназы I класса состоят из 2 субъединиц: каталитической субъединицы (110 кДа) и регуляторной субъединицы (85 кДа). Регуляторные субъединицы содержат SH2-домены (src-гомологичные домены 2) и связываются с остатками тирозина, фосфорилированными под действием рецепторов ростовых факторов, обладающих тирозинкиназной активностью, или продуктов онкогенов, тем самым запуская Pl3K-активность каталитической субъединицы р110, которая фосфорилирует свой липидный субстрат.Pl3-киназы 1 класса вовлечены в важные события передачи сигнала вниз по пути цитокинов, интегринов, ростовых факторов и иммунорецепторов, что предполагает, что регулирование этого пути может приводить к важным терапевтическим эффектам, таким как модулирование клеточной пролиферации и канцерогенеза. Pl3K I класса могут фосфорилировать фосфатидилинозит (Р1), фосфатидилинозит-4-фосфат и фосфатидилинозит-4,5-бифосфат (Р1Р2) с получением фосфатидилинозит-3-фосфата (PIP), фосфатидилинозит-3,4-бифосфата и фосфатидилинозит-3,4,5-трифосфата, соответственно. Pl3K II класса фосфорилируют Р1 и фосфатидилинозит-4-фосфат.Pl3K III класса могут фосфорилировать только Р1. Основной изоформой Pl3-киназы при раке является Pl3-киназа 1 класса - р110α (US 5824492; US 5846824; US 6274327). Другие изоформы вовлечены в сердечнососудистое и иммуновоспалительное заболевание (Workman P (2004) Biochem. Soc. Trans. 32: 393-396; Patel et al. (2004) Proc. Am. Assoc. of Cancer Res. (Abstract LB-247) 95th Annual Meeting, March 27-31, OrIando, Florida, USA; Ahmadi К and Waterfield MD (2004) "Phosphoinositide 3-Kinase: Function and Mechanisms" EncyClopedia of Biological Chemistry (Lennarz W J, Lane M D eds) Elsevier/Academic Press) и онкогенные мутации в Pl3-киназе (Samuels et al. (2004) Science 304: 554). Онкогенные мутации р110-альфа со значительной частотой обнаружены в солидных опухолях толстой кишки, молочной железы, головного мозга, печени, яичников, желудка, легких и головы и шеи. Нарушения в PTEN (гомологе фосфатазы и тензина с делецией на хромосоме 10) обнаруживаются при глиобластоме, меланоме, раке предстательной железы, эндометрия, яичников, молочной железы, легких, головы и шеи, гепатоцеллюлярном раке и раке щитовидной железы.
После первоначальной очистки и молекулярного клонирования Pl3-киназы было обнаружено, что она представляла собой гетеродимер, состоящий из субъединиц р85 и р110 (Otsu et al. (1991) Cell 65: 91-104; Hiles et al. (1992) Cell 70: 419-29). Впоследствии идентифицировано четыре разных Pl3K I класса, обозначенные как Pl3K-α (альфа), -β (бета), -δ (дельта) и -γ (гамма), каждая из которых состоит из разных каталитических субъединиц (110 кДа) и регуляторных субъединицы. Более конкретно, каждая из трех каталитических субъединиц, т.е. p110-альфа, p110-бета и р110-дельта, взаимодействует с одной и той же регуляторной субъединицей, р85; тогда как p110-гамма взаимодействует с другой регуляторной субъединицей, р101. Особенности экспрессии каждой из этих Pl3K в человеческих клетках и тканях также различны. В каждом из подтипов Pl3K-альфа, -бета и -дельта действие субъединицы р85 заключается в локализации Pl3-киназы на плазматической мембране благодаря взаимодействию ее SH2-домена с фосфорилированными тирозиновыми остатками (присутствующими в составе соответствующей последовательности) в белках-мишенях (Rameh et al. (1995) Cell, 83: 821-30; Volinia et al. (1992) Oncogene, 7: 789-93).
Путь Pl3-киназа/Ак1/РТЕМ представляет собой привлекательную мишень для разработки противораковых лекарственных средств, поскольку ожидается, что такие агенты будут ингибировать пролиферацию, реверсировать подавление апоптоза и преодолевать резистентность к цитотоксическим агентам в раковых клетках. Данные об ингибиторах Pl3-киназ опубликованы (Yaguchi et al. (2006) Jour. of the Nat. Cancer Inst. 98(8): 545-556; US 7173029; US 7037915; US 6608056; US 6608053; US 6838457; US 6770641; US 6653320; US 6403588; WO 2006/046031; WO 2006/046035; WO 2006/046040; WO 2007/042806; WO 2007/042810; WO 2004/017950; US 2004/092561; WO 2004/007491; WO 2004/006916; WO 2003/037886; US 2003/149074; WO 2003/035618; WO 2003/034997; US 2003/158212; EP 1417976; US 2004/053946; JP 2001247477; JP 08175990; JP 08176070). Аналоги вортманнина обладают Pl3-киназной активностью в организме млекопитающих (US 6703414; WO 97/15658).
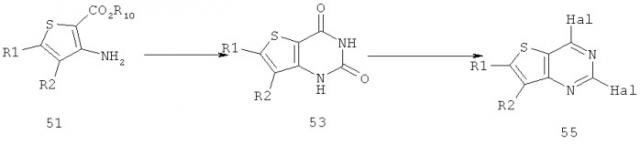
Соединения тиенопиримидинов формул I и II обладают p110-альфа-связывающей, Pl3-киназа-ингибирующей активностью и ингибируют рост раковых клеток (WO 2006/046031; US 2008/0039459; US 2008/0076768; US 2008/0076758; WO 2008/070740; WO 2008/073785.
Соединение формулы I, GDC-0941 (Genentech Inc.), представляет собой селективный, перорально биодоступный ингибитор Pl3K с многообещающими фармакокинетическими и фармацевтическими свойствами (Belvin et al., American AssoClation for Cancer Research Annual Meeting 2008, 99th: April 15, Abstract 4004; Folkes et al., American AssoClation for Cancer Research Annual Meeting 2008, 99th: April 14, Abstract LB-146; Friedman et al., American AssoClation for Cancer Research Annual Meeting 2008, 99th: April 14, Abstract LB-110).
В настоящее время в лечении рака общепризнано использование комбинаций противораковых фармацевтических терапевтических средств, вводимых в режиме одновременного или последовательного дозирования. Успешная комбинированная терапия обеспечивает улучшенный и даже синергический эффект по сравнению с монотерапией, т.е. фармацевтическим лечением, ограниченным одним лекарственным средством. Проведено изучение комбинированной терапии для лечения таких гиперпролиферативных расстройств, как рак, включая противоопухолевую активность эрлотиниба в комбинации с капецитабином в моделях опухолевых ксенотрансплантатов человека (Ouchi et al. (2006) Cancer Chemother. Pharmacol. 57: 693-702) и эрлотиниба в комбинации с гемцитабином и цисплатином в моделях опухолевых ксенотрансплантатов немелкоклеточного рака легкого (NSClC) (Higgins et al. (2004) Anti-Cancer Drugs 15:503-512). Доклиническое изучение составляет основу для прогнозирования синергического действия противораковых фармацевтических терапевтических комбинаций на клинической стадии, включая капецитабин и таксаны для лечения рака молочной железы (Sawada et al. (1998) Clin. Cancer Res. 4: 1013-1019). Некоторые дозы и схемы проведения комбинированной терапии капецитабина и таксана могут улучшать безопасность без нарушения эффективности (O'Shaughnessy et al. (2006) Clin. Breast Cancer, Apr 7(1):42-50). Синергические эффекты противогрибковых комбинаций in vitro коррелируют с синергическим действием на клинической стадии (Steinbach et al. (2003) Clin. Inf. Dis. Oct 1; 37 Suppl. 3: S188-224).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение в целом относится к соединениям тиенопиримидинов формул I и II с противораковой активностью и более конкретно с Pl3-киназа-ингибирующей активностью, вводимым в комбинации с химиотерапевтическими агентами для ингибирования роста раковых клеток. Некоторые комбинации соединений формулы I и II с химиотерапевтическими агентами демонстрируют синергические эффекты в ингибировании роста раковых клеток in vitro и in vivo. Комбинации и способы по изобретению могут быть полезны в лечении гиперпролиферативных расстройств, таких как рак. Такие композиции могут ингибировать опухолевый рост у млекопитающих и могут быть полезны для лечения раковых пациентов-людей.
В одном из аспектов изобретение включает способ лечения гиперпролиферативного расстройства, включающий введение терапевтической комбинации млекопитающему в виде комбинированной композиции или путем чередования, при этом терапевтическая комбинация содержит терапевтически эффективное количество соединения, имеющего формулу I или II, и терапевтически эффективное количество химиотерапевтического агента, выбранного из эрлотиниба, доцетаксела, 5-FU (5-фторурацила), гемцитабина, PD-0325901, цисплатина, карбоплатина, паклитаксела, бевацизумаба, трастузумаба, пертузумаба, темозоломида, тамоксифена, доксорубицина, Akti-1/2 (ингибитора Akt-1/2), HPPD, рапамицина и лапатиниба.
Изобретение также относится к способам применения композиций для диагностики или лечения in vitro, in situ и in vivo клеток, организмов млекопитающих или ассоциированных патологических состояний.
Согласно аспекту изобретения предложены терапевтические комбинации, содержащие 4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолин (US 2008/0076768; WO 2006/046031), также известный как GDC-0941 (Genentech, Inc.) и имеющий формулу Ia, и терапевтически эффективное количество химиотерапевтического агента, выбранного из эрлотиниба, доцетаксела, 5-FU, гемцитабина, PD-0325901, цисплатина, карбоплатина, паклитаксела, бевацизумаба, трастузумаба, пертузумаба, темозоломида, тамоксифена, доксорубицина, Akti-1/2, HPPD, рапамицина и лапатиниба.
Согласно аспекту изобретения предложены терапевтические комбинации, содержащие (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1 -ил)-2-гидроксипропан-1-он (WO 2008/070740), имеющий формулу Ib, и терапевтически эффективное количество химиотерапевтического агента, выбранного из эрлотиниба, доцетаксела, 5-FU, гемцитабина, PD-0325901, цисплатина, карбоплатина, паклитаксела, бевацизумаба, трастузумаба, пертузумаба, темозоломида, тамоксифена, доксорубицина, Akti-1/2, HPPD, рапамицина и лапатиниба.
Согласно аспекту изобретения предложены терапевтические комбинации, содержащие 4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[2,3-d]пиримидин-4-ил)морфолин (US 2008/0076758; WO 2006/046031), имеющий формулу IIa, и терапевтически эффективное количество химиотерапевтического агента, выбранного из эрлотиниба, доцетаксела, 5-FU, гемцитабина, PD-0325901, цисплатина, карбоплатина, паклитаксела, бевацизумаба, трастузумаба, пертузумаба, темозоломида, тамоксифена, доксорубицина, Akti-1/2, HPPD, рапамицина и лапатиниба.
Соединения формулы Ia, Ib и IIa являются перорально биодоступными и в виде отдельных агентов обладают противоопухолевой активностью во многих моделях рака человека.
Соединения формулы I и II включают все стереоизомеры, геометрические изомеры, таутомеры, метаболиты и их фармацевтически приемлемые соли. Некоторые соединения формулы I и II являются сильнодействующими ингибиторами Pl3K, обладающими такими же физико-химическими и фармакокинетическими свойствами, как и лекарственные средства. Некоторые соединения формулы I и II демонстрируют повышенную селективность по отношению к Pl3K класса Ia по сравнению с классом Ib, в частности, к подтипу p110-альфа.
Фармацевтические композиции и терапевтические комбинации по изобретению содержат химиотерапевтический агент, выбранный из эрлотиниба, доцетаксела, 5-FU, гемцитабина, PD-0325901, цисплатина, карбоплатина, паклитаксела, бевацизумаба, трастузумаба, пертузумаба, темозоломида, тамоксифена, доксорубицина, Akti-1/2, HPPD, рапамицина и лапатиниба.
Кроме того, фармацевтические композиции по изобретению могут содержать фармацевтически приемлемый носитель.
Согласно другому аспекту изобретения предложены способы лечения гиперпролиферативного заболевания или расстройства, модулируемого PI3-киназами, включающие введение млекопитающему, нуждающемуся в таком лечении, эффективных количеств соединения формулы I или II и химиотерапевтического агента. Соединение формулы I или II и химиотерапевтический агент могут быть изготовлены для совместного комбинированного введения в виде фармацевтической композиции, или они могут быть введены по отдельности путем чередования (последовательно) в виде терапевтической комбинации.
Согласно другому аспекту изобретения предложены способы лечения гиперпролиферативного расстройства, включающие введение млекопитающему, нуждающемуся в таком лечении, эффективных количеств соединения формулы I или II и химиотерапевтического агента.
В следующем аспекте согласно настоящему изобретению предложен способ применения фармацевтической композиции по изобретению для лечения заболевания или состояния, модулируемого Pl3-киназой, у млекопитающего.
Дополнительный аспект изобретения относится к применению фармацевтической композиции по изобретению в изготовлении лекарства для лечения заболевания или состояния, модулируемого Pl3-киназой, у млекопитающего.
Другой аспект изобретения включает изделия или наборы, содержащие соединение формулы I или II, химиотерапевтический агент, контейнер и возможно инструкцию по медицинскому применению препарата или этикетку с показанием лечения.
Другой аспект изобретения относится к продукту, содержащему соединение, имеющее формулу I или II, и химиотерапевтический агент, выбранный из эрлотиниба, доцетаксела, 5-FU, гемцитабина, PD-0325901, цисплатина, карбоплатина, паклитаксела, бевацизумаба, трастузумаба, пертузумаба, темозоломида, тамоксифена, доксорубицина, Akti-1/2, HPPD, рапамицина и лапатиниба; в виде комбинированной композиции для раздельного, одновременного или последовательного применения в лечений гиперпролиферативного расстройства.
Другой аспект изобретения включает способ определения соединений, которые могут быть использованы в комбинации для лечения рака, включающий: а) введение терапевтической комбинации соединения, имеющего формулу I или II, и химиотерапевтического агента в НЕК2(рецептор-2 эпидермального фактора роста человека)-амплифицирующие раковые клетки молочной железы в ламинин-обогащенных, воссозданных содержащих базальные мембраны средах (basement membrame media), при этом химиотерапевтический агент направленно воздействует на рецептор HER2, связывается с ним или модулирует его, и б) измерение ингибирования клеточной пролиферации, где незлокачественные и злокачественные клетки молочной железы различают на основании одного или более чем одного фенотипического различия, выбранного из жизнеспособности клеток и ацинарного морфогенеза.
Другой аспект изобретения включает способ определения соединений, которые могут быть использованы в комбинации для лечения рака, включающий: а) введение терапевтической комбинации по пункту I формулы изобретения в линию опухолевых клеток in vitro с мутацией K-ras и б) измерение синергического или несинергического эффекта.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1-А показана сводная информация in vitro анализов клеточной пролиферации с использованием комбинаций соединения формулы Ia и различных химиотерапевтических агентов, вводимых одновременно. Клеточные линии охарактеризованы по типу опухоли и наличию известной мутации. Проведено сравнение индивидуальных измеренных величин EC50 для химиотерапевтического агента и соединения формулы Ia (GDC-0941) с величиной EC50 для комбинации и показатель в баллах для комбинации (combination index score) рассчитан по методу Chou и Talalay (Chou, Т. and Talalay, P. (1984) Adv. Enzyme Regul. 22: 27-55). Эффективность синергического действия оценена в баллах с использованием системы ранжирования и приведена в последней колонке.
На Фиг.1-В показана сводная информация in vitro анализов клеточной пролиферации с использованием комбинаций соединения формулы IIa и различных химиотерапевтических агентов. Клеточные линии охарактеризованы по типу опухоли и наличию мутации Ras. Проведено сравнение индивидуальных измеренных величин ЕС50 для химиотерапевтического агента и соединения формулы IIa с величиной ЕС50 для комбинации и показатель в баллах для комбинации рассчитан по методу Chou и Talalay (Chou, Т. and Talalay, P. (1984) Adv. Enzyme Regul. 22: 27-55). Эффективность синергического действия оценена в баллах с использованием системы ранжирования Chou и Talalay.
На Фиг.1-С показана сводная информация in vitro анализов клеточной пролиферации с использованием комбинаций соединения формулы Ib и различных химиотерапевтических агентов. Клеточные линии охарактеризованы по типу опухоли и наличию мутации Ras. Проведено сравнение индивидуальных измеренных величин EC50 для химиотерапевтического агента и соединения формулы Ib с величиной EC50 для комбинации и показатель в баллах для комбинации рассчитан по методу Chou и Talalay (Chou, Т. and Talalay, P. (1984) Adv. Enzyme Regul. 22: 27-55). Эффективность синергического действия оценена в баллах с использованием системы ранжирования Chou и Talalay.
На Фиг.2 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х ЕС50), справа налево, 5-FU, соединения формулы Ia (GDC-0941) и комбинации 5-FU и соединения формулы Ia. Клетки MDA-MB-361 (тип опухоли молочной железы) обработаны одновременно (верх), предварительно обработаны соединением формулы Ia за 4 часа перед введением 5-FU (середина) и обработаны впоследствии соединением формулы Ia через 4 часа после введения 5-FU (низ).
На Фиг.3 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х ЕС50), справа налево, гемцитабина, соединения формулы Ia (GDC-0941) и комбинации гемцитабина и соединения формулы Ia. Клетки Cal-51 (тип опухоли молочной железы) обработаны одновременно (верх) и обработаны впоследствии соединением формулы Ia через 4 часа после введения гемцитабина (низ).
На Фиг.4 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х ЕС50), справа налево, гемцитабина, соединения формулы Ia (GDC-0941) и комбинации гемцитабина и соединения формулы Ia. Клетки MDA-MB-361 (тип опухоли молочной железы) обработаны одновременно (верх), предварительно обработаны соединением формулы Ia за 4 часа перед введением гемцитабина (середина) и обработаны впоследствии соединением формулы Ia через 4 часа после введения гемцитабина (низ).
На Фиг.5 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х EC50), справа налево, эрлотиниба, соединения формулы Ia (GDC-0941) и комбинации эрлотиниба и соединения формулы Ia. Клетки А549 (тип опухоли легкого с K-ras G12C) обработаны одновременно (верх), предварительно обработаны соединением формулы Ia за 4 часа перед введением эрлотиниба (середина) и обработаны впоследствии соединением формулы Ia через 4 часа после введения эрлотиниба (низ).
На Фиг.6 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х ЕС50), справа налево, эрлотиниба, соединения формулы Ia (GDC-0941) и комбинации эрлотиниба и соединения формулы Ia. Клетки Н23 (тип опухоли легкого с мутацией K-ras-G12C) обработаны одновременно (верх), предварительно обработаны соединением формулы Ia за 4 часа перед введением эрлотиниба (середина) и обработаны впоследствии соединением формулы Ia через 4 часа после введения эрлотиниба (низ).
На Фиг.7 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х ЕС5о), справа налево, темозоломида, соединения формулы Ia (GDC-0941) и комбинации темозоломида и соединения формулы Ia. Клетки U87 (тип опухоли - глиома) обработаны одновременно (верх), предварительно обработаны соединением формулы Ia за 4 часа перед введением темозоломида (середина) и обработаны впоследствии соединением формулы Ia через 4 часа после введения темозоломида (низ).
На Фиг.8 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х EC50), справа налево, темозоломида, соединения формулы Ia (GDC-0941) и комбинации темозоломида и соединения формулы Ia. Клетки А375 (тип опухоли - меланома) обработаны одновременно (верх), предварительно обработаны соединением формулы Ia за 4 часа перед введением темозоломида (середина) и обработаны впоследствии соединением формулы Ia через 4 часа после введения темозоломида (низ).
На Фиг.9 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х ЕС50), справа налево, темозоломида, соединения формулы Ia (GDC-0941) и комбинации темозоломида и соединения формулы Ia. Клетки MALME-3M (тип опухоли - меланома) обработаны одновременно (верх), предварительно обработаны соединением формулы Ia за 4 часа перед введением темозоломида (середина) и обработаны впоследствии соединением формулы Ia через 4 часа после введения темозоломида (низ).
На Фиг.10 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х ЕС50), справа налево, доксорубицина, соединения формулы Ia (GDC-0941) и комбинации доксорубицина и соединения формулы Ia. Клетки SKOV3 (тип опухоли яичников) обработаны одновременно (верх), предварительно обработаны соединением формулы Ia за 4 часа перед введением доксорубицина (середина) и обработаны впоследствии соединением формулы Ia через 4 часа после введения доксорубицина (низ).
На Фиг.11 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки, при варьировании концентраций (начиная от 4Х ЕС50), справа налево, доцетаксела, соединения формулы Ia (GDC-0941) и комбинации доцетаксела и соединения формулы Ia. Клетки РС3 (тип опухоли предстательной железы) обработаны одновременно (верх), предварительно обработаны соединением формулы Ia за 4 часа перед введением доцетаксела (середина) и обработаны впоследствии соединением формулы Ia через 4 часа после введения доцетаксела (низ).
На Фиг.12 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки MDA-MB 361 (тип опухоли молочной железы), при варьировании концентраций (начиная от 4Х EC50), справа налево: (верх) 5-FU, соединения формулы IIa и комбинации одновременно вводимых 5-FU и соединения формулы IIa; (середина) доцетаксела, соединения формулы IIa и комбинации одновременно вводимых доцетаксела и соединения формулы IIa; и (низ) гемцитабина, соединения формулы IIa и комбинации одновременно вводимых гемцитабина и соединения формулы IIa.
На Фиг.13 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют: (верх) жизнеспособные клетки МТ3 (тип опухоли молочной железы) при варьировании концентраций (начиная от 4Х ЕС50), справа налево, доцетаксела, соединения формулы IIa и комбинации одновременно вводимых доцетаксела и соединения формулы IIa; и (низ) жизнеспособные клетки U87 (тип опухоли - глиома) при варьировании концентраций (начиная от 4Х ЕС50), справа налево, темозоломида, соединения формулы IIa и комбинации одновременно вводимых темозоломида и соединения формулы IIa.
На Фиг.14 показаны результаты in vitro анализов клеточной пролиферации (Cell-Titer Glo, Promega), в которых измеряют жизнеспособные клетки ZR75-1 (тип опухоли молочной железы) при варьировании концентраций (начиная от 4Х ЕС50), справа налево: (верх) 5-FU, соединения формулы IIa и комбинации одновременно вводимых 5-FU и соединения формулы IIa; и (низ) доцетаксела, соединения формулы IIa и комбинации одновременно вводимых доцетаксела и соединения формулы IIa.
На Фиг.15 показана точечная диаграмма для экспериментов по синергическому действию (показатель для комбинации) эрлотиниба и соединения формулы Ia (GDC-0941) из Фиг.1-А против линий опухолевых клеток без мутаций Ras (Ras WT (дикий тип), эксперименты 41, 42, 73-75, 77, 79-81, 83, 84, 86) и с мутациями Ras (мут. Ras, эксперименты 40, 69-72, 76, 78, 82, 144, 145).
На Фиг.16 показана точечная диаграмма для экспериментов по синергическому действию (показатель для комбинации) PD-0325901 и соединения формулы Ia (GDC-0941) из Фиг.1-А против линий опухолевых клеток без мутаций Ras (Ras WT, эксперименты 22-24, 26-28, 31-33, 36-38, 55, 59, 61, 63-66, 85, 89-98, 149, 161, 162) и с мутациями Ras (мут. Ras, эксперименты 25, 30, 34, 35, 39, 56-58, 60,62,67,68, 146-148,150).
На Фиг.17 показаны результаты для синергидной линии опухолевых клеток MDA-MB-361 и не-синергидной линии опухолевых клеток МТ-3 в зависимости от времени обработки гемцитабином при уровнях дозировки, равных ЕС80. Уровни рАКТ (фосфо-АКТ) измеряли для момента времени Т=0 (без обработки, UT), 1 ч, 4 ч, 6 ч и 24 ч.
На Фиг.18 показана точечная диаграмма для экспериментов по синергическому действию (показатель для комбинации) доцетаксела, 5-FU или гемцитабина и соединения формулы Ia (GDC-0941) из Фиг.1-А против линий опухолевых клеток, которые демонстрируют увеличение уровня pAkt или не демонстрируют никакого увеличения в уровне pAkt.
На Фиг.19 показаны результаты проточной цитометрии с использованием FACS (клеточный сортер с активацией флуоресценции): (верх) клеток МВ361 (слева направо), необработанных, обработанных соединением формулы Ia, 5FU и сначала 5FU, затем соединением формулы Ia (GDC-0941); (середина) клеток РС3 (слева направо), необработанных, обработанных соединением формулы Ia, доцетакселом, одновременно соединением формулы Ia и доцетакселом, сначала соединением формулы Ia, затем доцетакселом и сначала доцетакселом, затем соединением формулы Ia; и (низ) клеток МВ361 (слева направо), необработанных, обработанных соединением формулы Ia, гемцитабином и сначала гемцитабином, затем соединением формулы Ia.
На Фиг.20 показана обработка клеток ВТ474М1 в объемной (3D) культуре. Ацинусный рост (aClnni growth) и морфогенез коррелирует с продуцированием клеткой АТФ, выраженным в относительных световых единицах (RLU), в среде с добавлением 10% FBS (фетальная телячья сыворотка) в присутствии и в отсутствие 1 нМ херегулина-1 в результате обработки (слева направо): средой, DMSO (диметилсульфоксид), комбинацией 20 мкг/мл трастузумаба и 25 мкг/мл пертузумаба, 250 нМ соединения формулы Ia (GDC-0941) и комбинацией 20 мкг/мл трастузумаба, 25 мкг/мл пертузумаба и 250 нМ соединения формулы Ia.
На Фиг.21 показана обработка клеток ВТ474М1 в объемной (3D) культуре. Ацинусный рост и морфогенез коррелирует с продуцированием клеткой АТФ, выраженным в относительных световых единицах (RLU), в среде с добавлением 10% FBS в присутствии и в отсутствие 1 нМ херегулина-1 в результате обработки (слева направо): средой, DMSO, комбинацией 20 мкг/мл трастузумаба и 25 мкг/мл пертузумаба, 250 нМ соединения формулы IIa и комбинацией 20 мкг/мл трастузумаба, 25 мкг/мл пертузумаба и 250 нМ соединения формулы IIa.
На Фиг.21-А показана обработка клеток ВТ474М1 в объемной (3D) культуре. Ацинусный рост и морфогенез коррелирует с продуцированием клеткой АТФ, выраженным в относительных световых единицах (RLU), в среде с добавлением 10% FBS в присутствии и в отсутствие 1 нМ херегулина-1 в результате обработки (слева направо): DMSO, комбинацией 20 мкг/мл трастузумаба и 25 мкг/мл пертузумаба, 20 нМ соединения формулы Ib и комбинацией 20 мкг/мл трастузумаба, 25 мкг/мл пертузумаба и 20 нМ соединения формулы Ib.
На Фиг.22 показано изменение среднего объема опухоли во времени у бестимусных и бесшерстных мышей линии CD-1 (Charles River Labs) с ксенотрансплантатами клеток опухоли молочной железы MDA-MB-361.1, которым на 0-е сутки вводили: разбавитель МСТ (0,5% метилцеллюлозы/0,2% Твина 80), 150 мг/кг соединения формулы Ia (GDC-0941), 5 мг/кг доцетаксела и комбинацию соединения формулы Ia (150 мг/кг) и доцетаксела (5 мг/кг). Мышам вводили доцетаксел на 1-е, 5-е и 9-е сутки (1х/4 сут х 3) внутривенно, тогда как соединение формулы Ia вводили ежесуточно в течение 21 суток путем перорального чреззондового кормления.
На Фиг.23 показано изменение среднего объема опухоли во времени у бестимусных и бесшерстных мышей линии CD-1 (Charles River Labs) с ксенотрансплантатами клеток опухоли молочной железы MDA-MB-361.1, которым на 1-е сутки вводили: разбавитель МСТ (0,5% метилцеллюлозы/0,2% Твина 80), 37,5 мг/кг соединения формулы IIa, 5 мг/кг доцетаксела и комбинацию 37,5 мг/кг соединения формулы IIa и 5 мг/кг доцетаксела. Мышам вводили доцетаксел на 1-е, 5-е и 9-е сутки (1х/4 сут х 3) внутривенно, тогда как соединение формулы IIa вводили ежесуточно в течение 21 суток путем перорального чреззондового кормления.
На Фиг.24 показано изменение среднего объема опухоли во времени у самок nu/nu (бестимусных и бесшерстных) мышей линии NMRI с ксенотрансплантатами эксплантатов первичной опухоли молочной железы MAXF 401, которым на 0-е сутки вводили: разбавитель МСТ (0,5% метилцеллюлозы/0,2% Твина 80), 100 мг/кг соединения формулы Ia (GDC-0941), 15 мг/кг доцетаксела и комбинацию 100 мг/кг соединения формулы Ia и 15 мг/кг доцетаксела. Мышам вводили внутривенно доцетаксел на 0-е сутки и 11-е сутки, тогда как соединение формулы Ia вводили на сутки 0-4, 11-17 и 21-28 путем перорального чреззондового кормления.
На Фиг.25 показано изменение среднего объема опухоли во времени у самок nu/nu бестимусных и бесшерстных мышей линии NMRI с ксенотрансплантатами эксплантатов первичной опухоли молочной железы MAXF 401, которым на 0-е сутки вводили: разбавитель МСТ (0,5% метилцеллюлозы/0,2% Твина 80), 100 мг/кг соединения формулы IIa, 15 мг/кг доцетаксела и комбинацию 100 мг/кг соединения формулы IIa и 15 мг/кг доцетаксела. Мышам вводили внутривенно доцетаксел на 0-е сутки и 11-е сутки, тогда как соединение формулы IIa вводили на сутки 0-3, 11-17 и 21-28 путем перорального чреззондового кормления.
На Фиг.26 показано изменение среднего объема опухоли во времени у самок nu/nu бестимусных и бесшерстных мышей линии NMRI с ксенотрансплантатами эксплантатов первичной опухоли молочной железы MAXF 1162, которым на 0-е сутки вводили: разбавитель МСТ (0,5% метилцеллюлозы/0,2% Твина 80), 100 мг/кг соединения формулы Ia (GDC-0941), 15 мг/кг доцетаксела и комбинацию 100 мг/кг соединения формулы Ia и 15 мг/кг доцетаксела. Мышам вводили внутривенно доцетаксел на 0-е, 11-е, 22-е и 44-е сутки, а соединение формулы Ia вводили на сутки 0-5, 11-16, 22-27, 30-32, 42 и 44 путем перорального чреззондового кормления.
На Фиг.27 показано изменение среднего объема опухоли во времени у самок nu/nu бестимусных и бесшерстных мышей линии NMRI с ксенотрансплантатами первичной опухоли молочной железы MAXF 1162, которым на 0-е сутки вводили: разбавитель МСТ (0,5% метилцеллюлозы/0,2% Твина 80), 100 мг/кг соединения формулы IIa, 15 мг/кг доцетаксела и комбинацию 100 мг/кг соединения формулы IIa и 15 мг/кг доцетаксела. Мышам вводили внутривенно доцетаксел на 0-е, 11-е, 22-е и 44-е сутки, а соединение формулы IIa вводили на сутки 0-5, 11-16, 22-23, 29-31 и 35-38 путем перорального чреззондового кормления.
На Фиг.28 показано изменение среднего объема опухоли во времени у самок nu/nu (бестимусных и бесшерстных) мышей линии CRL с ксенотрансплантатами опухоли немелкоклеточного рака легкого (NSClC) NCl-Н2122, которым на 0-е сутки вводили: разбавитель МСТ (0,5% метилцеллюлозы/0,2% Твина 80), 50 мг/кг соединения формулы Ia (GDC-0941), 75 мг/кг эрлотиниба и комбинацию 50 мг/кг соединения формулы Ia и 75 мг/кг эрлотиниба. Мышам вводили ежесуточно эрлотиниб и соединение формулы Ia ежесуточно в течение 16 суток путем перорального чреззондового кормления.
На Фиг.29 показано изменение среднего объема опухоли во времени у самок nu/nu (бестимусных и бесшерстных) мышей линии CRL с ксенотрансплантатами опухоли немелкоклеточного рака легкого (NSClC) NCl-Н2122, которым на 0-е сутки вводили: разбавитель МСТ (0,5% метилцеллюлозы/0,2% Твина 80), 50 мг/кг соединения формулы IIa, 75 мг/кг эрлотиниба и комбинацию 50 мг/кг соединения формулы IIa и 75 мг/кг эрлотиниба. Мышам вводили ежесуточно эрлотиниб и соединение формулы IIa в течение 14 суток (окончание исследования) путем перорального чреззондового кормления.
На Фиг.30 показано изменение среднего объема опухоли во времени у самок nu/nu мышей линии HRLN с ксенотрансплантатами клеток опухоли молочной железы MCF-7 (мутант по Pl3K), которым на 0-е сутки вводили: разбавитель МСТ и PBS (МСТ: 0,5% метилцеллюлозы/0,2% Твина 80, и PBS: забуференный фосфатом физиологический раствор), контроль IgG (иммуноглобулин G) (5 мг/кг), мышиное антитело против VEGF (сосудистый эндотелиальный ростовой фактор) mB20-4.1 (5 мг/кг), соединение формулы Ia (GDC-0941) (150 мг/кг) и комбинацию соединения формулы Ia (150 мг/кг) и мышиного антитела против VEGF mB20-4.1 (5 мг/кг). Животным вводили контроль IgG и mB20-4.1 внутрибрюшинно дважды в неделю в течение 3 недель, а соединение формулы Ia ежесуточно в течение 21 суток путем перорального чреззондового кормления, и мониторинг опухолевого роста проводили в течение дополнительных 41 суток (общее количество суток на одно исследование составляло 62). Соединение формулы Ia и mB20-4.1 вводили одновременно.
На Фиг.31 показано изменение среднего объема опухоли во времени у самок nu/nu мышей линии HRLN с ксенотрансплантатами клеток опухоли молочной железы MCF-7 (мутант по Pl3K), которым на 0-е сутки вводили: разбавитель МСТ и PBS (МСТ: 0,5% метилцеллюлозы/0,2% Твина 80, и PBS: забуференный фосфатом физиологический раствор), контроль IgG (5 мг/кг), мышиное антитело против VEGF mB20-4.1 (антиангиогенное средство) (5 мг/кг), соединение формулы IIa (100 мг/кг) и комбинацию соединения формулы IIa (100 мг/кг) и мышиного антитела против VEGF mB20-4.1 (5 мг/кг). Животным вводили контроль IgG и mB20-4.1 внугрибрюшинно дважды в неделю в течение 3 недель, а соединение формулы IIa перорально ежесуточно в течение 21 суток, и мониторинг опухолевого роста проводили в течение дополнительных 41 суток (общее количество суток на одно исследование составляло 62). Соединение формулы IIa и mB20-4.1 вводили одновременно.
На Фиг.32 показано изменение среднего объема опухоли во времени у самок nu/nu мышей от HarIan с ксенотрансплантатами опухолевых клеток глиомы U87MG, которым на 0-е сутки вводили: соединение формулы Ia (GDC-0941) (109 мг/кг), темозоломид (100 мг/кг) и комбинацию соединения формулы Ia (109 мг/кг) и темозоломида (100 мг/кг), а также у мышей, не получавших никакого лекарственного средства (нелеченная группа). Животным вводили соединение формулы Ia перорально ежесуточно в течение 21 суток и темозоломид перорально ежесуточно в течение 5 суток.
На Фиг.33 показано изменение среднего объема опухоли во времени у бестимусных и бесшерстных мышей линии CD-1 с ксенотрансплантатами клеток опухоли молочной железы MDA-MB-361.1, которым на 0-е сутки вводили: соединение формулы Ia (GDC-0941) (150 мг/кг), гемцитабин (100 мг/кг) и комбинацию соединения формулы Ia (150 мг/кг) и гемцитабина (100 мг/кг), а также у мышей, не получавших никакого лекарственного средства (группа, получавшая разбавитель). Животным вводили соединение формулы Ia перорально ежесуточно в течение 21 суток, а гемцитабин внутрибрюшинно на 1-е, 4-е, 7-е и 10-е сутки (1х/3 сут х 4).
На Фиг.34 показано изменение среднего объема опухоли во времени у самок nu/nu мышей от HarIan с ксенотрансплантатами клеток опухоли молочной железы ВТ474, которым на 0-е сутки вводили: соединение формулы Ia (GDC-0941) в дозах 18, 36 и 73 мг/кг, трастузумаб (20 мг/кг) и комбинации соединения формулы Ia в дозах 18, 36 и 73 мг/кг и трастузумаба (20 мг/кг), а также у мышей, не получавши